一种复合微生物菌肥及其制备方法和应用
本发明涉及生物领域,具体涉及一种复合微生物菌肥及其制备方法和应用。
背景技术:
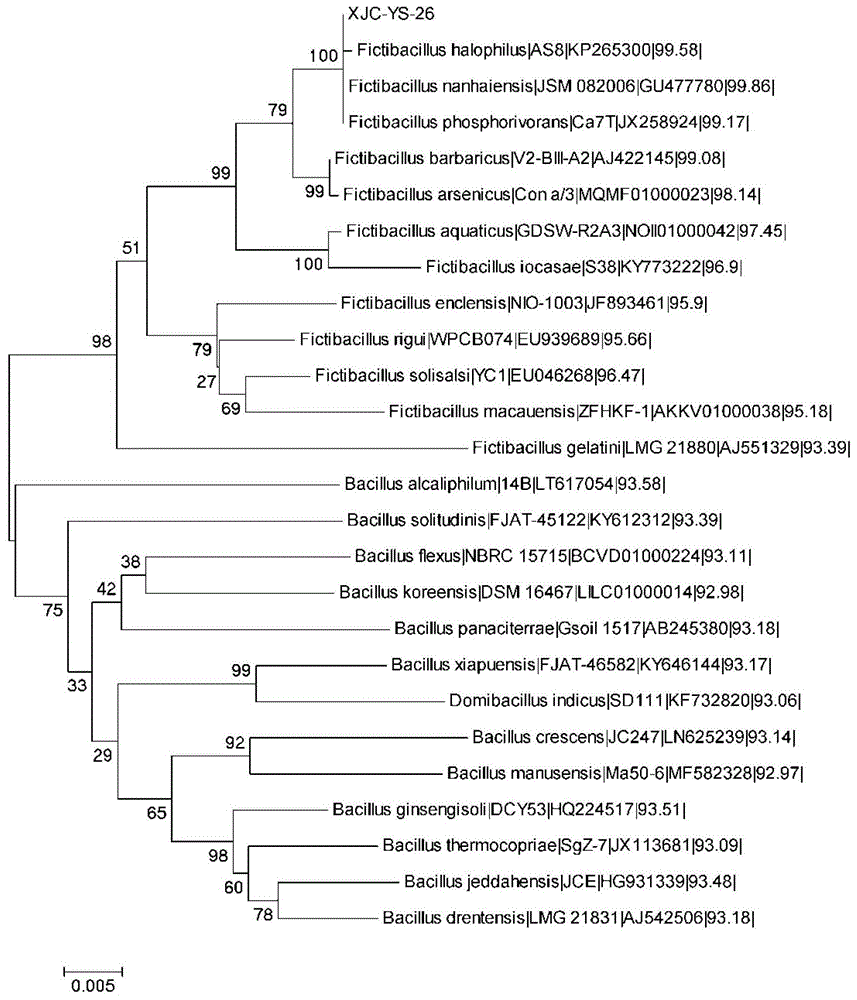
:香蕉是世界水果中排名第二,仅次于柑桔的热带和亚热带水果,世界年产量约有上亿吨。全球种植香蕉的国家约有130多个,而亚洲和非洲等发展中国家是香蕉主要种植区。香蕉生长迅速,经济价值高,营养成分丰富,是很多地区的经济支柱,在亚洲和非洲以靠香蕉为生的人约有5亿多。据联合国粮农组织(fao)认定,香蕉是一部分发展中国家的主要口粮,是仅次于水稻、小麦、玉米之后的第四大粮食作物。香蕉枯萎病(fusariumoxysporumf.sp.cubense)又称香蕉巴拿马病、黄叶病,是由尖孢镰刀菌古巴专化型病菌侵染而引起,破坏香蕉维管束,并导致植株死亡的一种毁灭性土传病害(stoveretal.,1972)。香蕉枯萎病的危害性已蔓延至世界各国,近年来世界许多香蕉生产国家和地区关于该病的发生报道甚多。目前在亚洲、非洲、拉丁美洲等热带及亚热带植蕉区普遍发生,严重影响了世界各地香蕉产业的发展。目前枯萎病的防治主要从育种、化学防治和生物防治等几方面入手,各类研究也较多。但大田实践研究表明,诸多防控措施的防治效果都不明显,作用甚微。而生物防治作为香蕉枯萎病的防治措施之一,是目前公认的最安全、最有效的土传病害防治方法。生物防治在保持生态平衡、环境稳定的同时,也符合农业可持续发展的战略路线和方针。技术实现要素:本发明的目的在于克服现有技术中的不足,提供一种复合菌剂以及一种复合微生物菌肥及其制备方法和应用。本发明的第一个方面是提供一种复合菌剂,所述复合菌剂含有厦门芽孢杆菌、南海芽孢杆菌、解淀粉芽孢杆菌和东方醋酸菌中的两种或以上。其中,所述厦门芽孢菌为厦门芽孢杆菌xjc-hk-7(bacillusxiamenensisxjc-hk-7),在中国典型培养物保藏中心登记保藏,保藏编号为cctccno:m2017619。其中,所述南海芽孢杆菌为南海芽孢杆菌xjc-ys-26(fictibacillusnanhaiensisxjc-ys-26),在中国普通微生物菌种保藏管理中心登记保藏,保藏编号为cgmccno.19591。其中,所述解淀粉芽孢杆菌为解淀粉芽孢杆菌xjc-z-9(bacillusamyloliquefaciensxjc-z-9),在中国普通微生物菌种保藏管理中心登记保藏,保藏编号为cgmccno.19593。其中,所述东方醋酸菌为东方醋酸菌xjc-c(acetobacterorientalisxjc-c),在中国普通微生物菌种保藏管理中心登记保藏,保藏编号为cgmccno.19592。优选地,根据按照有效活菌数量计,所述复合菌剂中,如果存在厦门芽孢杆菌,则所述复合菌剂含有厦门芽孢杆菌1-100份(例如1份、5份、10份、20份、30份、40份、50份、60份、70份、80份、90份、100份等);如果存在南海芽孢杆菌,则所述复合菌剂含有南海芽孢杆菌1-100份(例如1份、5份、10份、20份、30份、40份、50份、60份、70份、80份、90份、100份等);如果存在解淀粉芽孢杆菌,则所述复合菌剂含有解淀粉芽孢杆菌1-100份(例如1份、5份、10份、20份、30份、40份、50份、60份、70份、80份、90份、100份等);如果存在东方醋酸菌,则所述复合菌剂含有东方醋酸菌1-100份(例如1份、5份、10份、20份、30份、40份、50份、60份、70份、80份、90份、100份等)。优选地,所述复合菌剂含有所述南海芽孢杆菌和所述解淀粉芽孢杆菌。优选地,所述复合菌剂含有所述厦门芽孢杆菌和所述南海芽孢杆菌。优选地,所述复合菌剂含有所述解淀粉芽孢杆菌和所述东方醋酸菌。优选地,所述复合菌剂含有所述厦门芽孢杆菌、所述解淀粉芽孢杆菌和所述东方醋酸菌。优选地,所述复合菌剂含有所述南海芽孢杆菌、所述解淀粉芽孢杆菌和所述厦门芽孢菌。优选地,所述复合菌剂含有所述南海芽孢杆菌、所述解淀粉芽孢杆菌和所述东方醋酸菌。优选地,所述复合菌剂含有所述南海芽孢杆菌、所述解淀粉芽孢杆菌、所述厦门芽孢菌和所述东方醋酸菌。本发明的第二个方面是提供如本发明第一方面所述的复合菌剂的发酵液或发酵液的过滤液。本发明的第三个方面是提供一种复合微生物菌肥,其含有本发明第一方面所述的复合菌剂的发酵液或发酵液的过滤液。本发明的第四个方面是提供如本发明第一方面所述的复合菌剂、或者本发明第二方面所述的发酵液或发酵液的过滤液、或者本发明第三方面所述的复合微生物菌肥在制备防治香蕉枯萎病制剂中的应用。本发明的第五个方面是提供如本发明第一方面所述的复合菌剂、或者本发明第二方面所述的发酵液或发酵液的过滤液、或者本发明第三方面所述的复合微生物菌肥在制备促进香蕉幼苗生长的制剂中的应用。本发明的第六个方面是提供如本发明第一方面所述的复合菌剂、或者本发明第二方面所述的发酵液或发酵液的过滤液、或者本发明第三方面所述的复合微生物菌肥在制备提高香蕉抗逆能力的制剂中的应用。本发明的第七个方面是提供一种如本发明第三方面所述的复合微生物菌肥的制备方法,在发酵营养液中接入本发明第一方面所述的复合菌剂进行发酵培养。优选地,发酵营养液中的碳氮比为25:1。例如由红糖和豆粕加适量水制成的碳氮比为25:1的发酵营养液。本发明将不同功能微生物组合形成复合菌剂,对香蕉枯萎病有良好的防控效果,还能促进香蕉幼苗的生长,提高香蕉抗逆能力等,本发明的复合菌剂经发酵后可获得高效、稳定、群落多样性丰富的复合微生物菌肥,能在土壤中很好的定殖,协同促进土壤益生菌和拮抗菌的生长繁殖,增加土壤微生物多样性,进而抑制土壤中病原微生物的生长和繁殖,优化土壤微生物的群落结构和影响土壤微生物优势种群。附图说明图1为菌株xjc-ys-26系统发育树。图2为菌株xjc-z-9系统发育树。图3为菌株xjc-c系统发育树。图4为功能菌共生试验结果,a:平板共生试验;b:培养液共生试验;c:培养液涂布结果。图5为菌群总dna电泳图谱,m:marker,1:f菌群总dna条带,2:ff菌群总dna条带,3:xf菌群总dna条带,4:rf菌群总dna条带,5:fxf菌群总dna条带,6:frf菌群总dna条带,7:xrf菌群总dna条带,8:fxrf菌群总dna条带。图6为菌群16srdna的pcr扩增结果,m:marker,1:f总dnapcr扩增,2:ff总dnapcr扩增,3:xf总dnapcr扩增,4:rf总dnapcr扩增,5:fxf总dnapcr扩增,6:frf总dnapcr扩增,7:xrf总dnapcr扩增,8:fxrf总dnapcr扩增。图7为发酵3d、5d、7dt-rflp图谱分析结果。图8为发酵9d、15d、21dt-rflp图谱分析结果。图9为微生物菌群发酵第3d酶切trfs片段相对丰度。图10为微生物菌群发酵第5d酶切trfs片段相对丰度。图11为微生物菌群发酵第7d酶切trfs片段相对丰度。图12为微生物菌群发酵第9d酶切trfs片段相对丰度。图13为微生物菌群发酵第15d酶切trfs片段相对丰度。图14为微生物菌群发酵第21d酶切trfs片段相对丰度。图15为不同菌群复合微生物菌肥处理对香蕉苗的防病效果。图16为不同菌群复合微生物菌肥处理对香蕉株高的影响。图17为不同菌群复合微生物菌肥处理对香蕉茎粗的影响。图18为不同菌群复合微生物菌肥处理对香蕉生物量的影响。图19为各处理香蕉幼苗叶片的mda含量。图20为各处理香蕉幼苗叶片的cat活性。图21为各处理香蕉幼苗叶片的可溶性糖含量。具体实施方式下面参照附图,结合具体的实施例对本发明作进一步的说明,以更好地理解本发明。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。1试验材料1.1试验试剂本试验所用试剂如表1示。表1主要试剂及来源1.2试验仪器本试验所用主要仪器见表2。表2仪器及产品信息1.3供试菌株本试验供试菌种如表3示。表3供试菌种信息(1)厦门芽孢杆菌xjc-hk-7厦门芽孢杆菌xjc-hk-7(bacillusxiamenensisxjc-hk-7),保藏编号为cctccno:m2017619,保藏日期为2017年10月23日,保藏单位为中国典型培养物保藏中心,地址在中国武汉的武汉大学。本发明的厦门芽孢杆菌xjc-hk-7从采集自海南省临高县的香蕉根际土壤中分离、筛选得到。厦门芽孢杆菌xjc-hk-7的菌学特性等参见中国专利申请号为cn201711435433.x,发明名称为“一种厦门芽孢杆菌及其应用”的专利申请。(2)南海芽孢杆菌xjc-ys-26南海芽孢杆菌xjc-ys-26(fictibacillusnanhaiensisxjc-ys-26),保藏编号为cgmccno.19591,保藏日期为2020年04月20日,保藏单位为中国普通微生物菌种保藏管理中心,从南海软珊瑚中分离、筛选得到。经电子显微镜可观察到,菌株xjc-ys-26在30℃细菌基础培养基(lb液体培养基)上生长良好,经过结晶紫法检测可知,菌株xjc-ys-26属于革兰氏阴性菌。参照《常见细菌系统鉴定手册》对xjc-ys-26菌株进行生理生化分析,结果显示:菌株xjc-ys-26可以利用的碳源有肌醇、木聚糖、麦芽糖、甘露糖、松三糖、蔗糖、海藻糖、葡萄糖、木糖、d-半乳糖、无水乳糖、山梨糖、α-乳糖、鼠李糖、蜜二糖、d-果糖、d-甘露糖,不可以利用的碳源有可溶性淀粉;可以利用的氮源有天门冬酰胺、组氨酸、丝氨酸、酪氨酸、精氨酸、甲硫氨酸、四水合钼酸铵、胱氨酸、缬氨酸、蛋氨酸、苯丙氨酸、草酸铵、甘氨酸,不可以利用的氮源有氯化铵、硝酸铵、色氨酸、硫酸铵、乙酸铵;可以使硝酸盐还原,可以产生尿素酶,v-p反应呈现阳性,不能产生硫化氢、尿素酶、脂酶,mr反应呈现阴性;菌株xjc-ys-26适宜生长的ph范围在6.0~9.0,耐盐性在11%以下。选择细菌16srdna通用引物27f(5′-agagtttgatcctg-gctcag-3′)和1492r(5′-ggttaccttgttacgactt-3′)建立pcr扩增体系进行扩增,如表4。产物纯化后测定基因序列,将菌株的序列分别在genebank和ezbiocloud数据库中进行同源性的比对,应用mega7..软件的相关功能构建邻接距离矩阵法系统发育关系进化树(图1)。菌株xjc-ys-26和fictibacillushalophilus|as8|kp265300(相似性99.58%),fictibacillusnanhaiensis|jsm082006|gu477780(相似性99.86%)和fictibacillusphosphorivorans|ca7t|jx258924(相似性99.17%)序列在同一节点进行聚集,并且具有较近的遗传距离,表明这些序列为同一个属的,与此同时和其他属遗传距离则较远,进化树所得出的结果与序列比对的种属关系所得出的结果相一致,并将生理生化等方面与其模式菌进行对比后,可将xjc-ys-26鉴定为南海芽孢杆菌(fictibacillusnanhaiensis)。表4pcr反应条件(3)解淀粉芽孢杆菌xjc-z-9解淀粉芽孢杆菌xjc-z-9(bacillusamyloliquefaciensxjc-z-9),保藏编号为cgmccno.19593,保藏日期为2020年04月20日,保藏单位为中国普通微生物菌种保藏管理中心,从南海软珊瑚中分离、筛选得到。参照《常见细菌系统鉴定手册》对xjc-z-9菌株进行生理生化分析,结果显示:菌株xjc-z-9可以利用的碳源有麦芽糖、甘露醇、蔗糖、海藻糖、葡萄糖、d-半乳糖、无水乳糖、α-乳糖、、d-果糖、可溶性淀粉、d-甘露糖,不可利用的碳源有肌醇、木聚糖、松三糖、木糖、山梨醇、鼠李糖、蜜二糖;可利用的氮源有天门冬酰胺、组氨酸、精氨酸、硝酸铵、甲硫氨酸、硫酸铵、半胱氨酸、缬氨酸、蛋氨酸、色氨酸、苯丙氨酸、甘氨酸,不可利用的氮源有丝氨酸、酪氨酸、氯化铵、四水合钼酸铵、草酸铵、乙酸铵;还可以使明胶液化、硝酸盐水解;不能产生硫化氢、尿素酶、脂酶,不能使淀粉水解,v-p反应和mr反应都呈现阴性;菌株xjc-z-9适合在ph值为5.0~10.0的范围内生长,耐盐性在9%以下。选用细菌16srdna通用引物27f(5′-agagtttgatcctg-gctcag-3′)和1492r(5′-ggttaccttgttacgactt-3′)建立pcr扩增体系进行扩增,如表4。产物经纯化后测定基因序列,将菌株的序列分别在genebank和ezbiocloud数据库中进行同源性的比对,应用mega5.1软件的相关功能构建邻接距离矩阵法系统发育关系进化树(图2)。结果显示,菌株xjc-z-9与芽孢杆菌属(bacillus)的同源性均较高,大多数的序列聚集在同一节点处,并且具有较近的遗传距离,xjc-z-9和bacillusamyloliquefaciens序列在同一节点进行聚集,并且具有较近的遗传距离,表明这些序列为同一个属的,与此同时和其他属遗传距离则较远,进化树所得出的结果与序列比对的种属关系所得出的结果相一致,并将生理生化等方面与其模式菌进行对比后,可将xjc-z-9鉴定为解淀粉芽孢杆菌。(4)东方醋酸菌xjc-c东方醋酸菌xjc-c(acetobacterorientalisxjc-c),保藏编号为cgmccno.19592,保藏日期为2020年04月20日,保藏单位为中国普通微生物菌种保藏管理中心,从南海软珊瑚中分离、筛选得到。参照《常见细菌系统鉴定手册》对xjc-c菌株进行生理生化分析,结果显示:菌株xjc-c可利用碳源有肌醇、木聚糖、麦芽糖、甘露糖、松三糖、蔗糖、海藻糖、葡萄糖、木糖、d-半乳糖、无水乳糖、山梨糖、α-乳糖、蜜二糖、d-果糖、可溶性淀粉、d-甘露糖,不可利用碳源有鼠李糖;可利用氮源有天门冬酰胺、组氨酸、丝氨酸、甲硫氨酸、胱氨酸、缬氨酸、蛋氨酸、色氨酸、苯丙氨酸、草酸铵,不可利用氮源有酪氨酸、精氨酸、氯化铵、硝酸铵、硫酸铵、四水合钼酸铵、乙酸铵、甘氨酸;可以使硝酸盐还原、淀粉水解、明胶液化,不能产生硫化氢、尿素酶、脂酶,v-p反应和mr反应都呈现阴性;菌株xjc-c适宜生长的ph范围在5.0~9.0,耐盐性在13%以下。选用细菌16srdna通用引物27f(5′-agagtttgatcctg-gctcag-3′)和1492r(5′-ggttaccttgttacgactt-3′)建立pcr扩增体系进行扩增,如表4。产物经纯化后测定基因序列,将菌株的序列分别在genebank和ezbiocloud数据库中进行同源性的比对,应用mega5.1软件的相关功能构建邻接距离矩阵法系统发育关系进化树(图3)。结果显示,菌株xjc-c与醋酸杆菌属(acetobacter)的同源性均较高,大多数的序列聚集在同一节点处,并且具有较近的遗传距离,xjc-c和acetobacterorientalis序列在同一节点进行聚集,并且具有较近的遗传距离,表明这些序列为同一个属的,与此同时和其他属遗传距离则较远,进化树所得出的结果与序列比对的种属关系所得出的结果相一致,并将生理生化等方面与其模式菌进行对比后,可将xjc-c鉴定为东方醋酸菌。1.4pcr扩增引物本试验pcr扩增引物均由上海生工生物工程有限公司合成,引物信息见表5。表5pcr扩增引物1.5主要培养基本研究主要供试培养基,见表6。表6主要培养基及配方1.6供试香蕉苗香蕉组培苗均为生长较为一致,5~6叶期的健康巴西蕉杯苗,由中国热带农业科学院儋州组培中心提供。1.7供试发酵基质豆粕和红糖均购自海南省海口市粮油综合批发市场。1.8供试土壤试验所用土壤取自海口市龙华区(北纬n19°59′7.09″东经e110°19′24.97″),土质为少砾粘土,理化性状指标为:含0.59%的有机质,0.09%的全氮(n),ph为4.45,速效钾(k2o)含量为47.2mg/kg,有效磷(p2o5)含量为3.2mg/kg,碱解氮(n)含量为52.0mg/kg。1.9主要分析软件表7主要分析软件及网址2试验方法2.1菌株共生性试验配置lb营养培养基,121℃灭菌20min备用。将培养24h的待试菌株按5%的接种量,接种于同一固体营养培养基平板和液体培养液中,进行菌群组合。平板在恒温培养箱30℃倒置培养,液体培养液于30℃,180rpm/min摇床培养,3~5d后,观察菌株在平板上生长过程中相互间有无拮抗或抑制作用存在。液体培养基采用稀释平板涂布法,两者结合分析菌株间的共生性。2.2复合微生物菌肥的制备经海口市农业科学院测得,豆粕含氮量为7.0%,c/n为6.76,红糖含碳量为42.06%。本试验依据豆粕碳氮比和红糖的含碳量,调节基质碳氮比为25:1,红糖和豆粕的总量为250g,即豆粕63.7g,红糖186.3g,无菌水1000ml,配制成红糖和饼肥混合液,装入5l的三角瓶中供试。分别配置lb液体培养基,分装在250ml三角瓶中,于121℃灭菌20分钟,待冷却后接入新鲜的供试菌种,在28~30℃条件下,180rpm/min摇床培养3天后,按表8的菌种组合以5%的接菌量接入新配置的发酵营养液中,于28~30℃,180rpm/min摇床条件下,发酵培养。分别在3d、5d、7d、9d、15d、和21d取样,测定复合微生物菌肥群落结构稳定性。表8菌种组合菌群代号菌种组合f不加菌ffxjc-hk-7、xjc-ys-26(有效活菌数比例为1:1)xfxjc-ys-26、xjc-z-9(有效活菌数比例为1:1)rfxjc-z-9、xjc-c(有效活菌数比例为1:1)fxfxjc-hk-7、xjc-ys-26、xjc-z-9(有效活菌数比例为1:1:1)frfxjc-hk-7、xjc-z-9、xjc-c(有效活菌数比例为1:1:1)xrfxjc-ys-26、xjc-z-9、xjc-c(有效活菌数比例为1:1:1)fxrfxjc-hk-7、xjc-ys-26、xjc-z-9、xjc-c(有效活菌数比例为1:1:1:1)2.3基于t-rflp技术构建菌群群落结构动态分析2.3.1饼肥复合微生物菌肥总dna的提取(1)准确吸取1ml新鲜复合微生物菌肥样品到干净的离心管中,加入1ml的抽提液,加入10μl的蛋白酶k和50μl的溶菌酶,涡旋1~2min,充分混匀后37℃水浴15min(每隔2~3min剧烈震荡混匀)。(2)加入100μl溶液b,涡旋1~2min,充分混匀后65℃水浴10min(每隔2~3min剧烈震荡混匀)。(3)10,000rpm离心10min取上清至新的1.5ml离心管。(4)加入1/3体积的蛋白沉淀液,充分颠倒混匀。(5)冰浴8min,13,000rpm离心10min取上清。(6)纯化柱的处理:在纯化柱中间加入500μl的溶液c,静置1min,10,000rpm离心过滤30s,弃滤液。(此步骤是为了增加柱子过滤杂质及腐殖酸的能力)(7)将步骤(5)得到的上清液加入到处理过的纯化柱中,低速离心(4000rpm左右)过滤,收集下滤液(下滤液含dna)至新的1.5ml离心管中。(8)准确估计下滤液的体积,加入0.6倍体积的异丙醇,充分混匀,13,000rpm离心10min,小心倒掉上层悬液,倒扣离心管2min晾干,最后用30μl洗脱缓冲液eb溶解沉淀即可。(注:若沉淀还不是很干净,还可以用70%乙醇洗涤沉淀两次,最后用洗脱缓冲液eb溶解)(9)取5μl已溶解的总dna,与1μlloadingbuffer混匀后经1%琼脂糖凝胶电泳检测,有条带的dna于-20℃冰箱中保存。2.3.2细菌16srdna的pcr扩增16srdna引物:以27f、1492r双向引物进行pcr扩增,27f5′端用fam标记。pcr反应体系与条件分别如表9和表10所示。其中2×taqpcrmastermix中含taqdnapolymerase1.25u,dntps0.4mm,mg2+4mm。50μlpcr产物用1.5%的tae-琼脂糖凝胶进行电泳检测,凝胶成像仪下观测目的dna条带并记录。表916srdna的pcr扩增反应体系表1016srdna的pcr扩增反应条件2.3.3pcr扩增产物凝胶回收纯化pcr扩增产物凝胶回收步骤:(1)在紫外灯下切下含有目的dna的琼脂糖凝胶,用纸巾吸尽凝胶表面液体并切碎。计算凝胶重量(提前记录1.5ml离心管重量),该重量作为一个凝胶体积(如100mg=100μl体积)。(2)加入3个凝胶体积的bufferde-a,混合均匀后于75℃加热(低熔点琼脂糖凝胶于40℃加热),间断混合(每2~3min),直至凝胶块完全熔化(约6~8min)。(3)加0.5个bufferde-a体积的bufferde-b,混合均匀,当分离的nda片段小于400bp时,需再加入1个凝胶体积的异丙醇。(4)吸取步骤(3)中的混合液,转移至dna制备管(置于2ml离心管-试剂盒内提供)中,12,000×g离心1min,弃滤液。(5)将制备管置回2ml离心管,加500μlbufferw1,12,000×g离心30s,弃滤液。(6)将制备管置回2ml离心管,加700μlbufferw2,12,000×g离心30s,弃滤液。以同样的方法再用700μlbufferw2洗涤一次,12,000×g离心1min。(7)将制备管置回2ml离心管中,12,000×g离心1min。(8)将制备管置于1.5ml离心管中,在制备膜中央加25~30μleluent或去离子水,室温静置1min。12,000×g离心1min洗脱dna。(9)将(8)中洗脱好的dna离心管置于95℃水浴锅中水浴2min后,于-20℃冰箱保存备用。2.3.4限制性内切酶酶切反应纯化后的pcr产物用mspⅰ酶进行单酶切,酶切反应体系见表11。体系在1.5ml离心管配制后,于37℃水浴锅中温育4h,65℃温度下终止反应30min。由abi3730xldnaanalyzer对酶切产物进行毛细管电泳检测。表11mspⅰ的酶切反应体系2.3.5t-rflp图谱与数据统计分析样品t-rflp结果用软件peakscannersoftwarev1.0分析,数据输出前需先设定片段阈值,末端限制性片段(t-rfs)长度为50bp~500bp,峰面积占总面积百分比≥0.5%,荧光强度>50个fu(荧光单位)的trfs视为有效峰,每个有效trfs代表一个otu,可作群落丰富度分析,并通过网站(http://trflp.limnology.wisc.edu/index.jsp)检索每个有效trfs片段所代表的微生物类群。以有效trfs片段的相对峰面积(pi)作为对应otu的相对丰度,相对峰面积可表示为:pi=ni/n×100%,式中ni表示第i个trfs的峰面积,n表示i所在图谱中有效峰的总面积(dunbarj,2001)。其他数据统计分析利用spss19.0和microsoftexcel2003完成。根据图谱中otu的数目以及相对峰面积值,通过以下公式计算多样性指数:(1)香浓指数(shannon-wienerindex)h=-∑(ni/n)ln(ni/n)=-∑pilnpi。(2)均匀度指数(evennessindex)e=h/hmax(其中,hmax=lns)。2.4盆栽试验盆栽试验于2014年5~7月在中国热带农业科学院热带生物技术研究所温室进行,温室环境条件控制为:湿度为70%,温度为28℃左右,自然光照。试验设10个处理:(1)病原菌未处理:空白(施用清水);(2)病原菌处理:ck(施用清水);f(施不加菌复合微生物菌肥);ff(施ff菌群复合微生物菌肥);xf(施xf菌群复合微生物菌肥);rf(施rf菌群复合微生物菌肥);fxf(施fxf菌群复合微生物菌肥);frf(施frf菌群复合微生物菌肥);xrf(施xrf菌群复合微生物菌肥);fxrf(施fxrf菌群复合微生物菌肥)。本研究选用foc4为枯萎病试验病菌,采用伤根浸菌法接种。选取长势一致、有5~6片叶子的香蕉幼苗,剪掉第二条主根,在稀释浓度为106cfu/ml的病原菌悬浮液中浸泡30min后,移栽至装土量为700g的塑料盆钵中,并在香蕉幼苗根际土壤处浇灌20ml的病原菌悬浮液,待香蕉苗染病后,按不同处理施入稀释50倍的复合微生物菌肥,每株200ml,ck施入等量清水;每隔5d再重复施入各处理液,共计7次。每个处理各设3个重复,每个重复香蕉苗盆栽为10株。试验期间,各处理的其它管理措施均一致。2.5测定项目与方法2.5.1病情指数及防病效果的统计在香蕉移栽第60d时,记录各处理每株香蕉正常叶片数和黄化叶片数,并计算病情指数和防控效果。香蕉枯萎病分级标准:0级,健株;1级,有25%黄化病叶;3级,有25%~50%的黄化病叶;5级,有50%~90%黄化的病叶;7级,叶片全部黄化,植株死亡。香蕉病情指数及防病效果计算:2.5.2不同处理香蕉植株生理指标测定蕉苗移栽后,分别在35d、45d和55d,测定各处理上部完全展开的第二片叶片叶绿素含量,并在第55d记录株高、叶面积、假茎围、鲜重和干重、根系指标。其中叶绿素测定采用乙醇浸提法,用uv1000型紫外分光光度计测定。叶面积、根系长度及直径均采用la2400scanner根系扫描仪和洗根测量分析软件进行测定。2.6不同处理香蕉植株抗病相关酶活性测定分别于复合微生物菌肥处理的第1d、10d、20d、30d、40d时,取香蕉植株最上部第二叶片的主脉附近部位,清洗后测定香蕉植株抗病相关酶活性。2.6.1丙二醛(mda)测定初提液制备:剪取各处理第二片香蕉叶,蒸馏水反复清洗三次,风干后称取0.5g叶片,剪成1cm左右小段,放入研钵并加入适量pvpp及4ml50mm的ph7.8的磷酸缓冲液(pbs)进行研磨,磨碎后再加入4mlpbs溶液洗涤研钵,并转至15ml离心管4℃下12000rmp离心20min,收集上清液,mda含量的测定用硫代巴比妥酸(tba)法(赵世杰等,1994)。取液2ml(对照用等量蒸馏水代替),加入2ml0.6%tba溶液,沸水浴上反应15min后迅速冷却,9000rpm离心机离心10min。取上清液,测定450nm、532nm和600nm波长下的吸光值。按照下式计算mda浓度,然后再算出其单位鲜重组织中的含量。mda浓度(μmol.l-1)=6.45(od532-od600)-o.56od4502.6.2过氧化氢酶(catolase,cat)cat采用王学奎(2006)方法测定。称取0.5g叶片,剪成1cm左右小段,放入研钵后,加入2ml4℃的pbs溶液研磨,转移至25ml容量瓶定容。置于4℃冰箱静置10min,取上清液4000rmp离心15min,收集上清液为粗提液,4℃保存待用。沸水浴1min以杀死酶液制作调零对照管,取粗提液0.2ml+pbs1.5ml+蒸馏水1.0ml,25℃条件下逐管加入0.3ml0.1mol/l的h2o2,每隔1min测定一次od240,共四次。结果计算:以1min内a240减少0.1的酶量为1个酶活单位(u)。2.6.3可溶性糖可溶性糖含量采用蒽酮比色法测定(王学奎,2006),称取0.2g叶片,加入5ml蒸馏水,塑料薄膜封口,于沸水浴中提取30min,提取液滤于25ml容量瓶,蒸馏水反复冲洗试管定容。吸取样品提取液0.5ml于20ml刻度试管中,加入蒸馏水1.5ml。再向试管中加入0.5ml蒽酮乙酸乙酯和5ml浓硫酸,振荡后沸水浴1min,取出后自然冷却至室温,以2ml蒸馏水加入0.5ml蒽酮乙酸乙酯和5ml浓硫酸为空白对照,测定od630。2.7数据处理与统计分析数据处理和统计分析均用spss19.0和microsoftexcel2003完成。3结果与分析3.1复合微生物菌肥制备中菌株共生性筛选如图4所示,将待试菌株分别接种到营养培养基平板上,培养结果发现,菌株组合均能在营养培养基上共同生长,相互之间没有拮抗性,共生性比较强,适合做下一步菌群构建试验;待试菌株的培养液涂布结果表明,在营养液中,所接各类微生物均可生长,且生长数量均匀,彼此之间无相互抑制作用,适合共同发酵和菌群的构建。3.2复合微生物菌肥群落多样性t-rflp动态分析3.2.1用于t-rflp的细菌16srdna及pcr扩增通过土壤基因组dna快速提取试剂盒(升级版)提取8种菌群复合微生物菌肥样品的总dna,经1.5%的琼脂糖凝胶电泳,在凝胶成像仪上观察,电泳图谱如图5所示。以样品总dna为模板,细菌16srdna通用引物fam-27f、1492r进行pcr扩增,产物经1.5%的琼脂糖凝胶电泳,目标条带长度约为1500bp,如图6。3.2.2细菌16srdna区域的限制性酶切细菌16srdna纯化的pcr产物用回收试剂盒回收纯化后,利用mspⅰ酶对其进行单酶切,37℃温育4h后,65℃终止反应30min。吸取5μl酶切产物经1.5%琼脂糖凝胶电泳,剩余产物密封后用锡箔纸避光保藏,并送测,结果见下述3.2.3、3.2.4、3.2.5。3.2.3t-rflp图谱及分析从细菌的t-rflp图谱(图7-8)和表12可以看出,不同微生物菌群发酵样品中的细菌类群差别很大,而且随着发酵时间的延长,各菌群样品中的trfs数量也呈线性动态变化趋势。在发酵第3d,f样品中有29个out,但随着发酵时间延长,trfs数量呈降低趋势,且降低速率迅速,细菌类群不能稳定存在,相对丰度最大的trfs碱基长度分布在50~100bp区间。ff样品中的trfs数量,呈现降低-升高-降低-升高-降低剧烈波动现象,不能保持稳定发酵,主要优势trfs长度为50~150bp。xf菌群发酵过程中,随着发酵时间的增长,trfs数量基本保持稳定状态,平均约为20个out,优势trfs分布在147~233bp区间。rf和fxf菌群发酵过程中,trfs数量波动幅度较大,均在第7d达到最大值,out个数分别为49和56,不能稳定存在于复合微生物菌肥中。frf样品的trfs数量随时间的增长有微升高的趋势,但整体个数较少,类群优势不明显。xrf样品发酵过程中,trfs数量呈明显的下降趋势,从第3d到第21d,复合微生物菌肥中由42个out降到11个out。而fxrf菌群在发酵过程中,随着发酵时间的增长,trfs个数基本稳定,始终保持在32个out左右,其优势种群能稳定存在于复合微生物菌肥中,群落结构相对稳定。表128个菌群样品中trfs数量3.2.4基于t-rflp菌群微生物群落多样性动态分析根据t-rflp图谱中有效trfs的数目(out)及其相对峰面积值(area),分别计算了8个构建菌群复合微生物菌肥时间增长动态样品的细菌多样性指数(表13)和均匀度指数(表14)。结果表明,8个菌群发酵过程中,从发酵第3d~21d,随着时间的增长,各菌群复合微生物菌肥中细菌多样性均发生了相应的变化,且变化较明显,除fxrf菌群外,其他菌群均表现为无规则消长波动状态,其菌群在发酵培养过程中不稳定,菌群内部细菌生长繁殖情况复杂多元化。而反观fxrf菌群,fxrf菌群的多样性指数与均匀度指数平均值最高,其多样性指数分别在发酵第3d、5d、7d、9d和21d均显著高于其他菌群(p<0.05),而均匀度指数从第3d~21d整个发酵过程中,均显著高于其他菌群(p<0.05),且随着发酵时间的变化,fxrf的多样性指数与均匀度指数相对稳定。表138个菌群样品中细菌群落的多样性指数表148个菌群样品中细菌群落的均匀度指数3.2.5不同菌群随时间动态变化trfs片段相对丰度分析样品总16srdnapcr纯化产物经mspi酶切后,分析测得t-rflp峰值图谱中,每个有效trfs至少代表一个微生物类种,而有效trfs峰数量反映了样品中细菌种类的多寡,峰面积(area)大小则反映相对应种菌群中细菌的含量,相对丰度pi则表示该菌群样品的第i个trfs片段峰面积占总面积的相对比。如图9,在菌群发酵第3d时,各菌群间的trfs片段无显著性差异,各菌群相对含量大于1%且长度在50~500bp区间的trfs片段,f为11条,ff为13条,xf为30条,rf为17条,fxf为24条,frf为12条,xrf为27条,fxrf为30条,此结果与3.2.3中的结果基本保持一致。将不同片段按照相对丰度大小比较,trfs片段主要集中在100~200bp及400~500bp区间内,且以150~200bp区间的trfs片段最多,相对丰度最大,则400~500bp区间次之。其中f菌群的相对丰度最低,平均在10%左右,主要分布在50~400bp区间内;rf和xrf菌群仅分布在50~200bp区间,相对丰度平均值在30%左右;ff、xf、fxf、frf、fxrf菌群相对丰度均较大,且在100~500bp每个区间都有分布,但xf、fxf、frf的trfs片段在各区间分布不均匀,波动性较大,而ff和fxrf的trfs片段在各区间分布相对较均匀。如图10,在菌群发酵第5d时,各菌群间的trfs片段差异性较显著,各菌群相对含量大于1%且长度在50~500bp区间的trfs片段,f为6条,ff为10条,xf为18条,rf为18条,fxf为15条,frf为12条,xrf为20条,fxrf为30条,此结果与3.2.3中的结果基本保持一致。将不同片段按照相对丰度大小比较,trfs片段主要集中在50~100bp、150~200bp及400~500bp区间内,且以150~200bp区间的trfs片段最多,相对丰度最大,而400~500bp区间次之。除fxrf菌群分布较均匀,相对丰度大小消长变化不明显外,其他菌群的相对丰度均变化较突出,消长动态显著,大小差距大,在整个区间内分布极不均衡。如图11,在菌群发酵第7d时,各菌群间的trfs片段显著性较显著,各菌群相对含量大于1%且长度在50-500bp区间的trfs片段,f为5条,ff为36条,xf为19条,rf为36条,fxf为35条,frf为15条,xrf为34条,fxrf为33条,此结果与3.2.3中的结果基本保持一致。将不同片段按照相对丰度大小比较,trfs片段在50~500bp区间内均有分布,以150~400bp区间的trfs片段最多,400~500bp区间相对丰度最大,而50-100bp区间次之。其中f菌群trfs片段只在50~100bp和400~500bp区间分布,相对丰度差异性较大,分别为5.62%和94.38%;frf菌群相对丰度差异性也较大,分布区间狭隘;而其他菌群trfs片段在100~500每个区间均有分布,且分布较均匀,相对丰度平均值高,波动性较小。如图12,在菌群发酵第9d时,各菌群间的trfs片段显著性不显著,各菌群相对含量大于1%且长度在50-500bp区间的trfs片段,f为8条,ff为10条,xf为7条,rf为15条,fxf为21条,frf为9条,xrf为23条,fxrf为32条,此结果与3.2.3中的结果基本一致。将不同片段按照相对丰度大小比较,trfs片段在50~500bp区间内均有分布,以50~100bp及200~500bp区间的trfs片段最多,400~500bp相对丰度最大,以50~100bp区间次之。其中ff、rf、fxf、xrf和fxrf菌群trfs片段在50-500bp各区间都有分布,且分布较均匀,除xrf菌群外,各菌群的相对丰度也都较大。而xf和frf虽分布不均匀,但相对丰度却相对较大。如图13,在菌群发酵第15d时,各菌群间的trfs片段显著性极不显著,各菌群相对含量大于1%且长度在50-500bp区间的trfs片段,f为7条,ff为27条,xf为57条,rf为24条,fxf为19条,frf为26条,xrf为21条,fxrf为32条,此结果与3.2.3中的结果基本一致。将不同片段按照相对丰度大小比较,trfs片段在50~500bp区间内均有分布,trfs片段主要集中在150~200bp区间,相对丰度也最大。最大相对丰度虽是rf种群,且分布在150~200区间的最大相对丰度为89.37%,但以f、ff和fxrf菌群trfs片段分布最均匀,平均相对丰度比其他菌群大,且各区间的相对丰度变化不显著,菌群稳定性也相对较好。如图14,在菌群发酵第21d时,各菌群间的trfs片段显著性较显著,各菌群相对含量大于1%且长度在50~500bp区间的trfs片段,f为6条,ff为9条,xf为8条,rf为15条,fxf为31条,frf为12条,xrf为10条,fxrf为31条,此结果与3.2.3中的结果基本一致。将不同片段按照相对丰度大小比较,trfs片段在50~500bp区间内均有分布,而trfs片段主要集中在50~100bp区间,相对丰度也最大,400~500bp区间次之,其他区间分布都较少。f菌群只在50~100bp区间有分布,相对分度最大,为100%,fxf和fxrf菌群rfs片段分布较均匀,相对丰度值变化较小,每个区间内保持稳定。而其他菌群在50~500bp区间虽均有分布,但分布十分均匀,相对丰度变化较显著,波动性较大。综合不同菌群动态发酵天数下,trfs片段在不同区间的大小分布和相对丰度可知,在发酵第3d,除rf菌群仅分布在50~200bp区段外,其他各菌群trfs片段均在50~500bp每个区段都有分布,且分布较为均匀。发酵第5d,菌群相对丰度出现波动现象,f菌群、xf菌群和frf菌群trfs片段区段分布缩小,均分布在50~400bp区段;rf菌群trfs片段继续分布在50~200bp区段,其他菌群分布区段未有变化,分布较均匀。发酵第7d,f菌群trfs片段分布区段缩减为50~100bp和400~500bp,frf菌群分布变为50~100bp、150~200bp和400~500bp区段,且分布明显不均匀;而其他菌群,每个区段均有分布,分布较均匀,较稳定。发酵第9d,除fx菌群和frf菌群在200~400bp区段无相对丰度外,其他菌群trfs片段在整个有效区段均有分布。发酵第15d,rf菌群和xrf菌群trfs片段分布区段变为50~200bp,相对丰度大小差异性显著;f菌群和fxf菌群在200~400bp区间没有trfs片段分布。发酵第21d,f菌群仅在50~100bp区间有trfs片段分布,相对分度为100%;ff菌群在100~150bp的相对丰度和xf菌群和frf菌群在150~200bp区段的相对丰度均为0,其他菌群在各区段分布较均匀。比较各菌群在不同天数变化情况下,trfs片段大小分布和相对丰度动态变化,可以看出,随着发酵时间的增长,菌群群落结构会发生相应的动态变化,不能始终保持稳定状态,只有ff菌群、xrf菌群和fxrf菌群群落结构相对稳定,但ff菌群和xrf菌群trfs片段分布不太均匀,故此,fxrf菌群在发酵过程中能保持trfs片段大小和相对丰度分布均匀,群落结构稳定。3.3不同处理对香蕉枯萎病病情指数及防控效果的影响由表15和图15可以看出,染病香蕉幼苗经不同拮抗菌群复合微生物菌肥处理的香蕉苗,枯萎病病情指数和防控效果之间存在显著性差异,且成活株数也不尽相同。拮抗菌群复合微生物菌肥处理过的香蕉植株,其病情指数均显著低于ck(50.95),其中以fxrf菌群处理的病情指数最低,为11.78,与其他处理间差异极显著(p<0.05)。其次为fxf、xf和frf处理,病情指数分别为14.77、16.19和17.01,均低于20.00,三者无显著性差异。而f、ff、rf和xrf处理,4个处理的病情指数均大于20.00,f处理的高达35.48。各处理对香蕉枯萎病的防控效果相对较好,除了ck为9.60%,其他处理防控效果均达50%以上,以fxrf处理的防控效果最佳,高达82.12%,fxf、xf和frf处理的防控效果也分别达到73.91%和68.32%和63.76%,xrf、ff和rf处理的防控效果分别为57.94%、53.67%和50.54%,而f处理的防控效果仅高于ck,为16.53%。表15不同处理对香蕉枯萎病病情指数及防控效果的影响注:表中各列不同字母表示在0.05水平上差异显著3.4不同菌群复合微生物菌肥处理对香蕉叶片叶绿色含量的影响病原菌的侵染植物植株,会导致植物组织中的叶绿素被破坏或叶绿素的合成受抑制,进而致使植物的光合作用受阻,影响植物生长发育。由表16可知,病原菌未浸染的香蕉植株(空白),香蕉叶片叶绿素含量处于中等水平,随着时间的增加,后期由于营养等因素,叶绿素含量下降明显。而被病原菌浸染过得香蕉苗,在发病后用不同菌群复合微生物菌肥处理,各复合微生物菌肥处理的香蕉叶片叶绿素含量之间存在显著性差异。结果显示,各复合微生物菌肥处理的香蕉叶片叶绿素含量均显著高于ck,且加拮抗功能菌菌群复合微生物菌肥处理的香蕉叶片叶绿素含量显著高于不加拮抗菌发处理。在3次检测中,除了xrf处理呈现升高后降低趋势,其他各处理随着时间的延长,香蕉叶片叶绿素含量均呈现升高的趋势。移栽后35d、45d和55d,fxrf处理的叶绿素含量均显著高于其他处理,且呈大趋势增长态势,叶绿素含量分别为:0.85、0.95和1.56。结果表明,香蕉枯萎病病原菌可导致香蕉叶片叶绿素含量显著降低,但微生物菌群复合微生物菌肥均可显著提高香蕉叶片的叶绿素含量,对香蕉叶片的生长起促生作用,其中处理fxrf处理效果最佳。表16各处理香蕉叶片叶绿色含量注:各列后面不同的小写字母表示不同处理差异显著性(p<0.05)3.5不同菌群复合微生物菌肥处理对香蕉生理指标的影响植株叶面积大小直接影响植物的光合作用效果,根系是植物吸收养分和水分的重要器官,其形态大小和特征是影响植物养分吸收的重要因素。本研究采用la2400scanner根系扫描仪和洗根测量分析软件,测得各处理香蕉苗的叶面积和根系指标。由表17可知,各菌群复合微生物菌肥处理的香蕉植株叶面积、根长和根直径均显著大于ck,且加拮抗菌菌群复合微生物菌肥处理的香蕉叶面积、根长和根直径均显著高于不加拮抗菌复合微生物菌肥处理;其中fxrf处理的香蕉叶面积、根长和根直径均属最大,分别达1489.79cm2、1393.35cm和1.10mm;fxf处理次之,叶面积、根长和根直径分别为1390.57cm2、1358.46cm和1.06mm;而frf、xf、ff、xrf和rf四个处理间差异性不明显,叶面积、根长和根直径均表现为frf最大,分别为1298.48cm2、1328.17cm和1.03mm。综合结果分析可得,fxrf菌群复合微生物菌肥对香蕉植株促生最显著,主要通过提高香蕉植株根长和根系直径,来提高香蕉植株根系吸收率,进而增大叶面积。表17不同菌群复合微生物菌肥处理对香蕉叶面积及根系生长的影响注:各列后面不同的小写字母表示不同处理差异显著性(p<0.05)3.6不同菌群复合微生物菌肥处理对香蕉株高的影响由图16可以看出,不同菌群复合微生物菌肥处理和未染病的香蕉幼苗的株高均显著高于ck处理,且以同种发酵基质进行发酵,有拮抗功能菌菌群的香蕉幼苗株高显著高于无拮抗菌的复合微生物菌肥处理,香蕉幼苗的株高以fxrf处理最大,显著高于其他处理,高达47.59cm;空白、ff、xf、rf、fxf和xrf处理差异不显著,基本处于中等水平;而f和frf处理略低于其他处理,株高分别为24.25cm和29.63cm,以ck最小,株高仅为8.94cm。由此可见,fxrf菌群处理对香蕉的病害和促生作用最好。3.7不同菌群复合微生物菌肥处理对香蕉茎粗的影响由图17可以看出,不同菌群复合微生物菌肥处理的香蕉幼苗茎粗的变化趋势与香蕉株高基本一致,也表现为同种发酵基质复合微生物菌肥,有拮抗功能菌菌群的香蕉幼苗茎粗显著高于无拮抗菌的复合微生物菌肥处理,且各处理茎粗显著高于ck(假茎粗为3.20cm)。而将各菌群复合微生物菌肥处理作对比发现,以fxrf处理的香蕉茎粗最大,达7.52cm;而rf处理和空白对照次之,茎粗分别为6.94cm和6.80cm,与fxrf处理无显著性差异。而其他处理均处于中上水平,处理间无显著性差异,平均茎粗约为5.80cm,略低于前3个处理。由此可见,菌群复合微生物菌肥不仅能抑制枯萎病,还可提高香蕉植株株高,也能显著增加香蕉的茎粗,以fxrf处理效果最为明显。3.8不同菌群复合微生物菌肥处理对香蕉生物量的影响由图18可知,不同菌群复合微生物菌肥处理的香蕉鲜重和干重均显著高于ck。对于f、ff、xf、rf、fxf、frf、xrf和fxrf8个菌群复合微生物菌肥处理香蕉苗,其鲜重和干重以fxrf处理最高,分别达57.17g和51.13g,显著高于其他处理,且鲜重和干重两者只差较小,表示该处理香蕉苗体内有效生物量较大;鲜重和干重以xf处理和空白对照次之,鲜重为45.82g和44.59g,干重为35.36g和38.70g,二者无显著性差异;ff、rf和fxf三者之间无显著性差异,生物量略低于xf处理和空白;而f、frf、xrf生物量含量最低,显著低于其他处理。由此可知,构建菌群复合微生物菌肥能显著提高香蕉生物量,且fxrf菌群的效果最好,适合后续生产利用。3.9不同菌群复合微生物菌肥处理对香蕉苗抗病相关酶活性的影响3.9.1菌群复合微生物菌肥处理对香蕉苗丙二醛的影响丙二醛(mda)是膜脂过氧化最终分解的产物,该指标常用来检测膜脂过氧化程度,其含量的高低可反映出植物遭受干旱、高温、低温等逆境胁迫时的伤害程度(王爱国等,1986;赵世杰等,1994)。mda及自由基都是对细胞生命活动极为有害的基团,香蕉苗被香蕉枯萎病病菌侵染后,若香蕉苗叶片中mda含量越高,则说明其细胞质膜所受伤害越严重。由图19可知,ck在5次取样过程中mda含量呈显著升高的趋势,且mda含量明显高于其他菌群复合微生物菌肥处理,表明该处理香蕉苗受病原菌侵染严重。而反观空白对照组,该处理香蕉苗未经枯萎病菌处理,整个过程中mda含量始终处于中等水平,基本保持稳定。fxrf处理在整个处理过程中,丙二醛含量始终处于一个较低水平,波动性不大,且显著低于其他处理,丙二醛含量在0.30μmol·l-1左右。除此之外,其他处理的丙二醛含量也明显低于ck,和空白对照保持着上下波动的动态趋势,没有明显的增大或者减小,基本处于中等水平,但又显著高于fxrf处理。由此说明,香蕉苗被枯萎病病菌侵染一段时间后,香蕉苗叶片膜脂过氧化程度加剧,最终导致mda含量升高,但不同菌群复合微生物菌肥处理能缓解和抑制香蕉苗叶片的膜脂过氧化程度,进而抑制mda含量升高的速率及幅度,研究结果显示,以fxrf处理效果最佳,该处理能显著提高香蕉的抗逆能力。3.9.2菌群复合微生物菌肥处理对香蕉叶片过氧化氢酶活性的影响过氧化氢酶(cat)是植物体内一种保护性酶类,该物质存在于植物体所有组织中,植物在生长代谢过程中,所产生的过氧化氢可伤害植物细胞,而植物体内的cat却可以把过氧化氢分解成h2o和o2,以此来协同完成对植物体的保护,是植物体内最重要的活性氧清除系统之一(贾虎森,2001)。由图20可知,空白对照的cat在5次取样过程中均没有显著性变化,始终处理恒定中等水平,相对稳定;ck在整个取样过程中,cat活性波动较小,显著低于其他处理和空白对照,cat活性平均在16.50u·min-1·g-1左右。ff、fxf和fxrf三个处理,cat活性均出现先升高后下降的趋势,整个取样过程曲线图呈抛物线,且三者均在复合微生物菌肥处理后第10d出现峰值,cat活性分别为260.13、216.72和293.75(u·min-1·g-1);而其他处理cat活性在整个取样过程中,彼此间无显著性差异,彼此虽有微消长动态,但变化却不大,基本处于空白对照相对水平,cat活性约为40.50u·min-1·g-1,较为稳定。3.9.3菌群复合微生物菌肥处理对香蕉叶片可溶性糖的影响可溶性糖是植物体内一种渗透调节物质,在逆境压迫情况下,能够维持植物细胞的结构和功能稳定,故此,植物体内可溶性糖含量的高低,与植物的抗逆能力之间存在一定的相关性。由图21可以看出,在接种foc4之后,随着时间的增加,香蕉幼苗体内的可溶性糖含量持续积累,未接病原菌的空白对照处理在整个实验过程中可溶性糖含量相对比较稳定,基本处于平稳状态,变化量不大。在接种foc4后,对香蕉苗处理第1d到第5d,各处理间可的溶性糖含量差异不显著,含量大小基本处于相等水平。而处理后的第10d,ck和fxf两个处理可溶性糖含量出现了明显的降低,含量降低至2.95mg/g和2.20mg/g;rf处理出现峰值,可溶性糖含量达到11.74mg/g。在第15d和21d,fxrf处理和xf处理出现升高趋势,且和其他处理之间差异性显著,显著高于其他处理,含量在21d时分别达到32.11mg/g和25.35mg/g。其他处理在这两天却无显著性差异,含量基本相似。以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1