一种菌群和产油微生物联用生产微生物油脂的方法与流程
本发明属于微生物发酵领域,具体涉及一种菌群和产油微生物联用生产微生物油脂的方法。
背景技术:
生物质废弃物种类多样,包括以木质纤维素、粪污等富含多糖和有机质的物质,其中木质纤维素是自然界含量和产量最为丰富的多糖,粪污等富含有机质的生物质废弃物产量更是随着现代社会对畜牧业的巨大需求急剧飙升。但是由于木质纤维素结构复杂紧密、粪污等含有的有机质种类繁多,采用传统的单菌发酵方式难以有效实现对这些生物质废弃物的高效利用,造成其中富含的糖类和有机质等资源的巨大浪费。近年来的研究显示,相较于纯培养单菌,天然菌群由于存在多菌协同机制,能够更好地模拟自然界中对生物质废弃物的消解过程,因而能够更为高效的实现生物质废弃物的转化利用,获得包括单糖、有机酸醇等在内的多种发酵产物。
微生物油脂是由微生物包括细菌、酵母、霉菌和藻类等在特定条件下通过同化外界碳源,在菌体内合成的脂肪类化合物。微生物产油脂具有单体油脂含量高、生产周期短、生产投入低、不受季节影响等优势。常规方法采用葡萄糖、甘油等作为碳源,采用包括斯达氏酵母、浅白色隐球酵母、弯隐球酵母、斯达氏油脂酵母、产油油脂酵母等作为发酵菌株,虽然能够获得高达65%以上的油脂收率,但是由于葡萄糖、甘油等作为原料成本较高,限制了微生物产油的发展。近年来研究发现,粘红酵母和解脂耶罗维亚酵母等产油酵母不仅能够利用葡萄糖和甘油等价格高昂的原料作为产油碳源,还可以利用包括五碳糖、多种有机酸和醇类物质作为碳源进行油脂的积累。
技术实现要素:
本发明的一个目的是提供一种菌群和产油微生物联用生产微生物油脂的方法。
本发明提供的菌群和产油微生物联用生产微生物油脂的方法包括如下步骤:
1)制备用于降解生物质废弃物的微生物菌群;
2)用所述微生物菌群发酵生物质废弃物,得到发酵产物;
3)用产油微生物对所述发酵产物进行产油发酵培养,得到微生物油脂。
上述方法中,
所述产油微生物为产油酵母、产油细菌或其他能够用于生产微生物油脂的微生物。
上述方法中,
所述制备用于降解生物质废弃物的微生物菌群的方法为如下(1)或(2)或(3)或(4):
(1)将腐殖土在含有微晶纤维素的菌群富集培养基中进行发酵培养,得到发酵液,选取微晶纤维素降解率大于90%的发酵液,其中所含菌群即为所述目的微生物菌群;
(2)将污水在含有粪污的菌群富集培养基中进行发酵培养,得到发酵液,选取总有机碳降解率大于90%的发酵液,其中所含菌群即为目的微生物菌群;
(3)将如下菌混匀得到目的微生物菌群:Clostridium cellulosi、Clostridium stercorarium、Clostridium thermocellum、Tepidanaerobacter acetatoxydans、Thermobacillus composti和Bacillus coagulans;
(4)将如下菌混匀得到目的微生物菌群:Aminobacterium colombiense、Anaerococcus prevotii、Syntrophomonas wolfei、Clostridium thermocellum、Methanosarcina barkeri、Thermanaerovibrio acidaminovorans、Kosmotoga olearia、Alkaliphilus metalliredigens、Psychrobacter cryohalolentis。
上述方法中,所述腐殖土可以是以农林废弃物长期堆放获得或堆肥获得,还可以是自然界植物积累获得。
上述方法中,所述污水可以是生活污水,还可以是工业污水。
上述方法中,所述含有微晶纤维素的菌群富集培养基为将微晶纤维素(获取自西格玛奥德里奇(上海)贸易有限公司)和菌群富集培养基混匀得到的;所述微晶纤维素在所述含有微晶纤维素的菌群富集培养基中的浓度为30g/L;
所述含有粪污的菌群富集培养基为将粪污(获取自北京德青源农业科技股份有限公司)和菌群富集培养基混匀得到的;所述粪污在所述含有粪污的菌群富集培养基中的浓度为100g/L;
所述菌群富集培养基的溶剂为水,溶质及其在菌群富集培养基中的浓度如下:蛋白胨5g/L,酵母粉5g/L,氯化钠5g/L,碳酸钙5g/L,FeSO4·7H2O,0.05g/L,ZnSO4·7H2O 0.05g/L,MnSO4·5H2O 0.005g/L,H3BO30.005g/L,NiCl2·2H2O 0.005g/L,CoCl2·6H2O 0.005g/L,CuCl2·2H2O 0.005g/L,所述菌群富集培养基的pH为8.0±0.1。
上述方法中,(1)中所述的目的微生物菌群主要含有如下:Euryarchaeota、Actinobacteria、Bacterioidetes、Spirochaetes,Cyanobaceteria、Thermotogae、Fusobacteria等七大纲的菌株,具体包括Clostridium cellulosi、Clostridium stercorarium、Clostridium thermocellum、Tepidanaerobacter acetatoxydans、Thermobacillus composti、Bacillus coagulans等纤维素、半纤维素降解菌株;
上述方法中,(2)中所述的目的微生物菌群主要含有如下:Firmicutes、Proteobacteria、Bacterioidetes、Euryarchaeota、Thermotogae,Actinobacteria、Cyanobaceteria、Fusobacteria、Planctomycetes等九大纲的菌株,其中具体包括Aminobacterium colombiense、Anaerococcus prevotii、Syntrophomonas wolfei、Clostridium thermocellum、Methanosarcina barkeri、Thermanaerovibrio acidaminovorans、Kosmotoga olearia、Alkaliphilus metalliredigens、Psychrobacter cryohalolentis等产酸菌株。
上述方法中,
步骤2),所述发酵为将所述微生物菌群、所述生物质废弃物和菌群发酵培养基混匀,发酵;
所述微生物菌群、所述生物质废弃物和所述菌群发酵培养基的配比为(2-3)g:(0-200)g:1L;
步骤3),所述产油发酵为将所述产油微生物、所述发酵产物和产油发酵培养基混匀,产油发酵;
所述产油微生物、所述发酵产物和所述产油发酵培养基的配比为1×106cfu:10g:1L。
上述方法中,
所述生物质废弃物为富含碳源的废弃物,且所述微生物菌群、所述生物质废弃物和所述菌群发酵培养基的配比为(2-3)g:(0-100)g:1L;
或所述生物质废弃物为富含有机质的废弃物,且所述微生物菌群、所述生物质废弃物和所述菌群发酵培养基的配比为(2-3)g:(0-200)g:1L,且所述生物质废弃物中有机碳和有机氮的质量比为(10-50)g:1g。
上述方法中,所述生物质废弃物的质量不为0。
上述方法中,所述微生物菌群、所述生物质废弃物和所述菌群发酵培养基的配比为2g:25g:1L或2g:50g:1L或2g:75g:1L或2g:100g:1L或3g:25g:1L或3g:50g:1L或3g:75g:1L或3g:100g:1L。
上述方法中,
所述发酵的条件为30-75℃、200rpm、厌氧培养72-96h;
所述产油发酵培养的条件为20-40℃、200rpm、通气量0.5-2.0vvm培养72-120h;
在步骤2)和步骤3)之间还包括如下步骤:收集分子量大小为42-1000的发酵产物;
所述收集的方式具体为将发酵产物过截留分子量为500-1000的聚砜滤膜,收集滤液。
上述方法中,所述菌群发酵培养基的溶剂为水,溶质及其在发酵培养基中的浓度如下:蛋白胨2.1g/L,酵母粉1g/L,尿素2.1g/L,氯化钠5g/L,碳酸钙5g/L,FeSO4·7H2O 0.05g/L,ZnSO4·7H2O 0.05g/L,MnSO4·5H2O 0.005g/L,H3BO30.005g/L,NiCl2·2H2O 0.005g/L,CoCl2·6H2O 0.005g/L,CuCl2·2H2O 0.005g/L;所述发酵培养基的pH为8.0±0.1;
所述产油发酵培养基的溶剂为水,溶质及其在产油发酵培养基中的浓度如下:无氨基酵母氮源34g/L,硫酸铵88g/L,酵母提取物2g/L。
上述方法中,所述产油酵母为粘红酵母Kodamaeaohmeri或解脂耶罗维亚酵母Trichosporonoidesspathulata。
上述方法中,所述富含碳源的生物质废弃物为木质纤维素;所述富含有机质的生物质废弃物为粪污或有机废水或有机废渣。
本发明有以下益处:本发明采用生物质废弃物为原料,相较于葡萄糖、甘油等,能大幅度降低生物油脂生产的原料成本,对资源的再利用和降低生物油脂生产过程中碳排放具有重要的意义,而且本发明采用菌群进行生物质废弃物的利用,相较于纯培养单菌,培养过程不需要无菌操作,有效降低了成本,同时菌群中多菌协同效应能更高效的实现生物质中的纤维素和半纤维素等成分降解和转化。
本发明提供了一种菌群和产油微生物联用以生物质废弃物为原料生产生物油脂的方法。该方法利用天然菌群分解生物质废弃物中的多聚糖、蛋白质和脂肪等有机质,将生物质废弃物转化为含有糖、有机酸和醇类的混合有机物,进一步利用产油微生物转化该混合有机物为生物油脂。本发明创造性地结合了天然菌群对于纤维素类生物质的高效降解能力和产油微生物的生物油脂生产能力,不仅有效扩大生物油脂生产的原料来源,而且还简化了生产流程、降低了生产成本、减少了环境污染,为高效转化生物质废弃物产油脂提供了一条低成本的新途径,对国家新能源技术发展具有重要的战略意义。
附图说明
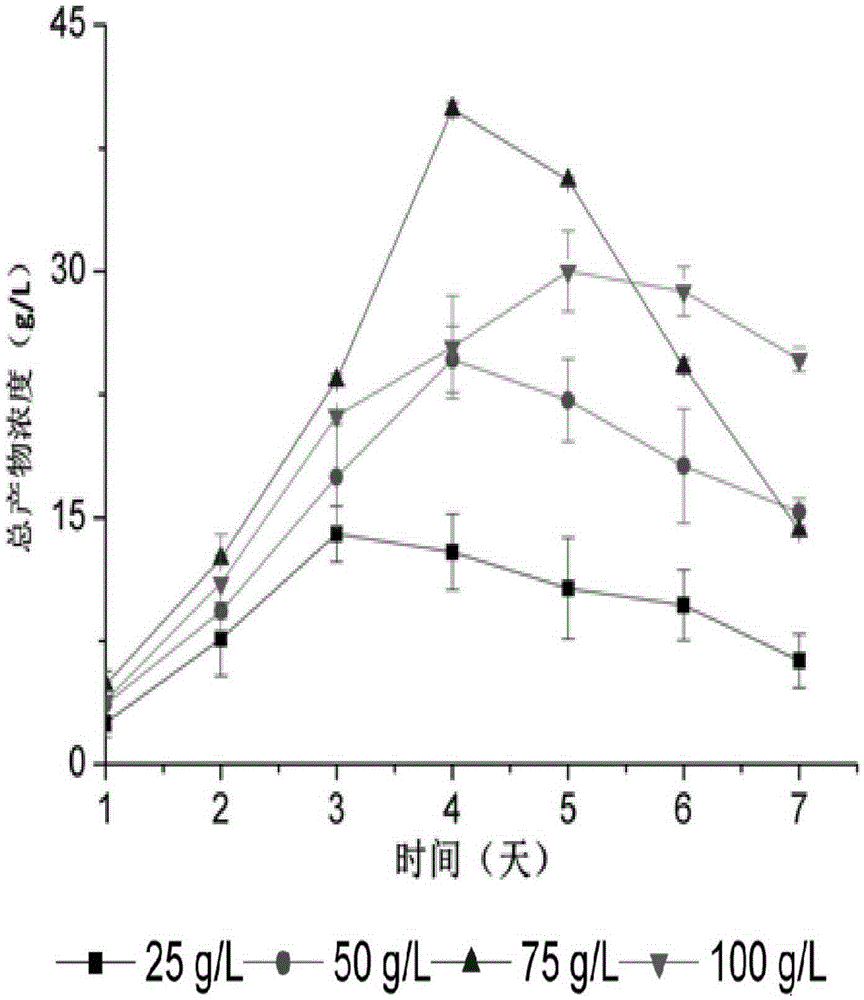
图1为不同浓度底物(木质纤维素)为原料的菌群发酵产物的变化。
图2为不同浓度底物(粪污)为原料的菌群发酵产物的变化。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的菌群富集培养基的溶剂为水,溶质及其在菌群富集培养基中的浓度如下:蛋白胨5g/L,酵母粉5g/L,氯化钠5g/L,碳酸钙5g/L,FeSO4·7H2O,0.05g/L,ZnSO4·7H2O 0.05g/L,MnSO4·5H2O 0.005g/L,H3BO30.005g/L,NiCl2·2H2O 0.005g/L,CoCl2·6H2O 0.005g/L,CuCl2·2H2O 0.005g/L,pH为8.0±0.1。操作中接种量为10%,培养基无需灭菌,培养条件为55℃,静置培养。
下述实施例中的菌群发酵培养基的溶剂为水,溶质及其在菌群发酵培养基中的浓度如下:蛋白胨2.1g/L,酵母粉1g/L,尿素2.1g/L,氯化钠5g/L,碳酸钙5g/L,FeSO4·7H2O 0.05g/L,ZnSO4·7H2O 0.05g/L,MnSO4·5H2O 0.005g/L,H3BO30.005g/L,NiCl2·2H2O 0.005g/L,CoCl2·6H2O 0.005g/L,CuCl2·2H2O 0.005g/L,pH为8.0±0.1。
下述实施例中的产油微生物培养基的溶剂为水,溶质及其在产油微生物培养基中的浓度如下:葡萄糖20g/L,蛋白胨10g/L,酵母提取物10g/L。除葡萄糖外培养基其他成分121℃灭菌20分钟,葡萄糖配制成50%母液后采用无菌0.22μm无菌滤器过滤后加入培养基中。接种量为10%,培养条件为37℃,200rpm,培养24h。
下述实施例中的产油发酵培养基的溶剂为水,溶质及其在产油发酵培养基中的浓度如下:无氨基酵母氮源34g/L,硫酸铵88g/L,酵母提取物20g/L。
实施例1、菌群和产油微生物联用以木质纤维素为原料生产微生物油脂的方法
一、转化生物质废弃物的菌群筛选
1、以木质纤维素为底物的菌群的筛选
取5g采集的样品(腐殖土,样品于2013年采集自海南五指山),将其接入含有30g/L微晶纤维素的菌群富集培养基中,在55℃条件下静置培养,连续传代培养5个月,得到天然菌群发酵液,检测天然菌群发酵液中微晶纤维素含量,计算微晶纤维素降解率,选取微晶纤维素降解率达到90%以上的天然菌群发酵液。微晶纤维素降解率的计算公式为(1-m/3)%,其中m为:100mL天然菌群发酵液离心后分别采用柠檬酸和无菌水清洗三次,烘干并称重沉淀为m。初始菌群主要含有如下:Euryarchaeota、Actinobacteria、Bacterioidetes、Spirochaetes、Cyanobaceteria、Thermotogae、Fusobacteria等七大纲的菌株,具体包括Clostridium cellulosi、Clostridium stercorarium、Clostridium thermocellum、Tepidanaerobacter acetatoxydans、Thermobacillus composti、Bacillus coagulans等纤维素、半纤维素降解菌株。
二、菌群转化木质纤维素
本发明以富含碳源的木质纤维素为底物,用步骤一获得的微晶纤维素降解率达到90%以上的天然菌群发酵液进行转化,具体步骤如下:
1、菌群扩大培养
将上述步骤一获得的微晶纤维素降解率达到90%以上的天然菌群发酵液作为种子以10%(体积比)的接种量接种于含有100g/L微晶纤维素的菌群富集培养基进行扩 大培养,得到发酵液。将获得的发酵液作为后续发酵实验的种子液。上述扩大培养的条件:在55℃无氧条件下,以30rpm搅拌培养96h。
2、木质纤维素的碱蒸馏预处理
称取6kg的木质纤维素与氢氧化钠水溶液混合,使氢氧化钠的质量分数达到12%,平铺于小型塔板式蒸馏釜(直径为0.4米,高度为0.45米)中;向蒸馏釜通入0.18Mpa的蒸汽,保持操作温度在95℃,计时35分钟,得到蒸馏后物料;将蒸馏后物料用清水洗至pH小于8,挤出多余水分后,得到碱蒸馏预处理后的木质纤维素,烘干备用。
3、菌群转化木质纤维素
分别将25g、50g、75g、100g的碱蒸馏预处理后的木质纤维素与2g步骤1获得的种子液和1L的菌群发酵培养基混匀,分别得到含有25g/L(质量分数2.5%)、50g/L(质量分数5%)、75g/L(质量分数7.5%)、100g/L碱蒸馏处理的木质纤维素的发酵培养基;将步骤1获得的种子液分别转接到含有不同浓度的碱蒸馏处理的木质纤维素的菌群发酵培养基中(种子液与含有不同浓度的碱蒸馏处理的木质纤维素的发酵培养基的体积比为1:10),在55℃无氧条件下,以30rpm搅拌培养96h,至木质纤维素底物降解率达到90%以上,得到菌群发酵液,并将菌群发酵液通过滤膜(截留分子量500-1000)过滤,收集滤液。
4、发酵液中有机产物浓度测定
采用装有Varian色谱柱CP-Wax 57CB的安捷伦7890A气相检测上述步骤3中的滤液中的有机产物(葡萄糖、有机酸和有机醇)含量。具体步骤如下:取定量体积滤液加入等体积的4g/L异丙醇内标,轻弹混匀后,加入气相样品瓶,放入样品盘,乙醇检测平台选用装置了Varian强极性的CP-Wax 57CB色谱柱的安捷伦7890A气相进行检测。检测器为FID,最高柱温为210℃,进样口200℃,检测器230℃,载气为氮气。
不同浓度(25g/L、50g/L、75g/L、100g/L)的碱蒸馏处理的木质纤维素的发酵液中总产物浓度的变化趋势如图1所示。从图1中可以看出:菌群能够高效转化木质纤维素生成包括葡萄糖、有机酸和有机醇在内的多种产物,转化质量分数为2.5-7.5%木质纤维素时间短于96h,在木质纤维素的质量分数达到7.5%时获得的总产物(糖、有机酸和醇类)浓度达到最高,约为4%。
三、产油微生物发酵生产生物油脂
1、分别将解脂耶罗维亚酵母(Yarrowia lipolyticaATCC 20177,购自美国菌种保藏中心)和粘红酵母(Rhodotorula glutinis ATCC 32765,购自美国菌种保藏中心)按照10%(体积比,cfu约为1×106)的接种量接种于产油微生物培养基中,分别得到ATCC 20177种子液和ATCC 32765种子液;
2、将步骤二的3中获得的滤液和产油发酵培养基(pH调整至4.0,滤液和产油发酵培养基的体积比为9:1)混匀,得到发酵培养体系。
3、将步骤1获得的ATCC 20177种子液和ATCC 32765种子液按照10%(体积比,cfu约为1×106)的接种量分别接种至步骤2获得的发酵培养体系中进行发酵培养,培养条件为28℃,200rpm,通气量1.0vvm,培养时间为72h,培养后停止搅拌与通气,待酵母沉降后,采用蠕动泵移去上清液,分别补加新的通过滤膜过滤的步骤二的3中获得的滤液,使糖、有机酸和醇类总浓度维持在发酵体系的1%(质量分数)以上,调整pH至4.0,设置培养条件为28℃,200rpm,通气量1.0vvm,继续培养72h,得到ATCC 20177发酵液和ATCC 32765发酵液。
四、产油酵母细胞干重和油脂重量的测定
1、分别取100ml上述步骤三获得的ATCC 20177发酵液和ATCC 32765发酵液,在5000rpm下离心10min,弃上清,取沉淀;用无菌水洗涤沉淀两次,并在-60℃下冷冻干燥24h,分别得到绝干酵母菌体,通过重量分析确定产油酵母细胞干重质量。
2、索氏抽提法提取酵母细胞内油脂
将步骤1获得的绝干酵母菌体研磨成粉后,准确称取5g,放入称重的滤纸中包好,放入索氏抽提器中加入正己烷进行抽提,每次循环时间约为10min,抽提总时间12h;室温冷却,将抽提液中正己烷用旋转蒸发仪回收,氮气流作为保护器,操作温度为55℃,转速20rpm,回收油脂后称重获得油脂产量。
解脂耶罗维亚酵母的细胞干重、油脂重量及菌体含油量的检测结果如表1所示;粘红酵母的细胞干重、油脂重量及菌体含油量的检测结果如表2所示。从表1和表2中可以看出,不同产油酵母获得最佳产油效果对应的菌群发酵木质纤维素量不同,解脂耶罗维亚酵母转化生物质废弃物产油脂浓度最高达到约16.6g/L,对应的生物质废弃物浓度为50g/L(质量分数为5%),其从木质纤维素原料到油脂的转化率达到了0.332g/g(16.6g/50g);粘红酵母转化生物质废弃物产油脂浓度最高达到约12.2g/L,对应的生物质废弃物浓度为7.5%,其从木质纤维素原料到油脂的转化率达到了0.163g/g(12.2g/75g)。
表1、不同浓度木质纤维素下解脂耶罗维亚酵母菌体干重、油脂重量及菌体含油量
表2、不同浓度生物质废弃物下粘红酵母菌体干重、油脂重量及菌体含油量
本实例采用菌群进行生物质废弃物的利用,相较于纯培养单菌,能够高效的实现生物质废弃物中多糖和有机质的降解,在获得葡萄糖等六碳糖单糖和木糖等五碳糖单糖以及多种寡聚多糖同时,其代谢产生的有机酸、醇等同样可以作为碳源被采用的产油酵母同化,实现高效的以生物质废弃物为原料进行生物油脂的生产。获得的菌群能够高效转化生物质废弃物,转化2.5-7.5%生物质废弃物时间短于96h,在生物质废弃物(木质素废弃物)的质量分数达到7.5%时获得的总产物(糖、有机酸和醇类物质)浓度达到最高,约为4%;以菌群发酵产物为原料,产油微生物产油脂浓度最高达到约16.6g/L,转化率最高达到0.332g/g(16.6g/50g)。
实施例2、一种菌群和产油微生物联用以粪污为原料生产微生物油脂的方法
一、转化粪污的菌群筛选
取10g采集的样品(污水,样品于2013年采集自北京大红门污水处理厂),将其接入含有100g/L粪污(获取自北京德青源农业科技股份有限公司)的菌群富集培养基中,在55℃条件下静置培养,连续传代5个月,得到天然菌群发酵液,检测天然菌群发酵液中TOC,计算TOC降解率,选取TOC降解率达到90%以上的天然菌群发酵液。TOC为总有机碳,TOC降解率采用基于快速消解分光光度法的美国哈希1950Plus TOC分析仪进行测定。初始菌群主要含有如下:Firmicutes、Proteobacteria、Bacterioidetes、Euryarchaeota、Thermotogae、Actinobacteria、Cyanobaceteria、Fusobacteria、Planctomycetes等九大纲的菌株,其中具体包括Aminobacterium colombiense、Anaerococcus prevotii、Syntrophomonas wolfei、Clostridium thermocellum、Methanosarcina barkeri、Thermanaerovibrio acidaminovorans、Kosmotoga olearia、Alkaliphilus metalliredigens、Psychrobacter cryohalolentis等产酸菌株。
二、菌群转化粪污
本发明以富含有机质的粪污为底物,用步骤一获得的TOC降解率达到90%以上的天然菌群发酵液进行转化,具体步骤如下:
1、菌群扩大培养
将上述步骤一筛选获得的TOC降解率达到90%以上的天然菌群发酵液作为种子以10%(体积比)的接种量接种于含有100g/L粪污的菌群富集培养基进行扩大培养, 得到发酵液。将获得的发酵液作为后续发酵实验的种子液。上述扩大培养的条件:在55℃无氧条件下,以30rpm搅拌培养96h。
2、粪污的总有机碳和总有机氮的测定
称取100g的粪污,在65℃干燥箱烘干至恒重,得到绝干样品,将绝干样品用中药粉碎机进行粉碎,并过分子筛,取40目与80目之间样品,得到筛选后的样品;采用哈希1950Plus TOC分析仪分析筛选后的样品的总有机碳含量(TOC为总有机碳,TOC降解率采用基于快速消解分光光度法的美国哈希1950Plus TOC分析仪进行测定);采用凯氏定氮仪测定筛选后的样品的总有机氮含量(采用基于凯氏定氮法的上海雷磁KDN-1型自动凯氏定氮仪进行测定)。根据测定结果换算出粪污样品中有机碳源和有机氮源的比例,并通过补加纤维素(补碳)或者尿毒(补氮)使有机碳源和有机氮源的比例在(10-50):1。本发明的有机碳源和有机氮源的比例为15:1。
3、菌群转化粪污
分别将25g、50g、75g、100g的粪污与3g步骤1获得的种子液和1L的菌群发酵培养基混匀,分别得到含有25g/L、50g/L、75g/L、100g/L碱蒸馏处理的粪污的发酵培养基,同时加入终浓度为1g/L的四碘化碳(CI4),在55℃无氧条件下,以30rpm搅拌培养96h,至粪污降解率达到90%以上,得到菌群发酵液,并将菌群发酵液通过滤膜(截留分子量500-1000)过滤,收集滤液。
4、发酵液中有机产物浓度测定
采用装有Varian色谱柱CP-Wax 57CB的安捷伦7890A气相检测上述步骤3中的滤液中的有机产物(葡萄糖、有机酸和有机醇)含量。具体步骤如下:取定量体积滤液加入等体积的4g/L异丙醇内标,轻弹混匀后,加入气相样品瓶,放入样品盘,乙醇检测平台选用装置了Varian强极性的CP-Wax 57CB色谱柱的安捷伦7890A气相进行检测。检测器为FID,最高柱温为210℃,进样口200℃,检测器230℃,载气为氮气。
不同浓度(25g/L、50g/L、75g/L、100g/L)的粪污的发酵液中总产物浓度变化趋势如图2所示。从图中可以看出:菌群能够将粪污中的有机碳和有机氮源转化为包括有机酸和有机醇在内的多种产物,转化质量分数为2.5-7.5%的粪污时间短于96h,在粪污的质量分数达到7.5%时获得的总产物(有机酸和醇类物质)浓度达到最高,约为4.3%。
三、产油微生物发酵生产生物油脂
1、分别将解脂耶罗维亚酵母(Yarrowia lipolyticaATCC 20177,购自美国菌种保藏中心)和粘红酵母(Rhodotorula glutinis ATCC 32765,购自美国菌种保藏中心)按 照10%(体积比,cfu约为1×106)的接种量接种于产油微生物培养基中,分别得到ATCC 20177种子液和ATCC 32765种子液;
2、将步骤二的3中获得的滤液和产油发酵培养基(pH调整至4.0,滤液和产油发酵培养基的体积比为9:1)混匀,得到发酵培养体系。
3、将步骤1获得的ATCC 20177种子液和ATCC 32765种子液按照10%(体积比,cfu约为1×106)的接种量分别接种至步骤2获得的发酵培养体系中进行发酵培养,培养条件为28℃,200rpm,通气量1.0vvm,培养时间为72h,培养后停止搅拌与通气,待酵母沉降后,采用蠕动泵移去上清液,分别补加新的通过滤膜过滤的步骤二的3中获得的滤液,使总有机酸浓度维持在发酵体系的5%(质量分数)以上,调整pH至4.0,设置培养条件为28℃,200rpm,通气量1.0vvm,继续培养72h,得到ATCC 20177发酵液和ATCC 32765发酵液。
四、产油酵母细胞干重和油脂重量的测定
1、取100ml上述步骤三获得的,得到ATCC 20177发酵液和ATCC 32765发酵液,在5000rpm下离心10min,弃上清,取沉淀;用无菌水洗涤沉淀两次,并在-60℃下冷冻干燥24h,得到绝干酵母菌体,通过重量分析确定产油酵母细胞干重质量。
2、索氏抽提法提取酵母细胞内油脂
将步骤1获得的干菌体研磨成粉后,准确称取5g,放入称重的滤纸中包好,放入索氏抽提器中加入正己烷进行抽提,每次循环时间约为10min,抽提总时间12h;室温冷却,将抽提液中正己烷用旋转蒸发仪回收,氮气流作为保护器,操作温度为55℃,转速为20rpm,回收油脂后称重获得油脂产量。
解脂耶罗维亚酵母的细胞干重、油脂重量及菌体含油量的检测结果如表3所示;粘红酵母的细胞干重、油脂重量及菌体含油量的检测结果如表4所示。从表3和表4中可以看出,不同产油酵母获得最佳产油效果对应的菌群发酵粪污量不同,解脂耶罗维亚酵母转化粪污产油脂浓度最高达到约19.8g/L,对应的粪污浓度为75g/L(质量分数为7.5%),其从粪污到油脂的转化率达到了0.264g/g(19.8g/75g);粘红酵母转化粪污产油脂浓度最高达到约14.2g/L,对应的粪污浓度为75g/L(质量分数为7.5%),其从粪污到油脂的转化率达到了0.189g/g(14.2g/75g)。
表3、不同浓度粪污下解脂耶罗维亚酵母菌体干重、油脂重量及菌体含油量
表4、不同浓度粪污下粘红酵母菌体干重、油脂重量及菌体含油量
本实例采用菌群进行生物质废弃物的利用,相较于纯培养单菌,能够高效的实现生物质废弃物中多糖和有机质的降解,在获得葡萄糖等六碳糖单糖和木糖等五碳糖单糖以及多种寡聚多糖同时,其代谢产生的有机酸、醇等同样可以作为碳源被采用的产油酵母同化,实现高效的以生物质废弃物为原料进行生物油脂的生产。获得的菌群能够高效转化生物质废弃物,转化2.5-7.5%粪污时间短于96h,在生物质废弃物(粪污)的质量分数达到7.5%时获得的总产物(有机酸和醇类物质)浓度达到最高,约为4.3%;以菌群发酵产物为原料,产油微生物产油脂浓度最高达到约19.8g/L,转化率最高达到0.264g/g(19.8g/75g)。
- 还没有人留言评论。精彩留言会获得点赞!