异构化反应的制作方法
1.本发明涉及有机合成领域,更具体而言,涉及一种β
‑
三取代的c3‑
c
70
羰基化合物的β位的异构化。
背景技术:
2.高度寻求获得具有特定立体化学的化合物的途径。导致获得富含立体异构体的化合物的方法之一是氢化。然而,获得反式取代的环烷烃或环烷酮化合物的可用氢化方法非常有限。特别地,尽管反式萘烷酮(decalone)化合物代表非常需要的骨架,因为它们可用作加香成分或用作构建具有更复杂骨架的化合物的起始原料,但是反式萘烷酮化合物主要是使用伯奇(birch)条件通过还原相应的烯酮而获得的。然而,出于安全和环境的原因,难以大规模地实施所述条件。即使最近已经报道了journal of american chemical society 2014,1300报道的使用钴和锰催化剂反式选择性还原环己烯以利于热力学产物的方法,但该方法仍要求制备还原剂,该还原剂在大规模条件下可能难以处理。
3.因此,需要开发一种更安全、更清洁的方法来获取此类化合物。
4.本发明通过进行异构化反应以允许改变在β
‑
三取代的c3‑
c
70
羰基化合物的β位的构型,提供了解决上述问题的方案。据我们所知,在现有技术中没有关于本发明中公开的异构化方法的报道。
技术实现要素:
5.本发明涉及一种新颖的方法,其允许通过异构化条件形成最热力学的产物。所述方法允许避免伯奇还原条件或不常用的催化剂。
6.因此,本发明的第一个目的是一种用于β
‑
三取代的c3‑
c
70
羰基化合物的异构化以改变三取代的β位的构型的方法,其特征在于所述方法在光氧化还原催化剂、氢原子转移供体、胺和光的存在下进行。
具体实施方式
7.现已发现,结合烯胺的形成、光氧化还原催化剂和氢原子供体,可以使羰基化合物的β位的立体化学异构化。
8.本发明的目的是一种用于β
‑
三取代的c3‑
c
70
羰基化合物的异构化以改变(modify)三取代的β位的构型的方法,其特征在于所述方法在光氧化还原催化剂、氢原子转移供体、胺和光的存在下进行。
9.为了清楚起见,通过表述“β
‑
三取代的c3‑
c
70
羰基化合物的异构化以改变三取代的β位的构型”或类似术语,是指本领域的正常含义。即,羰基官能团的β位上的碳的构型将被改变,并且本发明的方法允许增加一种对映异构体或非对映异构体的量。本发明的方法是使一种对映异构体或非对映异构体的量富集的方法。换句话说,羰基官能团的β位上的碳的构型可以在外消旋和r之间,在外消旋和s之间,在s和r之间或在r和s之间切换;即异构化是
差向异构化。根据另一个特定的实施方案,羰基官能团的β位上的碳的构型可以在r和“r与s的50∶50混合物”之间或在s和“r与s的50∶50混合物”之间切换;优选在r与s的50∶50之间。即异构化是外消旋化。本发明的方法允许获得热力学最稳定的对映异构体或非对映异构体。特别地,异构化是差向异构化;即,β
‑
三取代的c3‑
c
70
羰基化合物具有两个或更多个手性中心,并且仅改变了β位的构型。
10.通过“构型”,是指本领域的正常含义。即立体源(stereogenic)中心的空间排列。该构型可以是绝对的,也可以是相对的。
11.为了清楚起见,通过表述“对映异构体或非对映异构体”或类似术语,是指本领域技术人员所理解的正常含义,即羰基化合物可以具有几个立体中心,并且每个所述立体中心可以具有两种不同的立体化学(例如r或s)。羰基化合物甚至可以是纯对映异构体的形式,或对映异构体或非对映异构体的混合物的形式。羰基化合物可以呈外消旋形式或非外消旋(scalemic)形式。本发明的方法允许从外消旋或非外消旋形式的羰基化合物开始,获得非外消旋形式的羰基化合物(差向异构化)。或者,本发明的方法允许从非外消旋形式的羰基化合物开始,获得外消旋形式的羰基化合物(外消旋化)。
12.为了清楚起见,通过术语“光氧化还原催化剂”,是指本领域的正常含义,即通过单电子转移过程通过活化有机底物来吸收光以加速化学反应的催化剂。
13.为了清楚起见,通过表述“氢原子转移供体”,是指本领域的正常含义,即能够提供氢自由基的化合物。氢原子转移也称为hat。
14.为了清楚起见,通过术语“羰基化合物”,是指本领域的正常含义,即具有酮或醛官能团的化合物。
15.根据任何上述实施方案,羰基化合物的三取代的β位是环的一部分。
16.根据任何上述实施方案,本发明的羰基化合物为其任何一种立体异构体或其混合物形式的式(i):
[0017][0018]
并且其中r1和r2同时或独立地代表氢原子或可选地被取代的c1‑
11
烷基或c2‑
11
的烯基或炔基;r3和r4同时或独立地代表可选地被取代的c1‑
11
烷基或c2‑
11
的烯基或炔基;或者r1和r3结合在一起代表可选地被取代的c2‑
15
的烷二基或烯二基;或者/并且r2和r4结合在一起代表可选地被取代的c2‑
13
的烷二基或烯二基;或者/并且r3和r4结合在一起代表可选地被取代的c2‑9的烷二基或烯二基;条件是至少r1和r3或者r2和r4结合在一起。
[0019]
为了清楚起见,通过表述“其任何一种立体异构体或它们的混合物”或类似表述,是指本领域技术人员所理解的正常含义,即式(i)化合物可以是纯对映异构体或非对映异构体。换句话说,式(i)化合物可以具有几个立体中心,并且每个所述立体中心可以具有两种不同的立体化学(例如r或s)。式(i)化合物甚至可以是纯对映异构体的形式,或对映异构体或非对映异构体的混合物的形式。式(i)化合物可以呈外消旋形式或非外消旋形式。因此,式(i)化合物可以是一种立体异构体,或为包含各种立体异构体或由各种立体异构体组
成的物质组合物的形式。
[0020]
应当理解,通过
“…
r1和r3结合在一起代表c2‑
15
直链、支链或环状的烷二基,或者/并且r2和r4结合在一起代表c2‑
15
直链、支链或环状的烷二基,或者/并且r3和r4结合在一起
…”
或类似表述,所述基团可以形成(多)环烷基。换句话说,化合物(i)可以是单环或双环的,例如在r1和r3以及r3和r4结合在一起的情况下,式(ii)的化合物包含双环基团例如萘烷(decalin),即r1、r3和r4结合在一起代表烷三基。
[0021]
根据本发明的一个特定的实施方案,羰基化合物为其任何一种立体异构体或其混合物形式的式(ii):
[0022][0023]
其中n是1至11的整数,m是0至6的整数,r1代表氢原子或可选地被取代的c1‑
11
烷基或c2‑
11
的烯基或炔基;r6代表可选地被取代的c1‑
11
烷基或c2‑
11
的烯基或炔基;r5基团代表饱和环的取代基,并且彼此独立地是可选地被取代的c1‑4烷基或c2‑4的烯基或炔基,并且/或者当两个r5基团结合在一起时,代表可选地被取代的c2‑5烷二基。
[0024]
根据任何上述实施方案,n可以是1至5的整数。特别地,n可以是1、2或3。甚至更特别地,n可以是2。
[0025]
根据任何上述实施方案,m可以是0至4的整数。特别地,m可以是0、1、2或3。
[0026]
根据任何上述实施方案,r1可以是氢原子或c1‑6烷基或c2‑6的烯基或炔基。特别地,r1可以是氢原子或c1‑6烷基。甚至更特别地,r1可以是氢原子或c1‑4烷基。甚至更特别地,r1可以是氢原子或甲基、乙基或异丙基。甚至更特别地,r1可以是氢原子。
[0027]
根据任何上述实施方案,r5基团代表c1‑3烷基或c2‑3的烯基或炔基。特别地,r5基团代表c1‑3烷基。特别地,r5基团代表甲基或乙基。特别地,r5基团代表甲基。
[0028]
根据任何上述实施方案,r6基团代表可选地被取代的c1‑6烷基或c2‑6的烯基或炔基。特别地,r6基团代表c1‑4烷基。甚至更特别地,r6基团代表甲基或乙基。
[0029]
根据本发明的一个特定的实施方案,羰基化合物是环烷酮化合物。特别地,羰基化合物为其任何一种立体异构体形式的式(iii):
[0030][0031]
其中q是1至13的整数;r9代表可选地被取代的c1‑
11
烷基;每个r7彼此独立地代表氢原子或可选地被取代的c1‑4烷基或c2‑4的烯基或炔基;r8基团代表氢原子或可选地被取代的c1‑9烷基;或者当r8和r9基团结合在一起时,代表可选地被取代的c2‑9烷二基,并且/或者当r8和r7基团结合在一起时,代表可选地被取代的c2‑9烷二基,并且/或者当r9和r7基团结合在一起时,代表可选地被取代的c2‑9烷二基,并且/或者当两个r7基团结合在一起时,代表可选地
被取代的c2‑9烷二基,并且/或者当三个r7基结合在一起时,代表可选地被取代的c4‑9烷三基。
[0032]
根据上述实施方案中的任何一个,r8基团可以代表氢原子或可选地被取代的c1‑6烷基。特别地,r8基团可以代表氢原子或可选地被取代的c1‑3烷基。甚至更特别地,r8基团可以代表氢原子或甲基或乙基。
[0033]
根据上述实施方案中的任何一个,r9基团可以代表可选地被取代的c1‑6烷基。特别地,r9基团可以代表可选地被取代的c1‑3烷基。甚至更特别地,r9基团可以代表甲基或乙基。
[0034]
根据上述实施方案中的任何一个,当r8和r9基团结合在一起时可以代表可选地被取代的c3‑6烷二基。
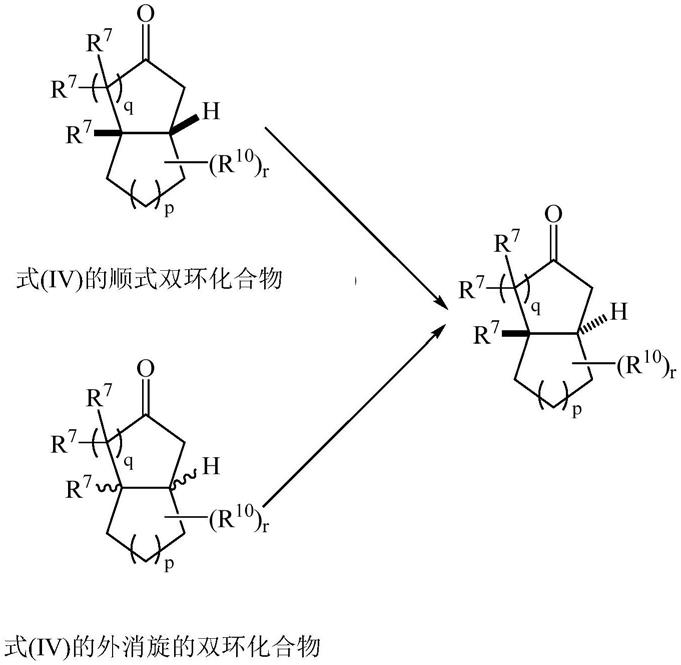
[0035]
根据上述实施方案中的任何一个,本发明的方法允许将顺式或外消旋的双环羰基化合物转化为反式双环羰基化合物,或将反式或外消旋的双环羰基化合物转化为顺式双环羰基化合物,如下所示:
[0036]
[0037][0038]
不受理论的束缚,本发明的方法允许获得热力学最稳定的化合物,其可以是顺式或反式双环羰基化合物。
[0039]
顺式双环羰基化合物或外消旋双环羰基化合物或反式双环羰基化合物表示环结处的相对构型。
[0040]
根据上述实施方案中的任何一个,羰基化合物为其任何一种立体异构体形式的式(iv):
[0041][0042]
其中q和p彼此独立地是1至3的整数;r为0至10的整数,每个r7代表氢原子或可选地被取代的c1‑4烷基或c2‑4的烯基或炔基;r
10
基团代表饱和环的取代基,并且彼此独立地为可选地被取代的c1‑4烷基或c2‑4的烯基或炔基;或者当r7和r
10
基团结合在一起时,代表c2‑
11
烷二基,并且/或者当两个r7基团结合在一起时,代表可选地被取代的c2‑
11
烷二基,并且/或者当三个r7基团结合在一起时,代表可选地被取代的c4‑
11
烷三基,并且/或者当两个r
10
基团结合在一起时,代表可选地被取代的c2‑
11
烷二基,并且/或者当三个r
10
基团结合在一起时,代表可选地被取代的c4‑
11
烷三基。
[0043]
根据任何上述实施方案,q可以是1或2。特别地,q可以是2。
[0044]
根据任何上述实施方案,p可以是1或2。
[0045]
根据任何上述实施方案,r可以是0至6的整数。特别地,r可以是0至4的整数。甚至更特别地,r可以是0、1、2或3。甚至更特别地,r可以是0、1或2。
[0046]
根据任何上述实施方案,r7基团可彼此独立地代表氢原子或可选地被取代的c1‑3烷基或c2‑3的烯基或炔基。甚至更特别地,r7可以代表氢原子或甲基、叔丁基、丙基或乙基。特别地,r7基团可以彼此独立地代表氢原子、甲基或丙基。甚至更特别地,至多四个r7基团可以代表甲基。甚至更特别地,一个r7基团可以代表氢原子、甲基或丙基,而其他r7基团可以代表氢原子。
[0047]
根据任何上述实施方案,r
10
基团可以彼此独立地代表可选地被取代的c1‑3烷基或c2‑3的烯基或炔基。甚至更特别地,r
10
基团可以彼此独立地代表甲基、叔丁基或乙基。甚至更特别地,r
10
基团可以彼此独立地代表甲基或乙基。甚至更特别地,当单独考虑时,r
10
基团可以彼此独立地代表甲基。
[0048]
特别地,羰基化合物是萘烷酮(decalone)衍生物。本发明的方法是将顺式或外消旋的萘烷酮衍生物转化为反式萘烷酮衍生物的方法。
[0049]
特别地,羰基化合物为其任何一种立体异构体形式的式(v):
[0050][0051]
其中s是0至8的整数,并且每个r7和r
10
具有与上述相同的含义。
[0052]
r1、r2、r3、r4、r5、r6、r7、r8、r9和r
10
的可选取代基为1至2个羟基、c1‑3烷基、c1‑3烷氧基、rcoo或roco基团,其中r彼此独立地是氢原子或c1‑4烷基。
[0053]
根据任何上述实施方案,s可以是0至6的整数。特别地,s可以是0至4的整数。甚至更特别地,s可以是0、1、2或3。
[0054]
合适的羰基化合物的非限制性例子可包括2,2,3,6
‑
四甲基环己烷
‑1‑
甲醛,4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮,八氢萘
‑
2(1h)
‑
酮,7
‑
乙基八氢萘
‑
2(1h)
‑
酮,6
‑
(叔丁基)
‑3‑
甲基八氢萘
‑
2(1h)
‑
酮,7,8,8
‑
三甲基八氢萘
‑
2(1h)
‑
酮,8,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮,4a
‑
甲基八氢萘
‑
2(1h)
‑
酮,7a
‑
丙基八氢
‑
5h
‑
茚
‑5‑
酮、3
‑
甲基环己
‑1‑
酮或5,5
‑
二甲基八氢萘
‑
2(1h)
‑
酮。
[0055]
根据上述实施方案中的任何一个,所述光氧化还原催化剂可以是金属络合物光氧化还原催化剂,无金属的光氧化还原催化剂或有机染料。
[0056]
金属络合物光氧化还原催化剂可以是铱、铜或钌基配合物。特别地,金属络合物光氧化还原催化剂可以为式(vi):
[0057]
[m(l)(l’)(l”)]z
n
ꢀꢀꢀ
(vi)
[0058]
其中m是铱或钌,l、l’和l”彼此独立地是可选地被1至6个羟基、c1‑4烷基、c1‑3烷氧基、卤素原子或卤代或全卤代烃取代的2,2
’‑
联吡啶或2
‑
苯基吡啶;z代表非配位阴离子,当
m为铱时n为0或1,而当m为钌时n为2。
[0059]“卤代或全卤代烃”是指被卤素原子取代的烃基,例如cf3或cclh2。
[0060]
根据上述实施方案中的任何一个;l、l’和l”可以彼此独立地是可选地被1至4个羟基、c1‑4烷基、c1‑3烷氧基、卤素原子或卤代或全卤代烃取代的2,2
’‑
联吡啶或2
‑
苯基吡啶。特别地,l、l’和l”可以是可选地被1至4个甲基、甲氧基、三氟甲基或叔丁基或氟原子取代的2,2
’‑
联吡啶或2
‑
苯基吡啶。合适的l、l’和l”的非限制性例子可包括2,2
’‑
联吡啶,2
‑
苯基吡啶,4,4
’‑
二甲氧基
‑
2,2
’‑
联吡啶,4,4'
‑
二叔丁基
‑
2,2
’‑
联吡啶,2
‑
(2,4
‑
二氟苯基)
‑5‑
甲氧基吡啶,2
‑
(4
‑
氟苯基)
‑5‑
甲氧基吡啶,5
‑
甲基
‑2‑
(对甲苯基)吡啶,2
‑
(4
‑
氟苯基)
‑5‑
甲基吡啶,2
‑
(对甲苯基)
‑5‑
(三氟甲基)吡啶,2
‑
(4
‑
氟苯基)
‑5‑
(三氟甲基)吡啶或2
‑
(2,4
‑
二氟苯基)
‑5‑
(三氟甲基)吡啶。
[0061]
根据上述实施方案中的任何一个;z代表clo4‑
,r’so3‑
,其中r’是氯或氟原子或c1‑
c8氟代烷基或氟芳基,bf4‑
,pf6‑
,sbcl6‑
,sbf6‑
或br”4
‑
,其中r”是可选地被一个至五个基团如卤素原子或甲基或cf3基团取代的苯基。特别地,z可以是bf4‑
,pf6‑
,clo4‑
,c6f5so3‑
,bph4‑
,cf3so3‑
或b[3,5
‑
(cf3)2c6h4]4‑
,甚至更特别是pf6‑
。
[0062]
根据一个特定的实施方案,合适的光氧化还原催化剂的非限制性例子可以包括曙红y,荧光素,2,4,5,6
‑
四(9h
‑
咔唑
‑9‑
基)间苯二腈(对应于4czipn),孟加拉玫红(rose bengal),10
‑
(3,5
‑
二甲氧基苯基)
‑9‑
均三甲基苯基(mesityl)
‑
1,3,6,8
‑
四甲氧基吖啶
‑
10
‑
鎓四氟硼酸酯(对应于mes
‑
acr
‑
4),三[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
n1,n1']六氟磷酸钌
(ii)
(对应于ru(bpy)3(pf6)2),三[2
‑
苯基吡啶并
‑
c2,n]铱
(iii)
(对应于ir(ppy)3),[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
n1,n1']双[2
‑
吡啶基
‑
n]苯基
‑
c]六氟磷酸铱
(iii)
(对应于ir(ppy)2(dtbbpy)pf6),[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
n1,n1']双[3,5
‑
二氟
‑2‑
[5
‑
(三氟甲基)
‑2‑
吡啶基
‑
n]苯基
‑
c]六氟磷酸铱
(iii)
(对应于ir(df(cf3)ppy)2(dtbbpy)pf6),[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
κn1,κn1']双[3,5
‑
二氟
‑2‑
[5
‑
(甲基)
‑2‑
吡啶基
‑
κn]苯基
‑
κc]六氟磷酸铱
(iii)
(对应于ir(df(me)ppy)2(dtbbpy)pf6),[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
κn1,κn1']双[3,5
‑
二氟
‑2‑
[2
‑
吡啶基
‑
κn]苯基
‑
κc]六氟磷酸铱
(iii)
(对应于ir(dfppy)2(dtbbpy)pf6)或[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
κn1,κn1']双[3
‑
氟
‑5‑
三氟甲基
‑2‑
[5
‑
(三氟甲基)
‑2‑
吡啶基
‑
κn]苯基
‑
κc]六氟磷酸铱
(iii)
(对应于ir(fcf3(cf3)ppy)2(dtbbpy)pf6),。特别地,光氧化还原催化剂可以是[4,4'
‑
双(1,1
‑
二甲基乙基)
‑
2,2'
‑
联吡啶
‑
n1,n1']双[2
‑
吡啶基
‑
n]苯基
‑
c]六氟磷酸铱
(iii)
(对应于ir(ppy)2(dtbbpy)pf6)或2,4,5,6
‑
四(9h
‑
咔唑
‑9‑
基)间苯二腈(对应于4czipn)。
[0063]
根据上述实施方案中的任何一个,可以将光氧化还原催化剂以大范围的浓度添加到本发明方法的反应介质中。作为非限制性例子,可以列举的光氧化还原催化剂的浓度值相对于羰基化合物的量为约0.001mol%至约10mol%,特别是相对于羰基化合物的量为约0.005mol%至约5mol%,甚至更优选相对于羰基化合物的量为约0.01mol%至约1mol%。如本领域技术人员所知,催化剂的最佳浓度将取决于后者的性质,取决于羰基化合物、氢原子转移供体和/或仲胺的性质,取决于反应温度以及所需的反应时间。
[0064]
根据上述实施方案中的任何一个,氢原子转移供体可以是在自由基化学中使用的任何氢原子转移供体,例如金属氢化物例如锡,硅,硫,硒,硼或磷的衍生物或有机化合物例
如丙二腈或环己二烯衍生物,例如环己
‑
1,4
‑
二烯或γ
‑
松油烯。
[0065]
根据一个特定的实施方案,氢原子转移供体是硫衍生物,例如硫醇(thiol)化合物,特别是芳族硫醇。特别地,氢原子转移供体是下式的硫酚衍生物:
[0066][0067]
其中每个r
a
彼此独立地代表氢原子,卤素原子,c1‑2直链烷基,c3‑4直链或支链烷基,可选地被1~5个卤素原子和/或c1‑4烷基或烷氧基取代的苯基,或被c1‑4烷基或芳基三取代的甲硅烷基。特别地,硫酚衍生物可以从由如下构成的群组中选出:苯硫醇,2,4,6
‑
三甲基苯硫醇,2,4,6
‑
三异丙基苯硫醇,2,6
‑
二甲基苯硫醇,2,6
‑
二叔丁基
‑4‑
甲基苯硫醇,2,6
‑
二异丙基苯硫醇,2,4,6
‑
三叔丁基苯硫醇,4
‑
叔丁基苯硫醇和4
‑
氟苯硫醇。特别地,硫酚衍生物可以从由如下构成的群组中选出:苯硫醇,2,4,6
‑
三甲基苯硫醇,2,4,6
‑
三异丙基苯硫醇,2,6
‑
二甲基苯硫醇,2,4,6
‑
三叔丁基苯硫醇,4
‑
叔丁基苯硫醇和4
‑
氟苯硫醇。特别地,硫酚衍生物可以从由如下构成的群组中选出:苯硫醇,2,6
‑
二甲基苯硫醇,2,4,6
‑
三甲基苯硫醇,2,6
‑
二叔丁基
‑4‑
甲基苯硫醇,2,6
‑
二异丙基苯硫醇,2,4,6
‑
三异丙基苯硫醇和2,4,6
‑
三叔丁基苯硫醇。甚至更特别地,硫酚衍生物可以是苯硫醇或2,4,6
‑
三异丙基苯硫醇。甚至更特别地,硫酚衍生物可以是苯硫醇。
[0068]
根据上述实施方案中的任何一个,可以将苯硫酚以大范围的浓度添加到本发明方法的反应介质中。作为非限制性例子,可以列举的硫酚浓度值相对于羰基化合物的量为约0.5mol%至约50mol%,特别是相对于羰基化合物的量为约1mol%至约30mol%,甚至更优选相对于羰基化合物的量为约5mol%至约25mol%。如本领域技术人员所知,硫酚的最佳浓度将取决于后者的性质,取决于醛、烯烃、光氧化还原催化剂和/或仲胺的性质,取决于反应温度以及所需的反应时间。
[0069]
根据上述实施方案中的任何一个,胺是伯胺或仲胺。特别地,胺是仲胺。
[0070]
术语“伯胺或仲胺”是本领域的正常含义,即对于伯胺,氮原子被两个氢原子和一个不同于氢原子的基团取代,而对于仲胺,氮原子被一个氢原子和两个不同于氢原子的基团取代。
[0071]
仲胺可以是可选地被1至3个卤素原子或酸或酯基团取代的环状或无环胺。所述仲胺可以是铵盐的形式。特别地,仲胺可以从由如下构成的群组中选出:吡咯烷,哌啶,氮杂环庚烷(azepane),2
‑
(双(3,5
‑
双(三氟甲基)苯基)((三甲基甲硅烷基)氧基)甲基)吡咯烷,2,2,2
‑
三氟
‑
n
‑
甲基乙烷
‑1‑
胺,2,2,2
‑
三氟
‑
n
‑
甲基乙烷
‑1‑
氯化铵,2,2,2
‑
三氟
‑
n
‑
乙基乙烷
‑1‑
胺,2,2,2
‑
三氟
‑
n
‑
乙基乙烷
‑1‑
氯化铵,双(2
‑
氯乙基)胺,双(2
‑
氯乙基)氯化铵,二甲胺和二甲基氯化铵。特别地,仲胺可以从由如下构成的群组中选出:吡咯烷,哌啶,氮杂环庚烷,2
‑
(双(3,5
‑
双(三氟甲基)苯基)((三甲基甲硅烷基)氧基)甲基)吡咯烷,2,2,2
‑
三氟
‑
n
‑
甲基乙烷
‑1‑
胺,2,2,2
‑
三氟
‑
n
‑
甲基乙烷
‑1‑
氯化铵,双(2
‑
氯乙基)胺,双(2
‑
氯乙基)氯化铵,二甲胺和二甲基氯化铵。甚至更特别地,仲胺可以是吡咯烷,哌啶,氮杂环庚烷。甚至更特别地,仲胺可以是吡咯烷或氮杂环庚烷。
[0072]
根据上述实施方案中的任何一个,仲胺可以大范围的浓度添加到本发明方法的反
应介质中。作为非限制性例子,可以列举的仲胺浓度值相对于醛的量为约0.5mol%至约20mol%,优选相对于醛的量为约5mol%至约15mol%。如本领域技术人员所知,仲胺的最佳浓度将取决于后者的性质,取决于醛、烯烃、光氧化还原催化剂和/或氢原子转移供体的性质,取决于反应温度以及所需的反应时间。
[0073]
根据上述实施方案中的任何一个,光可以具有在250nm和800nm范围内的波长。特别地,光可以是uv可见光。所述光可以由led灯或led条带产生。
[0074]
反应可以在溶剂存在或不存在的情况下进行。当出于实际原因需要或使用溶剂时,这种反应类型的任何溶剂流均可用于本发明的目的。具有高介电常数的溶剂是优选的。溶剂的非限制性例子包括dmso,dmpu,dmf,dma,nmp,乙腈,dme,甲基四氢呋喃或它们的混合物。溶剂的选择取决于底物和/或催化剂的性质,并且本领域技术人员能够在每种情况下选择最合适的溶剂以优化反应。
[0075]
本发明的方法可以在0℃至50℃的温度范围内进行,更具体而言,本发明的方法可以在室温下。即大约25℃下进行。当然,本领域技术人员也能够根据起始产物和最终产物的熔点和沸点以及所需的反应或转化时间来选择优选的温度。
[0076]
本发明的方法可以在间歇或连续条件下进行。
[0077]
实施例
[0078]
现在将通过以下实施例更详细地描述本发明,其中缩写具有本领域的通常含义,温度以摄氏度(℃)表示。nmr光谱数据用400或500mhz的机器对于1h和
13
c在cdcl3(除非另有说明)中记录,化学位移δ相对于tms为标准以ppm表示,偶合常数j以hz表示。
[0079]
实施例1
[0080]
将(4ars,8rs,8ars)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮异构化为(4ars,8rs,8asr)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮
[0081]
在氩气下,在舒伦克瓶(schlenk)中,向(4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶)双[2
‑
(2
‑
吡啶基
‑
kn)苯基
‑
kc]六氟磷酸铱(iii)(4mg,0.004mmol)的dmpu(0.5ml)溶液中加入外消旋
‑
(4ar,8r)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮(7.22g,38.9mmol,顺式/反式比53/47),吡咯烷(0.14g,1.92mmol)和苯硫醇(0.42g,3.85mmol)。将混合物在室温下搅拌并在蓝光灯条下照射24小时,以产生所需的高异构化的萘烷酮(顺式/反式比13/87)。将反应混合物用etoac稀释并用盐水洗涤。有机层经无水mgso4干燥,过滤并在减压下浓缩。球对球蒸馏得到所需的外消旋
‑
(4ar,8r)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮(6.45g,35.77mmol,顺式/反式比13/87,收率92%)。
[0082]1h nmr(500mhz,cdcl3):0.81(d,j=6.5hz,3h),0.89
‑
0.98(m,1h),1.04(s,3h),1.08
‑
1.10(m,2h),1.35
‑
1.73(m,7h),2.00(t,j=15.0hz,1h),2.26
‑
2.33(m,1h),2.43
‑
2.51(m,2h).
[0083]
13
c nmr(125mhz,cdcl3):212.2(c),50.8(ch),41.5(ch2),41.0(ch2),40.6(ch2),38.1(ch2),35.7(ch2),33.3(c),32.4(ch),21.4(ch2),19.7(ch3),16.0(ch3).
[0084]
实施例2
[0085]
将(4ars,6rs,8ars)
‑6‑
乙基八氢萘
‑
2(1h)
‑
酮异构化为(4ars,6rs,8asr)
‑6‑
乙基八氢萘
‑
2(1h)
‑
酮
[0086]
向(4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶)双[2
‑
(2
‑
吡啶基
‑
kn)苯基
‑
kc]六氟磷酸铱
(iii)(11mg,0.01mmol)的dmpu(1ml)溶液中加入外消旋
‑
(4ar,6r,8ar)
‑6‑
乙基萘烷
‑2‑
酮(3.57g,19.82mmol,顺式/反式比86/14),吡咯烷(76mg,1.07mmol)和2,4,6
‑
三异丙基苯硫醇(481mg,2.03mmol)。将混合物在室温下搅拌并在蓝光(kessil lamp)下照射8小时,以产生高异构化的萘烷酮(顺式/反式比2/98)。将反应混合物用etoac稀释并用盐水洗涤。有机层经无水mgso4干燥,过滤并在减压下浓缩。在硅胶上进行柱色谱纯化(洗脱剂为庚烷/etoac 95/5),并进行球对球蒸馏,得到所需的外消旋
‑
(4ar,6r,8as)
‑6‑
乙基萘烷
‑2‑
酮(2.50g,12.89mmol,顺式/反式比2/98,收率65%)。
[0087]1h nmr(500mhz,cdcl3):0.62
‑
0.70(m,1h),0.84
‑
0.93(m,1h),0.89(t,j=7.4hz,3h),1.08
‑
1.17(m,1h),1.21
‑
1.45(m,6h),1.65
‑
1.72(m,1h),1.74
‑
1.82(m,2h),1.93
‑
1.98(m,1h),2.05(t,j=13.3hz,1h),2.26
‑
2.41(m,3h).
[0088]
13
c nmr(125mhz,cdcl3):211.9(c),48.5(ch2),43.4(ch),41.5(ch2),41.4(ch),39.3(ch),39.0(ch2),34.1(ch2),33.6(ch2),31.9(ch2),29.8(ch2),11.5(ch3).
[0089]
实施例3
[0090]
将(4ars,8asr)
‑
八氢萘
‑
2(1h)
‑
酮异构化为(4ars,8ars)
‑
八氢萘
‑
2(1h)
‑
酮
[0091]
向(4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶)双[2
‑
(2
‑
吡啶基
‑
kn)苯基
‑
kc]六氟磷酸铱(iii)(4.7mg,0.005mmol)的dmpu(2ml)溶液中加入八氢萘
‑
2(1h)
‑
酮(76.6mg,0.50mmol,顺式/反式比79/21),吡咯烷(7.1mg,0.10mmol)和苯硫醇(11mg,0.10mmol)。将该混合物在室温下搅拌,并在蓝光灯条下照射24小时,以得到高异构化的八氢萘
‑
2(1h)
‑
酮至顺式/反式比为4/96。
[0092]
13
c nmr(90mhz,cdcl3):211.3(c),48.7(ch2),43.5(ch),41.8(ch),41.6(ch2),34.3(ch2),33.7(ch2),32.8(ch2),26.2(ch2),25.7(ch2).
[0093]
实施例4
[0094]
将(4asr,8ars)
‑
5,5
‑
二甲基八氢萘
‑
2(1h)
‑
酮异构化为(4asr,8asr)
‑
5,5
‑
二甲基八氢萘
‑
2(1h)
‑
酮
[0095]
在氩气下,向(4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶)双[2
‑
(2
‑
吡啶基
‑
kn)苯基
‑
kc]六氟磷酸铱(iii)(7.8mg,0.008mmol)的dmpu(5ml)溶液中加入外消旋
‑
(4ar,8as)
‑
5,5
‑
二甲基萘烷
‑2‑
酮(4.0g,22.2mmol,顺式/反式比97/3),吡咯烷(0.16g,2.2mmol)和2,4,6
‑
三异丙基苯硫醇(0.52g,2.2mmol)。将混合物在室温下搅拌,并在merck光反应器中在蓝光下照射24小时,以产生高异构化的萘烷酮(顺式/反式比7/93)。将反应混合物用etoac稀释并用盐水洗涤。有机层经无水mgso4干燥,过滤并在减压下浓缩。在硅胶上进行柱色谱纯化(洗脱剂庚烷/mtbe98/2),得到所需的外消旋
‑
(4ar,6r,8as)
‑6‑
乙基萘烷
‑2‑
酮(2.14g,11.9mmol,顺式/反式比1/99,收率53%)。
[0096]1h nmr(400mhz,cdcl3):0.81(s,3h),0.98(s,3h),1.00
‑
1.70(m,9h),2.02(t,j=13hz,1h),2.07
‑
2.12(m,1h),2.25
‑
2.43(m,3h).
[0097]
13
c nmr(100mhz,cdcl3):211.7(c),50.2(ch),49.1(ch2),42.0(ch2),41.8(ch2),38.5(ch),35.3(ch2),33.1(c),30.6(ch3),26.9(ch2),21.8(ch2),19.9(ch3).
[0098]
实施例5
[0099]
使用各种胺将(4ars,8rs,8ars)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮异构化为(4ars,8rs,8asr)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮
[0100]
如实施例1中所述进行异构化。
[0101]
表1:使用各种胺的异构化
[0102]
项胺顺式/反式1氮杂环庚烷12/882哌啶32/683吡咯烷12/884
‑
53/47
[0103]
实施例6
[0104]
使用各种无机光氧化还原催化剂将(4ars,8rs,8ars)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮异构化为(4ars,8rs,8asr)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮
[0105]
如实施例1中所述进行异构化。
[0106]
表2:使用各种无机光氧化还原催化剂的异构化
[0107][0108]
实施例7
[0109]
使用各种有机光氧化还原催化剂将(4ars,8rs,8ars)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮异构化为(4ars,8rs,8asr)
‑
4a,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮
[0110]
如实施例1中所述进行异构化。
[0111]
表3:使用各种有机光氧化还原催化剂的异构化
[0112][0113]
实施例8
[0114]
将(4ars)
‑
8,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮异构化为(4ars,8ars)
‑
8,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮
[0115]
向(4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶)双[2
‑
(2
‑
吡啶基
‑
kn)苯基
‑
kc]六氟磷酸铱(iii)(2.5mg,0.003mmol)的dmpu(1ml)溶液中加入(4ar)
‑
8,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮(901.5mg,5mmol,顺式/反式比19/81),吡咯烷(17.8mg,0.25mmol)和苯硫醇(55.1mg,
0.5mmol)。将混合物在室温搅拌,并用kessil blue灯照射24小时。将粗反应混合物用水稀释并用mtbe萃取。有机层经无水硫酸镁干燥并用旋转蒸发仪浓缩。将粗产物蒸馏以产生(4ars,8ars)
‑
8,8
‑
二甲基八氢萘
‑
2(1h)
‑
酮至顺式/反式比2/98(840mg,4.66mmol,收率93%)。
[0116]
13
c nmr(125mhz,cdcl3):213.0(c),51.8(ch),42.1(ch2),41.5(ch2),41.3(ch2),36.2(ch),34.2(ch2),33.6(ch2),33.4(c),29.9(ch3),21.6(ch2),19.6(ch3).
[0117]
实施例9
[0118]
将(7asr)
‑
7a
‑
丙基八氢
‑
5h
‑
茚
‑5‑
酮异构化为(3ars,7asr)
‑
7a
‑
丙基八氢
‑
5h
‑
茚
‑5‑
酮
[0119]
向(4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶)双[2
‑
(2
‑
吡啶基
‑
kn)苯基
‑
kc]六氟磷酸铱(iii)(3.7mg,0.004mmol)的dmpu(1ml)溶液中加入(7as)
‑
7a
‑
丙基八氢
‑
5h
‑
茚
‑5‑
酮(1.00g,5.55mmol,顺式/反式比56/44),吡咯烷(32mg,0.45mmol)和苯硫酚(73mg,0.66mmol)。将混合物在室温下搅拌,并用kessil blue灯照射24小时。将粗反应混合物用水稀释并用mtbe萃取。有机层经无水硫酸镁干燥并用旋转蒸发仪浓缩。蒸馏粗产物以产生(3ars,7asr)
‑
7a
‑
丙基八氢
‑
5h
‑
茚
‑5‑
酮至顺式/反式比99/1(800mg,4.44mmol,收率80%)。
[0120]
13
c nmr(125mhz,cdcl3):214(c),45.5(ch),42.7(c),42.3(ch2),41.9(ch2),37.1(ch2),36.5(ch2),32.6(ch2),30.4(ch2),22.4(ch2),18.0(ch2),15.0(ch3).
[0121]
实施例10
[0122]
将(r)
‑3‑
甲基环己
‑1‑
酮外消旋化为3
‑
甲基环己
‑1‑
酮
[0123]
在玻璃小瓶中,将吡咯烷(18.9mg,0.26mmol),苯硫醇(57.8mg,0.52mmol),(r)
‑3‑
甲基环己
‑1‑
酮(562.4mg,5.01mmol,ee>99%)与(4,4'
‑
二叔丁基
‑
2,2'
‑
联吡啶)双[2
‑
(2
‑
吡啶基
‑
kn)苯基
‑
kc]六氟磷酸铱(iii)(2.4mg,0.003mmol)的dmpu(1ml)溶液混合。将混合物在室温下搅拌,并用kessil blue灯照射24小时。用手性柱(mega dex det beta)进行的gc分析表明,得到了外消旋的3
‑
甲基环己
‑1‑
酮。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1