抗GITR抗体及其用途的制作方法
抗gitr抗体及其用途
技术领域
1.本发明涉及能够特异性结合gitr蛋白(优选地人gitr蛋白)的抗体或其抗原结合片段,及此类药剂的用途。在一些实施例中,本技术涉及针对gitr的小鼠和人源化单克隆抗体,及这些抗体的用途。这些抗体或其抗原结合片段可用作诊断且可用于治疗与gitr的活性和/或表达相关的疾病。对以电子方式提交的序列表的引用
2.本技术包含序列表,该序列表经由efs-web作为ascii格式的序列表以电子方式提交,文件名为“688096.129序列表”,创建日期为2019年12月28日,且大小为82kb。经由efs-web提交的序列表是说明书的一部分,并通过引用以其全文并入本文。
背景技术:
3.癌症免疫疗法通过刺激、放大或补充免疫系统利用人体自身的免疫系统来更好地识别、管理甚至逆转疾病表型。最常用的一类免疫疗法涉及靶向免疫检查点,例如程序性细胞死亡蛋白1(pd-1)、细胞毒性t淋巴细胞相关蛋白4(ctla4)、t细胞免疫球蛋白和含粘蛋白结构域蛋白-3(tim-3)、淋巴细胞活化基因3(lag-3)和t细胞活化v结构域ig抑制因子(vista),它们是遏制免疫应答的关键调节因子。对作为免疫检查点抑制剂的抗体的发现一直是癌症药物发现中最成功的方法之一。继2011年第一个靶向ctla4的检查点抑制剂伊匹单抗(ipilimumab)获批后,免疫检查点抑制剂现在被提供用作多种癌症的一线治疗,这些癌症例如转移性黑色素瘤、非小细胞肺癌(nsclc)、肾细胞癌(rcc)、乳腺癌、尿路上皮癌和肝癌。
4.尽管在免疫检查点阻滞方面取得了革命性的成功,但仍有一定比例的患者没有受益或显示出任何积极应答。因此,对替代性治疗选择的开发仍然是进一步增强抗肿瘤免疫力的主要焦点。其中,糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(gitr)作为有吸引力的免疫疗法靶点引起了广泛关注。
5.gitr属于肿瘤坏死因子受体超家族(tnfrsf),它是经由细胞外富含半胱氨酸的结构域与肿瘤坏死因子(tnf)结合的细胞因子受体。tnfrsf参与各种细胞过程,从细胞凋亡和炎症到增殖、存活和分化中的其他信号转导途径。gitr被确定为tnfrsf的成员,它在暴露于糖皮质激素(gc)时保护t细胞免于凋亡,糖皮质激素是t细胞死亡的有效诱导剂且常用作免疫抑制剂和抗炎剂。gitr在cd25
+
cd4
+
调节性t细胞上以高水平组成型且排他性地表达。其配体gitrl主要由活化的抗原呈递细胞(apc)表达。在表皮角质形成细胞、破骨细胞前体和上皮细胞上也注意到了gitr和gitrl的表达。这表明,gitr和gitrl的功能可能不仅限于调节免疫应答,还涉及介导白细胞粘附和迁移。调节gitr功能的抗癌治疗潜力归因于其在效应t细胞(t
eff
)中的共刺激作用以及对肿瘤浸润性调节性t(t
reg
)细胞的抑制或耗竭。使用激动剂抗小鼠gitr单克隆抗体(即dta-1)的临床前肿瘤模型已阐明其作用,其中包括增加cd4
+
、cd8
+ t和cd4
+
il9
+
(th9)细胞的浸润;降低cd4
+
foxp3
+
t
reg
的水平;以及总体上增强t
eff
与t
reg
比率。
6.抗gitr与其他治疗方式(如抗pd-1和抗ctla4)的临床前组合也通过潜在地克服t细胞耗尽和增强cd8
+
t
eff
细胞的增殖和浸润而显示出颇有前景的结果。通过靶向gitr的免疫调节为扩展抗癌治疗选择提供了颇有前景的机遇,并且可考虑与其他免疫调节抗体的组合疗法。
技术实现要素:
7.在一总体方面,本发明涉及分离的单克隆抗体或其抗原结合片段,其特异性结合糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(gitr),优选地人gitr。
8.提供了分离的单克隆抗体或其抗原结合片段,其包含重链互补决定区1(hcdr1)、hcdr2、hcdr3,轻链互补决定区1(lcdr1)、lcdr2和lcdr3,具有以下多肽序列:a.分别为seq id no:36、37、38、39、40、和41;b.分别为seq id no:42、43、44、45、46、和47;c.分别为seq id no:48、49、50、54、55、和56;d.分别为seq id no:51、52、53、54、55、和56;e.分别为seq id no:57、58、59、60、61、和62;f.分别为seq id no:63、64、65、66、67、和68;g.分别为seq id no:69、70、71、72、73、和74;h.分别为seq id no:75、76、77、78、79、和80;i.分别为seq id no:81、82、83、84、85、和86;j.分别为seq id no:87、88、89、93、94、和95;k.分别为seq id no:87、88、89、96、97、和98;l.分别为seq id no:90、91、92、93、94、和95;m.分别为seq id no:90、91、92、96、97、和98;n.分别为seq id no:99、100、101、102、103、和104;o.分别为seq id no:105、106、107、108、109、和110;p.分别为seq id no:111、112、113、114、115、和116;q.分别为seq id no:117、118、119、120、121、和122;r.分别为seq id no:123、124、125、126、127、和128;s.分别为seq id no:123、124、125、129、130、和131;t.分别为seq id no:123、124、125、132、133、和134;或者u.分别为seq id no:135、136、137、138、139、和140;或这些分离的单克隆抗体或其抗原结合片段的变体,该变体在hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和/或lcdr3中包含多达约三个氨基酸取代(例如,一个、两个、或三个氨基酸取代),其中该抗体或其抗原结合片段特异性结合gitr,优选地人gitr。
9.在某些实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区或轻链可变区,该重链可变区具有与seq id no:1、3、5、6、8、10、12、14、16、18、19、22、24、26、28、30、或34至少95%、至少96%、至少97%、至少98%、或至少99%同一性的多肽序列,该轻链可变区具有与seq id no:2、4、7、9、11、13、15、17、20、21、23、25、27、29、31、32、33、或35至少
95%、至少96%、至少97%、至少98%、或至少99%同一性的多肽序列。
10.在某些实施例中,该分离的单克隆抗体或其抗原结合片段包含:a.具有seq id no:1的多肽序列的重链可变区,和具有seq id no:2的多肽序列的轻链可变区;b.具有seq id no:3的多肽序列的重链可变区,和具有seq id no:4的多肽序列的轻链可变区;c.具有seq id no:5的多肽序列的重链可变区,和具有seq id no:7的多肽序列的轻链可变区;d.具有seq id no:6的多肽序列的重链可变区,和具有seq id no:7的多肽序列的轻链可变区;e.具有seq id no:8的多肽序列的重链可变区,和具有seq id no:9的多肽序列的轻链可变区;f.具有seq id no:10的多肽序列的重链可变区,和具有seq id no:11的多肽序列的轻链可变区;g.具有seq id no:12的多肽序列的重链可变区,和具有seq id no:13的多肽序列的轻链可变区;h.具有seq id no:14的多肽序列的重链可变区,和具有seq id no:15的多肽序列的轻链可变区;i.具有seq id no:16的多肽序列的重链可变区,和具有seq id no:17的多肽序列的轻链可变区;j.具有seq id no:18的多肽序列的重链可变区,和具有seq id no:20的多肽序列的轻链可变区;k.具有seq id no:18的多肽序列的重链可变区,和具有seq id no:21的多肽序列的轻链可变区;l.具有seq id no:19的多肽序列的重链可变区,和具有seq id no:20的多肽序列的轻链可变区;m.具有seq id no:19的多肽序列的重链可变区,和具有seq id no:21的多肽序列的轻链可变区;n.具有seq id no:22的多肽序列的重链可变区,和具有seq id no:23的多肽序列的轻链可变区;o.具有seq id no:24的多肽序列的重链可变区,和具有seq id no:25的多肽序列的轻链可变区;p.具有seq id no:26的多肽序列的重链可变区,和具有seq id no:27的多肽序列的轻链可变区;q.具有seq id no:28的多肽序列的重链可变区,和具有seq id no:29的多肽序列的轻链可变区;r.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:31的多肽序列的轻链可变区;s.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:32的多肽序列
的轻链可变区;t.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:33的多肽序列的轻链可变区;或者u.具有seq id no:34的多肽序列的重链可变区,和具有seq id no:35的多肽序列的轻链可变区。
11.在某些实施例中,该分离的单克隆抗体或其抗原结合片段是嵌合的。在某些实施例中,该分离的单克隆抗体或其抗原结合片段是嵌合的,并且该分离的单克隆抗体或其抗原结合片段包含人igg1恒定区或其变体。人igg1恒定区的变体例如包含选自k214r、d356e、l358m、和δk447的至少一个氨基酸修饰。
12.在某些实施例中,该分离的单克隆抗体或其抗原结合片段是人或人源化的。
13.在某些实施例中,该分离的单克隆抗体或其抗原结合片段是人源化的,并且该分离的单克隆抗体或其抗原结合片段包含:a.具有seq id no:143的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;b.具有seq id no:143的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;c.具有seq id no:144的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;d.具有seq id no:144的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;e.具有seq id no:145的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;f.具有seq id no:145的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;g.具有seq id no:148的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;h.具有seq id no:149的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;i.具有seq id no:150的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;j.具有seq id no:152的多肽序列的重链可变区,和具有seq id no:154的多肽序列的轻链可变区;或者k.具有seq id no:153的多肽序列的重链可变区,和具有seq id no:154的多肽序列的轻链可变区。
14.在某些实施例中,该分离的单克隆抗体或其抗原结合片段结合gitr并且能够诱导效应子介导的肿瘤细胞裂解。
15.还提供了编码本发明的单克隆抗体或其抗原结合片段的分离的核酸。
16.还提供了包含如下分离的核酸的载体,这些分离的核酸编码本发明的单克隆抗体或其抗原结合片段。
17.还提供了包含如下载体的宿主细胞,这些载体包含编码本发明的单克隆抗体或其抗原结合片段的分离的核酸。
18.在某些实施例中,提供了药物组合物,该药物组合物包含本发明的分离的单克隆抗体或其抗原结合片段以及药学上可接受的载剂。
19.还提供了治疗有需要的受试者的癌症的方法,该方法包括向该受试者施用本发明的药物组合物。癌症可以是任何液体癌或实体癌,例如,癌症可以选自但不限于肺癌、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性髓细胞性白血病(cml)、多发性骨髓瘤(mm)、急性骨髓性白血病(aml)和其他液体瘤。
20.还提供了产生本发明的单克隆抗体或其抗原结合片段的方法。这些方法包括在用于产生该单克隆抗体或其抗原结合片段的条件下对包含编码该单克隆抗体或其抗原结合片段的核酸的细胞进行培养,以及从该细胞或培养物中回收该单克隆抗体或其抗原结合片段。
21.还提供了产生包含本发明的单克隆抗体或其抗原结合片段的药物组合物的方法。这些方法包括将该单克隆抗体或其抗原结合片段与药学上可接受的载剂组合以获得该药物组合物。
22.还提供了确定受试者的gitr水平的方法。这些方法包括:(a)从受试者获得样品;(b)使该样品与本发明的分离的单克隆抗体或其抗原结合片段接触;以及(c)确定该受试者的gitr水平。样品可以例如是组织样品或血液样品。组织样品可以例如是癌组织样品。
附图说明
23.当结合附图阅读时,将更好地理解前述总结以及以下关于本技术的优选实施例的具体实施方式。然而,应理解的是本技术不限于显示于附图中的精确实施例。
24.图1a-1k显示了抗原特异性体液应答的结果。结果展示了针对以下利用基于elisa的测定的抗血清滴度:同种型对照(图1a);前血清(pre-serum)(图1b);pbs(图1c);小鼠ad94(图1d);小鼠ad95(图1e);小鼠ad96(图1f);小鼠ad97(图1g);小鼠ad98(图1h);小鼠ad99(图1i);小鼠ad100(图1j);以及小鼠ad101(图1k)。
25.图2a-2d显示了展示抗gitr小鼠抗体的facs结果的图。
26.图3显示了展示抗gitr小鼠抗体功能性报告基因剂量应答测定的结果的图。
27.图4a-4c显示了展示同时利用人gitr/cho-k1和cyno-gitr/cho-k1细胞系的facs结果的图。图4a和4b显示了展示人gitr的facs结合的图。图4c显示了展示cyno-gitr的facs结合的图。
28.图5a-5c显示了展示人源化抗gitr抗体的facs结合测定结果的图(图5a:45f1f3;图5b:270c5c10;以及图5c:225h7d12)。
29.图6a-6b显示了展示人源化抗gitr抗体报告基因功能性生物测定结果的图。
具体实施方式
30.在背景和整个说明书中引用或描述了各种出版物、文章和专利;这些参考文献中
的每一篇通过引用以其全文并入本文。包括在本说明书中的对文件、法案、材料、装置、制品等的讨论是出于提供本发明的背景的目的。这种讨论并不是承认任何或所有这些事项形成关于所披露或要求保护的任何发明的现有技术的一部分。
31.除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同含义。在其他方面,本文使用的某些术语具有如说明书中阐述的含义。
32.必须注意,除非上下文另外明确规定,否则如本文和所附权利要求书中所用,单数形式“一个/一种(a/an)”和“该”包括复数指示物。
33.除非另外陈述,否则任何数值(如本文所述的浓度或浓度范围)应理解为在所有情况下均由术语“约”修饰。因此,数值通常包括所列举值的
±
10%。例如,1mg/ml的浓度包括0.9mg/ml至1.1mg/ml。同样,1%至10%(w/v)的浓度范围包括0.9%(w/v)至11%(w/v)。如本文所用,数值范围的使用明确包括所有可能的子范围、该范围内的所有单独数值,包括此类范围内的整数和值的分数,除非上下文另外明确指示。
34.除非另外指示,否则在一系列要素前面的术语“至少”应被理解为指该系列中的每一个要素。本领域技术人员仅使用常规实验就将认识到或能够确定本文所述的本发明的具体实施例的许多等效物。此类等效物旨在涵盖在本发明中。
35.如本文所用,术语“包括/包含(comprises、comprising)”、“包括/包含(includes、including)”、“具有(has、having)”、“含有(contains或containing)”或其任何其他变化将被理解为意指包括所陈述的整数或整数组,但不排除任何其他整数或整数组,并且旨在是非排他性的或是开放性的。例如,包含一系列要素的组合物、混合物、工艺、方法、制品、或设备不必仅限于那些要素,而是可以包括其他未明确列出的要素,或此类组合物、混合物、工艺、方法、制品或设备固有的要素。另外,除非明确相反地陈述,否则“或”是指包括性的或而不是排他性的或。例如,以下项中的任一项满足条件a或b:a为真(或存在)且b为假(或不存在),a为假(或不存在)且b为真(或存在),并且a和b都为真的(或存在)。
36.如本文所用,多个列举的要素之间的连接术语“和/或”应被理解为同时涵盖单独的和组合的选项。例如,当两种要素由“和/或”连接时,第一选项是指在不具有第二要素的情况下第一要素的适用性。第二选项是指在没有第一要素的情况下第二要素的适用性。第三选项是指第一要素和第二要素一起的适用性。这些选项中的任一种应被理解为落入该含义内,因此满足如本文所用的术语“和/或”的要求。这些选项中的多于一种的同时适用性也应被理解为落入该含义内,因此满足术语“和/或”的要求。
37.如本文所用,“受试者”意指任何动物,优选地哺乳动物,最优选地人类。如本文所用的术语“哺乳动物”涵盖任何哺乳动物。哺乳动物的实例包括但不限于牛、马、羊、猪、猫、狗、小鼠、大鼠、兔、豚鼠、猴、人等,更优选地人。
38.还应理解,本文所用的术语“约”、“大约”、“通常”、“基本上”和类似术语在指代优选发明的组分的尺寸或特征时表示所描述的尺寸/特征不是严格的边界或参数,并且不排除与其功能上相同或相似的微小变化,如本领域普通技术人员将理解的。至少,包括数值参数的此类指示物将包括使用本领域接受的数学和工业原理(例如,舍入、测量误差或其他系统误差、制造公差等)不会改变最低有效数字的变化。
39.在两个或更多个核酸或多肽序列(例如,抗gitr抗体和编码这些抗体的多核苷酸,
gitr多肽和编码这些多肽的gitr多核苷酸)的背景下,术语“同一”或“同一性”百分比是指如使用以下序列比较算法之一或通过目视检查测量的,当比较和比对最大对应性时,两个或更多个序列或子序列是相同的或具有指定百分比的相同的氨基酸残基或核苷酸。
40.对于序列比较,通常一个序列用作参考序列,测试序列与该参考序列进行比较。当使用序列比较算法时,将测试序列和参考序列输入计算机中,必要时指定子序列坐标,并指定序列算法程序参数。基于指定的程序参数,序列比较算法然后计算一个或多个测试序列相对于参考序列的序列同一性百分比。
41.用于比较的序列的最佳比对可以通过以下来进行,例如:smith和waterman的局部同源性算法,adv.appl.math.2:482(1981);needleman和wunsch的同源性比对算法,j.mol.biol.48:443(1970);pearson和lipman的相似度搜索法,proc.nat’l.acad.sci.usa 85:2444(1988);这些算法的计算机化实施(gap、bestfit、fasta、和tfasta,在wisconsin genetics software package,genetics computer group,575science dr.,madison,wi中);或目视检查(通常参见,current protocols in molecular biology,f.m.ausubel等人,编辑,current protocols,greene publishing associates,inc.和john wiley&sons,inc.的合资企业,(1995增刊)(ausubel))。
42.适合用于确定序列同一性百分比和序列相似度的算法的实例是blast和blast 2.0算法,这些算法分别描述于altschul等人(1990)j.mol.biol.215:403-410和altschul等人(1997)nucleic acids res.25:3389-3402中。用于执行blast分析的软件可通过美国国家生物技术信息中心(national center for biotechnology information)公开地获得。这种算法涉及首先通过鉴定查询序列中具有长度w的短字而识别高评分序列对(hsp),这些短字当与数据库序列中具有相同长度的字比对时匹配或满足某个正值阈值得分t。t被称为邻域字得分阈值(altschul等人,同上)。这些初始邻域字命中充当启动搜索以查找含有它们的更长hsp的种子。然后这些字命中沿着每个序列在两个方向上进行延伸,直到可以增加累积比对得分。
43.对于核苷酸序列,使用参数m(一对匹配残基的奖励分;总是》0)和n(错配残基的罚分;总是《0)计算累积得分。对于氨基酸序列,使用评分矩阵来计算累积得分。在以下情况下,停止每个方向上的字命中的延伸:累积比对得分从其最大获得值下降数量x;由于一个或多个负评分残基比对的累积,累积评分趋于零或低于零;或达到任一序列的末端。blast算法的参数w、t、以及x决定了该比对的灵敏度与速度。blastn程序(对核苷酸序列而言)使用字长(w)为11、期望值(e)为10、m=5、n=-4,以及两条链的比较作为默认值。对于氨基酸序列,blastp程序使用字长(w)为3、期望值(e)为10,以及blosum62评分矩阵作为默认值(参见henikoff和henikoff,proc.natl.acad.sci.usa 89:10915(1989))。
44.除计算序列同一性百分比之外,blast算法还进行两个序列之间相似度的统计分析(参见例如,karlin和altschul,proc.nat’l.acad.sci.usa 90:5873-5787(1993))。由blast算法提供的相似度的一个量度是最小总和概率(p(n)),它提供了在两个核苷酸序列或氨基酸序列之间偶然发生匹配的概率的指示。例如,如果测试核酸与参考核酸比较中的最小总和概率小于约0.1,更优选地小于约0.01,最优选地小于约0.001,则认为该核酸与参考序列相似。
45.两个核酸序列或多肽基本上同一的进一步指示是由第一核酸编码的多肽与由第
二核酸编码的多肽免疫交叉反应,如下所述。因此,例如在多肽与第二多肽的区别仅在于保守取代的情况下,这两个肽通常基本上同一。两个核酸序列基本上同一的另一个指示是两个分子在严格条件下彼此杂交。
46.如本文所用,术语“分离的”意指生物组分(如核酸、肽或蛋白质)已与该组分在其中天然存在的生物体的其他生物组分基本上分离、已与这些其他生物组分分开产生、或已从这些其他生物组分中纯化出来,这些其他生物组分即其他染色体和染色体外dna和rna,以及蛋白质。因此,已经“分离”的核酸、肽和蛋白质包括通过标准纯化方法纯化的核酸和蛋白质。“分离的”核酸、肽和蛋白质可以是组合物的一部分,并且当该组合物不是该核酸、肽或蛋白质的天然环境的一部分时仍然是分离的。该术语还包括通过在宿主细胞中重组表达制备的核酸、肽和蛋白质以及化学合成的核酸。
47.如本文所用,术语“多核苷酸”同义地称为“核酸分子”、“核苷酸”或“核酸”,是指任何多聚核糖核苷酸或多聚脱氧核糖核苷酸,其可以是未经修饰的rna或dna或经修饰的rna或dna。“多核苷酸”包括但不限于单链和双链dna,以及单链和双链区域的混合物的dna,单链和双链rna,以及单链和双链区域的混合物的rna,包含可为单链或更典型地为双链或为单链和双链区域的混合物的dna和rna的杂合分子。另外,“多核苷酸”是指包含rna或dna或同时包含rna和dna的三链区域。术语多核苷酸还包括含有一个或多个经修饰碱基的dna或rna,以及具有出于稳定性或其他原因而修饰的主链的dna或rna。“经修饰的”碱基包括例如三苯甲基化碱基和如肌苷等不寻常碱基。可以对dna和rna进行多种修饰;因此,“多核苷酸”包括通常在自然界中发现的经化学、酶促或代谢修饰的形式的多核苷酸,以及病毒和细胞特有的dna和rna的化学形式。“多核苷酸”还包括相对较短的核酸链,通常称为寡核苷酸。
48.如本文所用,术语“载体”是其中可以有效地插入另一个核酸区段以引起该区段的复制或表达的复制子。
49.如本文所用,术语“宿主细胞”是指包含本发明的核酸分子的细胞。“宿主细胞”可以是任何类型的细胞,例如原代细胞、培养物中的细胞或来自细胞系的细胞。在一个实施例中,“宿主细胞”是用本发明的核酸分子转染或转导的细胞。在另一个实施例中,“宿主细胞”是这种转染或转导细胞的子代或潜在子代。细胞的子代可能与亲代细胞相同或可能不同,原因是例如,可能在后代中或核酸分子整合进宿主细胞基因组中时发生的突变或环境影响。
50.如本文所用,术语“表达”是指基因产物的生物合成。该术语涵盖将基因转录成rna。该术语还涵盖将rna翻译成一种或多种多肽,并进一步涵盖所有天然存在的转录后和翻译后修饰。所表达的多肽可以在宿主细胞的细胞质内,可以进入细胞外环境(如细胞培养物的生长培养基),或锚定至细胞膜。
51.如本文所用,术语“肽”、“多肽”或“蛋白质”可以指由氨基酸组成的分子并且可以被本领域技术人员视为蛋白质。本文使用了常规的氨基酸残基的单字母或三字母密码。在本文可互换使用的术语“肽”、“多肽”和“蛋白质”是指具有任何长度的氨基酸聚合物。该聚合物可以是直链或支链的,它可以包含经修饰的氨基酸,并且它可以被非氨基酸中断。这些术语还涵盖经天然修饰的或通过干预而修饰的氨基酸聚合物;例如,通过二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其他操作或修饰,如与标记组分缀合。这些定义内还包括例如含有一种或多种氨基酸类似物(包括例如非天然氨基酸等)以及本领域已知的其他修饰
的多肽。例如,本发明的肽、多肽和蛋白质可以包含一个或多个氨基酸取代。
52.本文所述的肽序列是根据通常的惯例书写的,由此肽的n末端区域在左侧,c末端区域在右侧。尽管氨基酸的异构形式是已知的,但除非另外明确指示,否则所表示的是氨基酸的l形式。
53.术语指定位置处的“氨基酸修饰”,例如fc区的氨基酸修饰是指指定残基的取代或缺失,或在该指定残基相邻处-插入至少一个氨基酸残基。与指定残基“相邻”的插入意指在其一至两个残基内插入。插入可以是指定残基的n末端或c末端。本文中的优选氨基酸修饰是取代。
54.如本文所用,术语“氨基酸取代”是指在多肽序列中一个氨基酸残基被另一个氨基酸残基替换。“保守氨基酸取代”是其中一个氨基酸残基被具有相似化学特征的侧链的另一个氨基酸残基替换的一种取代。本领域已经总体上定义了具有相似侧链的氨基酸残基家族,这些侧链包括碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-分支侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。例如,苯丙氨酸取代酪氨酸是保守取代。通常,本披露的多肽、可溶性蛋白质和/或抗体的序列中的保守取代不会消除含有氨基酸序列的多肽、可溶性蛋白质或抗体与靶结合位点的结合。对不消除结合的氨基酸保守取代进行鉴定的方法是本领域熟知的。
55.如本文所用,涉及具有有特定序列特征的多肽的抗体或其抗原结合片段(“参考抗体”)的术语“变体”是指具有如下多肽的不同抗体,该多肽相对于参考结合部分包含一个或多个(例如像,约1至约25、约1至约20、约1至约15、约1至约10、或约1至约5个)氨基酸序列取代、缺失和/或添加。抗gitr抗体或其抗原结合片段变体至少保留与gitr的特异性结合。在一些实施例中,抗gitr抗体或其抗原结合片段变体可源自对参考抗体的氨基酸序列进行的一种或多种(例如,约1至约25、约1至约20、约1至约15、约1至约10、或约1至约5种)改变。在某些实施例中,抗gitr抗体或其抗原结合片段变体可以包含至少三(3)个氨基酸取代。
56.抗体
57.本发明总体上涉及分离的抗糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(gitr)抗体、编码这些抗体的核酸和表达载体、含有这些载体的重组细胞以及包含这些抗体的组合物。还提供了制备这些抗体的方法,以及使用这些抗体治疗包括癌症的疾病的方法。本发明的抗体具有一种或多种所需的功能性质,包括但不限于与gitr的高亲和力结合、对gitr的高特异性,以及当单独施用或与其他抗癌疗法组合施用时在有需要的受试者和动物模型中抑制肿瘤生长的能力。
58.在总体方面,本发明涉及特异性结合gitr的分离的单克隆抗体或其抗原结合片段。
59.如本文所用,术语“抗体”在广义上使用并且包括免疫球蛋白或抗体分子,包括人抗体、人源化抗体、复合抗体和嵌合抗体以及单克隆或多克隆的抗体片段。通常,抗体是对特定抗原表现出结合特异性的蛋白质或肽链。抗体结构是熟知的。取决于重链恒定结构域氨基酸序列,免疫球蛋白可分为五个主要类别(即iga、igd、ige、igg和igm)。iga和igg可进
一步细分为同种型iga1、iga2、igg1、igg2、igg3和igg4。相应地,本发明的抗体可以属于五种主要类别中的任一种或对应的子类。优选地,本发明的抗体是igg1、igg2、igg3或igg4。脊椎动物物种的抗体轻链基于其恒定结构域的氨基酸序列可以归为两种明显不同的类型之一,即为κ和λ。相应地,本发明的抗体可以含有κ或λ轻链恒定结构域。根据特定实施例,本发明的抗体包括来自大鼠或人抗体的重链和/或轻链恒定区。除重链和轻链恒定结构域外,抗体还含有抗原结合区,该抗原结合区由轻链可变区和重链可变区构成,这些可变区中的每一个都含有三个结构域(即,互补决定区1-3;cdr1、cdr2、和cdr3)。轻链可变区结构域可替代地称为lcdr1、lcdr2、和lcdr3,且重链可变区结构域可替代地称为hcdr1、hcdr2、和hcdr3。
60.如本文所用,术语“分离的抗体”是指基本上不含具有不同抗原特异性的其他抗体的抗体(例如,特异性结合gitr的分离的抗体基本上不含不结合gitr的抗体)。另外,分离的抗体基本上不含其他细胞物质和/或化学物质。
61.如本文所用,术语“单克隆抗体”是指从基本上均质的抗体群(即构成该群的个体抗体除可少量存在的可能自然发生的突变外均相同)获得的抗体。本发明的单克隆抗体可通过杂交瘤方法、噬菌体展示技术、单淋巴细胞基因克隆技术或重组dna方法制备。例如,单克隆抗体可以由杂交瘤产生,该杂交瘤包括从转基因非人动物(如转基因小鼠或大鼠)获得的b细胞,该b细胞具有包含人重链转基因和轻链转基因的基因组。
62.如本文所用,术语“抗原结合片段”是指抗体片段,例如像双抗体、fab、fab'、f(ab')2、fv片段、二硫键稳定性fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定性双抗体(ds双抗体)、单链抗体分子(scfv)、单域抗体(sdab)、scfv二聚体(二价双抗体)、由包含一个或多个cdr的抗体的部分形成的多特异性抗体、驼峰化单域抗体、纳米抗体、结构域抗体、二价结构域抗体或任何其他与抗原结合但不包含完整的抗体结构的抗体片段。抗原结合片段能够与亲本抗体或亲本抗体片段所结合的相同抗原结合。根据特定实施例,抗原结合片段包含轻链可变区、轻链恒定区和重链的fd区段。根据其他特定实施例,抗原结合片段包含fab和f(ab’)2。
63.如本文所用,术语“单链抗体”是指本领域常规的单链抗体,其包含由约15至约20个氨基酸的短肽连接的重链可变区和轻链可变区。如本文所用,术语“单域抗体”是指本领域常规的单域抗体,其包含重链可变区和重链恒定区或其仅包含重链可变区。
64.如本文所用,术语“人抗体”是指由人产生的抗体或具有与由人产生的抗体相对应的氨基酸序列的、使用本领域已知的任何技术制备的抗体。人抗体的该定义包括完整或全长抗体、其片段和/或包含至少一种人重链和/或轻链多肽的抗体。
65.如本文所用,术语“人源化抗体”是指经修饰以增加与人抗体的序列同源性,以便保留抗体的抗原结合性质,但在人体内的抗原性降低的非人抗体。
66.如本文所用,术语“嵌合抗体”是指其中免疫球蛋白分子的氨基酸序列来源于两个或更多个物种的抗体。轻链和重链的可变区通常都与来源于一个哺乳动物物种(例如,小鼠、大鼠、兔等)的具有所需特异性、亲和力和能力的抗体的可变区相对应,而恒定区与来源于另一哺乳动物物种(例如,人)的抗体的序列相对应,以避免在该物种中引发免疫应答。
67.如本文所用,术语“多特异性抗体”是指包含多个免疫球蛋白可变结构域序列的抗体,其中该多个中的第一免疫球蛋白可变结构域序列对第一表位具有结合特异性,并且该
多个中的第二免疫球蛋白可变结构域序列对第二表位具有结合特异性。在实施例中,第一表位和第二表位在相同抗原(例如,相同蛋白质(或多聚体蛋白的亚基))上。在实施例中,第一表位和第二表位重叠或基本上重叠。在实施例中,第一表位和第二表位不重叠或基本上不重叠。在实施例中,第一表位和第二表位在不同的抗原(例如不同的蛋白质(或多聚体蛋白的不同亚基))上。在实施例中,多特异性抗体包含第三、第四或第五免疫球蛋白可变结构域。在实施例中,多特异性抗体是双特异性抗体分子、三特异性抗体分子、或四特异性抗体分子。
68.如本文所用,术语“双特异性抗体”是指与不超过两个表位或两个抗原结合的多特异性抗体。双特异性抗体的特征在于对第一表位具有结合特异性的第一免疫球蛋白可变结构域序列和对第二表位具有结合特异性的第二免疫球蛋白可变结构域序列。在实施例中,第一表位和第二表位在相同抗原(例如,相同蛋白质(或多聚体蛋白的亚基))上。在实施例中,第一表位和第二表位重叠或基本上重叠。在实施例中,第一表位和第二表位在不同的抗原(例如不同的蛋白质(或多聚体蛋白的不同亚基))上。在实施例中,双特异性抗体包含对第一表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列以及对第二表位具有结合特异性的重链可变结构域序列和轻链可变结构域序列。在实施例中,双特异性抗体包含对第一表位具有结合特异性的半抗体、或其片段,以及对第二表位具有结合特异性的半抗体、或其片段。在实施例中,双特异性抗体包含对第一表位具有结合特异性的scfv、或其片段,以及对第二表位具有结合特异性的scfv、或其片段。在实施例中,第一表位位于gitr上,且第二表位位于免疫检查点分子和/或其他肿瘤相关免疫抑制因子或表面抗原上。
69.如本文所用,术语“gitr”是指糖皮质激素诱导的肿瘤坏死因子受体相关蛋白。gitr属于肿瘤坏死因子受体超家族(tnfrsf),它是经由细胞外富含半胱氨酸的结构域与肿瘤坏死因子(tnf)结合的细胞因子受体。tnfrsf参与各种细胞过程,从细胞凋亡和炎症到增殖、存活和分化中的其他信号转导途径。gitr被确定为tnfrsf的成员,它在暴露于糖皮质激素(gc)时保护t细胞免于凋亡,糖皮质激素是t细胞死亡的有效诱导剂且常用作免疫抑制剂和抗炎剂。gitr在cd25
+
cd4
+
调节性t细胞上以高水平组成型且排他性地表达。其配体gitrl主要由活化的抗原呈递细胞(apc)表达。在表皮角质形成细胞、破骨细胞前体和上皮细胞上也注意到了gitr和gitrl的表达。这表明,gitr和gitrl的功能可能不仅限于调节免疫应答,可能还涉及介导白细胞粘附和迁移。调节gitr功能的抗癌治疗潜力归因于其在效应t细胞(t
eff
)中的共刺激作用以及对肿瘤浸润性调节性t(t
reg
)细胞的抑制或耗竭。因此,gitr是肿瘤相关/肿瘤特异性抗原,并且抗gitr单克隆抗体(mab)可能是潜在的抗癌疗法。此外,gitr可用于将治疗分子特异性靶向癌细胞。人gitr的示例性氨基酸序列由genbank登录号np_004186.1(同种型1)、genbank登录号np_683699.1(同种型2)和/或genbank登录号np_683700.1(同种型3)表示。
70.如本文所用,“特异性结合gitr”的抗体是指以1
×
10-7
m或以下、优选地1
×
10-8
m或以下、更优选地5
×
10-9
m或以下、1
×
10-9
m或以下、5
×
10-10
m或以下、或1
×
10-10
m或以下的kd结合gitr(优选地人gitr)的抗体。术语“k
d”是指解离常数,其获得自kd与ka的比率(即,kd/ka)并表示为摩尔浓度(m)。鉴于本披露,可以使用本领域中的方法确定抗体的kd值。例如,抗体的kd可以通过使用表面等离子体共振来确定,例如通过使用生物传感器系统(例如,系统),或通过使用生物膜层干涉技术(如octet red96系统)。
71.抗体的kd值越小,抗体与靶抗原结合的亲和力越高。
72.根据特定方面,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含重链互补决定区1(hcdr1)、hcdr2、hcdr3,轻链互补决定区1(lcdr1)、lcdr2和lcdr3,具有以下多肽序列:a.分别为seq id no:36、37、38、39、40、和41;b.分别为seq id no:42、43、44、45、46、和47;c.分别为seq id no:48、49、50、54、55、和56;d.分别为seq id no:51、52、53、54、55、和56;e.分别为seq id no:57、58、59、60、61、和62;f.分别为seq id no:63、64、65、66、67、和68;g.分别为seq id no:69、70、71、72、73、和74;h.分别为seq id no:75、76、77、78、79、和80;i.分别为seq id no:81、82、83、84、85、和86;j.分别为seq id no:87、88、89、93、94、和95;k.分别为seq id no:87、88、89、96、97、和98;l.分别为seq id no:90、91、92、93、94、和95;m.分别为seq id no:90、91、92、96、97、和98;n.分别为seq id no:99、100、101、102、103、和104;o.分别为seq id no:105、106、107、108、109、和110;p.分别为seq id no:111、112、113、114、115、和116;q.分别为seq id no:117、118、119、120、121、和122;r.分别为seq id no:123、124、125、126、127、和128;s.分别为seq id no:123、124、125、129、130、和131;t.分别为seq id no:123、124、125、132、133、和134;或者u.分别为seq id no:135、136、137、138、139、和140;或该分离的单克隆抗体或其抗原结合片段的变体,该变体在hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和/或lcdr3中包含多达约三个(例如,一个、两个或三个)氨基酸取代,其中该抗体或其抗原结合片段特异性结合gitr,优选地人gitr。
73.在一些实施例中,该分离的单克隆抗体或其抗原结合片段包含重链互补决定区1(hcdr1)、hcdr2、hcdr3,轻链互补决定区1(lcdr1)、lcdr2和lcdr3,具有以下多肽序列:a.分别为seq id no:36、37、38、39、40、和41;b.分别为seq id no:42、43、44、45、46、和47;c.分别为seq id no:48、49、50、54、55、和56;d.分别为seq id no:51、52、53、54、55、和56;e.分别为seq id no:57、58、59、60、61、和62;f.分别为seq id no:63、64、65、66、67、和68;g.分别为seq id no:69、70、71、72、73、和74;h.分别为seq id no:75、76、77、78、79、和80;i.分别为seq id no:81、82、83、84、85、和86;
j.分别为seq id no:87、88、89、93、94、和95;k.分别为seq id no:87、88、89、96、97、和98;l.分别为seq id no:90、91、92、93、94、和95;m.分别为seq id no:90、91、92、96、97、和98;n.分别为seq id no:99、100、101、102、103、和104;o.分别为seq id no:105、106、107、108、109、和110;p.分别为seq id no:111、112、113、114、115、和116;q.分别为seq id no:117、118、119、120、121、和122;r.分别为seq id no:123、124、125、126、127、和128;s.分别为seq id no:123、124、125、129、130、和131;t.分别为seq id no:123、124、125、132、133、和134;或者u.分别为seq id no:135、136、137、138、139、和140;其中该抗体或其抗原结合片段特异性结合gitr,优选地人gitr。
74.根据另一特定方面,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含重链可变区或轻链可变区,该重链可变区具有与seq id no:1、3、5、6、8、10、12、14、16、18、19、22、24、26、28、30、或34之一至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:2、4、7、9、11、13、15、17、20、21、23、25、27、29、31、32、33、或35之一85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。根据一个优选的实施例,本发明的分离的单克隆抗体或其抗原结合片段分别包含重链可变区和轻链可变区,该重链可变区具有与seq id no:1、3、5、6、8、10、12、14、16、18、19、22、24、26、28、30、或34至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:2、4、7、9、11、13、15、17、20、21、23、25、27、29、31、32、33、或35至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。
75.根据另一特定方面,本发明涉及本发明的分离的单克隆抗体或其抗原结合片段,其包含:a.具有seq id no:1的多肽序列的重链可变区,和具有seq id no:2的多肽序列的轻链可变区;b.具有seq id no:3的多肽序列的重链可变区,和具有seq id no:4的多肽序列的轻链可变区;c.具有seq id no:5的多肽序列的重链可变区,和具有seq id no:7的多肽序列的轻链可变区;d.具有seq id no:6的多肽序列的重链可变区,和具有seq id no:7的多肽序列的轻链可变区;e.具有seq id no:8的多肽序列的重链可变区,和具有seq id no:9的多肽序列的轻链可变区;f.具有seq id no:10的多肽序列的重链可变区,和具有seq id no:11的多肽序列的轻链可变区;
g.具有seq id no:12的多肽序列的重链可变区,和具有seq id no:13的多肽序列的轻链可变区;h.具有seq id no:14的多肽序列的重链可变区,和具有seq id no:15的多肽序列的轻链可变区;i.具有seq id no:16的多肽序列的重链可变区,和具有seq id no:17的多肽序列的轻链可变区;j.具有seq id no:18的多肽序列的重链可变区,和具有seq id no:20的多肽序列的轻链可变区;k.具有seq id no:18的多肽序列的重链可变区,和具有seq id no:21的多肽序列的轻链可变区;l.具有seq id no:19的多肽序列的重链可变区,和具有seq id no:20的多肽序列的轻链可变区;m.具有seq id no:19的多肽序列的重链可变区,和具有seq id no:21的多肽序列的轻链可变区;n.具有seq id no:22的多肽序列的重链可变区,和具有seq id no:23的多肽序列的轻链可变区;o.具有seq id no:24的多肽序列的重链可变区,和具有seq id no:25的多肽序列的轻链可变区;p.具有seq id no:26的多肽序列的重链可变区,和具有seq id no:27的多肽序列的轻链可变区;q.具有seq id no:28的多肽序列的重链可变区,和具有seq id no:29的多肽序列的轻链可变区;r.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:31的多肽序列的轻链可变区;s.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:32的多肽序列的轻链可变区;t.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:33的多肽序列的轻链可变区;或者u.具有seq id no:34的多肽序列的重链可变区,和具有seq id no:35的多肽序列的轻链可变区。
76.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:36、37、38、39、40、和41的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:1至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:2至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:1的多肽序列的重链可变区;以及具有seq id no:2的多肽序列的轻链可变区。
77.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含
hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:42、43、44、45、46、和47的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:3至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:4至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:3的多肽序列的重链可变区;以及具有seq id no:4的多肽序列的轻链可变区。
78.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:48、49、50、54、55、和56的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:5至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:7至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:5的多肽序列的重链可变区;以及具有seq id no:7的多肽序列的轻链可变区。
79.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:51、52、53、54、55、和56的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:6至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:7至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:6的多肽序列的重链可变区;以及具有seq id no:7的多肽序列的轻链可变区。
80.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:57、58、59、60、61、和62的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:8至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:9至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:8的多肽序列的重链可变区;以及具有seq id no:9的多肽序列的轻链可变区。
81.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:63、64、65、66、67、和68的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:10至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:11至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:10的多肽序列的重链可变区;以及具有seq id no:11的多肽序列的轻链可变区。
82.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:69、70、71、72、73、和74的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:12至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:13至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:12的多肽序列的重链可变区;以及具有seq id no:13的多肽序列的轻链可变区。
83.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:75、76、77、78、79、和80的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:14至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:15至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:14的多肽序列的重链可变区;以及具有seq id no:15的多肽序列的轻链可变区。
84.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:81、82、83、84、85、和86的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:16至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:17至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:16的多肽序列的重链可变区;以及具有seq id no:17的多肽序列的轻链可变区。
85.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:87、88、89、93、94、和95的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:18至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:20至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:18的多肽序列的重链可变区;以及具有seq id no:20的多肽序列的轻链可变区。
86.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:87、88、89、96、97、和98的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:18至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:21至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:18的
多肽序列的重链可变区;以及具有seq id no:21的多肽序列的轻链可变区。
87.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:90、91、92、93、94、和95的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:19至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:20至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:19的多肽序列的重链可变区;以及具有seq id no:20的多肽序列的轻链可变区。
88.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:90、91、92、96、97、和98的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:19至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:21至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:19的多肽序列的重链可变区;以及具有seq id no:21的多肽序列的轻链可变区。
89.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:99、100、101、102、103、和104的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:22至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:23至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:22的多肽序列的重链可变区;以及具有seq id no:23的多肽序列的轻链可变区。
90.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:105、106、107、108、109、和110的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:24至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:25至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:24的多肽序列的重链可变区;以及具有seq id no:25的多肽序列的轻链可变区。
91.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:111、112、113、114、115、和116的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:26至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:27至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或
99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:26的多肽序列的重链可变区;以及具有seq id no:27的多肽序列的轻链可变区。
92.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:117、118、119、120、121、和122的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:28至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:29至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:28的多肽序列的重链可变区;以及具有seq id no:29的多肽序列的轻链可变区。
93.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:123、124、125、126、127、和128的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:30至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:31至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:30的多肽序列的重链可变区;以及具有seq id no:31的多肽序列的轻链可变区。
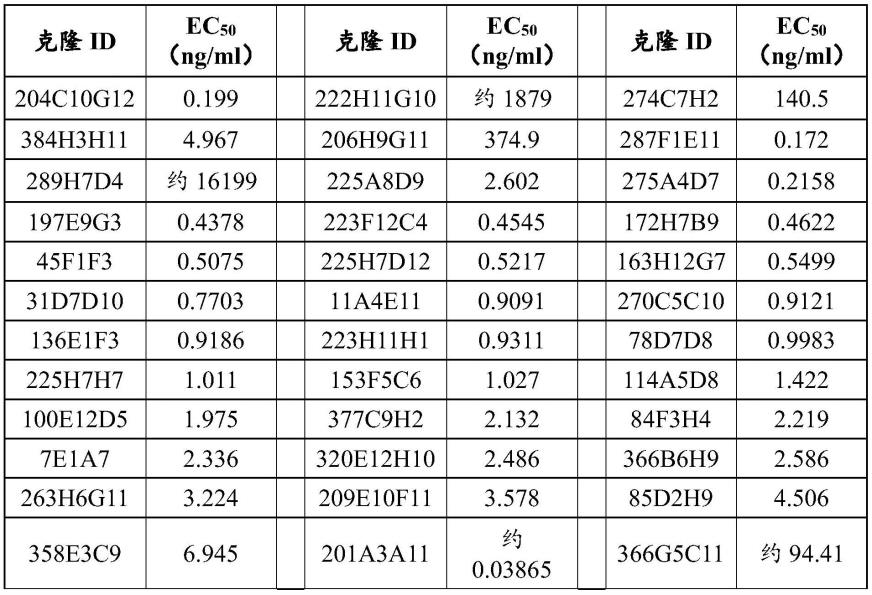
94.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:123、124、125、129、130、和131的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:30至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:32至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:30的多肽序列的重链可变区;以及具有seq id no:32的多肽序列的轻链可变区。
95.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:123、124、125、132、133、和134的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:30至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:33至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:30的多肽序列的重链可变区;以及具有seq id no:33的多肽序列的轻链可变区。
96.在一个实施例中,本发明涉及分离的单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:135、136、137、138、139、和140的多肽序列。在另一个实施例中,该分离的单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:34至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与
seq id no:35至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的单克隆抗体或其抗原结合片段包含具有seq id no:34的多肽序列的重链可变区;以及具有seq id no:35的多肽序列的轻链可变区。
97.根据另一特定方面,本发明涉及分离的单克隆抗体或其抗原结合片段,其中该抗体或其抗原结合片段是嵌合的。在某些实施例中,该分离的单克隆抗体或其抗原结合片段是嵌合的,并且该分离的单克隆抗体或其抗原结合片段包含人igg1恒定区或其变体。人igg1恒定区包含人igg1重链恒定区和轻链κ恒定区。人igg1重链恒定区的变体例如包含选自k214r、d356e、l358m、和δk447的至少一个氨基酸修饰。在某些实施例中,人igg1重链的恒定区包含seq id no:141的多肽序列,并且人igg1轻链的恒定区包含seq id no:142的多肽序列。在某些实施例中,变体人igg1重链的恒定区包含seq id no:155的多肽序列,并且人igg1轻链的恒定区包含seq id no:142的多肽序列。在某些实施例中,人igg1重链变体的恒定区包含seq id no:156的多肽序列,并且人igg1轻链的恒定区包含seq id no:142的多肽序列。举例而言,将下文所述的克隆45f1f3、225h7d12、270c5c10、163h12g7、172h7b9、和223f12c4的可变区融合到具有修饰k214r、d356e、l358m和δk447的人igg1恒定区上。再举例而言,将下文所述的克隆204c10g12、225a8d9、274c7h2、384h3h11、134d7b3、177c6b11、215f2a5、和223h11h1的可变区融合到具有修饰k214r的人igg1恒定区上。
98.在一些实施例中,抗gitr单克隆抗体或其抗原结合片段是嵌合的单克隆抗体或其抗原结合片段。某些嵌合抗体描述于例如美国专利号4,816,567;以及morrison等人,proc.natl.acad.sci.usa,81:6851-6855(1984)中。在一个实例中,嵌合抗体包含非人可变区(例如,来源于鼠科动物如小鼠的可变区)和人恒定区。在另一个实例中,嵌合抗体是“类别转换”抗体,其中类别或子类已相对于亲本抗体的类别或子类发生改变。
99.根据另一特定方面,本发明涉及分离的单克隆抗体或其抗原结合片段,其中该抗体或其抗原结合片段是人或人源化的。
100.在一些实施例中,嵌合抗体或其抗原结合片段是人源化抗体或其抗原结合片段。通常,对非人抗体进行人源化处理以降低对人的免疫原性,同时保留亲本非人抗体的特异性和亲和力。通常,人源化抗体包含一个或多个可变结构域,其中例如cdr的hvr(或其部分)来源于非人抗体,且fr(或其部分)来源于人抗体序列。人源化抗体任选地也将包含人恒定区的至少一部分。在一些实施例中,人源化抗体中的一些fr残基被来自非人抗体(例如,作为hvr残基来源的抗体)的对应残基取代,例如,以恢复或提高抗体特异性或亲和力。
101.人源化抗体及其制备方法综述于例如almagro和fransson,front.biosci.13:1619-1633(2008)中,并且进一步描述于例如以下中:riechmann等人,nature 332:323-329(1988);queen等人,proc.nat’l acad.sci.usa 86:10029-10033(1989);美国专利号5,821,337、7,527,791、6,982,321、和7,087,409;kashmiri等人,methods 36:25-34(2005)(描述sdr(a-cdr)移植);padlan,mol.immunol.28:489-498(1991)(描述“表面重修”);dall’acqua等人,methods 36:43-60(2005)(描述“fr改组”);以及osbourn等人,methods 36:61-68(2005)和klimka等人,br.j.cancer,83:252-260(2000)(描述fr改组的“导向选择”方法)。
102.可用于人源化的人框架区包括但不限于:使用“最佳拟合”方法选择的框架区(参见例如,sims等人j.immunol.151:2296(1993));来源于特定轻链或重链可变区亚组的人抗
体的共有序列的框架区(参见例如,carter等人proc.natl.acad.sci.usa,89:4285(1992);和presta等人j.immunol.,151:2623(1993));人成熟(体细胞突变的)框架区或人种系框架区(参见例如,almagro和fransson,front.biosci.13:1619-1633(2008));以及来源于筛选fr文库的框架区(参见例如,baca等人,j.biol.chem.272:10678-10684(1997)和rosok等人,j.biol.chem.271:22611-22618(1996))。
103.在某些实施例中,该分离的单克隆抗体或其抗原结合片段是人源化的,并且该分离的单克隆抗体或其抗原结合片段包含:a.具有seq id no:143的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;b.具有seq id no:143的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;c.具有seq id no:144的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;d.具有seq id no:144的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;e.具有seq id no:145的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;f.具有seq id no:145的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;g.具有seq id no:148的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;h.具有seq id no:149的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;i.具有seq id no:150的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;j.具有seq id no:152的多肽序列的重链可变区,和具有seq id no:154的多肽序列的轻链可变区;或者k.具有seq id no:153的多肽序列的重链可变区,和具有seq id no:154的多肽序列的轻链可变区。
104.在一个实施例中,本发明涉及分离的人源化单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:36、37、38、39、40、和41的多肽序列。在另一个实施例中,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:143、144或145至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:146或147至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:143至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:146至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人
源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:143至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:147至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:144至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:146至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:144至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:147至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:145至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:146至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:145至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:147至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。
105.在一个实施例中,本发明涉及分离的人源化单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:42、43、44、45、46、和47的多肽序列。在另一个实施例中,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:148、149或150至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区具有与seq id no:151至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:148至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:151至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:149至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:151至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:150至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:151至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。
106.在一个实施例中,本发明涉及分离的人源化单克隆抗体或其抗原结合片段,其包含hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和lcdr3,具有分别为seq id no:48、49、50、54、55、和56的多肽序列。在另一个实施例中,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:152或153至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列,该轻链可变区
具有与seq id no:154至少85%,优选地90%,更优选地95%或更高,如95%、96%、97%、98%、或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:152至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:154至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。优选地,该分离的人源化单克隆抗体或其抗原结合片段包含重链可变区和轻链可变区,该重链可变区具有与seq id no:153至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列,该轻链可变区具有与seq id no:154至少85%、90%、95%、96%、97%、98%或99%同一性的多肽序列。
107.抗体的cdr由本领域技术人员使用各种方法/系统定义。这些系统和/或定义已经过多年的发展和完善,并且包括kabat、chothia、imgt、abm和contact。kabat定义基于序列可变性,并且被普遍使用。chothia定义基于结构环区的位置。imgt系统基于可变结构域结构内的序列可变性和位置。abm定义是kabat与chothia之间的折衷。contact定义基于对可用抗体晶体结构的分析。示例性系统是kabat。
108.在另一总体方面,本发明涉及编码本发明的单克隆抗体或其抗原结合片段的分离的核酸。本领域技术人员将理解,蛋白质的编码序列可以在不改变蛋白质的氨基酸序列的情况下改变(例如,替换、缺失、插入等)。相应地,本领域技术人员将理解,可以在不改变蛋白质的氨基酸序列的情况下改变编码本发明的单克隆抗体或其抗原结合片段的核酸序列。
109.在另一总体方面,本发明涉及载体,其包含编码本发明的单克隆抗体或其抗原结合片段的分离的核酸。鉴于本披露,可以使用本领域技术人员已知的任何载体,例如质粒、粘粒、噬菌体载体或病毒载体。在一些实施例中,载体是重组表达载体,如质粒。载体可以包括用于建立表达载体的常规功能的任何元件,例如启动子、核糖体结合元件、终止子、增强子、选择标记和复制起点。启动子可以是组成型、诱导型或抑制型启动子。许多能够将核酸递送至细胞的表达载体是本领域已知的并且可以在本文中用于在细胞中产生抗体或其抗原结合片段。可以使用常规克隆技术或人工基因合成来产生根据本发明实施例的重组表达载体。鉴于本披露,此类技术对于本技术领域的技术人员来说是熟知的。
110.在另一总体方面,本发明涉及宿主细胞,其包含编码本发明的单克隆抗体或其抗原结合片段的分离的核酸。鉴于本披露,可以将本领域技术人员已知的任何宿主细胞用于本发明的抗体或其抗原结合片段的重组表达。在一些实施例中,宿主细胞是大肠杆菌(e.coli)tg1或bl21细胞(用于表达例如scfv或fab抗体)、cho-dg44或cho-k1细胞或hek293细胞(用于表达例如全长igg抗体)。根据特定实施例,将重组表达载体通过常规方法如化学转染、热激或电穿孔转化到宿主细胞中,在其中它被稳定整合到宿主细胞基因组中,使得重组核酸得到有效表达。
111.在另一总体方面,本发明涉及产生本发明的单克隆抗体或其抗原结合片段的方法,该方法包括在用于产生本发明的单克隆抗体或其抗原结合片段的条件下对包含编码该单克隆抗体或其抗原结合片段的核酸的细胞进行培养,以及从该细胞或培养物(例如,从上清液)中回收该抗体或其抗原结合片段。可以从细胞中收获表达的抗体或其抗原结合片段,并根据本领域已知的常规技术和如本文所述的方法进行纯化。
112.药物组合物
113.在另一总体方面,本发明涉及药物组合物,其包含本发明的分离的单克隆抗体或
其抗原结合片段以及药学上可接受的载剂。如本文所用,术语“药物组合物”意指包含本发明的抗体以及药学上可接受的载剂的产品。本发明的抗体和包含这些抗体的组合物也可用于制备用于本文提及的治疗应用的药物。
114.如本文所用,术语“载剂”是指任何赋形剂、稀释剂、填充剂、盐、缓冲液、稳定剂、增溶剂、油、脂质、含脂质的囊泡、微球、脂质体包封物或本领域中熟知的用于药物制剂中的其他材料。应理解,载剂、赋形剂或稀释剂的特征将取决于特定应用的施用途径。如本文所用,术语“药学上可接受的载剂”是指不会干扰根据本发明的组合物的有效性或根据本发明的组合物的生物活性的无毒材料。根据特定实施例,鉴于本披露,适合用于抗体药物组合物的任何药学上可接受的载剂均可用于本发明中。
115.药物活性成分与药学上可接受的载剂的制剂是本领域已知的,例如,雷明顿:药物科学与实践(remington:the science and practice of pharmacy)(例如,第21版(2005)和任何后续版本)。另外的成分的非限制性实例包括:缓冲液、稀释剂、溶剂、张度调节剂、防腐剂、稳定剂和螯合剂。一种或多种药学上可接受的载剂可用于配制本发明的药物组合物。
116.在本发明的一个实施例中,药物组合物是液体制剂。液体制剂的优选实例是水性制剂,即包含水的制剂。液体制剂可包含溶液、悬浮液、乳液、微乳液、凝胶等。
117.在一个实施例中,药物组合物可配制成可例如经由注射装置(例如,注射器或输注泵)注射的可注射剂。例如,可以皮下、肌内、腹膜内、玻璃体内或静脉内递送注射剂。
118.在另一个实施例中,药物组合物是固体制剂,例如冷冻干燥的或喷雾干燥的组合物,其可以原样使用,或者医生或患者在使用前向其中添加溶剂和/或稀释剂。固体剂型可以包括片剂(如压制片剂和/或包衣片剂)和胶囊(例如,硬或软明胶胶囊)。例如,药物组合物还可以呈药囊、糖衣丸、粉剂、颗粒、锭剂或用于重构的粉剂的形式。
119.剂型可以是立即释放的,在这种情况下剂型可以包含水溶性或可分散的载剂,或者剂型可以是延迟释放、持续释放或改良释放的,在这种情况下剂型可以包含调节该剂型在胃肠道或皮下的溶解速率的水不溶性聚合物。
120.在其他实施例中,药物组合物可以鼻内、颊内或舌下递送。
121.在本发明的另一个实施例中,药物组合物包含缓冲液。在本发明的另一个实施例中,药物组合物包含防腐剂。在本发明的另一个实施例中,药物组合物包含等渗剂。在本发明的另一个实施例中,药物组合物包含螯合剂。在本发明的另一个实施例中,药物组合物包含稳定剂。
122.在本发明的进一步实施例中,药物组合物包含一种或多种表面活性剂,优选地一种表面活性剂、至少一种表面活性剂或两种不同的表面活性剂。术语“表面活性剂”是指由水溶性(亲水性)部分和脂溶性(亲油性)部分组成的任何分子或离子。表面活性剂可以例如选自由以下组成的组:阴离子表面活性剂、阳离子表面活性剂、非离子表面活性剂和/或两性离子表面活性剂。
123.在本发明的进一步实施例中,药物组合物包含一种或多种蛋白酶抑制剂,例如像,edta和/或苯甲脒盐酸(hcl)。
124.在另一总体方面,本发明涉及产生包含本发明的单克隆抗体或其抗原结合片段的药物组合物的方法,该方法包括将单克隆抗体或其抗原结合片段与药学上可接受的载剂组合以获得药物组合物。
125.使用方法
126.在另一总体方面,本发明涉及靶向受试者的癌细胞表面上gitr的方法,该方法包括向该受试者施用特异性结合gitr的分离的单克隆抗体或其抗原结合片段或本发明的药物组合物。单克隆抗体或其抗原结合片段与gitr的结合可以介导补体依赖性细胞毒性(cdc)、抗体依赖性吞噬作用(adpc)和/或抗体依赖性细胞的细胞毒性(adcc)或致使靶癌细胞死亡的其他作用。单克隆抗体或其抗原结合片段可以例如用于募集缀合的药物,和/或可以与另一种单克隆抗体形成双特异性抗体以介导靶癌细胞的死亡。
127.结合gitr的抗体及其抗原结合片段的功能活性可以通过本领域已知的方法和如本文所述的方法来表征。用于表征结合gitr的抗体及其抗原结合片段的方法包括但不限于亲和力和特异性测定,包括biacore、elisa、和octetred分析;通过facs检测抗体与在癌细胞或重组表达gitr的细胞上的gitr结合的结合测定。根据特定实施例,用于表征结合gitr的抗体及其抗原结合片段的方法包括下文描述的那些。
128.在另一总体方面,本发明涉及治疗有需要的受试者的癌症的方法,该方法包括向该受试者施用特异性结合gitr的分离的单克隆抗体或其抗原结合片段或本发明的药物组合物。癌症可以例如选自但不限于肺癌、胃癌、结肠癌、肝细胞癌、肾细胞癌、膀胱尿路上皮癌、转移性黑色素瘤、乳腺癌、卵巢癌、宫颈癌、头颈癌、胰腺癌、胶质瘤和其他实体瘤,以及非霍奇金淋巴瘤(nhl)、急性淋巴细胞白血病(all)、慢性淋巴细胞白血病(cll)、慢性髓细胞性白血病(cml)、多发性骨髓瘤(mm)、急性骨髓性白血病(aml)和其他液体瘤。
129.根据本发明的实施例,药物组合物包含治疗有效量的抗gitr抗体或其抗原结合片段。如本文所用,术语“治疗有效量”是指在受试者中引发所希望的生物或药物反应的活性成分或组分的量。关于所阐述的目的,治疗有效量可以根据经验并且以常规方式来确定。
130.如本文关于抗gitr抗体或其抗原结合片段所用的,治疗有效量意指在有需要的受试者中调节免疫应答的抗gitr抗体或其抗原结合片段的量。
131.根据特定实施例,治疗有效量是指足以实现以下效果中的一种、两种、三种、四种或更多种的疗法的量:(i)减轻或改善待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的严重程度;(ii)缩短待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的持续时间;(iii)预防待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的进展;(iv)使待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状消退;(v)预防待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的发展或发作;(vi)预防待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的复发;(vii)减少患有待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的受试者的住院;(viii)缩短患有待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的受试者的住院时间;(ix)增加患有待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状的受试者的存活率;(xi)抑制或减少受试者的待治疗的疾病、障碍或病症或与该疾病、障碍或病症相关的症状;和/或(xii)增强或改善另一种疗法的一种或多种预防或治疗效果。
132.治疗有效量或剂量可以根据各种因素而变化,如待治疗的疾病、障碍或病症,施用方式,靶位点,受试者的生理状态(包括例如年龄、体重、健康),受试者是人还是动物,施用的其他药物,以及治疗是预防性的还是治疗性的。可以将治疗剂量优化滴定以优化安全性及功效。
133.根据特定的实施例,本文所述的组合物被配制成适合施用于受试者的预期途径。例如,本文所述的组合物可以被配制成适合静脉内、皮下或肌内施用。
134.如本文所用,术语“治疗(treat、treating和treatment)”均旨在是指改善或逆转与癌症有关的至少一种可测量的物理参数,这在受试者中不一定是可辨别的,但可以在受试者中辨别得出。术语“治疗(treat、treating和treatment)”还可以指引起消退,预防进展或至少减缓疾病、障碍或病症的进展。在特定实施例中,“治疗(treat、treating和treatment)”是指减轻、预防与疾病、障碍或病症(如肿瘤或更优选地癌症)相关的一种或多种症状的发展或发作,或缩短与疾病、障碍或病症相关的一种或多种症状的持续时间。在特定实施例中,“治疗(treat、treating和treatment)”是指预防疾病、障碍或病症的复发。在特定实施例中,“治疗(treat、treating和treatment)”是指增加患有疾病、障碍或病症的受试者的存活率。在特定实施例中,“治疗(treat、treating和treatment)”是指消除受试者的疾病、障碍或病症。
135.根据特定实施例,提供了用于治疗癌症的组合物。对于癌症疗法,组合物可以与另一种治疗组合使用,另一种治疗包括但不限于化学疗法、抗cd20 mab、抗cd47 mab、抗lag-3 mab、抗cd73 mab、抗ctla-4 mab、抗pd-l1 mab、抗pd-1 mab、pd-1/pd-l1疗法、其他免疫肿瘤学药物、抗血管生成剂、放射疗法、抗体药物偶联物(adc)、靶向疗法或其他抗癌药物。抗gitr抗体可用于与针对免疫检查点分子和/或其他肿瘤表面抗原的伴侣mab构建双特异性抗体,以治疗同时表达gitr和特异性肿瘤相关抗原的癌症/肿瘤。
136.如本文所用,在向受试者施用两种或更多种疗法的背景下,术语“组合”是指使用多于一种疗法。术语“组合”的使用不限制向受试者施用疗法的顺序。例如,第一疗法(例如,本文所述的组合物)可以在向受试者施用第二疗法之前(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周、或12周之前)施用、在向受试者施用第二疗法的同时施用、或向受试者施用第二疗法之后(例如,5分钟、15分钟、30分钟、45分钟、1小时、2小时、4小时、6小时、12小时、16小时、24小时、48小时、72小时、96小时、1周、2周、3周、4周、5周、6周、8周、或12周之后)施用。
137.在另一总体方面,本发明涉及确定受试者的gitr水平的方法。这些方法包括:(a)从受试者获得样品;(b)使该样品与本发明的单克隆抗体或其抗原结合片段接触;以及(c)确定该受试者的gitr水平。
138.如本文所用,“样品”是指从受试者分离的生物样品并且可以包括但不限于全血、血清、血浆、血细胞、内皮细胞、组织活检(例如,癌组织)、淋巴液、腹水、间质液、骨髓、脑脊液、唾液、粘液、痰液、汗液、尿液或任何其他分泌物、排泄物或其他体液。“血液样品”是指全血或其任何部分,包括血细胞、血清和血浆。
139.在某些实施例中,受试者的gitr水平可以利用选自但不限于蛋白质印迹测定、elisa测定和/或免疫组织化学(ihc)的测定来确定。相对蛋白质水平可以通过利用蛋白质印迹分析和免疫组织化学(ihc)来确定,并且绝对蛋白质水平可以通过利用elisa测定来确定。当确定gitr的相对水平时,可以在至少两个样品之间(例如,在来自不同时间点的同一受试者的样品之间、在来自同一受试者的不同组织的样品之间、和/或在来自不同受试者的样品之间)确定gitr的水平。可替代地,当例如通过elisa测定确定gitr的绝对水平时,样品
中gitr的绝对水平可以通过在测试样品之前产生用于elisa测定的标准物来确定。本领域技术人员将理解该利用哪些分析技术来利用本发明的抗体或其抗原结合片段来确定受试者样品中gitr的水平。
140.利用确定来自受试者样品中gitr水平的方法可以促使诊断出疾病的异常(升高、降低或不足)gitr水平并促使做出适当的治疗决定。这种疾病可以包括例如癌症。另外,通过监测受试者的gitr水平,可以基于对特定疾病中和/或特定疾病进展期间gitr水平的了解来确定如上文指示的发展疾病的风险。实施例
141.本发明提供了以下非限制性实施例。
142.实施例1是一种分离的单克隆抗体或其抗原结合片段,其包含重链互补决定区1(hcdr1)、hcdr2、hcdr3,轻链互补决定区1(lcdr1)、lcdr2和lcdr3,具有以下多肽序列:a.分别为seq id no:36、37、38、39、40、和41;b.分别为seq id no:42、43、44、45、46、和47;c.分别为seq id no:48、49、50、54、55、和56;d.分别为seq id no:51、52、53、54、55、和56;e.分别为seq id no:57、58、59、60、61、和62;f.分别为seq id no:63、64、65、66、67、和68;g.分别为seq id no:69、70、71、72、73、和74;h.分别为seq id no:75、76、77、78、79、和80;i.分别为seq id no:81、82、83、84、85、和86;j.分别为seq id no:87、88、89、93、94、和95;k.分别为seq id no:87、88、89、96、97、和98;l.分别为seq id no:90、91、92、93、94、和95;m.分别为seq id no:90、91、92、96、97、和98;n.分别为seq id no:99、100、101、102、103、和104;o.分别为seq id no:105、106、107、108、109、和110;p.分别为seq id no:111、112、113、114、115、和116;q.分别为seq id no:117、118、119、120、121、和122;r.分别为seq id no:123、124、125、126、127、和128;s.分别为seq id no:123、124、125、129、130、和131;t.分别为seq id no:123、124、125、132、133、和134;或者u.分别为seq id no:135、136、137、138、139、和140;或该分离的单克隆抗体或其抗原结合片段的变体,该变体在hcdr1、hcdr2、hcdr3、lcdr1、lcdr2、和/或lcdr3中包含多达约三个(例如,一个、两个或三个)氨基酸取代,其中该抗体或其抗原结合片段特异性结合糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(gitr),优选地人gitr。
143.实施例2是如实施例1所述的分离的单克隆抗体或其抗原结合片段,其中该分离的单克隆抗体或其抗原结合片段包含重链互补决定区1(hcdr1)、hcdr2、hcdr3,轻链互补决定区1(lcdr1)、lcdr2和lcdr3,具有以下多肽序列:
a.分别为seq id no:36、37、38、39、40、和41;b.分别为seq id no:42、43、44、45、46、和47;c.分别为seq id no:48、49、50、54、55、和56;d.分别为seq id no:51、52、53、54、55、和56;e.分别为seq id no:57、58、59、60、61、和62;f.分别为seq id no:63、64、65、66、67、和68;g.分别为seq id no:69、70、71、72、73、和74;h.分别为seq id no:75、76、77、78、79、和80;i.分别为seq id no:81、82、83、84、85、和86;j.分别为seq id no:87、88、89、93、94、和95;k.分别为seq id no:87、88、89、96、97、和98;l.分别为seq id no:90、91、92、93、94、和95;m.分别为seq id no:90、91、92、96、97、和98;n.分别为seq id no:99、100、101、102、103、和104;o.分别为seq id no:105、106、107、108、109、和110;p.分别为seq id no:111、112、113、114、115、和116;q.分别为seq id no:117、118、119、120、121、和122;r.分别为seq id no:123、124、125、126、127、和128;s.分别为seq id no:123、124、125、129、130、和131;t.分别为seq id no:123、124、125、132、133、和134;或者u.分别为seq id no:135、136、137、138、139、和140;其中该抗体或其抗原结合片段特异性结合糖皮质激素诱导的肿瘤坏死因子受体相关蛋白(gitr),优选地人gitr。
144.实施例3是如实施例1或2所述的分离的单克隆抗体或其抗原结合片段,其包含重链可变区或轻链可变区,该重链可变区具有与seq id no:1、3、5、6、8、10、12、14、16、22、24、26、28、30、或34至少95%、至少96%、至少97%、至少98%、或至少99%同一性的多肽序列,该轻链可变区具有与seq id no:2、4、7、9、11、13、15、17、23、25、27、29、31、32、33、或35至少95%、至少96%、至少97%、至少98%、或至少99%同一性的多肽序列。
145.实施例4是如实施例1至3中任一项所述的分离的单克隆抗体或其抗原结合片段,其包含:a.具有seq id no:1的多肽序列的重链可变区,和具有seq id no:2的多肽序列的轻链可变区;b.具有seq id no:3的多肽序列的重链可变区,和具有seq id no:4的多肽序列的轻链可变区;c.具有seq id no:5的多肽序列的重链可变区,和具有seq id no:7的多肽序列的轻链可变区;d.具有seq id no:6的多肽序列的重链可变区,和具有seq id no:7的多肽序列的轻链可变区;e.具有seq id no:8的多肽序列的重链可变区,和具有seq id no:9的多肽序列的
轻链可变区;f.具有seq id no:10的多肽序列的重链可变区,和具有seq id no:11的多肽序列的轻链可变区;g.具有seq id no:12的多肽序列的重链可变区,和具有seq id no:13的多肽序列的轻链可变区;h.具有seq id no:14的多肽序列的重链可变区,和具有seq id no:15的多肽序列的轻链可变区;i.具有seq id no:16的多肽序列的重链可变区,和具有seq id no:17的多肽序列的轻链可变区;j.具有seq id no:22的多肽序列的重链可变区,和具有seq id no:23的多肽序列的轻链可变区;k.具有seq id no:24的多肽序列的重链可变区,和具有seq id no:25的多肽序列的轻链可变区;l.具有seq id no:26的多肽序列的重链可变区,和具有seq id no:27的多肽序列的轻链可变区;m.具有seq id no:28的多肽序列的重链可变区,和具有seq id no:29的多肽序列的轻链可变区;n.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:31的多肽序列的轻链可变区;o.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:32的多肽序列的轻链可变区;p.具有seq id no:30的多肽序列的重链可变区,和具有seq id no:33的多肽序列的轻链可变区;或者q.具有seq id no:34的多肽序列的重链可变区,和具有seq id no:35的多肽序列的轻链可变区。
146.实施例5是如实施例1至4中任一项所述的分离的单克隆抗体或其抗原结合片段,其中该抗体或其抗原结合片段是嵌合的。
147.实施例6是如实施例5所述的分离的单克隆抗体或其抗原结合片段,其中该单克隆抗体或其抗原结合片段包含人igg1恒定区。
148.实施例7是如实施例6所述的分离的单克隆抗体或其抗原结合片段,其中这些人igg1恒定区包含选自k214r、d356e、l358m、和δk447的至少一个氨基酸修饰。
149.实施例8是如实施例5至7中任一项所述的分离的单克隆抗体或其抗原结合片段,其中该抗体或其抗原结合片段是人或人源化的。
150.实施例9是如实施例8所述的分离的单克隆抗体或其抗原结合片段,其包含:a.具有seq id no:143的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;b.具有seq id no:143的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;c.具有seq id no:144的多肽序列的重链可变区,和具有seq id no:146的多肽序
列的轻链可变区;d.具有seq id no:144的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;e.具有seq id no:145的多肽序列的重链可变区,和具有seq id no:146的多肽序列的轻链可变区;f.具有seq id no:145的多肽序列的重链可变区,和具有seq id no:147的多肽序列的轻链可变区;g.具有seq id no:148的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;h.具有seq id no:149的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;i.具有seq id no:150的多肽序列的重链可变区,和具有seq id no:151的多肽序列的轻链可变区;j.具有seq id no:152的多肽序列的重链可变区,和具有seq id no:154的多肽序列的轻链可变区;或者k.具有seq id no:153的多肽序列的重链可变区,和具有seq id no:154的多肽序列的轻链可变区。
151.实施例10是如实施例1至9中任一项所述的分离的单克隆抗体或其抗原结合片段,其中该单克隆抗体或其抗原结合片段能够结合gitr并诱导效应子介导的肿瘤细胞裂解。
152.实施例11是一种分离的核酸,其编码如实施例1至10中任一项所述的单克隆抗体或其抗原结合片段。
153.实施例12是一种载体,其包含如实施例11所述的分离的核酸。
154.实施例13是一种宿主细胞,其包含如实施例12所述的载体。
155.实施例14是一种药物组合物,其包含如实施例1至10中任一项所述的分离的单克隆抗体或其抗原结合片段,以及药学上可接受的载剂。
156.实施例15是一种治疗有需要的受试者的癌症的方法,该方法包括向该受试者施用如实施例14所述的药物组合物。
157.实施例16是一种靶向有需要的受试者的癌细胞表面上gitr的方法,该方法包括向该受试者施用如实施例14所述的药物组合物。
158.实施例17是一种产生如实施例1至10中任一项所述的单克隆抗体或其抗原结合片段的方法,该方法包括在用于产生该单克隆抗体或其抗原结合片段的条件下对包含编码该单克隆抗体或其抗原结合片段的核酸的细胞进行培养,以及从该细胞或培养物中回收该单克隆抗体或其抗原结合片段。
159.实施例18是一种产生包含如实施例1至10中任一项所述的单克隆抗体或其抗原结合片段的药物组合物的方法,该方法包括将该单克隆抗体或其抗原结合片段与药学上可接受的载剂组合以获得药物组合物。
160.实施例19是一种确定受试者的gitr水平的方法,该方法包括:a.从该受试者获得样品;b.使该样品与如实施例1至10中任一项所述的分离的单克隆抗体或其抗原结合片
段接触;以及c.确定该受试者的gitr水平。
161.实施例20是如实施例19所述的方法,其中样品是组织样品或血液样品。
162.实施例21是如实施例20所述的方法,其中组织样品是癌组织样品。实例
163.以下实例旨在纯粹作为本发明的示例,因此不应认为以任何方式限制本发明。以下实例和详细描述是以说明的方式而不是以限制的方式提供的。
164.实例1:抗gitr单克隆抗体(mab)的产生
165.免疫
166.根据现行动物福利规定,用人gitr-fc蛋白(genscript;目录号z03440)免疫balb/c和c57小鼠。对于免疫,将抗原以在pbs溶液中的形式施用或将抗原配制为与cfa(完全弗氏佐剂;初级免疫)或ifa(不完全弗氏佐剂;加强免疫)的乳液。在多组免疫方法中,用基因枪通过腹膜内注射或在背部皮下注射将抗原施用于小鼠的腹部皮肤中。每只动物接受4剂(第一剂为50μg/ml,随后接下来的三剂为每剂25μg/ml)。在免疫计划期间的每个时间点后7天,从动物收集20μl血液样品(图1a-1k)以固定化gitr-fc蛋白作为对照,在基于elisa的测定中监测抗血清滴度,直到满足融合标准。gitr-fc的特异性识别通过其与生物素-gitr配体-fc结合的elisa(结果)进行验证。
167.分泌抗gitr抗体的杂交瘤的选择
168.在最后一次免疫后三天,在无菌环境中按照标准杂交瘤产生方案提取来自所选小鼠的脾细胞并与sp2/0细胞融合。将融合细胞在含有1x hat(次黄嘌呤-氨基蝶呤-胸苷)的dmem培养基(补充有10%fbs)中培养6天。通过elisa分析上清液中的内容物与人gitr-fc结合的能力,同时进行针对人igg1的反筛选。仅选择针对人gitr-fc的单个阳性克隆,其中截止值为od
450
》1。通过facs分析所选克隆与过表达gitr的cho-k1稳定细胞系结合的能力。通过有限稀释对阳性亲本克隆进行亚克隆,并在含有1x ht(次黄嘌呤-胸苷)的dmem培养基(补充有10%fbs)中培养。将100μl细胞悬浮液等分以维持1-3个细胞/孔。细胞培养1周后进行新一轮使用elisa和facs的筛选,直至获得阳性单克隆。选择每个独特的克隆以产生0.5mg的纯化抗体用于进一步表征。测试了抗体同种型(clonotyping system-hrp,southernbiotech;birmingham,al)并用蛋白-a磁珠(genscript,目录号l00695)、通过0.5m柠檬酸钠溶液(ph 3.5)洗脱和用0.5m tris-hcl(ph 9.0)中和来纯化抗体。将储存缓冲液更换为pbs以使用nanodrop确定浓度。
169.实例2:抗gitr小鼠抗体的体外表征
170.通过facs分析的gitr
+
/cho-k1细胞结合
171.共有38个克隆被送往小规模生产,并产生了mab抗体产物,包括204c10g12、384h3h11、289h7d4、197e9g3、45f1f3、31d7d10、136e1f3、225h7h7、100e12d5、7e1a7、263h6g11、358e3c9、222h11g10、206h9g11、225a8d9、223f12c4、225h7d12、11a4e11、223h11h1、153f5c6、377c9h2、320e12h10、209e10f11、201a3a11、274c7h2、287f1e11、275a4d7、172h7b9、163h12g7、270c5c10、78d7d8、114a5d8、114a5d8、84f3h4、366b6h9、85d2h9、和366g5c11。
172.为了验证抗体产物的细胞表面抗原结合,收获了大约1
×
105个细胞/反应液的表
达人gitr的cho-k1细胞,并将这些细胞与从10-3
至102mm进行3倍连续稀释的抗gitr mab一起孵育,然后用1μg/ml的荧光团(ifluor 647)标记的山羊抗小鼠igg(h+l)二抗进行检测。结果呈现在图2a-2d中。ec
50
值汇总于表1中。共有34个mab展示ec
50
低于100ng/ml,其中30个mab的ec
50
低于10ng/ml。
173.表1.抗gitr小鼠单克隆抗体的facs结合数据
174.抗gitr小鼠抗体功能性报告基因测定
175.抗gitr小鼠抗体功能性筛选测定使用promega corp开发的基于报告基因的抗gitr激动剂测定试剂盒(目录号cs184009;promega;madison,wi)进行。该试剂盒含有一个表达gitr的效应细胞系,以及受启动子调控的荧光素酶报告基因。在抗gitr抗体的激动剂作用下,将刺激效应细胞以引发促炎应答,从而激活与荧光素酶报告基因上游应答元件结合的某些转录因子,从而产生荧光素酶。添加底物将会产生可以检测到的发光信号。
176.简而言之,将表达gitr的效应细胞系解冻并计数,并测试其活力。将细胞以每孔50,000个细胞转移到96孔板中。将抗体样品(即抗gitr人抗体(genscript,b50011812))作为阳性对照,或小鼠igg作为阴性对照,以一系列稀释液制备并分别添加到效应细胞中,并在37℃、5%co2条件下孵育6小时,然后将荧光素酶底物溶液添加到混合物中,并将整个板在黑暗中在室温下孵育10分钟。最后,在pherastar(bmglabtech,pherastarplus fsx)中的发光模式下读取板。如果抗体样品具有抗gitr激动剂作用,则发光信号显示出相对于抗体浓度增加的s形曲线(图3)。
177.ec
50
值显示于表2中。鉴于134d7b3的高ec
50
,其未显示出良好的活性。172h7b9、45f1f3和163h12g7展示了所希望的ec
50
和合理的跨度。
178.表2.抗gitr小鼠单克隆抗体的gitr功能性报告基因测定
179.实例3:抗体cdr序列比对
180.共对14种鼠抗体进行了测序。cdr3比对结果汇总于表3中,cdr序列汇总于表4中,并且可变区的序列如下所示。三个克隆的测序显示多于一个重链或轻链。
181.表3.单个抗体的cdr3序列的比对表3.单个抗体的cdr3序列的比对
182.表4:mab克隆的cdr序列
183.实例4:嵌合抗体生产和分析
184.用于表征的嵌合抗体的构建
185.将图3中测试的所有候选抗体与204c10g12、206h9g11、225a8d9、274c7h2、384h3h11、177c6b11、和215f2a5一起选择用于人igg1恒定区上的嵌合抗体合成并测序。这14种mab的可变区编码序列使用genscript在线工具针对人密码子偏倚表达进行了优化。合成45f1f3、163h12g7、172h7b9、223f12c4、225h7d12、270c5c10、204c10g12、225a8d9、274c7h2、206h9g11、134d7b3、177c6b11、215f2a5和384h3h11的可变dna片段并与人igg1重链结构域(ch1-铰链-ch2-ch3)和轻链κ恒定区(cl)融合用于以嵌合形式进行瞬时表达。将45f1f3、225h7d12、270c5c10、163h12g7、172h7b9、和223f12c4的可变dna片段融合到具有修饰k214r、d356e、l358m和δk447的人igg1恒定区上。将204c10g12、225a8d9、274c7h2、384h3h11、134d7b3、177c6b11、215f2a5、和223h11h1的可变dna片段融合到具有修饰k214r的人igg1恒定区上。将重链和轻链表达构建体克隆到单个基于ptt5的质粒中,这些质粒含有用于分泌表达的合成信号肽。克隆206h9g11未能表达,其从测序中显示出非克隆性。
186.在使用peimax 40,000(polysciences,inc.;warrington,pa)用抗体重链/轻链对质粒转染的hek293-6e细胞(国家研究委员会(national research council))中表达嵌合抗体。24小时后,用胰蛋白胨n-1补充剂增强表达/分泌。在37℃和5%co2下振荡培养5天后,收集上清液,并用上述蛋白-a珠纯化抗体内容物。将嵌合抗体产物保存在pbs中用于分析。
187.嵌合抗体facs结合分析
188.利用从300nm的起始浓度开始的3倍系列稀释的抗体对嵌合抗体与cho-k1细胞上表达的gitr的结合模式进行了绘制。使用几何平均值生成抗体-gitr结合曲线。用graphpad prism v6.02软件与四个参数绘制原始数据,并使用最佳拟合值程序分析ec
50
(图4a-4c)。结果汇总于表5中。
189.利用食蟹猴gitr/cho-k1细胞系(cyno gitr/cho-k1)在facs上测试了所有候选抗体的跨物种反应性。去除非食蟹猴结合物和弱食蟹猴结合物以进行进一步测试。在人和cyno gitr/cho-k1 facs分析中,选择均具有所希望的ec
50
的45f1f3、225h7d12、和270c5c10为先导候选抗体。与用作阳性对照的基准抗体相比,45f1f3和225h7d12均显示出优异的ec
50
。270c5c10具有稍高的ec
50
,并且在表位组合实验中,270c5c10显示出与45f1f3和225h7d12不同的表位结合。因此,选择所有三个克隆用于进一步开发。
190.表5.facs分析中gitr/cho-k1细胞上的嵌合抗体结合
191.嵌合抗gitr抗体功能性报告基因测定
192.如实例2中所述,来自gitr功能性报告基因测定的三个候选嵌合抗体的ec
50
值汇总于表6中。克隆45f1f3显示出最低的ec
50
值,为0.01446μg/ml。
193.表6.嵌合抗体gitr功能性报告基因测定
194.实例5.人源化抗体生产和分析
195.候选抗体的人源化设计
196.基于抗体可变结构域序列,分析了cdr、hv环和fr,并进行了同源性建模以获得小鼠抗体的建模结构。计算框架残基的溶剂可及表面积。基于结果,鉴定出被掩埋的框架残基(即溶剂可及表面积《15%)。选择了一种与小鼠对照物共有同一的顶部序列(top sequence)的vh和vl的人受体。将小鼠抗体的cdr直接移植到人受体框架上,以获得没有任何回复突变的移植抗体的序列,其中某些氨基酸被改回鼠框架序列。对于候选抗体45f1f3,合成了具有回复突变的4个vh序列和2个vl序列。对于候选抗体225h7d12,合成了具有回复
突变的4个vh序列和3个vl序列。对于候选抗体270c5c10,合成了具有回复突变的5个vh序列和2个vl序列。通过可开发性评估分析了移植序列中的翻译后修饰和化学降解,包括脱酰胺、异构化氧化和糖基化。鉴定了ptm热点,如n-糖基化位点、异常脯氨酸残基、脱酰胺位点、异构化位点、氧化位点和未配对的半胱氨酸残基,它们可能会影响移植抗体的结合活性和可制造性。
197.合成了编码人源化轻链和重链可变区的dna序列。比较抗体特征以选择最佳候选抗体。对于每种嵌合抗体,基于来自与gitr/cho-k1的facs结合测定的低ec
50
和最少数量的回复突变(图5a-5c),选择一种人源化抗体作为最终先导抗体。ec
50
值汇总于表7中。嵌合抗体45f1f3的所有三种人源化抗体均表现出较低的ec
50
。嵌合抗体270c5c10的两种人源化抗体均表现出较低的ec
50
。嵌合抗体225h7d12的两种人源化抗体表现出较低的ec
50
,除了vh1.4+vl1.2,其中ec
50
为0.1810μg/ml,而人源化前为0.1122μg/ml。
198.表7.人源化抗体的facs结合ec
50
199.人源化抗体的基于细胞的报告基因测定
200.使用genscript开发的基于报告基因的抗gitr激动剂测定进行抗gitr抗体功能筛选。该测定包括一个表达gitr的效应细胞系,以及受启动子调控的荧光素酶报告基因。在抗gitr抗体的激动剂作用下,对效应细胞进行刺激以引发促炎应答,从而激活与荧光素酶报告基因上游应答元件结合的nfkb转录因子,从而产生荧光素酶。添加底物会产生发光信号,该信号由发光计记录。所有人源化先导候选抗体、它们对应的嵌合抗体和阳性对照抗gitr抗体(genscript,抗gitrab ba20190125cft02)的功能性生物测定结果显示于图6a和b中。所测试的所有11种候选抗体都显示出比基准抗体更大的效力。候选抗体270c5c10 vl1+vh1.4显示出最低的ec
50
(0.03552μg/ml),其效力比ec
50
为0.1781μg/ml的基准抗体大5倍以上(表8)。
201.表8.人源化抗体gitr功能性报告基因测定
202.本领域技术人员将会理解的是,可以在不脱离本发明的广泛发明构思的情况下,
对上述实施例进行改变。因此,应当理解的是,本发明不限于所披露的特定实施例,而是旨在涵盖如本说明书限定的处于本发明精神和范围之内的修改。序列表seq id no:1 mab克隆45f1f3-h重链可变区seq id no:2 mab克隆45f1f3-l轻链可变区seq id no:3 mab克隆225h7d12-h重链可变区seq id no:4 mab克隆225h7d12-l轻链可变区seq id no:5 mab克隆270c5c10-ha重链可变区a(vha)seq id no:6 mab克隆270c5c10-hb重链可变区b(vhb)seq id no:7 mab克隆270c5c10-l轻链可变区(vl)seq id no:8 mab克隆134d7b3-h重链可变区(vh)seq id no:9 mab克隆134d7b3-l轻链可变区(vl)seq id no:10 mab克隆177c6b11-h重链可变区(vh)seq id no:11 mab克隆177c6b11-l轻链可变区(vl)seq id no:12 mab克隆215f2a5-h重链可变区(vh)seq id no:13 mab克隆215f2a5-l轻链可变区(vl)seq id no:14 mab克隆223h11h1-h重链可变区(vh)
seq id no:15 mab克隆223h11h1-l轻链可变区(vl)seq id no:16 mab克隆204c10g12-h重链可变区(vh)seq id no:17 mab克隆204c10g12-l轻链可变区(vl)seq id no:18 mab克隆206h9g11-ha重链可变区1(vh1)seq id no:19 mab克隆206h9g11-hb重链可变区2(vh2)seq id no:20 mab克隆206h9g11-la轻链可变区1(vl1)seq id no:21 mab克隆206h9g11-lb轻链可变区2(vl2)seq id no:22 mab克隆225a8d9-h重链可变区(vh)seq id no:23 mab克隆225a8d9-l轻链可变区(vl)seq id no:24 mab克隆274c7h2-h重链可变区(vh)seq id no:25 mab克隆274c7h2-l轻链可变区(vl)seq id no:26 mab克隆384h3h11-h重链可变区(vh)seq id no:27 mab克隆384h3h11-l轻链可变区(vl)seq id no:28 mab克隆163h12g7-h重链可变区(vh)
seq id no:29 mab克隆163h12g7-l轻链可变区(vl)seq id no:30 mab克隆172h7b9-h重链可变区(vh)seq id no:31 mab克隆172h7b9-la轻链可变区a(vla)seq id no:32 mab克隆172h7b9-lb轻链可变区b(vlb)seq id no:33 mab克隆172h7b9-lc轻链可变区c(vlc)seq id no:34 mab克隆223f12c4-h重链可变区(vh)seq id no:35 mab克隆223f12c4-l轻链可变区(vl)seq id no:141人igg1 chseq id no:155人igg1 ch变体1seq id no:156人igg1 ch变体2seq id no:142人igg1 clseq id no:143人源化mab 45f1f3 vh1.1
seq id no:144人源化mab 45f1f3 vh1.3seq id no:145人源化mab 45f1f3 vh1.4seq id no:146人源化mab 45f1f3 vl1seq id no:147人源化mab 45f1f3 vl1.1seq id no:148人源化mab 225h7d12 vh1.1seq id no:149人源化mab 225h7d12 vh1.3seq id no:150人源化mab 225h7d12 vh1.4seq id no:151人源化mab 225h7d12 vl1.2seq id no:152人源化mab 270c5c10 vh1.2seq id no:153人源化mab 270c5c10 vh1.4seq id no:154人源化mab 270c5c10 vl1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1