一种红外响应的N型有机分子及其应用的制作方法
一种红外响应的n型有机分子及其应用
技术领域
1.本发明涉及光电材料领域,尤其是涉及一种红外响应的n型有机分子及其应用。
背景技术:
2.短波红外光电探测器(探测波长:750-1700nm)在医疗监测、质量检查、机器视觉和生物成像等领域发挥着重大的作用。然而,目前商业化的短波近红外光电探测器仍以无机半导体为主,如:硅,锗和铟镓砷等。众所周知,无机材料由于制备工艺复杂,成本高,且带隙不可调节,极大的限制了无机光电探测器的发展。此外,无机光电探测器受红外热效应影响较大,使得其在工作时往往需要配备冷却装置,不仅增加了应用成本,而且不利于制备高分辨率成像阵列器件。而有机光电探测器(opd)凭借低成本、可溶液加工、材料可调、独特的结构-性能关系和良好的机械柔韧性逐渐成为一种新的选择。
3.目前,基于有机半导体的光电探测器已经得到研究人员的广泛关注。在材料设计方面,制造具有延伸到近红外区域光谱响应的opd的关键条件是如何设计合成出具有足够窄的光学带隙(《1.4ev)的活性层材料。目前,这类材料主要包括共轭聚合物、有机染料,和金属有机物等,均已经成功实现了超过1000nm范围的光谱响应。除此之外,窄带隙有机小分子受体(nfa)在近红外opd领域中同样取得了巨大成功。例如,yao等人报道了一种小分子非富勒烯受体ieico-4f,其光学带隙为1.24ev,应用于本体异质结有机太阳能电池时,其在大于800nm的波长范围内的eqe大于60%。lee等人设计合成了两种窄带隙小分子受体cotic-4f和siotic-4f,将光学带隙降低到约1.10ev,是迄今为止报道的nfas材料中光学带隙的最小值之一。nguyen等人报道了一种基于小分子受体co1-4cl的新型有机光电探测器,该有机光探测器在920-960nm波长范围内的响应率大于0.5aw-1
,在1010nm波长附近获得了10
12
jones的比探测率(d*)。
4.尽管有机小分子受体已经被广泛应用于有机太阳能电池等领域,但它们在近红外有机光电探测器中的应用仍然受到了一定的限制。一方面,目前可供选择的光学带隙小于1.2ev或吸收范围超过1050nm的小分子材料仍然很少。另一方面,这些小分子材料在大于1000nm 波长范围内的光学响应较低,其最大紫外可见吸收峰对应的波长普遍低于970nm。这使得当前有机光电探测器在近红外工作区域通常受到载流子生成和提取差、噪声电流大、电荷传输差、比探测率低,外量子效率(eqe)低的限制。
5.因此,如何进一步拓展有机小分子受体的紫外-可见吸收范围,使得有机光电探测器在超过1000nm波长范围内具有较高响应度的特性,仍是一个亟需解决的问题。
技术实现要素:
6.本发明涉及到一种红外响应的n型有机分子,还包括该材料的制备方法、性能测试及其在光电探测器中的应用。基于这类红外响应的n型有机分子材料制备的光电探测器在短波红外区域具有极高的响应度,以及极低的暗电流,可以极大地提升光电探测器对弱红外光的探测能力。
7.本发明中的术语“本体异质结”,是指将给受体材料共混所形成的一种具有纳米尺度相分离的互穿网络结构。
8.本发明中的术语“给体材料”,是指一种p型的半导体材料。
9.本发明中的术语“受体材料”,是指一种n型的半导体材料。
10.本发明中的术语“带隙”,是指半导体材料的光学带隙,其数值由1240除以半导体材料吸收边的截止波长所得。
11.本发明中的术语“光谱响应区”,是指光电二极管及其阵列的有效工作光学波段。定义为外量子效率大于百分之十峰值效率的波长区间。
12.本发明中的术语“活性层”,是指在在器件结构中,负责吸收光子并产生自由电子和空穴的薄膜层。
13.本发明中的术语“芳香基”是指含有共轭结构的芳香族环系统,可为部分共轭系统或完全共轭系统。芳香基可以独立地通过键合或稠合等方式与其它相邻单元连接。其含有碳原子或部分碳原子独立地被n、o、s、se等杂原子取代;其中n和s原子可以独立地被氧化;氮原子可以独立地取代或未取代,可以独立地被季铵化。
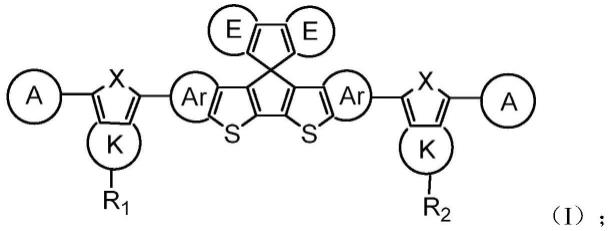
14.本发明的一个目的在于提供一种红外响应的n型有机分子。其具有如下结构式(i):
[0015][0016]
其中,
[0017]
ar独立地选自取代或未取代的芳香基,或不存在;
[0018]
k独立地选自取代或未取代的芳香基或环烷基,或不存在;
[0019]
e独立地选自取代或未取代的芳香基或环烷基,或不存在;
[0020]
r1、r2独立地选自氢原子、酯基、羟基、硝基、卤素、氰基、烷基、烷基衍生物、亚烷基、亚烷基衍生物、芳烷基、芳烷基衍生物的一种或多种;
[0021]
所述烷基衍生物或亚烷基衍生物或芳烷基衍生物上的一个或多个碳,被氧原子、氨基、砜基、羰基、芳基、烯烃基、炔烃基、酯基、氰基、硝基的一个或多个取代;
[0022]
和/或
[0023]
所述烷基衍生物或亚烷基衍生物或芳烷基衍生物上的一个或多个氢,被卤素、羟基、氨基、羧基、氰基、硝基、芳基、烯烃基、炔烃基的一个或多个取代;
[0024]
x独立地选自s、o、se或n-r1;
[0025]
a独立地选自电子受体单元;
[0026]
所述结构式(i)中的任意一个或多个氢原子,未被其他原子和/或基团取代,或独立地被氕、氘或氚原子取代。
[0027]
本发明中所述的“不存在”,是指可以视为该部分结构为无,比如,若中的k为不存在,则实质上其结构为的一元环结构。
[0028]
进一步地,所述a选自如下结构的一种或多种:
[0029][0030]
其中,
[0031]
ar’独立地选自取代或未取代的芳香基,或不存在;
[0032]
r4独立地选自氢或取代或未取代的烷基、取代或未取代的芳香基、取代或未取代的烷氧基、取代或未取代的烷硫基、取代或未取代的硅烷基或取代或未取代的酯基;
[0033]
y独立地选自s、o、se或n-r4;
[0034]
所述a结构中的任意一个或多个氢原子,未被其他原子和/或基团取代,或独立地被氕、氘或氚原子取代。
[0035]
优选地,e选自一个或多个苯基或噻吩基,所述苯基或噻吩基上的氢原子,可以有一个或多个被酯基、羟基、硝基、卤素、氰基、烷基、烷基衍生物、亚烷基、亚烷基衍生物、芳烷基、芳烷基衍生物的一种或多种所取代。所述多个苯基或噻吩基的相互连接方式,可以是联环或稠环结构。
[0036]
本发明中的术语“烷基”是指具有指定碳原子数的支链和直链饱和脂族烃基团。烷基的实例包括直链或支链烷基,直链烷基包括但不限于甲基、乙基、正丙基、正丁基、正戊基、正己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十三烷基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正十九烷基、正二十烷基、正二十一烷基、正二十二烷基、正二十三烷基、正二十四烷基;支链烷基包括但不限于异丙基、异丁基、叔丁基、异戊基、新戊基、2-乙基丁基、2-乙基己基,2-乙基辛基,2-丁基己基、2-己基辛基、4-己基癸基、3-己基十一烷基、2-辛基癸基、2-辛基十二烷基、3-辛基十三烷基、2-癸基十二烷基、2-癸基十四烷基、3-癸基十五烷基、2-十二烷基十六烷基、4-辛基十四烷基、4-癸基十六烷基、4-己基癸基、4-辛基十二烷基、4-癸基十四烷基、4-十二烷基十六烷基等。
[0037]
本发明中的术语“烷氧基”是指-o-烷基,其中烷基的定义符合本文上述关于烷基的定义。烷氧基的实例包括但不限于甲氧基、乙氧基、丙氧基、正丁氧基、正戊氧基、正己氧
基、正庚氧基、正辛氧基、正壬氧基、正癸氧基、正十一烷氧基、正十二烷氧基、2-乙基己氧基, 2-乙基辛氧基,2-丁基己氧基、2-己基辛氧基、4-己基癸氧基、3-己基十一烷氧基、2-辛基癸氧基、2-辛基十二烷氧基、3-辛基十三烷氧基、2-癸基十二烷氧基、2-癸基十四烷氧基、3
‑ꢀ
癸基十五烷氧基、2-十二烷基十六烷氧基、4-辛基十四烷氧基、4-癸基十六烷氧基、4-己基癸氧基、4-辛基十二烷氧基、4-癸基十四烷氧基、4-十二烷基十六烷氧基等;
[0038]
本发明中的术语“烷硫基”是指-s-烷基,其中烷基的定义符合本文上述关于烷基的定义。烷硫基的实例包括但不限于甲硫基、乙硫基、丙硫基、正丁硫基、正戊硫基、正己硫基、正庚硫基、正辛硫基、正壬硫基、正癸硫基、正十一烷硫基、正十二烷硫基、2-乙基己硫基, 2-乙基辛硫基,2-丁基己硫基、2-己基辛硫基、4-己基癸硫基、3-己基十一烷硫基、2-辛基癸硫基、2-辛基十二烷硫基、3-辛基十三烷硫基、2-癸基十二烷硫基、2-癸基十四烷硫基、3
‑ꢀ
癸基十五烷硫基、2-十二烷基十六烷硫基、4-辛基十四烷硫基、4-癸基十六烷硫基、4-己基癸硫基、4-辛基十二烷硫基、4-癸基十四烷硫基、4-十二烷基十六烷硫基等;
[0039]
本发明中的术语“硅烷基”是指-si-烷基,其中烷基的定义符合本文上述关于烷基的定义。硅烷基的实例包括但不限于甲基硅烷、乙基硅烷、丙基硅烷、正丁基硅烷、正戊基硅烷、正己基硅烷、正庚基硅烷、正辛基硅烷、正壬基硅烷、正癸基硅烷、正十一烷基硅烷、正十二烷基硅烷、三甲基己基硅烷、三甲基庚基硅烷、三甲基辛基硅烷、三甲基壬基硅烷、三甲基癸基硅烷、三甲基己基硅烷、己基甲基二(三甲基硅氧基)硅烷、庚基甲基二(三甲基硅氧基) 硅烷、辛基甲基二(三甲基硅氧基)硅烷、壬基甲基二(三甲基硅氧基)硅烷、癸基甲基二(三甲基硅氧基)硅烷、十一烷基甲基二(三甲基硅氧基)硅烷、十二烷基甲基二(三甲基硅氧基)硅烷。
[0040]
进一步地,所述r3独立地选自氢原子、取代或未取代的c1-c24的直链或支链的烷基、取代或未取代的c1-c24的直链或支链的烷氧基、取代或未取代的c1-c24的直链或支链的烷硫基、取代或未取代的c1-c24的直链或支链的硅烷基。
[0041]
进一步地,在本发明中,合理的选择r1、r2和r3的长度/体积组合,可以进一步优化分子间的相互作用,影响分子间的规整排列。当r3的长度较长时,r1和r2可以选择较短长度的烷基链,既实现分子结构的溶液可加工性能,又可以促进分子结构的规整排列。
[0042]
进一步地,在本发明中,r3的长度优选地,不宜过长,过长的支链,会导致螺结构与相邻的或者分子间的其他螺结构的排列趋于疏松,而非紧密,从而影响分子间的规整排列。
[0043]
然而,r3的长度若较短(或仅为氢原子),则需要r1和r2的大体积的烷基链的引入,从而实现分子结构的溶液可加工性能;而令人意外地发现,r1和r2的大体积,几乎不会影响分子结构的规整排列。
[0044]
进一步地,所述支链的烷基或支链的烷氧基或支链的烷硫基或支链的硅烷基的支化度为 2-4。
[0045]
支化度较大,可以进一步提升分子的溶解性,并且不会影响分子间的紧密排列。
[0046]
进一步地,所述k独立地选自取代或未取代的单芳香基,或取代或未取代的多元芳香基。
[0047]
进一步地,所述芳香基包括但不限于苯基、联苯基、茚满基、萘基、噻吩基、呋喃基、
吡咯基、吡啶基、咪唑基、吖啶基、氮杂环丁基、吖辛因基、苯并咪唑基、苯并呋喃基、苯并硫代呋喃基、苯并噻吩基、苯并噁唑基、苯并噁唑啉基、苯并噻唑基、苯并三唑基、苯并四唑基、苯并异噁唑基、苯并异噻唑基、苯并咪唑啉基、咔唑基、嘧啶基、吡咯烷基、吡咯啉基、2-吡咯烷酮基、2h-吡咯基、喹唑啉基、喹啉基、4h-喹嗪基、喹喔啉基、奎宁环基、四唑基、四氢呋喃基、四氢异喹啉基、四氢喹啉基、6h-1,2,5-噻二嗪基、1,2,3-噻二唑基、 1,2,4-噻二唑基、1,2,5-噻二唑基、1,3,4-噻二唑基、噻蒽基、噻唑基、噻吩基、噻唑并吡啶基、噻吩并噻唑基、噻吩并噁唑基、噻吩并咪唑基、噻吩基、三嗪基、1,2,3-三唑基、1,2,4-三唑基、1,2,5-三唑基、1,3,4-三唑基和呫吨基、喹啉基、异喹啉基、酞嗪基、喹唑啉基的一种或多种。
[0048]
进一步地,所述多元芳香基包括但不限于联芳香基、稠芳香基、螺芳香基的一种或多种。
[0049]
本发明中的k部分,可以是附加于噻吩环上的另一个或多个联环或稠环结构,所述联环或稠环可以被取代或未被取代,可以是不含任何杂原子的芳香环,也可以是含有一个或多个杂原子(如s、o、n-r、se等原子)的芳香杂环。
[0050]
令人意外地发现,当k并非不存在时,即此时为稠环或联环结构时,同样可以与核具有螺结构的噻吩并环戊二烯的衍生物形成共振醌式结构,从而增加了该有机小分子受体主链的刚性和平面性,同时,核具有螺结构的噻吩并环戊二烯的衍生物拓展了分子的二维结构,增强了分子间堆积,导致基于该结构的红外响应的n型有机分子的吸收光谱将明显红移,应用于光电器件中,更易获得近红外区域的光电响应信号。
[0051]
这是由于这一结构与核有更为立体的二维结构,使分子间的堆积更为紧密所致。这可能与其核上的螺结构的引入有较为密切的关系。
[0052]
本发明中的芳香环或芳香杂环,包括但不限于为常见的五元环或六元环结构。
[0053]
本发明的另一个目的在于提供分子结构中含有上述红外响应n型有机分子作为共聚单元的聚合物受体。
[0054]
本发明中所述的红外响应n型有机分子,可以作为聚合物结构中的一部分共聚单元,应用于聚合物受体中,使得聚合物受体中含有所述的红外响应n型有机分子的分子结构。
[0055]
本发明的另一个目的在于提供上述红外响应的n型有机分子在有机光电器件中的应用。
[0056]
和现有技术相比,本发明的有益效果如下:
[0057]
1.本发明的核为具有螺结构的噻吩并环戊二烯的衍生物,具有优异的给电子性能和平面结构,其与相邻的单元相连后,在一个较大的范围内形成一个π电子的大离域,具有强烈的给电子趋势;然后再与具有受体的a结构相连后,形成了显著的d-a结构,其吸收光谱可以覆盖至1000nm的近红外区域;
[0058]
2.核具有螺结构的噻吩并环戊二烯的衍生物具有明显的空间二维结构,有利于促进分子间聚集的形成,从而使得该红外响应的n型有机分子的吸收光谱进一步地红移,并促进了电荷传输。
[0059]
3.当与核具有螺结构的噻吩并环戊二烯的衍生物相连的相邻单元为稠环或联环结构时,在分子内部可以形成更为刚性的共振醌式结构,从而使得该红外响应的n型有机分
子的吸收光谱进一步地红移。
[0060]
4.本发明的红外响应的n型有机分子应用于光电器件中,尤其是有机近红外探测器中,在>1000nm的近红外区域有优异的响应度特性。
附图说明
[0061]
图1示出了对比例1-2中,d0和cotic-4f在薄膜状态下的紫外-可见吸收光谱;
[0062]
图2示出了实施例1-5中,d1-d5在薄膜状态下的紫外-可见吸收光谱;
[0063]
图3示出了实施例6-8中,d6-d8在薄膜状态下的紫外-可见吸收光谱;
[0064]
图4示出了实施例9-10中,d9和d10在薄膜状态下的紫外-可见吸收光谱;
[0065]
图5示出了对比例1-2中,d0和cotic-4f在有机光电探测器中的暗电流曲线;
[0066]
图6示出了对比例1-2中,d0和cotic-4f在有机光电探测器中的eqe曲线;
[0067]
图7示出了对比例1-2中,d0-cotic-4f在有机光电探测器中的响应度曲线;
[0068]
图8示出了实施例1-5中,d1-d5在有机光电探测器中的暗电流曲线;
[0069]
图9示出了实施例1-5中,d1-d5在有机光电探测器中的eqe曲线;
[0070]
图10示出了实施例1-5中,d1-d5在有机光电探测器中的响应度曲线;
[0071]
图11示出了实施例6-8中,d6-d8在有机光电探测器中的暗电流曲线;
[0072]
图12示出了实施例6-8中,d6-d8在有机光电探测器中的的eqe曲线。
[0073]
图13示出了实施例6-8中,d6-d8在有机光电探测器中的响应度曲线;
[0074]
图14示出了实施例9-10中,d9和d10在有机光电探测器中的暗电流曲线;
[0075]
图15示出了实施例9-10中,d9和d10在有机光电探测器中的eqe曲线;
[0076]
图16示出了实施例9-10中,d9和d10在有机光电探测器中的响应度曲线。
具体实施方式
[0077]
为了更清楚地说明本发明的技术方案,列举如下制备例和实施例。制备例和实施例中所出现的原料、反应和后处理手段,除非特别声明,均为市面上常见原料,以及本领域技术人员所熟知的技术手段。
[0078]
实施例1
[0079]
一种红外响应的n型有机分子d1,其结构如下所示:
[0080][0081]
d1的合成路线如下:
[0082][0083]
化合物1的合成:
[0084]
将2-溴联苯(9g,38.6mmol)加入到200ml无水正己烷中,缓慢加入正丁基锂(26.6ml, 42.5mmol),在n2保护下回流反应1.5h。向反应瓶中加入100ml无水thf,置于-80℃下冷却15min,缓慢加入4h-环戊[1,2-b:5,4-b
′
]二噻吩-4-酮(7.4g,38.6mmol),室温下搅拌过夜。将反应液萃取,水洗,干燥,过滤,旋干,通过柱层析,以pe:dcm=1:1为洗脱剂,得到白色固体(7.3g,55%)。1h nmr(500mhz,dmso-d6)δ8.29(dd,j=8.0,1.5hz,1h), 7.47(td,j=7.5,1.5hz,1h),7.26(td,j=7.5,1.5hz,1h),7.22(d,j=4.5hz,2h),6.95(m,1h), 6.84(d,j=7.5hz,2h),6.76(dd,j=7.5,1.5hz,1h),6.72(d,j=4.5hz,2h),6.20(s,1h),6.14 (dd,j=8.0,1.5hz,2h).
[0085]
化合物2的合成:
[0086]
将化合物1(7.4g,21.4mmol)加入到250ml二氯甲烷中,加入三氟化硼乙醚(3.95g, 27.8mmol),室温反应15min。将反应液萃取、水洗、干燥、过滤、旋干,并通过柱层析,以pe:dcm=6:1为洗脱剂,得到浅黄色固体(1.8g,26%)。1h nmr(500mhz,chloroform-d) δ7.81(d,j=7.5hz,2h),7.36(td,j=7.5,1.0hz,2h),7.13(td,j=7.5,1.0hz,2h),7.07(d,j= 5.0hz,2h),6.85(d,j=7.5hz,2h),6.41(d,j=5.0hz,2h).
[0087]
化合物3的合成:
[0088]
将化合物2(1.74g,5.3mmol)加入到150ml无水thf中,在n2保护下置于-80℃下冷却15min,缓慢滴加正丁基锂(5.3ml,13.3mmol),反应1h后,转移至室温继续反应1h。将反应瓶置于-80℃下冷却15min,加入三甲基氯化锡(15.9ml,15.9mmol),室温搅拌过夜。将反应液萃取、水洗、干燥、过滤、旋干,得到化合物3并直接进行下一步。
[0089]
化合物4的合成:
[0090]
将噻吩并[3,4-b]噻吩-2-甲酸(1g,5.43mmol),2-己基葵醇(6.57g,27.15mmol), n,n-二环己基碳二亚胺(dcc,1.68g,8.15mmol),二甲氨基吡啶(dmap,232mg,1.90 mmol)加入到200ml二氯甲烷中,室温搅拌16h。次日停止反应,将反应液萃取,水洗,干燥,过滤,旋干,通过柱层析,以pe:dcm=1:1为洗脱剂,得到淡黄色油状液体(1.8g,81%)。1h nmr(500mhz,chloroform-d)δ7.69(s,1h),7.59(d,j=1.5hz,1h),7.28(d,j=5.0hz, 1h),
4.24(d,j=5.0hz,2h),1.79(m,1h),1.47-1.27(m,24h),0.89-0.83(m,6h)。
[0091]
化合物5的合成:
[0092]
将化合物4(1.63g,4mmol)在冰水浴下加入到三氯氧磷(732mg,4.8mmol),dmf (352mg,4.8mmol)的1,2-二氯乙烷溶液中,60℃下搅拌过夜。次日停止反应,将反应液萃取,水洗,干燥,过滤,旋干,通过柱层析,以pe:dcm=2:1为洗脱剂,得到淡黄色油状液体(994mg,57%)。1h nmr(500mhz,chloroform-d)δ9.94(s,1h),8.07(s,1h),7.78(s, 1h),4.26(d,j=5.0hz,2h),1.71(m,1h),1.50-1.30(m,24h),0.97-0.88(m,6h)。
[0093]
化合物6的合成:
[0094]
将化合物5(0.91g,2mmol)加入到30ml无水dmf中,避光分批加入nbs(427mg, 2.4mmol),室温搅拌过夜。次日停止反应,将反应液萃取,水洗,干燥,过滤,旋干,通过柱层析,以pe:dcm=2:1为洗脱剂,得到亮橙色油状液体(731mg,71%)。1h nmr(500 mhz,chloroform-d)δ9.82(s,1h),7.66(s,1h),4.27(d,j=5.0hz,2h),1.72(m,1h),1.47-1.30 (m,24h),0.97-0.89(m,6h)。
[0095]
化合物7的合成
[0096]
将化合物3(200mg,0.3mmol)、化合物6(360mg,0.7mmol)和pd(pph3)4(58mg,0.05 mmol)加入到30ml甲苯中,n2保护下回流反应过夜。将反应液冷却至室温,旋干,通过柱层析,以pe:dcm=1:1为洗脱剂,得到蓝紫色固体(208mg,58%)。1h nmr(500mhz, chloroform-d)δ9.79(s,1h),8.00(s,1h),7.92(d,j=5.0hz,1h),7.47(m,1h),7.23(m,1h), 6.98(d,j=7.5hz,1h),6.90(s,1h),4.24(d,j=5.0hz,2h),1.76-1.81(m,1h),1.26-1.34(m, 24h),0.85-0.89(m,6h)。
[0097]
d1的合成
[0098]
将化合物7(150mg,0.13mmol),5,6-二氟-3-(二氰基亚甲基)靛酮(120mg,0.5mmol) 和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温,旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品d1(112mg,53%)。1h nmr(500mhz,chloroform-d)δ8.70(s,1h),8.49-8.52(m,1h), 7.96-7.98(d,j=5.0hz,1h),7.60-7.63(m,1h),7.50-7.53(m,1h),7.44(s,1h),7.23-7.26(m, 1h),7.14(s,1h),6.96-6.97(d,j=5.0hz,1h),4.16-4.17(d,j=7.5hz,2h),1.93-1.98(m,1h), 1.30-1.42(m,24h),0.90-0.96(m,6h)。
[0099]
实施例2
[0100]
一种红外响应的n型有机分子d2,其结构如下所示:
[0101][0102]
上述d2的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结
构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d2的反应底物的详细合成步骤,仅给出d2的最终结构即可。
[0103]
d2的合成
[0104]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(128mg,57%)。1h nmr(500mhz,chloroform-d)δ8.72(s,1h), 8.49-8.52(m,1h),7.95-7.97(d,j=5.0hz,1h),7.60-7.63(m,1h),7.50-7.53(m,1h),7.45(s, 1h),7.15(s,1h),6.94-6.96(d,j=7.5hz,1h),4.13-4.14(d,j=5.0hz,2h),1.93-1.97(m,1h), 1.29-1.40(m,24h),1.20(s,9h),0.88-0.94(m,6h)。
[0105]
实施例3
[0106]
一种红外响应的n型有机分子d3,其结构如下所示:
[0107][0108]
上述d3的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d3的反应底物的详细合成步骤,仅给出d3的最终结构即可。
[0109]
d3的合成
[0110]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(135mg,57%)。1h nmr(500mhz,chloroform-d)δ8.74(s,1h), 8.50-8.53(m,1h),7.95-7.97(d,j=5.0hz,1h),7.58-7.61(m,1h),7.50-7.53(m,1h),7.47(s, 1h),7.17(s,1h),6.95-6.97(d,j=5.0hz,1h),4.16-4.18(d,j=7.5hz,2h),2.63-2.66(m,2h), 1.93-1.97(m,1h),1.28-1.42(m,36h),0.88-0.94(m,9h)。
[0111]
实施例4
[0112]
一种红外响应的n型有机分子d4,其结构如下所示:
[0113][0114]
上述d4的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d4的反应底物的详细合成步骤,仅给出d4的最终结构即可。
[0115]
d4的合成
[0116]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(161mg,61%)。1h nmr(500mhz,chloroform-d)δ8.72(s,1h), 8.50-8.53(m,1h),7.95-7.97(d,j=5.0hz,1h),7.58-7.61(m,1h),7.51-7.54(m,1h),7.46(s, 1h),7.15(s,1h),6.95-6.97(d,j=7.5hz,1h),4.14-4.16(d,j=5.0hz,2h),2.66-2.68(m,2h), 1.94-1.98(m,1h),1.28-1.42(m,44h),0.88-0.94(m,9h)。
[0117]
实施例5
[0118]
一种红外响应的n型有机分子d5,其结构如下所示:
[0119][0120]
上述d5的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d5的反应底物的详细合成步骤,仅给出d5的最终结构即可。
[0121]
d5的合成
[0122]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结
晶得到最终产品(137mg,58%)。1h nmr(500mhz,chloroform-d)δ8.70(s,1h), 8.47-8.50(m,1h),7.95-7.97(d,j=5.0hz,1h),7.45(s,1h),7.26(s,1h),7.15(s,1h),3.98-4.01 (d,j=5.0hz,2h),1.91-1.96(m,1h),1.29-1.40(m,24h),1.21(s,9h),0.88-0.94(m,6h)。
[0123]
实施例6
[0124]
一种红外响应的n型有机分子d6,其结构如下所示:
[0125][0126]
上述d6的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d6的反应底物的详细合成步骤,仅给出d6的最终结构即可。
[0127]
d6的合成
[0128]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(147mg,62%)。1h nmr(500mhz,chloroform-d)δ8.64(s,1h), 8.46-8.49(m,1h),7.96-7.98(d,j=5.0hz,1h),7.60-7.73(m,1h),7.50-7.53(m,1h),7.44(s, 1h),7.23-7.26(m,1h),7.13(s,1h),6.96-6.97(d,j=7.5hz,1h),4.16-4.17(d,j=5.0hz,2h), 1.93-1.98(m,1h),1.30-1.42(m,24h),1.21(s,9h),0.90-0.96(m,6h)。
[0129]
实施例7
[0130]
一种红外响应的n型有机分子d7,其结构如下所示:
[0131][0132]
上述d7的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d7的反应底物的详细合成步骤,仅给出d6的最终结构即可。
[0133]
d7的合成
[0134]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反
应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(135mg,56%)。1h nmr(500mhz,chloroform-d)δ8.66(s,1h), 8.46-8.49(m,1h),7.77-7.79(d,j=5.0hz,1h),7.72(s,1h),7.46-7.48(m,1h),7.35(s,1h), 6.95-6.97(m,2h),4.09-4.11(d,j=5.0hz,2h),1.90-1.95(m,1h),1.25-1.40(m,24h),1.18(s, 9h),0.86-0.91(m,6h)。
[0135]
实施例8
[0136]
一种红外响应的n型有机分子d8,其结构如下所示:
[0137][0138]
上述d8的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d8的反应底物的详细合成步骤,仅给出d8的最终结构即可。
[0139]
d8的合成
[0140]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(109mg,63%)。1h nmr(500mhz,chloroform-d)δ8.71(s,1h), 8.48-8.51(m,1h),7.95-7.97(d,j=5.0hz,1h),7.47(s,1h),7.30(s,1h),7.17(s,1h),4.06-4.08 (d,j=5.0hz,2h),1.91-1.96(m,1h),1.28-1.40(m,24h),1.23(s,9h),0.87-0.92(m,6h)。
[0141]
实施例9
[0142]
一种红外响应的n型有机分子d9,其结构如下所示:
[0143][0144]
上述d9的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d9的反应底物的详细合成步骤,仅给出d9的最终结构即可。
[0145]
d9的合成
[0146]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(93mg,51%)。1h nmr(500mhz,chloroform-d)δ8.66(s,1h), 8.46-8.49(m,1h),7.77-7.79(d,j=5.0hz,1h),7.72(s,1h),7.68-7.73(m,4h),7.60-7.55(m, 4h),7.44(s,1h),6.96-6.98(m,2h),2.63-2.67(m,4h),1.90-1.94(m,2h),1.25-1.39(m,16h), 1.20(s,9h),0.85-0.92(m,12h)。
[0147]
实施例10
[0148]
一种红外响应的n型有机分子d10,其结构如下所示:
[0149][0150]
上述d10的反应底物的制备方法与实施例1中d1的反应底物制备方法相同,区别仅在于反应底物结构上的差异,差异仅表现为连在核心结构上芳香基数目的不同、烷基链结构的不同,或者其他取代原子的不同,不涉及任何核心制备方法的替换;并且所涉及的反应底物,均为本领域技术人员常见的化学结构,故在此省略组成d10的反应底物的详细合成步骤,仅给出d10的最终结构即可。
[0151]
d10的合成
[0152]
将相关反应底物和1ml吡啶加入到50ml三氯甲烷中,n2保护下50℃反应16h。将反应液冷却至室温、旋干,通过柱层析,以pe:dcm=1:2为洗脱剂,得到蓝黑色固体。后经重结晶得到最终产品(92mg,54%)。1h nmr(500mhz,chloroform-d)δ8.72(s,1h), 8.50-8.42(m,1h),7.76-7.78(d,j=5.0hz,1h),7.72(s,1h),7.58-7.63(m,4h),7.37(s,1h), 6.96-6.98(m,2h),2.59-2.63(m,4h),1.91-1.96(m,2h),1.22-1.35(m,16h),1.19(s,9h), 0.83-0.91(m,12h)。
[0153]
对比例1
[0154]
为了与实施例所得红外响应的n型有机分子进行对比,合成了d0作为对比例。d0的化学结构如下所示。
[0155][0156]
对比例2
[0157]
为了与实施例所得红外响应的n型有机分子进行对比,选择了cotic-4f作为对比
例。 cotic-4f的化学结构如下所示。
[0158][0159]
测试例
[0160]
对上述实施例和对比例进行光电性能测试,包括:
[0161]
(1)材料吸收光谱的测试;
[0162]
(2)暗电流的测试;
[0163]
(3)eqe的测试;
[0164]
(4)响应度的测试;
[0165]
(5)比探测率的测试。
[0166]
上述测试方法,均为本领域技术人员所熟知的方法。
[0167]
其中,所得测试结果如表1所示。
[0168]
实施例1-10,以及对比例1-2的红外响应的n型有机分子的相关表征图片,请参照图 1-12。其中,实施例1-10中的样品,分别以d1-d10表示,对比例1-2中的样品,分别以 d0和cotic-4f表示。
[0169]
表1对比例d0,cotic-4f及实施例d1-d10的eqe和比探测率。
[0170][0171][0172]
从表1可以看出,d1-d10的相关器件参数,明显优于对比例中的d0和cotic-4f。这充分说明了本发明技术方案所构建的分子结构,更适合作为电子受体,应用于有机光电探测器之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1