CD163抗体或结合蛋白的制作方法
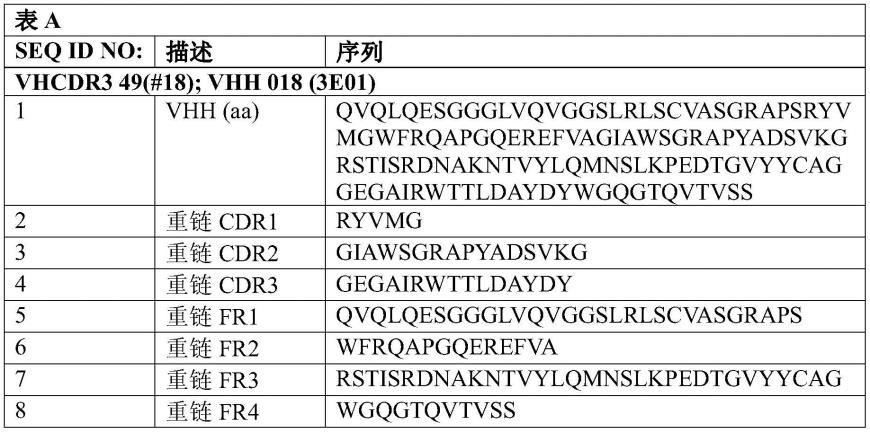
cd163抗体或结合蛋白
技术领域
1.本发明总体上涉及结合cd163(分化簇163)的结合蛋白,特别是抗体,特别是结合猪cd163的结合蛋白和抗体的领域。这样的抗cd163结合蛋白和抗体具有治疗和保护用途,例如在治疗或预防感染如猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,prrs)病毒感染中的用途,例如降低它们的发病率和严重性。还提供了基于结合蛋白和抗体的组合物、方法和试剂盒。
背景技术:
2.猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,prrs)是世界范围内最具破坏性的病毒性猪疾病之一,给养猪业造成巨大的经济损失。病原体是prrs病毒(prrsv),一种包膜rna病毒,被分类为巢状病毒目(nidovirales)中的动脉炎病毒科(arteriviridae)。prrsv具有受限的宿主和细胞向性,以猪肺泡巨噬细胞(pam)作为重要的靶细胞。临床症状是多样的,但包括幼猪和小猪的呼吸窘迫和呼吸疾病,小母猪和母猪的晚期流产和死产,妊娠早期的胎儿再吸收和育肥猪的生长减少。由于妊娠减少或丧失、幼小仔猪死亡以及所有感染prrsv的猪的生长速率降低,据估计仅在美国每年对猪肉生产商造成超过6.5亿美元的损失。
3.所有目前已知的prrsv分离株都属于两种基因型(或物种),1型(prrsv-1)或2型(prrsv-2)其中之一,其在核苷酸水平上仅具有约60%同一性,尽管它们均引起长期感染并产生类似的临床体征。基因型1来源于欧洲并且倾向于在欧洲prrsv分离株或菌株中发现,而基因型2来源于北美并且倾向于在亚洲或美国分离株或菌株中发现(参见stoian和rowland的综述,2019,《兽医学(vet.sci.)》,6,9)。在每种基因型中,发现的大量菌株具有显著的多样性,包括自2006年以来出现的新的高致病性菌株,特别是在中国和越南。类似的高致病性菌株也已经出现在别处,从马来西亚半岛延伸至俄罗斯南部,并且这些对猪种群呈现日益增长的威胁(an等人,2011,《新发传染病(emerging infect dis)》17(9):1782)。仅在中国,2006年和2007年每年因prrs病毒感染而淘汰超过2000万头猪(an等人,2010,《新发传染病(emerging infect dis)》16(2):365)。最近,欧洲爆发的强毒株病例报告表明,prrs病毒的出现日益成为威胁(sinn等人,2016,《猪健康管理(porcine health management)》(2):28)。
4.清道夫受体cd163是prrsv感染的关键进入介质,因此在prrsv感染中具有关键作用。cd163是130kda的i型跨膜蛋白,其具有信号肽,随后是9个富含清道夫受体半胱氨酸(srcr)的结构域,每个约100个氨基酸长,具有35种氨基酸的脯氨酸-丝氨酸-苏氨酸(pst)富集区,分隔srcr结构域6(srcr6)和srcr7。第二pst富集区将srcr9与跨膜结构域和短胞质尾连接,短胞质尾含有功能性内化基序。cd163的表面表达限于单核细胞-巨噬细胞谱系的细胞。已发现cd163的srcr5结构域在prrsv猪肺泡巨噬细胞感染中发挥重要作用(gorp等人,2010,《病毒学杂志(j.of virology)》,3月,3101-3105)。
5.prrsv感染的确切机制尚不清楚。然而,作为该机制的一部分,认为prrsv进入细胞
的内体区室,其中prrsv的cd163和gp2-gp3-gp4异三聚体之间的相互作用介导病毒的脱壳和病毒基因组释放到细胞质中。
6.一种建议的prrsv治疗选择包括cd163的某种遗传敲除或基因编辑,以便使猪对prrsv感染具有抗性,然后繁殖这些猪以繁殖遗传修饰(burkard等人,2017,《公共科学图书馆-病原体(plos pathogens)》13(2):e1006206)。尽管这已被证明非常有效,但就能够治疗相当大比例的猪群而言,这种治疗将是复杂且耗时的。此外,重要的是,在许多市场中对涉及动物遗传修饰的技术存在显著的阻力,例如当期望从这些动物生产动物产品时。
7.用于限制prrs经济影响的最常见的医疗干预是疫苗接种。疫苗通常用于疾病流行的所有地区。通常使用两种类型的疫苗,灭活病毒疫苗(病毒)或(在大多数情况下)修饰的活疫苗(mlv)。然而,目前的疫苗仅是部分有效的,并且当在同时紧密结合生物安全和畜牧业决策的疾病管理的综合方法中使用时,其具有最大价值。疫苗效力不足的原因很复杂,但prrsv群体的高遗传多样性加上病毒的生物学(对肺泡巨噬细胞的向性和高可变性)使得当疫苗株和循环株在免疫原性方面紧密匹配时得到最佳结果(nan等人的综述,2017,《免疫学前言(front.immunol.)》8:1635)。另外,活疫苗菌株可以与野毒株重组以产生新的可能致病的野毒株。
8.目前没有针对prrsv感染的抗病毒治疗选择。
9.因此,对于prrsv感染(或其它cd163介导的感染),显然需要替代的优选改进的治疗和预防选择,这些选择可以很容易地用于治疗或预防大量动物的感染。
技术实现要素:
10.本发明以针对猪cd163的结合蛋白和抗体的形式提供了一种这样的替代治疗性或预防性选择,其可用于减少或预防prrsv感染。
11.令人惊讶地,靶向猪cd163上的相同表位的单一类型的抗体(单克隆抗体),与例如靶向猪cd163上的多个不同表位的多克隆抗体制剂相反,已经被证明有效地显著减少或预防prrsv感染。此外,已经发现了这些抗cd163抗体的亚组,其显示对1型和/或2型prrsv感染的差别抑制。
12.本发明人因此提供了能够结合并抑制cd163特别是猪cd163的活性或功能的抗cd163抗体。这样的抗体(或例如包含本文所述的cd163抗原结合结构域的其它结合蛋白)可以例如抑制cd163与其它蛋白如病毒蛋白相互作用的能力,并由此抑制细胞如猪肺泡巨噬细胞的感染。这样的抗体(或例如包含本文所述的cd163抗原结合结构域的其它结合蛋白)可以方便地且有利地用于治疗或预防猪感染,特别是prrsv感染。
13.在一个实施例中,本发明提供了结合蛋白,例如抗体,例如单克隆抗体,其结合cd163,例如猪cd163,用于治疗或预防猪的感染,例如prrs病毒感染或cd163介导的感染。因此,特别地,本发明提供了一种结合猪cd163的单克隆抗体,其用于治疗或预防猪prrs病毒感染。然而,本发明的抗体可用于治疗或预防任何显示cd163发挥作用的猪的病状,在这种情况下,这种蛋白质的结合和抑制可能是有用的治疗工具。
14.如本文别处所讨论的,本发明的适合供本文所述的治疗方法的用途使用的优选抗体(或结合蛋白)具有结合cd163的srcr5结构域的能力,例如在cd163的srcr5结构域中具有表位。此外,优选抗体(或结合蛋白)具有抑制1型和/或2型prrsv感染,更优选1型和2型
prrsv感染的能力。此外,一些优选抗体具有抑制2型prrsv感染的能力,并且优选具有特异性抑制2型prrsv感染的能力。
15.抑制1型和/或2型prrsv感染的能力
16.家族40
17.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
18.(i)包含氨基酸序列ryvmg(seq id no:2)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
19.(ii)包含氨基酸序列giawsgrapyadsvkg(seq id no:3)的可变重链(vh)cdr2,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
20.(iii)包含氨基酸序列gegairwttldaydy(seq id no:4)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
21.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
22.(i)包含氨基酸序列ryvmg(seq id no:10)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
23.(ii)包含氨基酸序列aiswsgrapyadsvkg(seq id no:11)的可变重链(vh)cdr2,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
24.(iii)包含氨基酸序列gegaikwttldaydy(seq id no:12)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
25.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
26.(i)包含氨基酸序列ryvmg(seq id no:18)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
27.(ii)包含氨基酸序列giawsgrapyadsvkg(seq id no:19)的可变重链(vh)cdr2,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
28.(iii)包含氨基酸序列gegailwttpgayny(seq id no:20)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或
4个氨基酸取代的序列。
29.在优选实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
30.(i)包含氨基酸序列ryvmg(seq id no:2)的可变重链(vh)cdr1,
31.(ii)包含氨基酸序列giawsgrapyadsvkg(seq id no:3)的可变重链(vh)cdr2,以及
32.(iii)包含氨基酸序列gegairwttldaydy(seq id no:4)的可变重链(vh)cdr3。
33.在优选实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
34.(i)包含氨基酸序列ryvmg(seq id no:10)的可变重链(vh)cdr1,
35.(ii)包含氨基酸序列aiswsgrapyadsvkg(seq id no:11)的可变重链(vh)cdr2,以及
36.(iii)包含氨基酸序列gegaikwttldaydy(seq id no:12)的可变重链(vh)cdr3。
37.在优选实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
38.(i)包含氨基酸序列ryvmg(seq id no:18)的可变重链(vh)cdr1,
39.(ii)包含氨基酸序列giawsgrapyadsvkg(seq id no:19)的可变重链(vh)cdr2,以及
40.(iii)包含氨基酸序列gegailwttpgayny(seq id no:20)的可变重链(vh)cdr3。
41.在本发明进一步的实施例中,vh cdr2具有或包含氨基酸序列x
1 i x
3 w s g r a p y a d s v k g(seq id no:73)。在这些实施例中,x1或x3可以是任何氨基酸。优选地,这些x残基中的一种或多种,最优选全部选自以下基团:x1是g或a,并且x3是a或s。因此,优选的vh cdr2具有或包含氨基酸序列g/a i a/s w s g r a p y a d s v k g(seq id no:74)。例如,该实施例的优选vh cdr2序列具有或包含seq id no:3、11或19。
42.在本发明进一步的实施例中,vh cdr3具有或包含氨基酸序列g e g ai x
6 w t t x
10 x
11 a y x
14 y(seq id no:75)。在这些实施例中,x6、x
10
、x
11
和x
14
可以是任何氨基酸。优选地,这些x残基中的一种或多种,最优选全部选自以下基团:x6是r或k或l;x
10
是l或p;x
11
是d或g,并且x
14
是d或n。因此,优选的vh cdr3具有或包含氨基酸序列g e g a i r/k/l w t t l/p d/g a y d/n y(seq id no:76)。例如,该实施例的优选vh cdr3序列具有或包含seq id no:4、12或20。
43.在进一步的实施例中,本发明提供了一种抗体(或结合蛋白),该抗体包含:
44.vh区,其包含seq id no:2的vh cdr1或与其基本同源的序列、seq id no:73的vh cdr2以及seq id no:75的vh cdr3,其中所述基本同源的序列是与给定cdr序列相比含有1个或2个(优选1个)改变的氨基酸的序列。在一些这样的实施例中,vh cdr1优选为seq id no:2。在一些这样的实施例中,vh cdr2优选为seq id no:3、11或19。在一些这样的实施例中,vh cdr3优选为seq id no:4、12或20。
45.在一个实施例中,本发明提供了一种抗体(或结合蛋白),该抗体包含:
46.vh区,vh区包含seq id no:2的vh cdr1或与其基本同源的序列、seq id no:74的vh cdr2以及seq id no:76的vh cdr3,其中所述基本同源的序列是与给定cdr序列相比含有1个或2个(优选1个)改变的氨基酸的序列。在一些这样的实施例中,vh cdr1优选为seq id no:2。在一些这样的实施例中,vh cdr2优选为seq id no:3、11或19。在一些这样的实施例中,vh cdr3优选为seq id no:4、12或20。
47.在本发明的进一步实施例中,抗体(或结合蛋白)包含:
48.vh区,vh区包含seq id no:2的vh cdr1或与给定cdr序列相比含有1个或2个(优选1个)改变的氨基酸的序列、seq id no:73的vh cdr2或与其基本同源的序列,以及seq id no:75的vh cdr3或与其基本同源的序列。在这样的实施例中,所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个,优选1个、2个或3个,优选1个或2个(更优选1个)改变的氨基酸的序列。
49.在本发明的进一步实施例中,抗体(或结合蛋白)包含:
50.vh区,vh区包含seq id no:2的vh cdr1或与给定cdr序列相比含有1个或2个(优选1个)改变的氨基酸的序列、seq id no:74的vh cdr2或与其基本同源的序列,以及seq id no:76的vh cdr3或与其基本同源的序列。在这样的实施例中,所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个,优选1个、2个或3个,优选1个或2个(更优选1个)改变的氨基酸的序列。
51.家族70
52.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
53.(i)包含氨基酸序列tysmg(seq id no:26)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
54.(ii)包含氨基酸序列ahrwsgsayyaehadsveg(seq id no:27)的可变重链(vh)cdr2,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
55.(iii)包含氨基酸序列gvgsaaqyry(seq id no:28)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
56.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
57.(i)包含氨基酸序列pgsmg(seq id no:34)的可变重链(vh)cdr1,或与其基本同源的序列,其中基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
58.(ii)包含氨基酸序列ahrwsgsayyadyadsveg(seq id no:35)的可变重链(vh)cdr2,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
id no:26、34或42。
77.在本发明进一步的实施例中,vh cdr2具有或包含氨基酸序列a h r w s g s a y y a x
12 x
13 a d s v e g(seq id no:79)。在这些实施例中,x
12
或x
13
可以是任何氨基酸。优选地,这些x残基中的一种或多种,最优选全部选自以下基团:x
12
是e或d,并且x
13
是h或y。因此,优选的vh cdr2具有或包含氨基酸序列a h r w s g s a y y a e/d h/y a d s v e g(seq id no:80)。例如,该实施例的优选vh cdr2序列具有或包含seq id no:27、35或43。
78.在本发明进一步的实施例中,vh cdr3具有或包含氨基酸序列g v g s x
5 a q y x9y(seq id no:81)。在这些实施例中,x5和x9可以是任何氨基酸。优选地,这些x残基中的一种或多种,最优选全部选自以下基团:x5是a或e,并且x9是r或t。因此,优选的vh cdr3具有或包含氨基酸序列g v g s a/e a q y r/t y(seq id no:82)。例如,该实施例的优选vh cdr3序列具有或包含seq id no:28、36或44。
79.在一个实施例中,本发明提供了一种抗体(或结合蛋白),该抗体包含:
80.vh区,vh区包含seq id no:77的vh cdr1、seq id no:79的vh cdr2和seq id no:81的vh cdr3。在一些这样的实施例中,vh cdr1优选为seq id no:26、34或42。在一些这样的实施例中,vh cdr2优选为seq id no:27、35或43。在一些这样的实施例中,vh cdr3优选为seq id no:28、36或44。
81.在一个实施例中,本发明提供了一种抗体(或结合蛋白),该抗体包含:
82.vh区,vh区包含seq id no:78的vh cdr1、seq id no:80的vh cdr2和seq id no:82的vh cdr3。在一些这样的实施例中,vh cdr1优选为seq id no:26、34或42。在一些这样的实施例中,vh cdr2优选为seq id no:27、35或43。在一些这样的实施例中,vh cdr3优选为seq id no:28、36或44。
83.在本发明的其它实施例中,抗体(或结合蛋白)包含:
84.vh区,vh区包含seq id no:77的vh cdr1或与给定cdr序列相比含有1个或2个(优选1个)改变的氨基酸的序列、seq id no:79的vh cdr2或与其基本同源的序列,以及seq id no:81的vh cdr3或与其基本同源的序列。在这样的实施例中,所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个,优选1个、2个或3个,优选1个或2个(更优选1个)改变的氨基酸的序列。
85.在本发明的其它实施例中,抗体(或结合蛋白)包含:
86.vh区,vh区包含seq id no:78的vh cdr1或与给定cdr序列相比含有1个或2个(优选1个)改变的氨基酸的序列、seq id no:80的vh cdr2或与其基本同源的序列,以及seq id no:82的vh cdr3或与其基本同源的序列。在这样的实施例中,所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个,优选1个、2个或3个,优选1个或2个(更优选1个)改变的氨基酸的序列。
87.在本发明的实施例中,其中一种或多种cdr序列含有x
x
残基(或如本文所定义的另一类型的替代残基),那么cdr以及与其基本同源的与给定cdr序列相比含有1个、2个、3个或4个,优选1个、2个或3个(更优选1个或2个,或1个)改变的氨基酸或氨基酸取代的序列也包括在本发明中。在一些这样的实施例中,所述氨基酸残基的改变或取代可以包括一个或多个x
x
残基或可以在除x
x
残基以外的残基上。在其它这样的实施例中,所述改变是在x
x
残基和非x
x
残基的混合中。
88.克隆150(#15)
89.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
90.(i)包含氨基酸序列sysmg(seq id no:50)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
91.(ii)包含氨基酸序列aitwngyitnyadsvkg(seq id no:51)的可变重链(vh)cdr2,其或与其基本同源的序列,中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
92.(iii)包含氨基酸序列ttfsttspisrtyny(seq id no:52)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
93.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
94.(i)包含氨基酸序列sysmg(seq id no:50)的可变重链(vh)cdr1,
95.(ii)包含氨基酸序列aitwngyitnyadsvkg(seq id no:51)的可变重链(vh)cdr2,以及
96.(iii)包含氨基酸序列ttfsttspisrtyny(seq id no:52)的可变重链(vh)cdr3。
97.克隆70(#23)
98.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
99.(i)包含氨基酸序列tyamg(seq id no:58)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
100.(ii)包含氨基酸序列iisfggtfyadsvkg(seq id no:59)的可变重链(vh)cdr2,其或与其基本同源的序列,中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
101.(iii)包含氨基酸序列grtlskradsyas(seq id no:60)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
102.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
103.(i)包含氨基酸序列tyamg(seq id no:58)的可变重链(vh)cdr1,
104.(ii)包含氨基酸序列iisfggtfyadsvkg(seq id no:59)的可变重链(vh)cdr2,以及
105.(iii)包含氨基酸序列grtlskradsyas(seq id no:60)的可变重链(vh)cdr3。
106.克隆144(#1)
107.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
108.(i)包含氨基酸序列myams(seq id no:66)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
109.(ii)包含氨基酸序列aintsgrysryadsvkg(seq id no:67)的可变重链(vh)cdr2,其或与其基本同源的序列,中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
110.(iii)包含氨基酸序列tdkgnwalamsydy(seq id no:68)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
111.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
112.(i)包含氨基酸序列myams(seq id no:66)的可变重链(vh)cdr1,
113.(ii)包含氨基酸序列aintsgrysryadsvkg(seq id no:67)的可变重链(vh)cdr2,以及
114.(iii)包含氨基酸序列tdkgnwalamsydy(seq id no:68)的可变重链(vh)cdr3。
115.上述部分中描述的所有抗体(或结合蛋白)具有抑制1型和2型prrsv感染的能力,因此可用于治疗或预防1型和/或2型prrsv感染。
116.抑制2型prrsv感染的能力
117.如上所述,本发明的其它抗cd163抗体和结合蛋白具有抑制2型prrsv感染的能力,并且优选特异性地(或仅,或优先)抑制2型prrsv感染,例如抑制2型prrsv感染但不抑制(或不显著抑制)1型prrsv感染。因此,本发明的进一步的实施例提供可特异性抑制2型prrsv感染的抗体(或结合蛋白)。这种“2型”抗体或结合蛋白的实例如下所述。在其它优选实施例中,可抑制2型prrsv感染的这些“2型”抗体和结合蛋白可与上述可抑制1型和/或2型prrsv感染,优选抑制1型或1型和2型prrsv感染的抗体联合使用。
118.克隆57(#11)
119.因此,在进一步的实施例中,本发明提供了包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
120.(i)包含氨基酸序列vygtg(seq id no:84)的可变重链(vh)cdr1,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
121.(ii)包含氨基酸序列gisgttgstlyadsvkg(seq id no:85)的可变重链(vh)cdr2,其或与其基本同源的序列,中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3
个或4个氨基酸取代的序列,以及
122.(iii)包含氨基酸序列ggrvyittssway(seq id no:86)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
123.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
124.(i)包含氨基酸序列vygtg(seq id no:84)的可变重链(vh)cdr1,
125.(ii)包含氨基酸序列gisgttgstlyadsvkg(seq id no:85)的可变重链(vh)cdr2,以及
126.(iii)包含氨基酸序列ggrvyittssway(seq id no:86)的可变重链(vh)cdr3。
127.克隆41(#12)
128.在进一步的实施例中,本发明提供了包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
129.(i)包含氨基酸序列ryamg(seq id no:92)的可变重链(vh)cdr1,或与其基本同源的序列,其中基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
130.(ii)包含氨基酸序列aiawstgstyyansvkg(seq id no:93)的可变重链(vh)cdr2,其或与其基本同源的序列,中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
131.(iii)包含氨基酸序列etrycsgfgcldprtygs(seq id no:94)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
132.在进一步的实施例中,本发明提供了包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
133.(i)包含氨基酸序列ryamg(seq id no:92)的可变重链(vh)cdr1,
134.(ii)包含氨基酸序列aiawstgstyyansvkg(seq id no:93)的可变重链(vh)cdr2,以及
135.(iii)包含氨基酸序列etrycsgfgcldprtygs(seq id no:94)的可变重链(vh)cdr3。
136.克隆171(#14)
137.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
138.(i)包含氨基酸序列tdtma(seq id no:100)的可变重链(vh)cdr1,或与其基本同源的序列,其中基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
139.(ii)包含氨基酸序列gigrsggsiyyadavkg(seq id no:101)的可变重链(vh)cdr2,其或与其基本同源的序列,中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3
个或4个氨基酸取代的序列,以及
140.(iii)包含氨基酸序列rqriglvvgalgydy(seq id no:102)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
141.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
142.(i)包含氨基酸序列tdtma(seq id no:100)的可变重链(vh)cdr1,
143.(ii)包含氨基酸序列gigrsggsiyyadavkg(seq id no:101)的可变重链(vh)cdr2,以及
144.(iii)包含氨基酸序列rqriglvvgalgydy(seq id no:102)的可变重链(vh)cdr3。
145.克隆29(#17)
146.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
147.(i)包含氨基酸序列dytig(seq id no:108)的可变重链(vh)cdr1,或与其基本同源的序列,其中基本同源的序列是与给定的cdr序列相比含有1个或2个氨基酸取代的序列,
148.(ii)包含氨基酸序列cinsitsntyyadsvkg(seq id no:109)的可变重链(vh)cdr2,或与其基本同源的序列,其中所述基本同源的序列是与给定的cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列,以及
149.(iii)包含氨基酸序列dsglfsgssclkyramrfgs(seq id no:110)的可变重链(vh)cdr3,或与其基本同源的序列,其中所述基本同源的序列是与给定cdr序列相比含有1个、2个、3个或4个氨基酸取代的序列。
150.在进一步的实施例中,本发明提供了一种包含结合cd163例如猪cd163的抗原结合结构域的结合蛋白,例如抗体,所述抗原结合结构域包含至少一个重链可变区,重链可变区包含三个互补决定区(cdr),其中重链可变区包含:
151.(i)包含氨基酸序列dytig(seq id no:108)的可变重链(vh)cdr1,
152.(ii)包含氨基酸序列cinsitsntyyadsvkg(seq id no:109)的可变重链(vh)cdr2,以及
153.(iii)包含氨基酸序列dsglfsgssclkyramrfgs(seq id no:110)的可变重链(vh)cdr3。
154.其它实施例
155.本发明的某些优选实施例提供了结合cd163例如猪cd163的抗体(或结合蛋白),其包含具有氨基酸序列seq id no:1、9、17、25、33、41、49、57或65的vh结构域,或与其基本同源的序列。在一些实施例中,这样的抗体(或结合蛋白)还包含vl结构域,其包含至多3种轻链cdr,并且优选3种轻链cdr。
156.在一个优选实施例中,本发明提供了结合cd163例如猪cd163的抗体(或结合蛋白),其包含具有氨基酸序列seq id no:1、9、17、25、33、41、49、57或65的vh结构域,或与其具有至少80%序列同一性(例如,至少85%、90%、95%或98%同一性)的序列。在一些实施
例中,这样的抗体(或结合蛋白)还包含vl结构域,其包含至多3种轻链cdr,并且优选3种轻链cdr。
157.在一个优选实施例中,本发明提供了结合cd163例如猪cd163的抗体(或结合蛋白),其包含具有氨基酸序列seq id no:1、9、17、25、33、41、49、57或65的vh结构域。在一些实施例中,这样的抗体(或结合蛋白)还包含vl结构域,其包含至多3种轻链cdr,并且优选3种轻链cdr。
158.本发明的某些优选实施例提供了结合cd163例如猪cd163的抗体(或结合蛋白),其包含具有氨基酸序列seq id no:83、91、99或107的vh结构域,或与其基本同源的序列。在一些实施例中,这样的抗体(或结合蛋白)还包含vl结构域,其包含至多3种轻链cdr,并且优选3种轻链cdr。
159.在一个优选实施例中,本发明提供了结合cd163例如猪cd163的抗体(或结合蛋白),其包含具有氨基酸序列seq id no:83、91、99或107的vh结构域,或与其具有至少80%序列同一性(例如,至少85%、90%、95%或98%同一性)的序列。在一些实施例中,这样的抗体(或结合蛋白)还包含vl结构域,其包含至多3种轻链cdr,并且优选3种轻链cdr。
160.在一个优选实施例中,本发明提供了结合cd163例如猪cd163的抗体(或结合蛋白),其包含具有氨基酸序列seq id no:83、91、99或107的vh结构域。在一些实施例中,这样的抗体(或结合蛋白)还包含vl结构域,其包含至多3种轻链cdr,并且优选3种轻链cdr。
161.其它优选实施例是本文定义的各种抗体(或结合蛋白)的免疫球蛋白(ig)形式例如igg形式,或含有全部或部分免疫球蛋白恒定区例如igg恒定区的形式,例如全长ig或igg形式。当然可以理解,全igg抗体通常包含两条基本相同的重链和两条基本相同的轻链。含有部分免疫球蛋白恒定区的优选形式是含有fc区或结构域的形式,例如fc融合体。此类fc区或结构域是本领域已知的,通常包含抗体重链的ch2和ch3结构域,它们结合形成同型二聚体。这些区可以衍生自任何合适的来源或物种,例如不同于用于例如通过免疫产生抗体的宿主物种的来源或物种,或不同于衍生抗体的来源或物种,但优选对应于或衍生自猪fc区或结构域。由于这种fc区是同型二聚体(或形成同型二聚体),它们可以方便地用于二聚化两条多肽链。因此,通过将本发明的一种或多种单结构域抗体(例如vhh抗体)连接或融合至fc区的每条链,当fc区的两条链二聚化时,它们可以用于在单个构建体或分子中提供本发明的单结构域抗体(例如vhh抗体)的多个拷贝。如果多于一种的本发明的单结构域抗体(例如vhh抗体)按顺序连接或融合至fc区的每条链,则这些抗体可以是相同的抗体(例如可以在每条链上提供相同vhh的两个或更多个拷贝)或不同的抗体。因此,例如,fc融合可以用于提供包含本发明的相同单结构域抗体的多于一个拷贝或本发明的不同单结构域抗体的多于一个拷贝的构建体。由于这样的构建体通常含有本发明的相同抗体多于一个拷贝(例如单结构域抗体或vhh抗体的多于一个拷贝或多个不同的单结构域抗体或vhh抗体的多于一个拷贝),这样的构建体可以表现出改善cd163结合,例如由于亲和力效应。
162.基于表a、表b、表c、表d、表e、表f、表g、表h或表i中列出的49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1)抗体序列的结合蛋白例如抗体是优选的。本发明通过单克隆抗体举例说明,所述单克隆抗体是vhh抗体(单结构域抗体),其序列示于本文中的表a、表b、表c、表d、表e、表f、表g、表h和表i中。这些vhh抗体各自的vh cdr结构域和vh结构域在本文中的表a至表i中示出。包含这些vh cdr结构域的组,或vh结构
域,或包含这些结构域的igg序列(或与其基本同源的序列)的抗体(或结合蛋白)是本发明的优选实施例。
163.此外,基于表1、表2、表3或表4中列出的57(#11)、41(#12)、171(#14)、29(#17)抗体序列的结合蛋白例如抗体是优选的。本发明通过单克隆抗体举例说明,所述单克隆抗体是vhh抗体(单结构域抗体),其序列示于在本文中的表1、表2、表3和表4中。这些vhh抗体各自的vh cdr结构域和vh结构域在本文中的表1、表2、表3和表4中示出。包含这些vh cdr结构域的组,或vh结构域,或包含这些结构域的igg序列(或与其基本同源的序列)的抗体(或结合蛋白)是本发明的优选实施例。
164.基本同源序列的某些实例是与公开的氨基酸序列具有至少60%或65%同一性的序列。在某些实施例中,本发明的抗体(或结合蛋白)包含至少一个重链可变区,重链可变区包括与氨基酸序列seq id no:1、9、17、25、33、41、49、57或65具有至少约60%、65%、70%或75%,更优选至少约80%,更优选至少约85%,更优选至少约90%或95%且最优选至少约97%、98%或99%氨基酸序列同一性的氨基酸序列区。
165.基本同源序列的其它某些实例是与公开的氨基酸序列具有至少60%或65%同一性的序列。在某些实施例中,本发明的抗体(或结合蛋白)包含至少一个重链可变区,重链可变区包括与氨基酸序列seq id no:83、91、99或107具有至少约60%、65%、70%或75%,更优选至少约80%,更优选至少约85%,更优选至少约90%或95%且最优选至少约97%、98%或99%氨基酸序列同一性的氨基酸序列区。
166.基本同源序列的其它优选实例是含有公开的氨基酸序列的保守氨基酸取代的序列。
167.基本同源序列的其它优选实例是在公开的一个或多个cdr区或一个或多个fr区中含有1个、2个、3个或4个,优选1个、2个或3个,优选1个或2个(更优选1个)改变的氨基酸的序列。这种改变可以是保守的或非保守的氨基酸取代,或其混合。
168.在这些实施例中,优选的改变是保守氨基酸取代。
169.在所有实施例中,含有基本同源的序列的结合蛋白例如抗体保留结合cd163例如猪cd163的能力。优选地,含有基本同源的序列的结合蛋白例如抗体保留本文所述的与49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1)抗体相关的一种或多种(优选全部)其它性质。
170.在所有实施例中,含有基本同源的序列的结合蛋白例如抗体保留结合cd163例如猪cd163的能力。优选地,含有基本同源的序列的结合蛋白例如抗体保留本文所述的与57(#11)、41(#12)、171(#14)或29(#17)抗体相关的一种或多种(优选全部)其它性质。
171.根据本发明的基本同源的氨基酸序列的其它实例在本文其它地方描述。
172.本发明的抗体(或结合蛋白)的cdr优选被适当的构架区分隔,如在天然存在的抗体和/或有效的工程化抗体中发现的那些构架区。因此,本发明的vh(例如vhh)、v
l
和单独的cdr序列优选地设置在适当的框架或支架内或结合在适当的框架或支架中以能够结合抗原(此处为cd163)。这样的构架序列或区可以对应于天然存在的构架区,fr1、fr2、fr3和/或fr4,以适当地形成适当的支架,或者可以对应于共有构架区,例如通过比较各种天然存在的构架区发现的。可替代地,可以使用非抗体支架或框架,例如t细胞受体框架。
173.可用于构架区的合适序列在本领域中公知并记载,并且可使用这些序列中的任何
序列。构架区的优选序列是组成本发明的vhh抗体的一个或多个构架区,优选是49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1)vhh抗体的一个或多个构架区,如表a、表b、表c、表d、表e、表f、表g、表h和表i中公开的,或与其基本同源的构架区,特别是允许维持抗原特异性的构架区,例如产生与抗体基本相同或相同3d结构的构架区。
174.构架区的其它优选序列,特别是对于本发明的“2型”抗体,是组成本发明的vhh抗体的一个或多个构架区,优选表1、表2、表3和表4中公开的57(#11)、41(#12)、171(#14)或29(#17)vhh抗体的一个或多个构架区,或基本上与其同源的构架区,特别是允许维持抗原特异性的构架区,例如产生与抗体基本相同或相同3d结构的构架区。
175.在某些优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:5、6、7和8)构架区(fr),或与其基本同源的fr区。
176.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:13、14、15和16)构架区(fr),或与其基本同源的fr区。
177.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:21、22、23和24)构架区(fr),或与其基本同源的fr区。
178.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:29、30、31和32)构架区(fr),或与其基本同源的fr区。
179.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:37、38、39和40)构架区(fr),或与其基本同源的fr区。
180.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:45、46、47和48)构架区(fr),或与其基本同源的fr区。
181.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:53、54、55和56)构架区(fr),或与其基本同源的fr区。
182.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:61、62、63和64)构架区(fr),或与其基本同源的fr区。
183.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:69、70、71和72)构架区(fr),或与其基本同源的fr区。
184.在某些优选实施例中,特别是对于本发明的“2型”抗体,在本发明的抗体中适当发现了所有4种可变重链(seq id no:87、88、89和90)构架区(fr),或与其基本同源的fr区。
185.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:95、96、97和98)构架区(fr),或与其基本同源的fr区。
186.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:103、104、105和106)构架区(fr),或与其基本同源的fr区。
187.在其它优选实施例中,在本发明的抗体中适当发现了所有4种可变重链(seq id no:111、112、113和114)构架区(fr),或与其基本同源的fr区。
188.如上所述,本发明提供结合(或特异性识别或特异性结合)cd163的结合蛋白,例如抗体。cd163也称为m130、mm130、scar1、巨噬细胞相关抗原、血球蛋白清道夫受体或清道夫受体半胱氨酸富集1型蛋白m130。本发明优选的结合蛋白是抗体,特别是vhh抗体。然而,本文所述的涉及抗体例如vhh抗体的实施例经必要的修正同样适用于其它类型的结合蛋白,
反之亦然。
189.优选的结合蛋白是能够结合(例如特异性结合)猪cd163的任何单一多肽链。可用于本发明的合适类型的结合蛋白是本领域已知的。例如,在一些实施例中,使用基于免疫球蛋白的多肽,其通常包含cdr区(和任选地fr区或基于免疫球蛋白的支架),使得本发明的抗体的cdr区(和任选地fr区)可以移植到合适的支架或框架上,例如免疫球蛋白支架。
190.然而,在其它实施例中,可以使用基于非免疫球蛋白的单链结合蛋白/支架蛋白,其可以根据其自身的特异性结合特定靶抗原(cd163或猪cd163)的能力进行选择。此类分子也称为抗体模拟物(或抗体类似物)。合适的基于非免疫球蛋白的单链结合蛋白的实例是本领域已知并描述的,并且包括纤连蛋白(或基于纤连蛋白的分子),例如基于纤连蛋白iii型结构域的第十模块,例如adnectin(例如来自马萨诸塞州沃尔瑟姆compound therapeutics公司(compound therapeutics,inc,waltham,ma));亲和物(例如来自avacta);锚蛋白重复蛋白或darpins(例如来自瑞士苏黎世的molecular partners公司(molecular partners ag,zurich,switzerland));脂质运载蛋白,例如anticalin(例如来自德国弗赖辛的pieris proteolab公司(pieris proteolab ag,freising,germany));人a-结构域(例如avimer);葡萄球菌蛋白a(例如来自瑞典的affibody公司(affibody ag,sweden));硫氧还蛋白;和基于γ-b-晶状体蛋白或泛素的分子,例如affilin(例如来自德国哈雷的scil proteins公司(scil proteins gmbh,halle,germany))。此类分子也可以用作支架,在其上可以移植介导靶抗原结合的合适的cdr。例如,将本发明的抗体的cdr区(和任选地fr区)移植到合适的非免疫球蛋白支架上。
191.在本发明的其它实施例中,可以使用基于核酸的分子,例如适体,条件是可以根据其自身的特异性结合特定靶抗原(cd163或猪cd163)的能力来选择这样的分子。因此,当本文涉及结合蛋白时,这些实施例可以扩展到其它类型的结合实体或部分,例如基于核酸的分子。
192.本发明的优选非抗体结合蛋白(或结合部分)具有结合与本发明的抗cd163抗体相同的表位的能力,并且这样的结合蛋白(或结合部分)可以例如通过竞争测定选择,例如本文别处描述的那些,使用例如本发明的抗体作为参考抗体。
193.cd163是130kda的i型跨膜蛋白,其具有信号肽,随后是9个富含清道夫受体半胱氨酸(srcr)的结构域,每个约100个氨基酸长,具有35种氨基酸的脯氨酸-丝氨酸-苏氨酸(pst)富集区,分隔srcr结构域6(srcr6)和srcr7。第二pst富集区将srcr9与跨膜结构域和短胞质尾连接,短胞质尾含有功能性内化基序。cd163的表面表达限于单核细胞-巨噬细胞谱系的细胞。
194.与本发明特别相关的是,cd163在猪肺泡巨噬细胞(pam)的表面上表达,并且被认为对各种病原体(包括病毒病原体,特别是prrsv)引起猪疾病的能力发挥重要作用。
195.因此,本发明的结合蛋白或抗体结合或能够结合cd163。根据本发明,cd163可以来自任何物种,例如任何哺乳动物物种如猪(pig/porcine)、人、牛(cattle/bovine)、狗(dog/canine)、猫(cat/feline)、绵羊(sheep/ovine)、马(horse/equine)、小鼠和猴。在一个优选实施例中,cd163是猪cd163,并且抗体结合或能够结合(或特异性识别或特异性结合)猪cd163。
196.在某些实施例中,抗体可以与cd163的其它物种交叉反应(或也结合)。因此,在一
些实施例中,抗体可以结合猪cd163,以及cd163的一种或多种其它物种,例如一种或多种其它哺乳动物物种,例如上述那些。在一些实施例中,抗体可以结合猪cd163以及人cd163。换句话说,抗体可以与猪cd163和人cd163交叉反应。在其它实施例中,抗体可以结合猪cd163但不结合(或不显著结合或不与人cd163交叉反应)人cd163。
197.本发明的结合蛋白和抗体可以结合任何适当形式的cd163,特别是包含srcr5结构域的cd163形式。因此,这样的形式可以包括全长cd163,或非全长形式的cd163,例如截短形式的cd163,或其它变体形式的cd163,其例如含有srcr结构域的子集,但通常包括srcr5结构域。本发明的结合蛋白和抗体可以结合的cd163的优选且方便的形式包括重组cd163,例如重组猪cd163,或当在细胞表面上表达时的cd163(细胞表面表达的cd163)。因此,这些细胞表面形式在许多情况下代表cd163的原始或天然形式,例如在天然表达或过表达cd163的细胞上发现的形式。
198.天然表达cd163的合适细胞类型是本领域技术人员公知的,包括单核细胞和巨噬细胞。优选的细胞类型是pam。可替代地,cd163可以在通常不表达cd163的细胞类型中表达或过表达,例如通过重组手段(或通过其它工程手段),换句话说,可以使用cd163的细胞表达重组形式。
199.可以用于本文以评估结合蛋白和抗体的结合能力的cd163的示例性形式,例如重组cd163,是全长cd163,或含有不同cd163 srcr结构域的亚组如cd163-srcr1-9、cd163-srcr4-7或cd163-srcr5-6的构建体。同样可以使用cd163 srcr结构域和含有不同cd163 srcr结构域的亚组的片段的其它组合,条件是存在全部或部分(优选全部)的srcr5结构域。在一些实施例中,抗体不结合(或不显著结合)包含srcr5结构域的缺失或内部或内部突变的cd163分子。猪形式优选用于评估本发明的抗体,尽管也可以使用来自其它物种例如其它哺乳动物物种的等价形式,例如用于评估交叉反应性。
200.各种物种中cd163的序列是在本领域中公知并记载,并且可以例如从各种序列数据库,例如uniprot获得。为了便于参考,猪cd163具有uniprot编号q2vl90,人cd163具有uniprot编号q86vb7。
201.因此,本发明的优选结合蛋白或抗体具有结合cd163的srcr5结构域或srcr5结构域中的表位,优选猪srcr5结构域的能力。
202.猪srcr5结构域的序列如下所示并且对应于uniprot q2vl90的残基477-577:prlvggdipcsgrvevqhgdtwgtvcdsdfsleaasvlcrelqcgtvvsllggahfgegsgqiwaeefqcegheshlslcpvaprpdgtcshsrdvgvvcs(seq id no:115)。
203.猪cd163的序列如下所示并且对应于uniprot q2vl90的全序列:
204.mdklrmvlhensgsadfrrcsahlssftfavvavlsaclvtsslggkdkelrltggenkcsgrvevkvqeewgtvcnngwdmdvvsvvcrqlgcptaikatgwanfsagsgriwmdhvscrgnesalwdckhdgwgkhncthqqdagvtcsdgsdlemglvnggnrclgrievkfqgrwgtvcddnfninhasvvckqlecgsavsfsgsanfgegsgpiwfddlvcngnesalwnckhegwgkhncdhaedagviclngadlklrvvdgvtecsgrlevkfqgewgticddgwdsddaavackqlgcptavtaigrvnasegtghiwldsvschghesalwqcrhhewgkhycnhdedagvtcsdgsdlelrlkgggshcagtveveiqklvgkvcdrswglkeadvvcrqlgcgsalktsyqvysktkatntwlfvsscngnetslwdcknwqwgglscdhydeakitcsahrkprlvggdipcsgrvevqhgdtwgtvcdsdfsleaasvlcrelqcgtvvsllggahfgegsgqiwaeefqcegheshlslcpvaprpdgtcshsrdvgvvcsrytqirlvngktpcegrvelnil
gswgslcnshwdmedahvlcqqlkcgvalsipggapfgkgseqvwrhmfhctgtekhmgdcsvtalgaslcssgqvasvicsgnqsqtlspcnssssdpsssiiseengvacigsgqlrlvdgggrcagrvevyhegswgticddswdlndahvvckqlscgwainatgsahfgegtgpiwldeincngkeshiwqchshgwgrhncrhkedagvicsefmslrlisensretcagrlevfyngawgsvgrnsmspatvgvvcrqlgcadrgdispassdktvsrhmwvdnvqcpkgpdtlwqcpsspwkkrlaspseetwitcankirlqegntncsgrveiwyggswgtvcddswdledaqvvcrqlgcgsaleagkeaafgqgtgpiwlnevkckgnetslwdcparswghsdcghkedaavtcseiaksreslhatgrssfvalaifgvillacliafliwtqkrrqrqrlsvfsggensvhqiqyremnsclkadetdmlnpsgdhsevq(seq id no:116).
205.评估与适当形式的cd163的结合(或结合能力)的方法是本领域技术人员公知的,并且可以使用任何适当的方法。
206.用于评估结合的方便且适当的方法包括体外结合测定,例如elisa测定,以评估抗体与固定化抗原例如如上所述的cd163的固定化形式的结合。本领域技术人员熟悉elisa测定,并且能够容易地建立合适的条件来评估结合蛋白或抗体在这种测定中结合cd163的能力。在实例部分描述了特别优选的elisa测定。可替代地或另外地,抗体与细胞表面表达的cd163的结合可以通过任何合适的方法评估,包括通过流式细胞术分析(例如facs分析),例如使用pam或表达重组形式的cd163的细胞,例如本文别处描述的形式。在实例部分描述了特别优选的流式细胞分析。另一种用于测试抗体结合细胞表面cd163能力的方法是免疫组织化学。
207.在某些实施例中,本发明的结合蛋白或抗体在表面等离振子共振(spr)测定(例如biacore测定)中(如所确定的)结合cd163(例如猪cd163或人cd163)。合适的spr测定是本领域已知的。在某些优选的spr测定中,将适当形式的cd163捕获(或固定)在固体支持物(例如传感器芯片)上,例如通过胺偶联(例如2000个应答单位(ru)cd163被固定),然后注射各种浓度(例如稀释系列,例如双倍或三倍稀释系列)的待测试的结合蛋白或抗体。在本文的实例部分中描述了注射的优选浓度和流速。
208.这样的spr测定方法也可以方便地用于测量抗体-抗原相互作用的结合动力学,例如用于测定缔合速率(ka)、解离速率(kd)和亲和力(kd)。在某些实施例中,测量可以在25℃下在合适的缓冲液中在ph 7.4下进行,缓冲液例如标准hepes-edta缓冲液,如hbs-ep(由ge healthcare life sciences销售,0.01m hepes ph7.4,0.15m nacl,3mm edta,0.0005%表面活性剂p20)。动力学参数可以通过任何合适的模型或软件确定或计算,例如通过假设1:1相互作用,例如使用biaevaluation软件拟合sensogram实验数据。在本文的实例部分中描述了特别优选的spr测定。
209.因此,在特别优选的实施例中,本发明的结合蛋白或抗体在表面等离振子共振(spr)测定(例如biacore测定)(如在其中测定,当在其中评估时)中结合cd163(例如猪或人cd163,优选猪cd163)。
210.在某些优选的实施例中,本发明的抗体,当处于vhh形式时,对cd163(例如猪cd163)具有高结合亲和力,例如具有50nm或更低(更好)范围内的kd(平衡解离常数)。
211.因此,优选地,本发明的抗体,当处于vhh形式时,对cd163(例如猪cd163)具有与小于100nm、小于80nm、小于60nm、小于50nm、小于45nm、小于40nm、小于35nm、小于30nm、小于25nm、小于20nm、小于15nm或小于10nm,更优选小于10.0、9.5、9.0、8.5、8.0、7.5、7.0、6.5、6.0、5.5、5.0、4.5、4.0、3.5、3.0、2.5、2.0、1.5或1.0nm的kd相对应的结合亲和力。在实例中
公开了具体的示例性结合亲和力。可用于评估这种结合亲和力的cd163的示例性形式是含有srcr4-7的重组猪cd163或含有srcr1-9的重组猪cd163。在实例部分中描述了合适的示例性形式,例如构建体pcd163-srcr4-7hufc或pcd163-srcr1-9hufc。因此,当使用这些构建体测定本发明的抗体时或如果使用这些构建体测定本发明的抗体,例如在spr测定中,可以观察到上述结合亲和力。
212.如上所述,在本发明的一些实施例中,抗体可以结合猪cd163但不结合(或不显著结合)人cd163。可替代地考虑,与人cd163相反,它们优先结合猪cd163。
213.本发明的结合蛋白或抗体的优选用途是治疗或预防涉及cd163的病原体感染,最值得注意的是prrsv感染,典型地,本发明的结合蛋白或抗体抑制(或阻断或减少)病原体(例如prrsv)感染,例如抑制(或阻断或减少)病原体(例如prrsv)引起感染(例如感染合适的宿主细胞)的能力。优选地,抑制或减少是可测量的抑制或减少,更优选显著的抑制或减少,例如统计学上显著的抑制或减少,例如概率值为≤0.05或《0.05。在某些实施例中,本发明的结合蛋白或抗体可抑制(或阻断或降低)病原体例如prrsv感染宿主细胞的能力至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少92%、至少95%或至少98%。典型地,这样的%抑制(和如本文所述的其它百分比抑制水平)是相比(或相对于)适当的对照测定或对照水平,例如不存在结合蛋白或抗体(抗cd163抗体)的对照测定或对照水平(例如阴性对照或背景水平或测定)。因此,0%抑制(对照)水平(或相反100%或最大感染水平)通常是不存在结合蛋白或抗体(抗cd163抗体)时的水平。
214.这种抑制感染的能力可以在任何合适的测定中确定或测试,其实例容易由本领域技术人员得到。合适的测定可以是例如体外或离体测定,并且例如涉及使用cd163表达宿主细胞如pam或重组cd163表达宿主细胞,如本文别处所讨论的。这样的细胞可以与prrsv或其它合适的病原体以引起细胞感染的水平接触。合适的测定通常可以在血清,例如猪血清或胎牛血清(fbs)存在下进行。本领域技术人员容易确定使用的血清的合适百分比,例如在实施例部分中描述的测定中使用10%fbs和80%猪血清的水平。然后,可以容易地分析本发明的结合蛋白或抗体抑制或减少这种感染的能力,例如相比(相对于)对照测定设定的100%感染水平。在实例部分描述了合适的示例性感染测定。
215.任何适当浓度的结合蛋白或抗体可用于抑制或减少感染。当以至少50、60、70、80、90、100、120、140、160、180、200、300或400μg/ml,例如以高达200、300或400μg/ml,例如在50或100至200、300或400μg/ml的浓度使用时,本发明的示例性抗体具有引起抗体特别是vhh的抑制,例如如本文所概述的抑制水平的能力。如果使用抗体(例如vhh抗体)的组合,则在一些实施例中这些水平可以指存在的抗体(例如vhh)的总量,即存在的抗体的单个浓度的总和。
216.在一些实施例中,本发明的结合蛋白或抗体可抑制(或阻断或降低)1型prrsv或2型prrsv引起感染(例如感染cd163表达宿主细胞)的能力。在一些实施例中,本发明的结合蛋白或抗体可抑制(或阻断或降低)1型prrsv和2型prrsv两者引起感染(例如感染cd163表达宿主细胞)的能力。可以注意到,与prrsv(或其它致病实体)本身相反,本发明的结合蛋白或抗体靶向宿主细胞cd163。这提供了能够抑制任何病毒例如prrsv感染的重要优点,所述病毒使用cd163上的相同结合区用于感染或发病。这样,本发明的抗体等可提供阻断prrsv
的许多毒株或分离物(包括高致病性毒株或分离物)的方法,条件是它们使用cd163感染细胞。据信利用cd163对于多种prrsv毒株感染是常见的。因此,本发明的抗体具有广泛的用途。这与例如用于prrsv的一些已知方法相反,例如疫苗接种,其可以是毒株特异性的,并且它们的效力(或它们是否完全有效)可以根据毒株而变化。因此,本发明的抗体提供了优于这些现有方法的重要优点和灵活性。
217.本发明的优选抗体具有几乎完全抑制1型prrsv感染的能力,例如可观察到至少90%的抑制。可替代地,可以观察到至少50%、60%、70%、75%或80%的抑制。在一些实施例中,具有对1型prrsv感染显示至少80%抑制,更优选至少85%、90%或95%抑制的能力的抗体是优选的。
218.本发明的优选抗体具有抑制2型prrsv感染至少50%、至少55%或至少60%,更优选至少65%、至少70%、至少75%或至少80%抑制的能力。
219.本发明的一些优选抗体具有抑制1型和2型prrsv感染的能力,例如以上述和本文其它地方所述的水平。这些抗体在本文中有时称为“双重”抗体。因此,示例性抗体能够抑制2型prrsv至少50%,与抑制1型prrsv至少50%、60%、70%、75%、80%、85%、90%或95%相结合。替代示例性抗体能够抑制2型prrsv至少55%或60%,与抑制1型prrsv至少50%、60%、70%、75%、80%、85%、90%或95%相结合。替代示例性抗体能够抑制2型prrsv至少65%、70%或75%,与抑制1型prrsv至少50%、60%、70%、75%、80%、85%、90%或95%相结合。在一些实施例中,本发明的优选抗体能够抑制2型prrsv至少65%、70%或75%,与抑制1型prrsv至少90%或95%相结合。
220.vhh抗体形式的示例性“双重”抗体是49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)和144(#1),分别如表a、表b、表c、表d、表e、表f、表g、表h和表i所示。
221.在一些实施例中,本发明的结合蛋白或抗体可抑制(或阻断或降低)2型prrsv感染宿主细胞的能力。在一些实施例中,本发明的结合蛋白或抗体具有特异性抑制(或阻断或降低)2型prrsv引起感染(例如感染cd163表达宿主细胞或特异性抑制2型prrsv感染)的能力。与1型prrsv感染相反,这种结合蛋白或抗体优先抑制或减少2型prrsv感染。因此,示例性抗体能够抑制2型prrsv感染至少40%、45%或50%(例如抑制2型prrsv感染宿主细胞的能力至少40%、45%或50%)。
222.在其它实施例中,此类结合蛋白或抗体不抑制或减少(例如不显著抑制或减少)1型prrsv感染(例如不抑制或减少,或不显著抑制或减少1型prrsv感染宿主细胞的能力)。仅作为实例,不显著抑制或减少1型prrsv感染的此类抗体可仅将此类感染减少小于10%,或小于5%,或小于2%,并且优选地根本不减少(减少0%)。这些抗体在本文中有时称为“2型特异性”或“仅2型”抗体。vhh抗体形式的示例性的此类抗体为57(#11)、41(#12)、171(#14)和29(#17),分别如表1、表2、表3和表4所示。
223.可以容易地使用测定比较1型和2型prrsv抑制,例如其中测定条件保持相同,例如使用相同浓度的测试抗体或结合蛋白,但是一个测定用1型prrsv进行,另一个用2型prrsv进行。评估这种抑制的合适对照也在本文别处描述。
224.在某些实施例中,本发明的抗体的ic
50
(例如用于抑制宿主细胞的prrsv1感染,例如pam)为350μg/ml或以下、300μg/ml或以下、280μg/ml或以下、260μg/ml或以下、240μg/ml
或以下、220μg/ml或以下、200μg/ml或以下、190μg/ml或以下、180μg/ml或以下、170μg/ml或以下、160μg/ml或以下、150μg/ml或以下、140μg/ml或以下、130μg/ml或以下、120μg/ml或以下、110μg/ml或以下、100μg/ml或以下、90μg/ml或以下或80μg/ml或以下。在一些实施例中,ic
50
为80至350、300、250或200μg/ml,或80至160μg/ml,或80至120μg/ml,或100至200μg/ml,或100至160μg/ml,或100至120μg/ml。具体的示例性ic
50
值也示于实例中。
225.在某些实施例中,本发明的抗体的具有ic
50
(例如用于抑制宿主细胞的prrsv2感染,例如pam)为300μg/ml或以下、280μg/ml或以下、260μg/ml或以下、240μg/ml或以下、220μg/ml或以下、210μg/ml或以下、200μg/ml或以下、180μg/ml或以下、170μg/ml或以下、160μg/ml或以下、150μg/ml或以下、140μg/ml或以下、130μg/ml或以下、120μg/ml或以下、110μg/ml或以下或100μg/ml或以下。在一些实施例中,ic
50
为100或150或200至300μg/ml,或200至260μg/ml,或200至220μg/ml,或220至300μg/ml,或220至260μg/ml,或220至240μg/ml。具体的示例性ic
50
值也示于实例中。
226.上述优选ic
50
值优选地如在合适的病毒感染性测定中所测定,例如如上文或实例部分中所述。
227.尽管本文所述的双重抗体显示出良好的抑制2型prrsv感染的能力,但通常观察到对2型prrsv感染的抑制不如所观察到的对1型prrsv感染的抑制完全或未达到其同样高的水平。虽然不希望受理论束缚,但可能在cd163上存在多于一个表位,其涉及2型感染。因此,在本发明的优选实施例中,例如本文所述的双重抗体和2型特异性抗体可以组合使用。当需要或希望治疗或预防2型prrsv感染时,此类组合可能特别有用。
228.在本发明的替代实施例中,本发明的结合蛋白或抗体可用于降低prrsv感染的风险或预防prrsv感染。
229.优选地,当与适当的对照水平相比时,以可测量的或显著的水平,更优选以统计学显著的水平观察上述能力和性质。本文在别处讨论了适当的显著性水平。更优选地,当与对现有技术抗体观察到的能力相比时,以可测量地更好或更优选地显著更好(优选地统计学上显著更好)的水平观察到一种或多种上述能力和性质。
230.在本文提及的任何统计分析中,优选地,相对于相关对照或其它比较实体或测量的统计学显著差异的概率值为≤0.1或《0.1,优选地≤0.05或《0.05。确定统计显著性的适当方法在本领域中是公知的且有文献记载,并且可以使用这些方法中的任一种。
231.在一些实施例中,本发明的结合蛋白或抗体具有一种或多种,优选两种或多种,或三种或多种,最优选所有的功能特性,特别是本文所述的优选功能特性。
232.如在整个申请中所使用的,术语“一”和“一个”以它们表示所提及的部件或步骤的“至少一个”、“至少第一”、“一个或多个”或“多个”的意义使用,除了其中在其后具体陈述上限的情况。因此,本文所用的“抗体”是指“至少第一抗体”。
233.此外,当本文使用术语“包含”、“包括”、“具有”或“含有”或其它等同术语时,则在一些更具体的实施例中,例如在本文cdr或fr序列的定义中,这些术语包括术语“由
…
组成”或“基本上由
…
组成”或其它等同术语。
234.包含编码如本文所定义的本发明的结合蛋白或抗体或其部分或片段的核苷酸序列的核酸分子,或与其基本同源的核酸分子,形成本发明的其它方面。
235.优选的核酸分子是编码本发明的vhh抗体或vh区或结构域的核酸分子(例如,编码
seq id no:1、9、17、25、33、41、49、57或65的核酸分子)。其它优选的核酸分子是编码如表表a、表b、表c、表d、表e、表f、表g、表h或表i任一者中定义的三个cdr序列的组的那些核酸分子。优选的这种核酸分子还编码合适的构架区,例如fr1、fr2、fr3和fr4区,优选如表a、表b、表c、表d、表e、表f、表g、表h或表i任一者中定义的fr序列组。
236.在其它实施例中,优选的核酸分子是编码本发明的vhh抗体或vh区或结构域的核酸分子(例如编码seq id no:83、91、99或107的核酸分子)。其它优选的核酸分子是编码如表1、表2、表3或表4任一者中定义的三个cdr序列的组的那些核酸分子。优选的此类核酸分子还编码适当的构架区,例如fr1、fr2、fr3和fr4区,优选如表1、表2、表3或表4任一者中定义的fr序列组(例如本发明的2型特异性抗体)。
237.如本文所用,与氨基酸或核酸序列相关的术语“基本同源”包括与所公开的氨基酸或核酸序列具有至少60%、65%、70%或75%,优选至少80%,甚至更优选至少85%、90%、95%、96%、97%、98%或99%序列同一性的序列。因此,本发明的基本同源的序列包括本发明序列的单个或多个碱基或氨基酸改变(添加、取代、插入或缺失)。在氨基酸水平上,优选的基本同源的序列在组成本发明序列的一个或多个构架区和/或一个或多个cdr中含有至多5个,例如仅1个、2个、3个、4个或5个,优选1个、2个、3个或4个,优选1个、2个或3个,更优选1个或2个改变的氨基酸。所述改变可以是保守或非保守氨基酸。优选地,所述改变是取代,优选保守氨基酸取代。
238.在某些实施例中,如果给定的起始序列相对较短(例如长度为5个氨基酸),则与可能任选地在与较长起始序列基本同源的序列中进行的氨基酸取代的数目相比,在与其基本同源的序列中可能存在更少的氨基酸取代。例如,在某些实施例中,与本发明的起始vh cdr1序列基本同源的序列,例如起始vh cdr1序列在一些实施例中长度可以是5个氨基酸残基,优选与起始序列相比具有1或2个(更优选1个)改变的氨基酸。因此,在一些实施例中,基本同源的序列(例如基本同源的cdr序列)中的改变的氨基酸的数目可以根据给定起始cdr序列的长度来定制。例如,根据给定的起始cdr序列的长度,可以存在不同数目的改变的氨基酸,以便在cdr中实现特定的序列同一性%,例如至少60%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%的序列同一性。
239.可以使用本领域的常规方法,例如丙氨酸扫描诱变和/或分析抗原-抗体复合物的晶体结构,以确定cdr的哪些氨基酸残基对抗原结合没有贡献或没有显著贡献,因此在涉及基本同源的序列的本发明实施例中是改变或取代的良好候选物。
240.一旦确定,可以使用本领域常规的技术对亲本抗体的氨基酸序列中一个或多个氨基酸进行添加、缺失、取代或插入以形成新的抗体,其中所述亲本抗体是如本文别处定义的本发明的抗体之一,并且测试所得新抗体以鉴定根据本发明结合cd163的抗体。这些方法可用于形成多种新抗体,这些抗体均可测试它们结合cd163的能力。优选地,一个或多个氨基酸的所述添加、缺失、取代或插入发生在一个或多个cdr结构域中。
241.例如,所述操作可以方便地在核酸水平上通过基因工程进行,其中编码合适的结合蛋白及其结构域的核酸分子被修饰,使得所得表达蛋白的氨基酸序列进而以合适的方式被修饰。可以通过在本领域中公知且记载的任何合适的方法测试一种或多种修饰的抗体结合cd163的能力。还在本文别处以及实例部分中描述了合适的方法也描述。
242.通过这些方法产生、获得或可获得的新抗体形成本发明的另一方面。
243.术语“基本同源”还包括本发明的氨基酸和核苷酸序列的修饰或化学等价物,其以基本上相同的方式执行与本发明的蛋白质或核酸分子基本上相同的功能。例如,任何基本同源的抗体应保留如上所述结合cd163的能力。优选地,任何基本同源的抗体应保留起始抗体的一种或多种(或全部)功能能力。
244.优选地,任何基本同源的抗体应保留特异性结合由所讨论的起始抗体识别的cd163的相同表位的能力,例如,由本发明的一种或多种抗体的cdr结构域或如本文所述的本发明的vh(vhh)结构域识别的相同表位,例如结合与本发明的多种抗体中的一种或多种相同的表位(例如,vhh抗体49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1)中的一种或多种,分别如表a、表b、表c、表d、表e、表f、表g、表h和表i所示)。因此,优选地,任何基本同源的抗体应保留在合适的测定中与本发明的各种抗体(例如分别如表a、表b、表c、表d、表e、表f、表g、表h和表i中所示的vhh抗体49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1))中的一种或多种竞争结合cd163的能力。
245.在其它实施例中,任何基本同源的抗体应保留特异性结合由所讨论的起始抗体识别的cd163的相同表位的能力,例如,由本发明的一种或多种抗体的cdr结构域或如本文所述的本发明的vh(vhh)结构域识别的相同表位,例如结合与本发明的多种2型抗体中的一种或多种相同的表位(例如,vhh抗体57(#11)、41(#12)、171(#14)或29(#17)中的一种或多种,分别如表1、表2、表3和表4所示)。因此,优选地,任何基本同源的抗体应保留与本发明的各种2型抗体(例如,vhh抗体57(#11)、41(#12)、171(#14)或29(#17),分别如表1、表2、表3和表4所示,例如本发明的2型特异性抗体)中的一种或多种竞争结合cd163的能力。
246.与相同表位/抗原的结合可以容易地通过在本领域中公知且记载的方法进行测试,例如使用结合测定,例如竞争测定或通过分析抗原-抗体复合物的晶体结构。对其它功能性质的保留也可以容易地通过在本领域或本文中公知且记载的方法进行测试。
247.因此,本领域技术人员将理解,结合测定可用于测试任何抗体(例如“基本同源的”抗体)是否具有与本发明的抗体和抗体片段相同的结合特异性,例如结合相同的表位,或具有相同或等效的亲和力,例如结合测定,如本文别处所述的竞争测定或elisa测定。biacore测定也可以容易地用于确定抗体,例如“基本同源的”抗体是否可以结合cd163。本领域技术人员将意识到其它合适的方法和变型。
248.如下所述,竞争结合测定法可用于测试抗体,例如“基本同源的”抗体是否保留了特异性结合如本文各序列表中所示的本发明的一种或多种抗体所识别的cd163的基本上相同的表位的能力,或是否具有与本文各序列表中所示的本发明的一种或多种抗体竞争的能力。下面描述的方法仅仅是合适的竞争测定的一个实例。本领域技术人员将意识到其它合适的方法和变型。
249.示例性竞争测定涉及在存在不同浓度的测试抗体(例如基本同源的抗体)的情况下评估各种有效浓度的本发明抗体与cd163的结合。然后可以评估测试抗体诱导的结合抑制的量。在增加的浓度下(即增加的测试抗体浓度导致本发明抗体与cd163结合的量相应减少)显示出与本发明抗体竞争增加的测试抗体是与基本上相同的表位结合的证据。优选地,测试抗体显著降低本发明抗体与cd163结合的量。优选地,测试抗体使本发明抗体与cd163结合的量减少至少约95%。elisa和流式细胞术分析可用于在这种竞争分析中评估结合抑
制,但其它合适的技术是本领域技术人员公知的。
250.这样的抗体(单克隆抗体),其具有特异性结合与本发明抗体(例如,vhh抗体49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1),分别如表a、表b、表c、表d、表e、表f、表g、表h和表i所示)所识别的基本上相同(或相同)的cd163表位或cd163重叠表位的能力,或具有与本发明的各种抗体(例如,vhh抗体49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1),分别如表a、表b、表c、表d、表e、表f、表g、表h和表i所示)中的一种或多种竞争的能力,是本发明的进一步的实施例。
251.在另一实施例中,抗体(单克隆抗体),其具有特异性结合与本发明的抗体(例如,vhh抗体57(#11)、41(#12)、171(#14)或29(#17),分别如表1、表2、表3和表4所示)所识别的基本上相同(或相同)的cd163表位或cd163重叠表位的能力,或具有与本发明的各种抗体(例如,vhh抗体57(#11)、41(#12)、171(#14)或29(#17),分别如表1、表2、表3和表4所示,例如本发明的2型特异性抗体)中的一种或多种竞争的能力,是本发明的进一步的实施例。在一些实施例中,优选的此类抗体是包含如表3中概述的seq id no:99(或所述序列的相关三种cdr序列)的vhh抗体171(#14)。
252.如本文所用,术语“竞争抗体”是指与“参考抗体”结合大约、基本上或大体上相同或甚至相同的表位的抗体。“竞争抗体”包括具有重叠表位特异性的抗体。因此,竞争抗体能够有效地与参考抗体竞争结合cd163。优选地,竞争抗体可以结合与参考抗体相同的表位。另一方面,竞争抗体优选具有与参考抗体相同的表位特异性。
253.如本文所用,“参考抗体”是根据本发明的能够结合cd163的抗体,其优选地具有如本文定义的vh结构域,更优选地具有vh结构域或是包含如在表a、表b、表c、表d、表e、表f、表g、表h或表i中概述的seq id no:1、9、17、25、33、41、49、57或65(或所述序列的相关三种cdr序列)的vhh抗体。
254.如本文所用,“参考抗体”是根据本发明的能够结合cd163的抗体,其优选地具有如本文定义的vh结构域,更优选地具有vh结构域或是包含如在表1、表2、表3或表4中概述的seq id no:83、91、99或107(或所述序列的相关三种cdr序列)的vhh抗体(例如本发明的2型特异性抗体)。在一些实施例中,优选的参考抗体是包含如表3中概述的seq id no:99(或所述序列的相关三种cdr序列)的vhh抗体。
255.既然已经提供了参考抗体,例如本文序列表中概述的那些,那么鉴定一种或多种竞争性抗体或结合相同表位的抗体是一个简单的技术问题。由于鉴定竞争抗体或结合相同表位的抗体可通过与参考抗体比较来确定,应当理解,实际上确定任一种或两种抗体结合的表位对于鉴定竞争抗体或结合相同表位的抗体不是必需的。然而,如果需要,可以使用标准技术进行表位作图。
256.对seq id no:115所示的猪cd163的srcr5结构域和vhh抗体171(#14)(即vhh 014(2d01),其具有表3所示的氨基酸序列(seq id no:17'或99))之间的抗原-抗体复合物的晶体结构进行分析,以确定该抗体结合的cd163中的区域(表位)(参见图6)。猪cd163上有助于抗原结合的残基已被鉴定为猪cd163的s507、e509、l526和l527(参照seq id no:116中所示的uniprot q2vl90序列)。晶体结构显示s507和e509与vhh 014(2d01)的l104相互作用,l526与vhh 014(2d01)的y59相互作用,l527与vhh 014(2d01)的d62相互作用。
257.cd163上的表位
258.因此,进一步的方面提供了包含结合或特异性结合猪cd163的抗原结合结构域的抗体(或结合蛋白),其中所述抗体(抗原结合结构域)结合猪cd163的srcr5结构域中的表位,该表位包含(或由其定义)seq id no:116的氨基酸s507、e509、l526和l527,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。
259.可替代地考虑,进一步的方面提供了包含结合或特异性结合猪cd163的抗原结合结构域的抗体(或结合蛋白),其中所述抗体(抗原结合结构域)结合猪cd163的srcr5结构域中的表位,该表位包含(或由其定义)seq id no:115的氨基酸s32、e34、l51和l52,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。相关残基在下面seq id no:115中以下划线表示。
260.prlvggdipcsgrvevqhgdtwgtvcdsdfsleaasvlcrelqcgtvvsllggahfgegsgqiwaeefqcegheshlslcpvaprpdgtcshsrdvgvvcs(seq id no:115).
261.特别地,vhh的cdr2与猪cd163(seq id no:116)的残基l526和l527之间的相互作用对于抗原-抗体(抗原结合结构域)相互作用而言是重要的。因此,本发明的进一步的方面提供了包含结合或特异性结合猪cd163的抗原结合结构域的抗体(或结合蛋白),其中所述抗体(抗原结合结构域)结合猪cd163的srcr5结构域中的表位,该表位包含(或由其定义)seq id no:116的氨基酸l526和l527,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。
262.在其它实施例中,本发明提供了包含结合或特异性结合猪cd163的抗原结合结构域的抗体(或结合蛋白),其中所述抗体(抗原结合结构域)结合猪cd163的srcr5结构域中的表位,该表位包含(或由其定义)seq id no:116的氨基酸l526、l527和s507,或l526、l527和e509,或氨基酸l526、l527、s507和e509,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。
263.在其它实施例中,所述抗体(或结合蛋白)结合猪cd163的srcr5结构域中的表位,该表位包含(或由其定义)seq id no:116的残基s507、e509、l526和l527中的一种、两种、三种或全部,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。换句话说,由本发明的抗体(或结合蛋白)结合的cd163上的表位的至少一种氨基酸包含seq id no:116的s507、e509、l526或l527,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。此类抗体可被认为是结合重叠表位的抗体的实例。
264.可替代地考虑,所述抗体(或结合蛋白)结合猪cd163的srcr5结构域中的表位,该表位包含(或由其定义)seq id no:115的残基s32、e34、l51和l52中的一种、两种、三种或全部,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。换句话说,由本发明的抗体(或结合蛋白)结合的cd163上的表位的至少一种氨基酸包含seq id no:115的s32、e34、l51或l52,或替代的cd163序列例如来自另一物种的cd163序列中的相应残基。此类抗体可被认为是结合重叠表位的抗体的实例。
265.据本发明人所知,本领域尚未描述能够结合或特异性结合猪cd163,特别是结合猪cd163的srcr5结构域中的表位,并且能够抑制或减少2型prrsv感染的单克隆抗体,其形式为仅抑制或减少2型prrsv感染的形式,或为其中所述抗体能够抑制或减少1型和2型prrsv感染的形式。
266.因此,本文所述的单个单克隆抗体是不寻常的且是有利的。此外,如上所述,本发
明人相信他们已经鉴定了猪cd163上的表位,该表位对于2型prrsv感染很重要,因此通常是抗体和结合蛋白的靶标,以减少或抑制prrsv感染。还可以注意到,在本文中被鉴定为表位的一部分的猪cd163上的残基位于与先前鉴定为可能对prrsv感染重要的那些残基不同的cd163区域。例如,先前的报道,例如ma等人,2017(《美国微生物学会(am.soc.for microbiology)》,91(3):e01897-16),鉴定cd163的srcr5结构域中的残基r561对于1型prrsv感染重要。该残基存在于猪cd163的环5-6中,其位于cd163的残基phe 544与arg 570之间。其它报道推测cd163中位于cd163的残基s487与g499之间的配体结合口袋(lbp)也可能是prrsv感染的重要区域。在本研究中鉴定为表位的一部分的4个残基都不在这些区域中。
267.因此,相信本发明已在猪cd163的srcr5区的不同部分中鉴定了对prrsv感染、特别是2型prrsv感染重要的新表位,并且与该表位结合的抗体(或结合蛋白)或重叠表位是特别优选的。如上所述,表3中所示的抗体171(#14)已显示出结合该表位。使用竞争结合研究的初始实验显示至少抗体57(#11)、70(#23)、144(#1)和150(#15)可以结合相同的或重叠的表位。
268.抗体上的互补位
269.cd163中的两种l残基l526和l527已显示出与vhh抗体171(#14)即vhh 014(2d01)的cdr2中发现的yyad基序中的y59和d62相互作用。该vhh抗体已显示出对2型prrsv感染具有抑制作用或减少2型prrsv感染。可以注意到,序列yyad或与序列yyad高度相似的序列存在于本文所述的所有vhh抗体的cdr2的等同或相应的区域中。本文所述的所有vhh抗体已显示出对2型prrsv感染具有抑制作用或减少2型prrsv感染。因此,该vh cdr2区似乎是具有抑制或减少2型prrsv感染的能力的抗体(例如,vhh抗体)的重要特征。
270.因此,本发明优选的抗体(或结合蛋白)包含cdr2,特别是vh cdr2,其包含氨基酸序列yad或yae,优选xyad或xyae,其中x可以是任何氨基酸,优选y、l、p、n、f或r,更优选y、f、l、n或r,或y、p或l,最优选y。在其它实施例中,序列可包含yan或xyan作为yad或yae的替代物。
271.在实施例中,x残基位于vhh抗体171(#14)即表3中所示的vhh 014(2d01)的seq id no:17'或99的位置59处,或替代的抗体(或vhh)的vh cdr2中的相应位置处。可替代地考虑,x残基位于vhh抗体171(#14)即表3中所示的vhh 014(2d01)的seq id no:19'或101(cdr2)的位置10处,或替代的抗体(或vhh)的vh cdr2中的相应位置处,其可例如位于如本文所述的其它vhh抗体的cdr2区中的位置8或9处。xyad或xyae或xyan基序中的其它残基的位置可以根据这些位置来确定。
272.cd163中的两种残基s507和e509已显示处与vhh抗体171(#14)即vhh 014(2d01)的cdr3中的l104相互作用。该vhh抗体已显示出对2型prrsv感染具有抑制作用或减少2型prrsv感染。因此,该vh cdr3残基(或其它抗体例如vhh抗体中的相应残基)可以是具有抑制或减少2型prrsv感染的能力的抗体(例如vhh抗体)中的重要残基。
273.因此,在一些实施例中,本发明的抗体(或结合蛋白)包含cdr3,特别是vh cdr3,其包含vhh抗体171(#14)即表3中所示的vhh 014(2d01)的seq id no:17'或99中的位置104处,或替代的抗体(或vhh)的vh cdr3中的相应位置处的氨基酸残基l。可替代地考虑,l残基位于vhh抗体171(#14)即表3中所示的vhh 014(2d01)的seq id no:20'或102的位置6处,或
替代的抗体(或vhh)的vh cdr3中的相应位置处。
274.在一些实施例中,上述l残基除了存在于上述cdr2中的yad或yae或yan序列中之外,还存在于cdr3中,优选xyad或xyae或xyan,其中x可以是任何氨基酸,优选y、l、p、n、f或r,更优选y、f、l、n或r,或y、p或l,最优选y。
275.在本发明提供基本同源序列的实施例中,在一些实施例中,如上定义的残基yad、yae或yan,或xyad、xyae或xyan被保持或存在,并且变异发生在这些残基之外。
276.本发明的蛋白质的基本同源的序列包括但不限于保守氨基酸取代,或例如不影响抗体的vh、vl或cdr结构域的改变,例如其中添加了对抗原结合无贡献的标签序列、毒素或其它组分的抗体,或将一种类型或形式的结合蛋白、抗体分子或片段转化为另一种类型或形式的结合蛋白、抗体分子或片段的改变(例如从vhh转化为fab或scfv或全抗体,或反之亦然),或抗体分子转化为抗体分子的特定类别或亚类(例如抗体分子转化为igg或其亚类,例如igg2)。
277.如本文所用,“保守氨基酸取代”是其中氨基酸残基被具有相似侧链的另一个氨基酸残基置换。本领域已经定义了具有相似侧链的氨基酸残基家族,包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如甘氨酸、半胱氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。在其它实例中,氨基酸残基家族可以基于疏水侧基或亲水侧基分组。
278.可以通过任何方便的方法评估同源性。然而,为了测定序列之间的同源性程度,进行序列多重比对的计算机程序是有用的,例如clustal w(thompson,higgins,gibson,《核酸研究(nucleic acids res.)》,22:4673-4680,1994)。如果需要,可以将clustal w算法与blosum 62评分矩阵(henikoff和henikoff,《美国科学学院学报》,89:10915-10919,1992)一起使用并且空位开放罚分为10,空位延伸罚分为0.1,使得在两个序列之间获得最高阶匹配,其中序列之一的总长度的至少50%参与比对。可以用于比对序列的其它方法是needleman和wunsch的比对方法(needleman和wunsch,《分子生物学杂志(j.mol.biol)》,48:443,1970),由smith和waterman修订(smith和waterman,《应用数学进展(adv.appl.math)》2:482 1981),使得在两个序列之间获得最高阶的匹配,并且在两个序列之间确定相同氨基酸的数目。用于计算两个氨基酸序列之间的同一性百分比的其它方法通常是本领域公知的,包括例如由carillo和lipton描述的那些方法(carillo和lipton,《siam应用数学杂志(siam j.applied math)》,48:1073,1988)和在《计算分子生物学(computational molecular biology)》,lesk编辑,牛津大学出版社(oxford university press),纽约,1988,“生物计算:信息学和基因组学项目(biocomputing:informatics and genomics projects)”中描述的那些方法。
279.通常,将使用计算机程序进行此类计算。比较和比对序列的程序,例如align(myers和miller,cabios,4:11-17,1988)、fasta(pearson和lipman,《美国科学学院学报》,85:2444-2448,1988;pearson,《酶学方法(methods in enzymology)》,183:63-98,1990)和有缺口的blast(altschul等人,《核酸研究》,25:3389-3402,1997)、blastp、blastn或gcg(devereux,haeberli,smithesies,《核酸研究》,12:387,1984)也可用于此目的。此外,欧洲
retargeting(双亲性重定位)”);包含一个或多个cdr等的小抗体模拟物。
290.制备和使用各种基于抗体的构建体和片段的技术是本领域公知的。
291.可以使用常规技术将抗体片段化。例如,可以通过胃蛋白酶处理抗体产生f(ab')2片段。可以处理得到的f(ab')2片段以还原二硫键,产生fab'片段。木瓜蛋白酶消化可导致fab片段的形成。fab、fab'和f(ab')2、scfv、fv、dsfv、fd、dabs、tandabs、ds-scfv、二聚体、微型抗体、双链抗体、双特异性抗体片段和其它片段也可以通过重组技术合成或可以化学合成。产生抗体片段的技术在本领域中公知且记载。
292.在本发明的所有实施例中,优选单结构域抗体(也称为vhh抗体、sdabs、dabs、dabs、纳米抗体、骆驼抗体、vnar(鲨)抗体、vh抗体或vl抗体),特别是vhh抗体、纳米抗体、骆驼抗体和vnar(鲨)抗体。这样的抗体包含单个单体可变抗体结构域,通常是vh结构域,其可以结合抗原(尽管已经描述并可以使用具有结合抗原能力的单个vl结构域)。因此,在一些这样的优选实施例中,本发明的抗体(或抗原结合结构域)包含一个(或单个)重链可变区(vh或vhh),尽管在一些实施例中,许多这些单独的重链可变区具有相同或不同序列可以一起存在于相同的构建体或分子中。
293.这些抗体可以使用在本领域中公知且记载的标准技术获得或制备。例如,这些抗体可以通过用所需抗原免疫合适的动物,例如骆驼科动物如美洲驼或鲨鱼,然后将产生的抗体的vh结构域克隆到合适的表达载体中并选择结合物而获得。也可以获得或可以产生vh结构域的库(例如人vh结构域的噬菌体展示库),然后可以对其进行筛选。
294.由于其尺寸较小,单结构域抗体可以具有相对较短的半衰期,例如相对较短的血浆半衰期。因此,有时修饰这些抗体以延伸或延长它们的半衰期。在本领域中公知且记载了这样做的技术,并且可以使用这些技术中的任何一种。实例包括将抗体附着或缀合或融合至白蛋白(或自身具有长(或更长)半衰期的另一种蛋白质或实体),或将抗体附着或缀合或融合至自身可与具有长(或更长)半衰期的蛋白质或实体相互作用的另一种蛋白质或实体,或将抗体附着或缀合至peg(或其它聚合物),或将抗体附着或缀合或融合至结合fcrn的抗体或其它蛋白质或实体。
295.在某些实施例中,本发明的抗体或抗体片段包含全部或部分的重链恒定区,如igg1、igg2、igg3、igg4、iga1、iga2、ige、igm或igd恒定区。优选地,重链恒定区是igg重链恒定区,例如igg2重链恒定区,或其部分。此外,抗体或抗体片段可以包含全部或一部分的kappa轻链恒定区或lambda轻链恒定区,或其一部分。这些恒定区的全部或部分可以是天然产生的,或者可以是全部或部分合成的。在本领域中公知且记载了这种恒定区的合适序列。当本发明的抗体中包括来自重链和轻链的恒定区的完整互补时,此类抗体在本文中通常称为“全长”抗体或“全”抗体。在一些实施例中,优选igg2抗体。
296.在其它实施例中,优选不存在恒定区,例如不存在重链或轻链恒定区,例如可变结构域或重链可变结构域(vh)是存在的抗体的唯一部分。
297.抗体或抗体片段可以天然产生或可以全部或部分合成产生。
298.许多抗体或抗体片段包含有包含三个cdr结构域的抗体轻链可变区(v
l
)和包含三个cdr结构域的抗体重链可变区(vh)。所述vl和vh通常形成抗原结合位点。
299.然而,本领域充分证明抗体轻链可变结构域的三个cdr和重链可变结构域的三个cdr的存在对于抗原结合并不总是必需的。因此,已知比上述经典抗体片段更小的构建体是
有效的。
300.例如,骆驼抗体具有广泛的抗原结合文库,但缺乏轻链。另外,单独包含vh结构域或单独包含vl结构域的单结构域抗体的结果显示,这些结构域可以以可接受的高亲和力结合抗原,并且具有其它优点,例如它们的尺寸小和易于生产。因此,三个cdr可以有效地结合抗原,并且在本文中举例说明此类单结构域抗体(例如vhh抗体、sdabs、dabs、dabs、纳米抗体、骆驼抗体、vnar(鲨)抗体、vh抗体或vl抗体,特别是vhh抗体、纳米抗体、骆驼抗体、vnar(鲨)抗体),并且此类抗体是优选的(例如vhh抗体)。
301.本发明的抗体、结合蛋白和核酸分子通常是“分离的”或“纯化的”分子,只要它们区别于任何可在人或动物体(例如骆驼)或源自人或动物体(例如骆驼)的组织样品中原位存在的此类组分。然而,所述序列可能与在人或动物体(例如骆驼)中发现的序列相对应或基本同源。因此,如本文所用,关于核酸分子或序列和蛋白质或多肽(例如抗体)的术语“分离的”或“纯化的”是指当从它们的天然环境分离、纯化或基本上没有其天然环境(例如分离自或纯化自人或动物体(如果它们确实天然存在))时的此类分子,或是指当通过技术方法产生时的此类分子,即包括重组和合成产生的分子。
302.可以注意到,本发明的抗体等不是天然存在的,并且就这一点来说,是人造构建体,因为它们不对应于天然存在的分子。例如,优选的抗体是可以被工程化或重组产生的单结构域抗体,甚至在天然产生这种抗体的物种中,例如骆驼,这种物种将不产生针对cd163特别是猪cd163的抗体,除非它们被实验诱导,例如通过免疫。换句话说,本发明的抗体等是非天然的。
303.本文所用的术语“片段”是指生物学相关的片段,例如有助于抗原结合(例如形成抗原结合位点的一部分)和/或有助于cd163抗体的功能特性的片段。某些优选的片段包含或由本发明抗体的重链可变区(vh结构域或三个vh cdr)组成。
304.本领域技术人员将理解,本发明的蛋白质和多肽例如重链cdr和轻链cdr、重链可变区和轻链可变区、抗体和抗体片段,可以用在本领域公知且记载的几种方法中的任一种制备,但最优选使用重组方法制备。
305.适当时,编码本发明抗体的重链可变区和轻链可变区的核酸片段可以通过任何适当的方法获得或产生,例如通过克隆或合成。
306.一旦获得了编码本发明抗体的重链可变区和/或轻链可变区的核酸片段,可以通过标准重组dna技术进一步操作这些片段,例如将可变区片段转化为具有适当恒定区结构域的全长抗体分子,或转化为本文别处讨论的特定形式的抗体片段,例如单结构域抗体如vhh、fab片段、scfv片段等。典型地,或作为该进一步操作程序的一部分,编码本发明抗体分子的核酸片段通常整合到一个或多个合适的表达载体中,以促进本发明抗体的产生,或例如促进选择或筛选,例如通过整合到噬菌体展示载体中。
307.可能的表达载体包括但不限于粘粒、质粒或修饰的病毒(例如复制缺陷型逆转录病毒、腺病毒和腺伴随病毒),只要该载体与所用宿主细胞相容。表达载体“适于宿主细胞的转化”,这意味着表达载体包含本发明的核酸分子和与核酸分子可操作地连接的基于要用于表达的宿主细胞选择的调控序列。可操作地连接意指核酸以允许核酸表达的方式与调控序列连接。
308.因此,本发明涉及表达载体,例如含有或包含本发明的核酸分子或其片段以及用
于转录和翻译由本发明的核酸分子编码的蛋白质序列所必需的调节序列的重组表达载体。
309.可以将表达载体导入宿主细胞以产生转化的宿主细胞。术语“用
…
转化”、“用
…
转染”、“转化”和“转染”旨在涵盖通过本领域已知的许多可能技术之一将核酸(例如载体)引入细胞中。在sambrook等人,1989(sambrook,fritsch和maniatis,《分子克隆:实验室手册(molecular cloning:a laboratory manual)》,第二版,冷泉港出版社(spring harbor press),冷泉港,纽约,1989)和其它实验室教科书中可以找到用于转化和转染宿主细胞的合适方法。
310.合适的宿主细胞包括多种真核宿主细胞和原核细胞。例如,本发明的蛋白质可以在酵母细胞或哺乳动物细胞中表达。此外,本发明的蛋白质可以在原核细胞如大肠杆菌中表达。
311.本发明的蛋白质还可以通过使用蛋白质化学中公知的技术如固相合成的化学合成来制备。
312.另一方面提供了包含本发明的一种或多种核酸片段或段或分子的表达构建体或表达载体或表达系统(例如病毒或细菌或其它表达构建体、载体或系统)。优选地,表达构建体或载体或系统是重组的。优选地,所述构建体或载体或系统还包含用于转录和翻译由本发明的核酸分子编码的蛋白质序列所必需的调节序列。优选的构建体等是允许本发明的抗体(或结合蛋白)在宿主靶物种内例如在猪体内延长或持续表达的构建体等。这样的表达可以是瞬时的,例如是游离的,或者是更持久的,例如通过基因组整合,只要获得足够水平和长度的表达以观察治疗或生物效应。
313.另一方面提供了包含本发明的一种或多种表达构建体或表达载体的宿主细胞(例如,哺乳动物或细菌或酵母宿主细胞)或病毒。还提供包含本发明的一种或多种核酸分子的宿主细胞或病毒。表达本发明的抗体(或结合蛋白)的宿主细胞(例如哺乳动物宿主细胞或细菌宿主细胞,或酵母宿主细胞)或病毒形成了又一方面。
314.这样的表达构建体或载体或系统,或宿主细胞或病毒,或编码本发明的抗体(或结合蛋白)的其它核酸产物或片段可以作为治疗剂给予受试者,以允许在受试者体内原位产生本发明的抗体(或结合蛋白),从而发挥它们的治疗作用。
315.本发明的另一方面提供了一种用于生产(或制造)本发明抗体的方法,包括培养本发明宿主细胞的步骤。优选的方法包括以下步骤:(i)在适于表达编码的抗体或蛋白质的条件下培养包含本发明的一种或多种重组表达载体或一种或多种核酸序列的宿主细胞;以及任选地(ii)从宿主细胞或从生长培养基/上清液分离或获得抗体或蛋白质。这样的生产(或制造)方法还可以包括纯化抗体或蛋白质产物和/或将抗体或产物配制成包含至少一种额外组分如药学上可接受的载体或赋形剂的组合物的步骤。
316.在实施例中,当本发明的抗体或蛋白质由多于一条多肽链(例如某些片段,如fab片段或全抗体)组成时,则所有多肽优选在宿主细胞中表达,其来自相同或不同的表达载体,使得完整蛋白质,例如本发明的抗体蛋白质,可以在宿主细胞中组装并从中分离或纯化。
317.另一方面,本发明提供了一种用于结合cd163的方法,包括使包含cd163的组合物与本发明的抗体接触。
318.在另一方面,本发明提供了一种用于检测cd163的方法,包括将疑似含有cd163的
组合物与本发明的抗体在有效允许形成cd163/抗体复合物的条件下接触,并检测如此形成的复合物。
319.包含本发明的至少第一抗体(或结合蛋白)的组合物构成本发明的另一方面。包含与合适的稀释剂、载体或赋形剂混合的本发明的一种或多种抗体的制剂(组合物)构成本发明的优选实施例。这样的制剂可以用于药物用途,例如兽医用途,因此本发明的组合物优选是药学上可接受的或可接受用于给予非人动物,例如哺乳动物,优选猪。合适的稀释剂、赋形剂和载体是本领域技术人员已知的。
320.本发明的组合物可以例如以适于口服、鼻、肠胃外、静脉内、局部或直肠给药的形式存在。
321.本文定义的活性化合物(例如本发明的抗体)可以以常规的药理学施用形式存在,例如片剂、包衣片剂、鼻喷雾剂、溶液、乳剂、脂质体、粉末、胶囊或持续释放形式。常规药物赋形剂以及通常的生产方法可以用于制备这些形式。
322.注射溶液可以例如以常规方式生产,如通过添加防腐剂(如对-羟基苯甲酸酯)或稳定剂(如edta)。然后将溶液装入注射小瓶或安瓿中。
323.合适的剂量单位可由本领域技术人员确定。
324.在共同施用方案或组合方案的情况下,药物组合物可以另外包含另外的活性成分(例如如本文别处描述的)。
325.本发明的另一方面提供了本文定义的抗cd163抗体(或结合蛋白),其用于疗法,特别是用于治疗或预防与cd163相关的或cd163在其中发挥作用例如致病作用(例如完全或部分致病作用)或必要作用的任何疾病或病症。例如,本发明的抗cd163抗体可以用于治疗或预防由病毒或其它病原体引起的任何感染,其中所述感染与cd163相关,或cd163在其中发挥作用例如致病作用(例如全部或部分致病作用)或必要作用。换言之,根据本发明,抗cd163抗体(或结合蛋白)可以靶向并抑制或降低cd163的功能,特别是在pams或其它cd163阳性细胞上或细胞中表达的cd163。因此,本文定义的抗cd163抗体(或结合蛋白)可以用于治疗或预防任何在其中抑制cd163或阻断或降低cd163功能有用的疾病或病症。
326.优选的实施例提供了用于治疗或预防猪感染,优选猪病毒感染的本发明的抗cd163抗体(或结合蛋白)。特别优选的是治疗或预防prrsv感染。在治疗猪的实施例中,本发明的抗cd163抗体(或结合蛋白)通常是抗猪cd163抗体(或结合蛋白)。
327.cd163被认为是所有prrs病毒的可能受体。然而,如本文别处所述,存在prrsv的两种血清型;1型和2型病毒。尽管1型和2型病毒在若干水平上表型相似,但病毒基因型存在差异。本发明的抗体(或结合蛋白)可用于治疗或预防1型和/或2型prrs病毒,例如1型和2型prrs病毒。在其它实施例中,本发明提供具有抑制2型prrsv感染,优选特异性抑制2型prrsv感染的能力的抗体(或结合蛋白),且因此可用于治疗或预防2型prrs病毒。
328.在本发明的治疗方法和用途中,以药学、治疗学或生理学有效量向需要治疗的受试者(动物或哺乳动物,例如猪)施用结合蛋白或抗体。因此,所述方法和用途可以包括鉴定需要治疗的受试者的附加步骤。
329.根据本发明的疾病或病症的治疗(例如预先存在的疾病的治疗)包括治愈所述疾病或病症,或任何减轻或缓解疾病(例如降低疾病严重性)或疾病的症状。
330.本发明的治疗方法和用途适用于疾病的预防以及疾病的积极治疗(例如治疗已有
疾病)。因此,预防性和元预防性(metaphylactic)治疗(面对疾病爆发进行治疗,例如在诊断出一组受试者中的一部分的感染和/或临床疾病后对该组受试者进行治疗,目的是防止传染病传播给密切接触和/或面临重大风险的动物)也包括在本发明中。因此,在本发明的方法和用途中,治疗还包括适当时预防、元预防(metaphylaxis)或防止。
331.这样的预防性(或保护性)方面可以方便地在健康或正常或有风险的受试者中进行,并且可以包括完全预防和显著预防。类似地,显着预防可以包括与不给予治疗时预期的严重程度或症状相比,疾病或疾病症状的严重程度降低(例如可测量或显着降低)的情况。
332.例如prrs感染的临床症状包括妊娠母猪或小母猪的胎儿重吸收、死胎和晚期流产,以及所有猪,尤其是幼猪和小猪的呼吸疾病和综合征,例如呼吸窘迫。其它症状包括食欲缺乏(通常导致生长速率降低)、发烧、嗜睡、呼吸窘迫、生殖失败和腹泻(特别是在幼小仔猪中)以及中枢神经系统(cns)症状。患有prrsv感染的受试者也对地方病具有易感性,如脑膜炎、格拉斯病(glassers disease)、渗出性皮炎、疥螨病和细菌性支气管肺炎,通常报道为增加(《猪病学(diseases of swine)》,第11版,编者:jeffrey j.zimmerman locke a.karriker alejandro ramirez kent j.schwartz gregory w.stevenson jianqiang zhang,第一版:2019年3月29日),这些疾病通过使用抗微生物产品如抗生素来治疗。因此,本发明在减少农场使用的抗微生物产品方面发挥作用。
333.因此,本发明的抗体可用于治疗或预防临床疾病或症状,例如与prrsv感染相关的临床疾病或症状或下游地方性疾病,例如上文概述的那些,或用于减少病毒循环,例如prrsv循环(例如循环病毒颗粒的数目或滴度)或用于预防感染(例如第一次感染)或新的感染(例如第二次或后续感染),例如prrsv感染(例如第一次prrsv感染)或新的prrsv感染(例如第二次或后续prrsv感染)。
334.因此,根据本发明治疗的优选受试者包括所有类型的猪(有时也称为猪),例如任何猪(pig/swine)或猪物种,包括所有年龄和物种的猪,条件是它们对本文定义的病原体,特别是prrsv敏感或能够被其感染。仔猪,尤其是幼小仔猪或来自受感染母猪的活产仔猪(高达80%的仔猪将死亡)是特别优选的受试者,如保育猪(例如达到12周龄的断奶后猪)和生长或肥育猪(例如达到屠宰年龄的猪),特别是生长猪。断奶前的仔猪,例如达到4周龄的仔猪(尤其是受感染母猪的仔猪,其中感染可通过受感染母猪的乳腺分泌物传播)也是待治疗的优选受试者,母猪和妊娠母猪也是如此。
335.在一些实施例中,例如当涉及预防时,受试者是有风险受所讨论的疾病或病症影响的受试者,例如有风险被如上所述的病原体或病毒(例如prrsv)感染并发展疾病的受试者。这样的受试者可以是健康受试者或不显示任何疾病症状的受试者或任何其它适当的“有风险”的受试者。在另一实施例中,受试者是患有或怀疑患有(或发展)或潜在地患有(或发展)如上所述的所讨论的疾病或病症的受试者。
336.可替代地考虑,本发明提供了一种用于治疗或预防与cd163相关或其中cd163发挥作用例如致病作用(例如完全或部分致病作用)或必要作用的疾病或病症的方法,该方法包含向有需要的受试者施用治疗有效量的如本文定义的本发明的抗cd163抗体(或结合蛋白)。本文别处描述了合适的疾病或病症。
337.优选治疗或预防猪的感染,优选猪的病毒感染。特别优选的是治疗或预防prrsv感染,例如治疗或预防1型和/或2型prrs病毒感染,例如1型和2型prrs病毒感染,或治疗或预
防(例如特异性治疗或预防)2型prrs病毒感染。
338.因此,另一方面提供了一种用于治疗或预防猪prrsv感染的方法,例如治疗或预防猪1型和/或2型prrs病毒感染,该方法包括向有需要的受试者施用治疗有效量的结合猪cd163的单克隆抗体。本文描述了用于此类方法的合适的cd163抗体(或结合蛋白)。
339.在此描述的本发明的治疗用途的实施例,比照适用于本发明的该方面。
340.治疗有效量将基于临床评估确定并且可以容易监测。
341.进一步替代地考虑,本发明提供了本文定义的本发明的抗cd163抗体(或结合蛋白)例如本发明的单克隆抗体在制备用于疗法的药物中的用途。本文别处描述了优选的治疗用途,特别是用于治疗或预防与cd163相关的或任何其中cd163发挥作用例如致病作用(例如完全或部分致病作用)或必要作用的疾病或病症。例如,本发明的抗cd163抗体(或结合蛋白)可以用于治疗或预防由病毒或其它病原体引起的任何感染,其中所述感染与cd163相关,或cd163在其中发挥作用例如致病作用(例如全部或部分致病作用)或必要作用。换言之,根据本发明,抗cd163抗体(或结合蛋白)可以靶向并抑制或降低cd163的功能,特别是在pams或其它cd163阳性细胞上或细胞中表达的cd163。因此,本文定义的抗cd163抗体(或结合蛋白)可以用于治疗或预防任何在其中抑制cd163或阻断或降低cd163功能有用的疾病或病症。
342.优选的实施例提供了本发明的抗cd163抗体(或结合蛋白)在制备用于治疗或预防猪感染,优选猪病毒感染的药物中的用途。特别优选的是治疗或预防prrsv感染,例如治疗或预防1型和/或2型prrs病毒感染,例如1型和2型prrs病毒感染,或治疗或预防(例如特异性治疗或预防)2型prrs病毒感染。
343.因此,又一方面提供了t结合猪cd163的单克隆抗体在制备用于治疗或预防猪中的prrs病毒感染,优选1型和/或2型prrs病毒感染的药物中的用途。本文描述了用于此类用途的合适的cd163抗体(或结合蛋白)。
344.在此描述的本发明的治疗用途的实施例,比照适用于本发明的该方面。
345.在一些实施例中,本发明的抗体可以组合使用。
346.可以使用分别如表a、表b、表c、表d、表e、表f、表g、表h和表i所示的vhh抗体49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)、and144(#1)的任何组合。因此,这些中的2种、3种、4种、5种、6种、7种、8种或全部9种可以组合使用,优选2种或3种,更优选2种。
347.优选的组合包含:
348.70(#23)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
349.144(#1)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
350.150(#15)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种,例如150(#15)和47(#19);
351.76(#2)和70(#23)或144(#1)或150(#15)中的一种或多种,优选一种;
352.77(#16)和70(#23)或144(#1)或150(#15)中的一种或多种,优选一种;
353.49(#18)和70(#23)或144(#1)或150(#15)中的一种或多种,优选一种;
354.47(#19)和70(#23)或144(#1)或150(#15)中的一种或多种,优选一种;
355.48(#20)和70(#23)或144(#1)或150(#15)中的一种或多种,优选一种;或
356.78(#8)和70(#23)或144(#1)或150(#15)中的一种或多种,优选一种。
357.优选的组合包含:
358.76(#2)和150(#15);
359.76(#2)和77(#16);
360.76(#2)和48(#20);
361.150(#15)和77(#16);
362.150(#15)和48(#20);
363.77(#16)和48(#20);或
364.150(#15)和77(#16)和48(#20)。
365.vhh抗体57(#11)、41(#12)、171(#14)和29(#17)的任何组合,分别如表1、表2、表3和表4所示,可用于本发明。因此,可以组合使用2种、3种或所有4种,优选2种或3种,更优选2种。
366.优选的组合包含:
367.57(#11)和41(#12)或29(#17)中的种或多种,优选一种,例如57(#11)和29(#17);
368.171(#14)和41(#12)或29(#17)中的一种或多种,优选一种;
369.41(#12)和57(#11)或171(#14)中的一种或多种,优选一种;或
370.29(#17)和57(#11)或171(#14)中的一种或多种,优选一种。
371.其它组合包括:
372.分别如表a、表b、表c、表d、表e、表f、表g、表h和表i所示的vhh抗体49(#18)、47(#19)、48(#20)、76(#2)、77(#16)、78(#8)、150(#15)、70(#23)或144(#1)中的一种或多种,优选一种与分别如表1、表2、表3和表4所示的vhh抗体57(#11)、41(#12)、171(#14)或29(#17)中的一种或多种,优选一种的任何组合。
373.优选的组合包含:
374.150(#15)和29(#17);
375.47(#19)和29(#17);或
376.144(#1)和29(#17)。
377.其它优选的组合包含:
378.57(#11)和41(#12)或29(#17)中的一种或多种,优选一种;
379.57(#11)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
380.171(#14)和41(#12)或29(#17)中的一种或多种,优选一种;
381.171(#14)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
382.70(#23)和41(#12)或29(#17)中的一种或多种,优选一种;
383.70(#23)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
384.144(#1)和41(#12)或29(#17)中的一种或多种,优选一种;
385.144(#1)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
386.150(#15)和41(#12)或29(#17)中的一种或多种,优选一种;或
387.150(#15)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种。
388.可供选择的优选组合包含:
389.41(#12)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
390.41(#12)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
391.29(#17)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选地一种;或
392.29(#17)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种。
393.可供选择的优选组合包含:
394.76(#2)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
395.76(#2)和41(#12)或29(#17)中的一种或多种,优选一种;
396.77(#16)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
397.77(#16)和41(#12)或29(#17)中的一种或多种,优选一种;
398.49(#18)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
399.49(#18)和41(#12)或29(#17)中的一种或多种,优选一种;
400.47(#19)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
401.47(#19)和41(#12)或29(#17)中的一种或多种,优选一种;
402.48(#20)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
403.48(#20)和41(#12)或29(#17)中的一种或多种,优选一种;
404.78(#8)和57(#11)、171(#14)、70(#23)、144(#1)或150(#15)中的一种或多种,优选地一种;或
405.78(#8)和41(#12)或29(#17)中的一种或多种,优选一种。
406.优选的组合包含:
407.57(#11)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
408.171(#14)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
409.70(#23)和41(#12)或29(#17)中的一种或多种,优选一种;
410.144(#1)和41(#12)或29(#17)中的一种或多种,优选一种;
411.150(#15)和41(#12)或29(#17)中的一种或多种,优选一种;
412.41(#12)和70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
413.41(#12)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
414.29(#17)和70(#23)、144(#1)或150(#15)中的一种或多种,优选一种;
415.29(#17)和76(#2)、78(#8)、77(#16)、49(#18)、47(#19)或48(#20)中的一种或多种,优选一种;
416.76(#2)和57(#11)或171(#14)中的一种或多种,优选一种;
417.76(#2)和41(#12)或29(#17)中的一种或多种,优选一种;
418.77(#16)和57(#11)或171(#14)中的一种或多种,优选一种;
419.77(#16)和41(#12)或29(#17)中的一种或多种,优选一种;
420.49(#18)和57(#11)或171(#14)中的一种或多种,优选一种;
421.49(#18)和41(#12)或29(#17)中的一种或多种,优选一种;
422.47(#19)和57(#11)或171(#14)中的一种或多种,优选一种;
423.47(#19)和41(#12)或29(#17)中的一种或多种,优选一种;
424.48(#20)和57(#11)或171(#14)中的一种或多种,优选一种;
425.48(#20)和41(#12)或29(#17)中的一种或多种,优选一种;
426.78(#8)和57(#11)或171(#14)中的一种或多种,优选一种;或
427.78(#8)和41(#12)或29(#17)中的一种或多种,优选一种。
428.在所有上述组合中,也可以使用具有如表a至表i和表1至4所示的3种cdr的抗体。
429.优选的组合是与作为单一活性剂(单一疗法)或单一抗体或单一抗cd163药剂施用的本发明的任何抗体(例如vhh)相比,导致治疗功效改善或增加,优选显著改善或增加的那些组合。其它优选的组合是组合中的各种抗cd163抗体与cd163分子上的不同表位结合的那些组合。
430.对于使用本发明的两种或多种抗体(或结合蛋白)的这种联合治疗,本发明的第二种(或随后的)抗cd163抗体可以与第一种抗cd163抗体基本上同时施用于受试者,例如来自单一药物组合物或来自一起紧密施用(在相同或相似时间)的两种药物组合物。可替代地,本发明的第二种(或随后的)抗cd163抗体可以在给予本发明的第一种抗cd163抗体之前或之后的时间给予受试者。如本文所用,“在施用前或施用后的时间”是指“交错”,使得施用第二种抗体在与施用第一种抗cd163抗体组分不同的时间施用给受试者。通常,两种(或多种)组分可以有效地间隔开或一起施用以使单种组分发挥它们各自的治疗效果,即它们以“生物有效量”以“生物有效时间间隔”施用并作为同一治疗方案的一部分施用。
431.如果合适,本发明的抗cd163抗体(或结合蛋白)的组合可以方便地作为相同分子或构建体的一部分施用,例如可以缀合或连接在一起,例如用人工接头。这种给药方式可特别适用于vhh抗体(或由单一多肽链组成的其它类型的抗体分子),其单个抗体可方便地通过合适的肽(或其它)接头(例如非天然肽或人工接头)连接在含有本发明的多种vhh(或其它)抗体的单一多肽链中或与其它vhh或其它抗体组合。在这样的实施例中,通常使用适当的技术例如间隔将药剂连接在一起,使得每种组分可以发挥它们各自的作用,例如结合
cd163。例如,在本发明的抗cd163抗体与cd163上的不同表位结合的实施例中,这样的抗体的组合是优选的,并且适当地设计构建体,使得每个单独的抗体可以与cd163结合,例如与其cd163表位结合。
432.因此,在一些实施例中,本发明的抗cd163抗体(或结合蛋白)可以在治疗方案(单一疗法)中用作唯一的活性剂,或本发明的多于一种的抗cd163抗体可以组合使用,例如如上所述。在一些实施例中,本发明的抗cd163抗体(或结合蛋白)(或适当的组合)可以用作治疗方案中的唯一活性抗cd163药剂或唯一活性抗cd163抗体,或者它们可以是治疗方案中的唯一活性抗prrsv药剂。然而,在一些实施例中,可以使用另外的抗cd163试剂或抗prrsv试剂。
433.因此,本发明的抗cd163结合蛋白或抗体(或适当的组合)可以与一种或多种另外的(另外的cd163靶向或非cd163靶向)活性剂组合,例如与至少第二种治疗剂或生物剂组合,其中本发明的抗cd163结合蛋白或抗体(或此类结合蛋白或抗体的组合)是第一种。
434.本发明的抗cd163抗体(或结合蛋白)(或适当时的组合)可以例如与用于治疗本文别处所述的所讨论疾病的任何其它治疗剂例如prrsv组合。
435.对于这样的联合治疗,一般而言,第二种(非本发明的抗cd163抗体)药剂可以与本发明的抗cd163抗体(或此类抗体的组合)基本上同时施用于受试者,例如来自单一药物组合物或来自一起紧密施用(在相同或相似的时间)的两种药物组合物。可替代地,第二种(非本发明的抗cd163抗体)试剂可以在施用本发明的抗cd163抗体组分之前或之后的时间施用给受试者。如本文所用,“在之前或之后的时间”是指“交错”,使得第二种(非本发明的抗cd163抗体)试剂在与施用抗cd163抗体组分不同的时间施用给受试者。通常,两种(或多种)组分可以有效地间隔开或一起施用以使两种组分发挥它们各自的治疗效果,即它们以“生物有效量”以“生物有效时间间隔”施用并作为同一治疗方案的一部分施用。
436.本发明还包括试剂盒,其包含本发明的一种或多种抗体或组合物,或一种或多种编码本发明的抗体的核酸分子,或包含本发明的一种或多种核酸序列的重组表达载体,或包含本发明的一种或多种重组表达载体或核酸序列的宿主细胞或病毒。优选地,所述试剂盒用于本文所述的方法和用途,例如本文所述的治疗方法。优选地,所述试剂盒包含试剂盒组分的使用说明书。优选地,所述试剂盒用于治疗如本文别处所述的疾病或病症,并且任选地包含使用试剂盒组分治疗此类疾病或病症的说明书。还提供了与本发明的结合蛋白等同的实施例。
437.如本文定义的本发明的抗体(或结合蛋白)也可用作体外或体内应用和测定的分子工具。由于抗体(和一些结合蛋白)具有抗原结合位点,因此这些抗体可以充当特异性结合对的成员,并且这些分子可以用于任何需要特定结合对成员的测定中。
438.因此,本发明的其它方面提供了包含如本文所定义的本发明的抗体(或结合蛋白)的试剂,以及此类抗体(或结合蛋白)作为分子工具的用途,例如在体外或体内测定中的用途。
439.本文公开的氨基酸序列的表及它们的序列标识符(seq id no)
440.所有氨基酸序列在本文中按照本技术领域的惯例从n-末端到c-末端列举。
[0441][0442][0443][0444]
[0445][0446][0447][0448]
[0449][0450][0451][0452][0453]
表j-共有序列
[0454][0455][0456][0457]
[0458][0459]
附图说明
[0460]
现在将参考以下附图在以下非限制性实例中进一步描述本发明:
[0461]
图1:在高猪血清存在下阻断1型prrs病毒bor57
[0462]
图a至图i中的数据证明了当在80%猪血清存在下与猪肺泡巨噬细胞一起温育17小时时,候选vhh抗体抑制1型bor57 prrs病毒的生产性病毒感染的能力。在50至400μg/ml的剂量反应范围内评价候选vhh抗体。数据以与模拟物对照相比相对于不存在供试品时的感染的方式显示,以平均值+/-sem(n》3)的形式呈现。
[0463]
图2:在含有10%fbs的培养基中阻断2型prrs病毒mn184
[0464]
数据证明当在10%fbs存在下与猪肺泡巨噬细胞一起温育17小时时,候选vhh抗体抑制2型mn184 prrs病毒的生产性病毒感染的能力。在50至300μg/ml的剂量响应范围内评估候选抗体。数据以与模拟物对照相比相对于不存在供试品时的感染的方式显示,以平均值+/-sem(n》3)的形式呈现。
[0465]
图3:prrs病毒2型特异性vhh抑制抗体阻断1型病毒感染
[0466]
数据证明当在80%猪血清存在下与猪肺泡巨噬细胞一起温育17小时时,候选vhh
7-hufc的抗体滴度。
[0479]
在该elisa中,96孔板(maxisorp;nunc)用重组蛋白包被。封闭并加入稀释的血清样品后,使用小鼠抗骆驼igg2/3(emd微孔;产品编号mac131),随后是抗小鼠免疫球蛋白过氧化物酶缀合物(jir,产品编号715-035-150)来证明抗pcd163抗体的存在。
[0480]
文库构建
[0481]
从3只免疫的美洲驼的pbmc中提取rna(各400ml)。使用随机引物将40μg rna用于cdna合成。使用在前导序列和铰链ch1区退火的未标记引物,将cdna用于一次pcr扩增,然后进行二次pcr扩增,引入限制性内切酶位点用于在pdcl1噬菌粒载体中克隆vhh基因。将文库电穿孔到tg1大肠杆菌细胞中,并将免疫文库的细菌甘油原液储存在-80℃(fl1158和fl1159)。
[0482]
选择
[0483]
在使用pcd163重组蛋白或猪肺泡巨噬细胞(ppam)的连续两轮噬菌体展示选择中使用来自美洲驼vhh文库池的噬菌体生产。使用10μg/ml的pcd163-srcr1-9-hufc或pcd163-srcr4-7-hufc ph 7.4(pbs缓冲液)进行重组蛋白上的选择轮次,洗涤非特异性噬菌体,随后用胰蛋白酶进行特异性噬菌体洗脱(总洗脱)。使用5e106细胞在ph 7.4(pbs缓冲液)进行ppam上的选择轮次,洗涤非特异性噬菌体,然后用胰蛋白酶进行特异性噬菌体洗脱(总洗脱)。对洗脱的噬菌体进行系列稀释并用于感染指数生长的tg1。将感染的tg1铺板在lbcarb100glu 2%板上,并在背景上计算富集值(没有抗原用于选择)。
[0484]
elisa筛选
[0485]
将来自第二轮选择条件输出的单个克隆挑选到96孔主板中,并作为周质提取物(p.e.)通过结合elisa在ph 7.0测试与pcd163-srcr4-7-hufc或pcd163-srcr5-6-hufc蛋白的结合。对于p.e.结合elisa,maxisorp
tm
高蛋白结合能力96孔elisa板用1μg/ml的pcd163-srcr4-7-hufc蛋白包被,在pbs中稀释,在4℃下过夜。第二天,用pbs tween 0.05%(ph 7.4)洗涤板3次,并在室温下用250μl/孔的4%marvel/cpa或4%marvel/pbs封闭1小时。封闭后,用pbs tween 0.05%(ph 7.4)洗涤板3次,并将每孔与20μl的p.e+80μl在1%marvel/pbs(ph 7.4)中在室温下振摇温育1小时。用pbs tween 0.05%(ph 7.4)洗涤板3次,并用100μl的抗c-myc抗体(roche;产品编号11667203001),然后第二抗体dam-hrp(jir;产品编号715-035-150)在1%marvel/pbs(ph7.4)中在室温下振摇温育1小时。用pbs tween 0.05%(ph 7.4)洗涤板3次,并将底物溶液(tmb溶液)加入到板中。用h2so4终止反应,在板读数器中于450nm读板。
[0486]
细胞筛选(facs):
[0487]
将来自所选克隆的周质提取物(p.e)与特异于存在于可溶性vhh中的c-myc标签的抗c-myc抗体(roche;产品编号11667203001)在室温(rt)下搅拌温育30分钟。将混合物(p.e+抗c-myc抗体)添加至ppam或ppamδ5结构域(缺失srcr结构域5的细胞),并且在4℃下伴随温和振摇温育60分钟。
[0488]
将细胞用150μl/孔的facs缓冲液洗涤3次,并与50μl/孔的第二抗体gam-apc在4℃温育30分钟,并避光振摇。
[0489]
将细胞用150μl/孔的facs缓冲液洗涤3次,并重悬于75μl/孔的facs缓冲液中,以在facs机器(attune
tm
nxt)中在rl-1通道(apc通道)中进行测量,并且每种样品总共获取
10000个细胞。
[0490]
测序
[0491]
阳性结合物被送去测序。根据不同的hcdr3序列将克隆按家族分类。
[0492]
结果与讨论:
[0493]
表5:elisa结合数据总结
[0494][0495]
表6:通过流式细胞术评估候选物与原代肺泡巨噬细胞的结合
[0496][0497]
用重组cd163免疫美洲驼后,通过2轮噬菌体淘选来筛选噬菌体克隆。与对照人igg相比,由elisa通过结合重组cd163表达构建体(pcd163srcr1-9-fc或pcd163-srcr4-7-fc)证实噬菌体候选物。如表5所示,几种候选物表现出与猪cd163的选择性结合。
[0498]
进一步筛选克隆结合分离的原代猪肺泡巨噬细胞上天然膜结合的cd163的能力,所述分离的原代猪肺泡巨噬细胞从来自供体动物的支气管肺泡灌洗回收的细胞制备(burkard c.等人,《公共科学图书馆-病原体(plos pathogens)》2017)。当cd163受体更可能被内吞机制内化时,证明候选噬菌体在4℃以及室温下结合天然膜结合cd163。
[0499]
还通过选择不能结合分离自猪的猪肺泡巨噬细胞的候选物来评估所有候选物与cd163的srcr5结构域的选择性结合,所述猪肺泡巨噬细胞在cd163基因中具有该结构域的缺失。(burkard c.等人,《公共科学图书馆-病原体(plos pathogens)》2017)。所有选择的
候选物不能结合从这些动物分离的pam,因此证明优先结合猪cd163的srcr5结构域。
[0500]
因此,用重组cd163蛋白构建体对美洲驼进行免疫导致成功分离能够与在原代猪肺泡巨噬细胞上表达的cd163结合的候选噬菌体抗体,其特异性靶向srcr5结构域,已知其对于这些细胞prrs病毒感染是必需的。
[0501]
参考文献:
[0502]
burkard c、lillico sg、reid e、jackson b、mileham aj、ait-ali t等人,(2017),猪prrsv抗性的精确工程:来自缺乏cd163 srcr5结构域的基因组编辑猪的巨噬细胞完全耐受两种prrsv基因型,同时保持生物功能。《公共科学图书馆-病原体(plos pathogens)》13(2):e1006206.doi:10.1371/journal.ppat.1006206
[0503]
实例2:抗cd163 vhh抗体对猪cd163的亲和力测定
[0504]
材料和方法:
[0505]
通过表面等离子体共振测定每种鉴定的vhh抗体候选物对猪cd163的结合亲和力。
[0506]
vhh候选抗体的表达和纯化
[0507]
购买了编码具有flag和his标签的vhh可变结构域的合成基因,并根据制造商的说明书重构。将每个dna构建体用限制酶消化,对插入物进行凝胶纯化,并将每个可变结构域插入物与哺乳动物表达载体pcdna3.1连接。使用40μg的总dna质粒构建体,用23个前导区序列转染expicho-s细胞。将25ml总体积的细胞用于8天蛋白质生产(32℃,5%co2)。在pure 25fplc系统上使用histrap hp 5ml imac柱(ge healthcare,产品编号17-5248-02)从澄清的上清液中捕获产生的vhh抗体。将洗脱的抗体峰级分缓冲液更换为1x pbs ph 7.4,并使用3kda mco旋转浓缩器(amicon,产品编号ufc900324)浓缩。通过分析大小排阻层析(asec)和sds-page来分析纯化的蛋白质是否存在正确的链。
[0508]
亲和力测定
[0509]
为了评价所选择的纯化的克隆对pcd163的亲和力,将pcd163-srcr1-9-hufc或pcd163-srcr4-7-hufc蛋白通过胺偶联包被在cm5传感载体(ge healthcare)上。使用表面胞质团共振(spr)(biacore 3000,ge healthcare)来确定所选单结构域抗体在ph7.4下的结合动力学。使用标准胺偶联程序将ph 5.0或ph 5.5的乙酸盐缓冲液中20或30μg/ml的约2000ru的pcd163-srcr1-9-hufc或pcd163-srcr4-7-hufc蛋白质固定到cm5芯片上。固定的qc使用商品化的抗hufc抗体(jir,产品编号109-005-098)进行,浓度为30.0μg/ml。
[0510]
在结合动力学测量期间使用1x hbs-ep ph 7.4作为运行缓冲液。以3倍稀释度(300nm;100nm;33nm;11nm;3.7nm;1.2nm;0.4nm;0nm)注射纯化vhh,持续120s,流速为30μl/min。在样品之间用10μl的10mm naoh/1m nacl和10μl的10mm甘氨酸ph 1.5再生后,ru水平恢复至基础水平。使用biaevaluation软件的同时拟合选项将1:1结合与质量转移拟合应用于设定的样品曲线,以计算抗体-抗原相互作用的动力学常数,包括缔合速率(ka)、解离速率(kd)和亲和力(kd)。在目视检查残留物并考虑chi2的值后,从拟合中删除曲线:同时拟合最少考虑4条曲线。
[0511]
结果与讨论:
[0512]
表7:vhh对猪cd163的亲和力测定
[0513][0514]
如上所述,噬菌体候选物作为vhh表达和纯化。如上文所述,通过表面等离子共振来表征每个vhh与cd163的全长或截短形式的结合。测定每种抗体的结合速率和解离速率并计算亲和力测定。如表7所示,抗体候选物的kd值在1至75nm之间。对全长或截短的pcd163-srcr4-7构建体的相对亲和力大致相似。
[0515]
实例3:候选cd163特异性候选抗体抑制原代猪肺泡巨噬细胞的猪呼吸和生殖(prrs)病毒感染
[0516]
材料和方法:
[0517]
prrs病毒感染方案
[0518]
试剂
[0519]
vhh候选抗体以1mg/ml的浓度等分。
[0520]
对照抗体:
[0521]
第一抗体:抗prrs 1ac7,ingenasa
[0522]
第二抗体:山羊抗小鼠igg(h+l)alexa fluor plus 488,thermofisher,a32723
[0523]
培养基:
[0524]
完全rpmi(10%fbs或80%(高)猪血清,ultraglutamine,pen/strep)
[0525]
pam分离:如burkard等人,《公共科学图书馆-病原体(plos pathogens)》2017所述进行猪肺泡巨噬细胞分离。
[0526]
病毒分离物:
[0527]
1型病毒:bor57分离物(英国爱丁堡的罗斯林研究所(roslin institute,edinburgh,uk))
[0528]
2型病毒:mn184美国品系(han等人,2006)
[0529]
感染方案
[0530]
第1天-种子细胞
[0531]
将猪肺泡巨噬细胞以2000万/板接种在48孔板中的完全rpmi中,并在co2培养箱中放置过夜。
[0532]
第2天-vhh治疗和感染攻击
[0533]
1.预处理(感染前30分钟)
[0534]
a.从细胞中吸出培养基
[0535]
b.将100μl培养基添加至未处理的未感染对照和未处理的被感染对照
[0536]
c.将100μl培养基中的20μl pbs添加至模拟物处理的被感染对照
[0537]
d.在100μl培养基中添加适量的vhh原液至经处理的被感染的样品
[0538]
e.将板放回co2培养箱30分钟
[0539]
2.解冻病毒原液并在使用前超声处理15秒
[0540]
3.感染攻击(2小时)
[0541]
a.从细胞中取出培养基并保存含vhh的培养基用于过夜温育步骤
[0542]
b.将100μl培养基添加至未处理的未感染对照
[0543]
c.将100μl培养基中的10μl病毒添加至未处理的被感染对照
[0544]
d.将100μl培养基中的10μl病毒加上20μl pbs添加至模拟物处理的被感染对照
[0545]
e.将适量的vhh原液和100μl培养基中的10μl病毒添加至经处理的被感染的样品
[0546]
f.轻轻搅拌平板并返回co2培养箱
[0547]
g.每15分钟轻轻搅拌平板2小时
[0548]
4.温育过夜(15小时)
[0549]
a.从细胞中吸出培养基
[0550]
b.将100μl培养基添加至未处理的未感染对照和未处理的被感染对照
[0551]
c.将100μl培养基中的20μl pbs添加至模拟物处理的被感染对照
[0552]
d.将预处理步骤中保留的含vhh培养基添加到适当样品中
[0553]
e.将板放回co2培养箱15小时
[0554]
第3天-孔内固定和染色方案
[0555]
5.从细胞抽吸培养基
[0556]
6.在室温下将细胞固定在4%甲醛/pbs++(含钙和镁)溶液中30分钟
[0557]
7.用pbs++洗涤一次
[0558]
8.用triton-x(1%,pbs++中)在室温下透化5分钟
[0559]
9.用ppbs++或阻断溶液(pbs++/5%fbs)洗涤一次
[0560]
10.在室温下用封闭溶液(pbs++/5%fbs)封闭20分钟
[0561]
11.将第一抗体抗prrs 1ac7以1:5000将加入除未染色对照和仅第二抗体的对照以外的所有孔中
[0562]
12.室温温育1小时
[0563]
13.用pbs++洗涤三次
[0564]
14.将第二抗体山羊抗小鼠igg(h+l)alexa fluor plus 488以1:5000加入除未染色对照以外的所有孔中。
[0565]
15.在室温下温育45分钟
[0566]
16.用pbs++洗涤三次
[0567]
17.加入300μl pbs++
[0568]
18.用宽孔p200移液管尖端刮擦细胞,然后用正常p200尖端刮擦孔边缘周围,然后用p1000洗涤孔表面3次,收集细胞转移到facs管中。
[0569]
19.在fortessa x20上进行测量(电压:fsc=418,ssc=308&b530-30=386)
[0570]
结果和讨论:
[0571]
下面描述单种vhh阻断prrs病毒家族成员感染pam宿主细胞的能力。如上所述的测定用于测量病毒感染的程度,如通过在17小时感染周期后通过facs测量的传播病毒的能力所定量的。所提供的数据示于图1和图2中并总结于下表8中。
[0572]
表8:阻断prrs病毒感染
[0573][0574]
n.d.-未确定
[0575]
数据清楚地显示vhh能够抑制1型(也参见图1)和2型(也参见图2)prrs同种型对猪肺泡巨噬细胞的生产性感染。在感染试验中显示出活性的vhh可分为对1型和2型病毒感染均有效的vhh(vhh 001、002、008、015、016、018、019、020和023),以及对1型prrs病毒感染不显示任何抑制活性但对2型prrs病毒感染显示选择性抑制活性的vhh(vhh 011、012、014、017)。数据清楚地显示vhh能够抑制1型和2型prrs同种型对猪肺泡巨噬细胞的生产性感染。
[0576]
在高达300μg/ml的浓度范围内,一些vhh仅在2型病毒感染中显示抑制活性(vhh 011、012、014、017)(图2)。这些候选vhh显示出对2型prrs病毒的特异性,并且在1型病毒感染测定中在高达100μg/ml的类似剂量反应浓度范围内不显示任何抑制活性(图3)。
[0577]
参考文献:
[0578]
burkard c.等人,猪prrsv抗性的精确工程:来自缺乏cd163 srcr5结构域的基因组编辑猪的巨噬细胞完全耐受两种prrsv基因型,同时保持生物功能。《公共科学图书馆-病原体(plos pathogens)》,13(2)2017:e1006206
[0579]
han j,y.wang,k.s.faaberg。猪繁殖和呼吸综合征病毒的rflp 184分离物的完整基因组分析,《病毒研究(virus research)》,122(2006),第175页。
[0580]
实例4:候选cd163特异性候选抗体组合抑制原代猪肺泡巨噬细胞的猪呼吸和生殖(prrs)病毒感染
[0581]
材料和方法:
[0582]
prrs病毒感染方案
[0583]
试剂
[0584]
vhh候选抗体以1mg/ml的浓度等分。
[0585]
对照抗体:
[0586]
第一抗体:抗prrs 1ac7,ingenasa
[0587]
第二抗体:山羊抗小鼠igg(h+l)alexa fluor plus 488,thermofisher,a32723
[0588]
培养基:
[0589]
完全rpmi(10%fbs或80%高猪血清,ultraglutamine,pen/strep)
[0590]
pam分离:如burkard等人,《公共科学图书馆-病原体(plos pathogens)》2017所述进行猪肺泡巨噬细胞分离。
[0591]
病毒分离物:
[0592]
1型病毒:bor57分离物(英国爱丁堡的罗斯林研究所(roslin institute,edinburgh,uk))
[0593]
2型病毒:mn184美国品系(han等人,2006)
[0594]
感染方案
[0595]
第1天-种子细胞
[0596]
将猪肺泡巨噬细胞以2000万/板接种在48孔板中的完全rpmi中,并在co2培养箱中放置过夜。
[0597]
第2天-vhh治疗和感染攻击
[0598]
1.预处理(感染前30分钟)
[0599]
a.从细胞中吸出培养基
[0600]
b.将100μl培养基添加至未处理的未感染对照和未处理的被感染对照
[0601]
c.将100μl培养基中的20μl pbs添加至模拟物处理的被感染对照
[0602]
d.在100μl培养基中添加适量的vhh原液至经处理的被感染的样品
[0603]
e.将板放回co2培养箱30分钟
[0604]
2.解冻病毒原液并在使用前超声处理15秒
[0605]
3.感染攻击(2小时)
[0606]
a.从细胞中取出培养基并保存含vhh的培养基用于过夜温育步骤
[0607]
b.将100μl培养基添加至未处理的未感染对照
[0608]
c.将100μl培养基中的10μl病毒添加至未处理的被感染对照
[0609]
d.将100μl培养基中的10μl病毒加上20μl pbs添加至模拟物处理的被感染对照
[0610]
e.将适量的单独vhh原液(或vhh组合)和100μl培养基中的10μl病毒添加到经处理的被感染样本
[0611]
f.轻轻搅拌平板并返回co2培养箱
[0612]
g.每15分钟轻轻搅拌平板2小时
[0613]
4.温育过夜(15小时)
[0614]
a.从细胞中吸出培养基
[0615]
b.将100μl培养基添加至未处理的未感染对照和未处理的被感染对照
[0616]
c.将100μl培养基中的20μl pbs添加至模拟物处理的被感染对照
[0617]
d.将预处理步骤中保留的含vhh培养基添加到适当样品中
[0618]
e.将板放回co2培养箱15小时
[0619]
第3天-孔内固定和染色方案
[0620]
5.从细胞抽吸培养基
[0621]
6.在室温下将细胞固定在4%甲醛/pbs++(含钙和镁)溶液中30分钟
[0622]
7.用pbs++洗涤一次
[0623]
8.用triton-x(1%,pbs++中)在室温下透化5分钟
[0624]
9.用ppbs++或阻断溶液(pbs++/5%fbs)洗涤一次
[0625]
10.在室温下用封闭溶液(pbs++/5%fbs)封闭20分钟
[0626]
11.将第一抗体抗prrs 1ac7以1:5000将加入除未染色对照和仅第二抗体的对照以外的所有孔中
[0627]
12.室温温育1小时
[0628]
13.用pbs++洗涤三次
[0629]
14.将第二抗体山羊抗小鼠igg(h+l)alexa fluor plus 488以1:5000加入除未染色对照以外的所有孔中。
[0630]
15.在室温下温育45分钟
[0631]
16.用pbs++洗涤三次
[0632]
17.加入300μl pbs++
[0633]
18.用宽孔p200移液管尖端刮擦细胞,然后用正常p200尖端刮擦孔边缘周围,然后用p1000洗涤孔表面3次,收集细胞转移到facs管中
[0634]
19.在fortessa x20上进行测量(电压:fsc=418,ssc=308&b530-30=386)
[0635]
结果和讨论:
[0636]
下面描述单种vhh阻断prrs病毒家族成员感染pam宿主细胞的能力。如上所述的测定用于测量病毒感染的程度,如通过在17小时感染周期后通过facs测量的传播病毒的能力所定量的。所呈现的数据在图4和图5中示出。
[0637]
vhh 15、16和20的组合用于在含有10%fbs的培养基存在下使用bor57 1型prrs病毒进行感染测定。vhh 15和vhh 16、vhh 15和vhh 20、vhh16和vhh20各100μg的特定组合以及vhh 15+vhh 16+vhh 20各50μg的三重组合显示出可将1型prrs病毒的感染潜力降低至极低水平的感染性(参见图4)。
[0638]
在含有10%fbs的培养基存在下使用bor57 1型prrs病毒在感染测定中研究不同vhh成对组合的潜力。vhh02(01b04)作为配偶体与vhh15(02g01)、vhh16(02h11)和vhh20(03h11)一起使用以评估阻断感染的潜力。在各配偶体vhh浓度增加的情况下测试组合。数据表明vhh的组合可用于阻断1型prrs病毒感染(参见图5)。
[0639]
数据显示vhh的组合能够增强1型prrs同种型对猪肺泡巨噬细胞的生产性感染的抑制,其程度可能大于单独的vhh候选物。数据表明,可以组合单独的vhh以增强prrs病毒家族成员感染的潜在阻断。
[0640]
参考文献:
[0641]
burkard c.等人,同上;han j、y.wang、k.s.faaberg,同上。
[0642]
实例5:抗cd163 vhh抗体与猪cd163 srcr5结合的测定
[0643]
材料和方法:
[0644]
测定与vhh抗体候选物2d01(vhh14)结合的猪cd163 srcr5结构域的x射线晶体学结构。
[0645]
vhh14抗体的表达和纯化
[0646]
购买了编码具有flag和his标签的vhh可变结构域的合成基因,并根据制造商的说明书重构。将每个dna构建体用限制酶消化,对插入物进行凝胶纯化,并将每个可变结构域插入物与哺乳动物表达载体pcdna3.1连接。使用40μg的总dna质粒构建体,用23个前导区序列转染expicho-s细胞。将25ml总体积的细胞用于8天蛋白质生产(32℃,5%co2)。在pure 25fplc系统上使用histrap hp 5ml imac柱(ge healthcare,产品编号17-5248-02)从澄清的上清液中捕获产生的vhh抗体。将洗脱的抗体峰级分缓冲液更换为1x pbs ph 7.4,并使用3kda mco旋转浓缩器(amicon,产品编号ufc900324)浓缩。通过分析大小排阻层析(asec)和sds-page来分析纯化的蛋白质是否存在正确的链。
[0647]
猪srcr5的表达和纯化
[0648]
将编码具有^x his标签的猪cd163 srcr5区的合成基因亚克隆到ptxbac1(专有载体)中,然后转化到大肠杆菌dh10bac中以产生重组杆状病毒质粒。重组杆状病毒质粒用于转化草地夜蛾(spodoptera frugiperda,sf)细胞以产生p1病毒克隆。对来自p1克隆的细胞和培养基样品的蛋白质表达进行常规检查以鉴定高表达克隆。通过用p1病毒原液感染sf细胞来扩增高表达克隆,以产生p2病毒原液,随后用于以感染复数(moi)~1在72小时期间内在sf1细胞中表达重组srcr5蛋白。
[0649]
在sf细胞的10l培养物中进行生产放大。如上所述使用最佳表达条件。在通过标准方案使用imac上的his标签纯化之前,用磷酸盐缓冲盐水(pbs)ph 7.5平衡培养上清液。用pbs ph 7.5和0.1%triton x-114缓冲液洗涤样品。根据制造商的说明书用咪唑洗脱蛋白质。洗脱的样品用ph7.5的pbs缓冲液进行交换,然后在钴-树脂上进一步纯化。洗涤(如上所述)后使用咪唑转移洗脱样品。将所得洗脱样品缓冲液更换为20mm tris-hcl,ph 7.4,150mm nacl。
[0650]
表9:
[0651][0652]
结晶&x射线结构测定研究
[0653]
cd163 srcr5:在pbs ph 7.4缓冲液中制备浓度为11.84mg/ml的vhh14复合物。在0.2m nacl,0.1m磷酸盐/柠檬酸盐ph 4.5,20%w/v peg 8000中生长。在加入含有以下物质的冷冻溶液后,将各种晶体在液氮中快速冷冻:0.14m nacl,0.07m磷酸盐/柠檬酸盐缓冲液ph 4.5,13.9%peg 8000和46%乙二醇。
[0654]
在100k下在瑞典max iv的biomax光束线上收集数据光束线配备有eiger 16m混合像素检测器。
[0655]
使用phaser软件和两种同源蛋白(pdb代码:5da4和5jfb)确定结构,分别测定为和可以模拟cd163 srcr5结构域的103种氨基酸(粗体表9)和vhh014(02d01)的122种氨基酸,以粗体向前标记残基4(表9)。
[0656]
结果与讨论:
[0657]
cd163 srcr5的结构:vhh014复合物揭示了与单一单体vhh014抗体(右侧)相互作用的单一单体srcr5结构域(左侧),如图6所示。电子密度图揭示了vhh014中的残基和cd163:srcr5结构域中鉴定的氨基酸之间的特异性相互作用。特别地,根据vhh14的cdr2中的xyad/e/n基序,猪cd163 srcr5结构域内的亮氨酸526和亮氨酸527似乎与特定的保守残基形成相互作用,该基序在鉴定的所有vhh候选物之间共享。vhh14(02d01)是令人感兴趣的,因为它不抑制1型prrs病毒的感染,但能够减少2型prrs家族病毒的感染。在猪cd163 srcr5中鉴定的二亮氨酸基序可以代表对于2型prrs病毒与srcr5的相互作用和猪肺泡巨噬细胞的生产性感染非常重要的特征。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1