25-羟基二氢速甾醇关键中间体的有关物质及其制备方法与流程
1.本发明涉及一种25-羟基二氢速甾醇关键中间体的有关物质及其制备方法。
背景技术:
2.在过去的几十年里,维生素d在化学和生化方面受到了相当大的关注,维生素d及其类似物已用于治疗骨质疏松症、继发性甲状旁腺功能亢进症、银屑病等。25-羟基二氢速甾醇(25-oh-dht2)作为一种维生素d类似物,具有与维生素d相似的药理活性,其合成方法现已有不同的文献报道,但其有关物质暂未见文献与专利报道。
[0003][0004]
25-oh-dht2的合成路线如tetrahedron 1992,48,42,9283-9294所述,其中(1s,3ar,4s,7ar)-1-((5s,e)-6-羟基-5,6-二甲基庚-3-烯-2-基)-7a-甲基八氢-1h-茚-4-醇(化合物1)除作为合成25-oh-dht2的关键中间体外,在多种维生素d类似物的合成过程中都需使用,其结构如下式1所示。
[0005][0006]
出于人用药安全考虑,在药物活性成分的产品商业化之前,国内和国际药品监管机构都会建立很低的未知杂质质控限度。通常已知杂质的质控限度为0.15%,未知杂质的质控限度通常会小于0.10%,因此在原料药的制备过程中产品的纯度非常重要。在关键中间体中确定关键的杂质,并把杂质的量控制在一定的范围内,对产品质量的控制至关重要,如果能合成出杂质对照品确定出未知杂质的结构对于药品的注册申报将更加有利。
技术实现要素:
[0007]
本发明所要解决的技术问题是克服现有技术中缺少化合物1的质量控制方法和纯化方法,其可能影响25-oh-dht2最终产品质量,从而本技术提供了一种化合物1的有关物质
及其制备方法,进一步还提供了化合物1的纯化方法和检测方法。
[0008]
发明人在采用文献tetrahedron 1992,48,42,9283-9294报道的方法合成化合物1的过程中,发现得到的化合物1产品中含有如下式所示的化合物2杂质。化合物2与化合物1的结构十分的相似,具有相同的反应位点,会按照tetrahedron 1992,48,42,9283-9294中的反应路线,在各步反应中产生相应的杂质,最终在产品中产生侧链脱羟基的25-oh-dht2杂质。在以后的中间体和产品中,杂质和产品的相似度越来越高,分离杂质和纯化产品也将越来越困难,该杂质化合物2的存在,将影响最终药物的产品质量和安全性。所以在关键中间体化合物1中确定杂质化合物2的结构,并用高效的方法将该杂质去除,将提高最终产品、关键中间体化合物、以及以后各步中间体的质量,对整个合成工艺来说是至关重要的。
[0009][0010]
本发明提供一种化合物2:
[0011][0012]
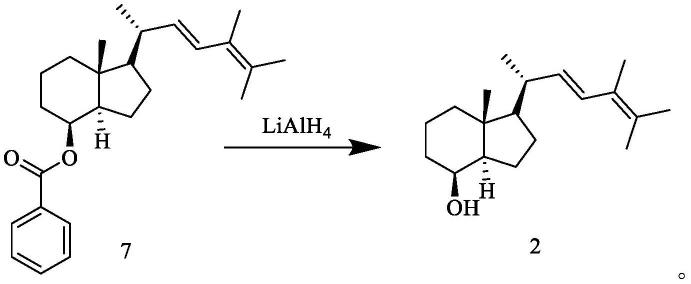
本发明提供了一种化合物2的制备方法,其包括如下步骤:在溶剂中,将化合物7在还原剂存在的条件下进行如下所示的还原反应,得到所述化合物2;
[0013][0014]
所述还原反应的条件可以为本领域该类型反应的常规条件。
[0015]
本发明一些实施方案中,所述的还原反应中,所述溶剂为四氢呋喃。
[0016]
本发明一些实施方案中,所述的还原反应中,所述还原剂为氢化铝锂。
[0017]
本发明一些实施方案中,所述的还原反应中,所述还原剂与化合物1的摩尔比为1.2:1~3:1(例如2:1)。
[0018]
本发明一些实施方案中,所述的还原反应的反应温度为20℃~30℃。
[0019]
所述的还原反应的进程可采用本领域中的常规测试方法(如tlc)进行监控,本领域技术人员可依据监测结果(包括原料转化程度、杂质生成情况等)确定何时终止反应,以获得较佳的反应结果。所述的还原反应的反应时间可以为2~10小时。
[0020]
所述的还原反应完成后,还可以进一步包括后处理步骤,例如:向反应液中加入氯化铵溶液淬灭,萃洗,有机相干燥,除去溶剂得到化合物2粗品。可以将化合物2粗品进行柱层析纯化以得到化合物2纯品。
[0021]
所述化合物2的制备方法可以进一步包括如下步骤:在溶剂中,将化合物5与化合物6在碱性试剂存在的条件下进行如下所示的wittig反应,得到所述化合物7;
[0022][0023]
所述wittig反应的条件可以为本领域该类型反应的常规条件。
[0024]
本发明一些实施方案中,所述的wittig反应中,所述溶剂为四氢呋喃。
[0025]
本发明一些实施方案中,所述的wittig反应中,所述碱性试剂为苯基锂。
[0026]
本发明一些实施方案中,所述的wittig反应中,所述化合物5与化合物6的摩尔比为1:1~1.2:1(例如1.1:1)。
[0027]
本发明一些实施方案中,所述的wittig反应中,所述碱性试剂与化合物6的摩尔比为1:1~1.2:1(例如1.1:1)。
[0028]
本发明一些实施方案中,所述的wittig反应的反应温度为-20℃~-40℃(例如-30℃)。
[0029]
所述的wittig反应的进程可采用本领域中的常规测试方法(如tlc)进行监控,本领域技术人员可依据监测结果(包括原料转化程度、杂质生成情况等)确定何时终止反应,以获得较佳的反应结果。所述的wittig反应的反应时间可以为2~10小时。
[0030]
所述的wittig反应完成后,还可以进一步包括后处理步骤,例如:将反应液进行萃洗,有机相干燥,除去溶剂得到化合物7粗品。化合物7粗品可以不经纯化直接用于下一步反应。
[0031]
本发明还提供了一种化合物7:
[0032]
[0033]
本发明还提供了一种化合物7的制备方法,其包括如下步骤:在溶剂中,将化合物5与化合物6在碱性试剂存在的条件下进行如下所示的wittig反应,得到所述化合物7;
[0034][0035]
所述的化合物7的制备方法中,所述wittig反应的条件均可以如上所述。
[0036]
本发明还提供了一种化合物1的纯化方法,其包括如下步骤:将待纯化的化合物1产品采用降温结晶法进行重结晶,得到纯化后的化合物1产品;所述重结晶的溶剂为正己烷、“正己烷与二氯甲烷的混合溶剂(例如正己烷:二氯甲烷体积比为9:1的混合溶剂)”、“正己烷与乙酸乙酯的混合溶剂(例如正己烷:乙酸乙酯体积比为9:1的混合溶剂)”、异丙醚或甲基叔丁基醚,优选为异丙醚;
[0037][0038]
本发明还提供了一种化合物1产品或其有关物质的检测方法,其包括如下步骤:将化合物1产品进行色谱分析,其中固定相为c18键合硅胶,流动相:a为乙腈:甲醇=75:25;b:含0.1%磷酸的乙腈:水=10:90;a:b=60:40,溶剂比例均为体积比;
[0039][0040]
在一些实施方案中,所述的检测方法中,所述的有关物质为
[0041][0042]
在一些实施方案中,所述的检测方法中,所述的色谱分析使用thermo acclaim
tm 120c18色谱柱。
[0043]
在一些实施方案中,所述的检测方法中,所述的色谱分析的检测波长为200nm。
[0044]
在一些实施方案中,所述的检测方法中,所述的色谱分析的条件包括:
[0045]
色谱柱:thermo acclaim
tm 120c18,5μm,4.6x 250mm;
[0046]
柱温:30℃
[0047]
流动相:a为乙腈:甲醇=75:25;b:含0.1%磷酸的乙腈:水=10:90;a:b=60:40,溶剂比例均为体积比;
[0048]
流速:1ml/min
[0049]
检测波长:200nm
[0050]
进样体积:10μl。
[0051]
本发明还提供了一种化合物5的制备方法,其包括如下步骤:在溶剂中,将化合物4与三苯基膦进行如下所示的亲核取代反应,得到所述的化合物5;所述的溶剂为乙腈、丙酮和乙酸乙酯中的一种或多种;
[0052][0053]
所述亲核取代反应的条件可以为本领域该类型反应的常规条件。
[0054]
本发明一些实施方案中,所述的亲核取代反应中,所述的溶剂优选为丙酮和/或乙酸乙酯,进一步优选为乙酸乙酯。
[0055]
本发明一些实施方案中,所述的亲核取代反应中,所述三苯基膦与化合物4的摩尔比为1.5:1~4:1(例如2:1、3:1或3.5:1,优选为3:1或3.5~1)。
[0056]
本发明一些实施方案中,所述的亲核取代反应中,所述的溶剂为丙酮和/或乙酸乙酯,进一步优选为乙酸乙酯;
[0057]
所述三苯基膦与化合物4的摩尔比为3:1~3.5:1。
[0058]
本发明一些实施方案中,所述的亲核取代反应的反应温度为溶剂回流温度。
[0059]
所述的亲核取代反应的进程可采用本领域中的常规测试方法(如tlc)进行监控,本领域技术人员可依据监测结果(包括原料转化程度、杂质生成情况等)确定何时终止反应,以获得较佳的反应结果。所述的亲核取代反应的反应时间可以为20~30小时。
[0060]
所述的亲核取代反应完成后,还可以进一步包括后处理步骤,例如:将反应液蒸除溶剂,乙醚打浆,滤出固体,得到所述的化合物5。
[0061]
所述的化合物5的制备方法还可以进一步包括如下步骤:在溶剂中,将化合物3与i2在三苯基膦和咪唑的存在下进行如下所示的碘代反应,得到所述的化合物4;
[0062][0063]
所述碘代反应的条件可以为本领域该类型反应的常规条件。
[0064]
本发明一些实施方案中,所述的碘代反应在避光条件下进行。
[0065]
本发明一些实施方案中,所述的碘代反应中,所述溶剂为二氯甲烷、四氢呋喃、甲
苯和乙腈中的一种或多种,优选为二氯甲烷、四氢呋喃和乙腈中的一种或多种,进一步优选为乙腈和/或四氢呋喃,进一步优选为四氢呋喃。
[0066]
本发明一些实施方案中,所述的碘代反应中,所述i2与化合物3的摩尔比为1:1~1.5:1(例如1:1、1.2:1或1.5:1)。
[0067]
本发明一些实施方案中,所述的碘代反应中,所述三苯基膦与i2的摩尔比为1:1~1.2:1(例如1:1)。
[0068]
本发明一些实施方案中,所述的碘代反应中,所述咪唑与i2的摩尔比为1:1~1.5:1(例如1.2:1~1.3:1,例如1.25:1)。
[0069]
本发明一些实施方案中,所述的碘代反应中,所述三苯基膦、咪唑、i2与化合物3的摩尔比为1.2:1.5:1.2:1。
[0070]
本发明一些实施方案中,所述的碘代反应的反应温度为溶剂回流温度。
[0071]
所述的碘代反应的操作可以包括如下步骤:将三苯基膦、咪唑、i2和溶剂的混合液避光搅拌(例如30分钟),降温,然后向其中滴加化合物3与溶剂的混合液,滴加完毕后进行反应。
[0072]
所述的碘代反应的进程可采用本领域中的常规测试方法(如tlc)进行监控,本领域技术人员可依据监测结果(包括原料转化程度、杂质生成情况等)确定何时终止反应,以获得较佳的反应结果。所述的碘代反应的反应时间可以为30分钟~1小时。
[0073]
所述的碘代反应完成后,还可以进一步包括后处理步骤,例如:将反应液经硅胶过滤,硅胶层用正己烷冲洗,所得滤液除去溶剂后进行柱层析得到所述的化合物5;或者,将反应液经硅胶过滤,硅胶层用正己烷冲洗,所得滤液经硫代硫酸钠溶液、水洗、饱和食盐水萃洗后,干燥,浓缩至干;将浓缩物用甲基叔丁基醚打浆,所得滤液浓缩至干得到所述的化合物5。
[0074]
本发明还提供了一种化合物4的制备方法,其包括如下步骤:在溶剂中,将化合物3与i2在三苯基膦和咪唑的存在下进行如下所示的碘代反应,得到所述的化合物4;
[0075][0076]
所述的化合物4的制备方法中,所述碘代反应的条件均可以如上所述。
[0077]
在不违背本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0078]
本发明所用试剂和原料均市售可得。
[0079]
本发明的积极进步效果在于:提供了一种化合物1的有关物质、检测方法和纯化方法,以及该有关物质的制备方法、中间体及其应用,有利于化合物1及25-oh-dht2产品的质量控制。
附图说明
[0080]
图1为化合物1粗品在一般hplc检测条件下的检测结果。
[0081]
图2为化合物1粗品在改进后的hplc检测条件下的检测结果。
[0082]
图3为实施例4中纯化后的化合物1的hplc检测结果。
[0083]
图4为实施例19中制备的化合物2的hplc检测结果。
具体实施方式
[0084]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0085]
1、以下实施例中化合物1粗品采用文献tetrahedron 1992,48,42,9283-9294报道的方法合成。
[0086]
采用hplc检测化合物1粗品的纯度,测试条件如下:
[0087]
色谱柱:thermo acclaim
tm 120c18,5μm,4.6x 250mm
[0088]
柱温:30℃
[0089]
流动相:a:乙腈:甲醇=75:25,b:10%的乙腈(含0.1%磷酸)+90%的水。a:b=55:45。
[0090]
流速:1ml/min
[0091]
检测波长:200nm
[0092]
进样体积:10μl
[0093]
检测结果如下表和图1所示。
[0094][0095]
2、本发明化合物1改进后的hplc条件:
[0096]
色谱柱:thermo acclaim
tm 120c18,5μm,4.6x 250mm
[0097]
柱温:30℃
[0098]
流动相:a:乙腈:甲醇=75:25,b:10%的乙腈(含0.1%磷酸)+90%的水;a:b=60:40。
[0099]
流速:1ml/min
[0100]
检测波长:200nm
[0101]
进样体积:10μl
[0102]
检测结果如下表和图2所示。
[0103]
[0104]
3、本发明的化合物1的纯化方法
[0105]
以下实施例对化合物1粗品进行纯化后,均采用改进后的hplc条件进行检测。
[0106]
实施例1:化合物1的纯化
[0107]
将化合物1粗品约1.0g溶于30ml正己烷中,升温至回流,自然降至室温析晶,抽滤,减压干燥得化合物1约0.97g,hplc纯度96.8%。
[0108]
实施例2:化合物1的纯化
[0109]
将化合物1粗品约1.0g溶于20ml正己烷:二氯甲烷=9:1的溶剂中,升温至回流,自然降至室温析晶,抽滤,减压干燥得化合物1约0.89g,hplc纯度97.2%。
[0110]
实施例3:化合物1的纯化
[0111]
将化合物1粗品约1.0g溶于20ml正己烷:乙酸乙酯=9:1的溶剂中,升温至回流,自然降至室温析晶,抽滤,减压干燥得化合物1约0.83g,hplc纯度98.5%。
[0112]
实施例4:化合物1的纯化
[0113]
将化合物1粗品约1.0g溶于10ml异丙醚中,升温至回流,自然降至室温析晶,抽滤,减压干燥得化合物1约0.92g,hplc纯度100%,检测结果如下表和图3所示。
[0114][0115]
实施例5:化合物1的纯化
[0116]
将化合物1粗品约1.0g溶于10ml甲基叔丁基醚中,升温至回流,自然降至室温析晶,抽滤,减压干燥得化合物1约0.88g,hplc纯度99.4%。
[0117]
4、化合物2的合成路线如下所示:
[0118][0119]
即以化合物3为起始原料,先进行碘代、与三苯基膦成盐,再与化合物6进行wittig偶联,最后经lialh4还原得到,其中化合物3可按照专利wo 2019134984制备,化合物6可按照文献tetrahedron 1992,48卷,42期,9283-9294制备,在此不再赘述。
[0120]
实施例6:化合物4的制备
[0121]
将5.2g(20mmol)三苯基膦溶于50ml二氯甲烷中,加入1.4g(20mmol)咪唑和5.0g(20mmol)碘单质,避光,搅拌30分钟后,冰浴冷却,缓慢滴加2.0g(20mmol)化合物3溶于25ml
二氯甲烷形成的溶液,滴加完毕反应30分钟,tlc监测无原料点。加硅胶过滤,正己烷冲洗,蒸干滤液,硅胶柱层析得3.2g化合物4,收率为76.3%。
[0122]
实施例7:化合物4的制备
[0123]
将5.2g(20mmol)三苯基膦溶于50ml无水四氢呋喃中,加入1.4g(20mmol)咪唑和5.0g(20mmol)碘单质,避光,搅拌30分钟后,冰浴冷却,缓慢滴加2.0g(20mmol)化合物3溶于25ml无水四氢呋喃形成的溶液,滴加完毕反应30分钟,tlc监测无原料点。加硅胶过滤,正己烷冲洗,蒸干滤液,硅胶柱层析得3.6g化合物4,收率为85.2%。
[0124]
实施例8:化合物4的制备
[0125]
将5.2g(20mmol)三苯基膦溶于50ml甲苯中,加入1.4g(20mmol)咪唑和5.0g(20mmol)碘单质,避光,搅拌30分钟后,冰浴冷却,缓慢滴加2.0g(20mmol)化合物3溶于25ml甲苯形成的溶液,滴加完毕反应30分钟,tlc显示有原料点,继续反应30分钟,基本反应完全。加硅胶过滤,正己烷冲洗,蒸干滤液,硅胶柱层析得2.8g化合物4,收率为67.7%。
[0126]
实施例9:化合物4的制备
[0127]
将5.2g(20mmol)三苯基膦溶于50ml乙腈中,加入1.4g(20mmol)咪唑和5.0g(20mmol)碘单质,避光,搅拌30分钟后,冰浴冷却,缓慢滴加2.0g(20mmol)化合物3溶于25ml乙腈形成的溶液,滴加完毕反应30分钟,tlc监测无原料点。加硅胶过滤,正己烷冲洗,蒸干滤液,硅胶柱层析得3.3g化合物4,收率为79.5%。
[0128]
实施例10:化合物4的制备
[0129]
将7.8g(30mmol)三苯基膦溶于50ml无水四氢呋喃中,加入2.0g(30mmol)咪唑和7.6g(30mmol)碘单质,避光,搅拌30分钟后,冰浴冷却,缓慢滴加2.0g(20mmol)化合物3溶于25ml无水四氢呋喃形成的溶液,滴加完毕反应30分钟,tlc监测无原料点。加硅胶过滤,正己烷冲洗,蒸干滤液,硅胶柱层析得3.4g化合物4,收率为80.1%。
[0130]
实施例11:化合物4的制备
[0131]
将6.3g(24mmol)三苯基膦溶于50ml无水四氢呋喃中,加入2.0g(30mmol)咪唑和6.1g(24mmol)碘单质,避光,搅拌30分钟后,冰浴冷却,缓慢滴加2.0g(20mmol)化合物3溶于25ml无水四氢呋喃形成的溶液,滴加完毕反应30分钟,tlc监测无原料点。加硅胶过滤,正己烷冲洗,蒸干滤液,硅胶柱层析得3.8g化合物4,收率为91.0%。
[0132]
实施例12:化合物4的制备
[0133]
将6.3g(24mmol)三苯基膦溶于50ml无水四氢呋喃中,加入2.0g(30mmol)咪唑和6.1g(24mmol)碘单质,避光,搅拌30分钟后,冰浴冷却,缓慢滴加2.0g(20mmol)化合物3溶于25ml无水四氢呋喃形成的溶液,滴加完毕反应30分钟,tlc监测无原料点。加硅胶过滤,正己烷冲洗,滤液用硫代硫酸钠溶液、水洗、饱和食盐水洗后,无水硫酸钠干燥,浓缩至干。甲叔醚打浆,滤液浓缩至干,得4.1g化合物4,收率为97.7%。
[0134]
实施例13:化合物5的制备
[0135]
tetrahedron 1992,48,24,5151-5162首次报道化合物5的结构,但无文献报道其合成方法。
[0136]
将2.0g(9.5mmol)化合物4溶于50ml乙腈中,加入5.0g(19mmol)三苯基膦,加热回流24小时。蒸干反应液,乙醚打浆数次,得到的白色固体真空烘箱干燥,得2.9g化合物5,收率为65.5%。esi-ms(m/z):342.35[m-i]
+
。
[0137]
实施例14:化合物5的制备
[0138]
将2.0g(9.5mmol)化合物4溶于50ml乙腈中,加入7.5g(28.5mmol)三苯基膦,加热回流24小时。蒸干反应液,乙醚打浆数次,得到的白色固体真空烘箱干燥,得3.3g化合物5,收率为74.4%。
[0139]
实施例15:化合物5的制备
[0140]
将2.0g(9.5mmol)化合物4溶于50ml乙腈中,加入8.7g(33.3mmol)三苯基膦,加热回流24小时。蒸干反应液,乙醚打浆数次,得到的白色固体真空烘箱干燥,得3.4g化合物5,收率为75.6%。
[0141]
实施例16:化合物5的制备
[0142]
将2.0g(9.5mmol)化合物4溶于50ml丙酮中,加入8.7g(33.3mmol)三苯基膦,加热回流24小时。蒸干反应液,乙醚打浆数次,得到的白色固体真空烘箱干燥,得4.2g化合物5,收率为93.2%。
[0143]
实施例17:化合物5的制备
[0144]
将2.0g(9.5mmol)化合物4溶于50ml乙酸乙酯中,加入8.7g(33.3mmol)三苯基膦,加热回流24小时。蒸干反应液,乙醚打浆数次,得到的白色固体真空烘箱干燥,得4.4g化合物5,收率为97.2%。
[0145]
实施例18:化合物7的制备
[0146]
将2.0g(4.2mmol)化合物5溶于15ml无水四氢呋喃中,冰浴冷却,滴加2.5ml(4.2mmol)1.7mol/l的苯基锂四氢呋喃溶液,滴完室温搅拌1小时,冷至-30℃,滴加1.2g(3.8mmol)化合物6溶于7.5ml无水四氢呋喃的溶液,-30℃搅拌3小时。tlc监测无原料点,反应液中加入乙酸乙酯,饱和碳酸氢钠溶液洗后,水洗,饱和食盐水洗,无水硫酸钠干燥,浓缩至干。得到化合物2约1.5g,收率102%。esi-ms(m/z):403.46[m+na]
+
,783.85[2m+na]
+
[0147]
实施例19:化合物2的制备
[0148]
将1.0g(2.6mmol)化合物7溶于15ml无水四氢呋喃,室温下加入0.2g(5.2mmol)lialh4,搅拌2小时,tlc监测无原料点。冰浴下加入饱和氯化铵溶液淬灭,加乙酸乙酯分层,有机层水洗、饱和食盐水洗后,无水硫酸钠干燥,硅胶柱层析得0.7g化合物2,收率为93.6%,采用改进后的hplc条件进行检测,结果如图4所示。esi-ms(m/z):299.1[m+na]
+
,575.25[2m+na]
+
.1h nmr(400mhz,dmso):δ6.37(d,j=15.4hz,1h),5.35(dd,j=15.4,8.7hz,1h),4.22
–
4.11(m,1h),3.87(s,1h),2.20
–
2.00(m,1h),1.89(d,j=12.5hz,1h),1.66(s,4h),1.55(d,j=7.7hz,2h),0.99(d,j=6.6hz,3h),0.91(s,3h)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1