一种猪流行性腹泻病毒M基因的荧光探针引物组合、试剂盒及应用的制作方法
一种猪流行性腹泻病毒m基因的荧光探针引物组合、试剂盒及应用
技术领域
1.本发明属于生物技术领域,涉及流行性腹泻病毒m基因检测,尤其是涉及一种猪流行性腹泻病毒m基因的荧光探针引物组合、试剂盒及应用。
背景技术:
2.pedv属冠状病毒属,呈现多形性,大小95
‑
190nm(包括纤突)。核酸为线性单股正链rna,外包衣壳。有囊膜,囊膜上有放射状纤突。pedv有纤突蛋白(s)、小膜蛋白(sm)、膜蛋白(m)和核衣壳蛋白(n)4种结构蛋白,以及pol(polymerase)基因编码的复制酶1a、1b蛋白和orf3基因编码orf3蛋白。
3.猪流行性腹泻(porcine epidemic diarrhea,ped)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,pedv)引起的一种以仔猪水样腹泻、呕吐和脱水为主要临床特征的急性、高度接触性传染病。由于该病对新生仔猪的感染率和致死率均很高,给养猪业造成了巨大的经济损失。特别是在冬季,流行性腹泻病毒更容易爆发,表现为发病率和致死率高、流行广、损失大的特征。因此早发现早控制,能够有效的减少损失,这就需要建立一种快速、灵敏度高、特异性强的检测方法,对pedv进行确诊和监测。
技术实现要素:
4.本发明的目的就是为了提供一种猪流行性腹泻病毒m基因的荧光探针引物组合、试剂盒及应用。
5.pedv的m蛋白作为一个膜糖蛋白,在ped病毒的遗传进化过程中很少发生突变,从而保证宿主识别的一致性。因此m基因具有高度的保守性。本发明通过pedv不同毒株m基因的序列比对,选取m基因的中段保守序列设计引物及探针,目的片段约为189bp,能够最大限度识别pedv的所有毒株,并研制方便诊断的试剂盒,建立相应的检测方法。
6.本发明通过分析pedv的遗传进化树,将不同分支的26个典型的pedv毒株进行m蛋白氨基酸序列的比对,发现m蛋白的第68
‑
132个氨基酸最保守,同源性为100%,因此选取此段基因序列设计引物,参见图5和图6。最终pcr产物序列为m基因的第265
‑
453bp:
7.ccaactggtgtaacgctaacactccttagtggtacattgcttgtagagggctataaggttgctactggcgtacaggtaagtcaattacctaatttcgtcacagtcgccaaggccactacaacaattgtctacggacgtgttggtcgttcagtcaatgcttcatctggcactggttgggctttctatgtc。
8.本发明的目的可以通过以下技术方案来实现:
9.本发明第一方面提供一种猪流行性腹泻病毒m基因的荧光探针引物组合,包括上游引物pedv
‑
mf(seq id no:1)、下游引物pedv
‑
mr(seq id no:2)和荧光探针pedv
‑
p(seq id no:3),分别具有以下碱基序列:
10.上游引物pedv
‑
mf:5
’‑
ccaactggtgtaacgctaac
‑3’
,
11.下游引物pedv
‑
mr:5
’‑
gacatagaaagcccaaccag
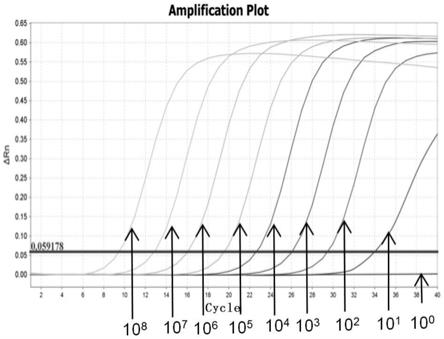
‑3’
,
12.荧光探针pedv
‑
p:fax
‑
agggctataaggttgctactggcgt
‑
tamra。
13.本发明第二方面提供一种猪流行性腹泻病毒m基因的试剂盒,含有所述的荧光探针引物组合,并记为pcr mix。
14.优选地,该试剂盒还包括阳性对照、阴性对照、反转录试剂和pcr扩增液。
15.优选地,pcr mix中,上游引物pedv
‑
mf、下游引物pedv
‑
mr和荧光探针pedv
‑
p的摩尔比为1:1:1。
16.优选地,所述的阳性对照为含有669bp的pedv基因序列的重组质粒,目的片段位于该序列中心区域。
17.优选地,所述的阴性对照为双蒸水。
18.优选地,所述的pcr扩增液包括荧光定量qpcr mix(2
×
)。
19.本发明第三方面提供所述的猪流行性腹泻病毒m基因的试剂盒的应用,将其应用于检测猪流行性腹泻病毒,包括以下方法:
20.1)提取待测样品的rna,利用反转录试剂反转录得到样品cdna;
21.2)配制反应体系:取样品cdna、pcr mix、pcr扩增液,并用双蒸水定量至一定体积,配制反应体系;
22.3)荧光定量pcr扩增;
23.4)参照待测样品对阳性对照和阴性对照进行处理;
24.5)结果判定。
25.优选地,步骤(4)中的结果判定方法为:
26.阳性对照ct值<30并出现特异的s型扩增曲线,阴性对照无ct值且无特异的扩增曲线,实验结果成立;
27.待测样品ct值<35并出现特异的s型扩增曲线,判为猪流行性腹泻病毒核酸阳性;无ct值且无特异的扩增曲线,判为猪流行性腹泻病毒核酸阴性;35<ct值≤40并出现特异的扩增曲线,判为猪流行性腹泻病毒核酸可疑,可疑样品需重新取样提取rna,进行复检,ct值<40判为阳性,否则判为阴性;
28.对于未呈现s型扩增曲线的待测样品,判为阴性。
29.优选地,步骤(1)中,取待测样品的rna,反转录的条件为42℃下进行45min。
30.优选地,步骤(2)的反应体系中,样品cdna 2μl,pcr mix 3μl,pcr扩增液10μl,并加入双蒸水定量至25μl。
31.优选地,步骤(3)中,扩增程序为:95℃1min,循环为95℃5s,60℃35s(采集荧光信号),共计40个循环,报告基团“fam”,淬灭基团“tamra”。
32.与现有技术相比,本发明具有以下有益效果:
33.(1)本发明参照ncbi genbank中公布的pedv毒株的基因序列,选择pedv最保守的m基因进行同源性比对,筛选出m基因的中段保守序列进行引物及探针的设计,能够最大限度识别pedv的所有毒株。
34.(2)本发明设计的引物的灵敏度较高,最低检测限度为14.7copise/μl。
35.(3)本发明的特异性较强,对于猪轮状病毒,传染性胃肠炎病毒,猪瘟病毒,猪伪狂犬病毒,猪蓝耳病毒和猪圆环病毒均无非特异性扩增曲线,保证检测的准确性。
36.(4)本发明建立了一个快速精准检测pedv病毒的试剂盒,设置阳性对照为含有
669bp的pedv基因组序列,扩增的目的片段位于该序列的中段,保证了阳性对照的稳定性,同时增大载体片段,降低了阳性对照产生气溶胶的风险。
附图说明
37.图1为rt
‑
pcr获取阳性对照标准品目的条带的电泳图,图中,m:dna marker,1:阴性对照;2:669bp的目的条带。
38.图2为本发明荧光定量扩增动力学曲线示意图。
39.图3为本发明荧光定量标准曲线示意图。
40.图4为本发明荧光定量特异性检测结果图,图中:阴性对照,猪轮状病毒,传染性胃肠炎病毒,猪瘟病毒,猪伪狂犬病毒,猪蓝耳病毒和猪圆环病毒均无非特异性扩增曲线,唯一一条扩增曲线为pedv阳性样品。
41.图5为26个典型的pedv毒株m蛋白氨基酸序列比对图,图中为第1
‑
120个氨基酸。
42.图6为26个典型的pedv毒株m蛋白氨基酸序列比对图,图中为第120
‑
225个氨基酸。
具体实施方式
43.下面结合附图和具体实施例对本发明进行详细说明。
44.实施例
45.1、阳性标准品的制备
46.用已知pedv的阳性样品提取rna,按照天根的rna病毒提取试剂盒,进行总rna的提取,取rna样品模版4μg反转录获得总cdna,采用25μl的体系,反应体系2
×
rt
‑
pcr mix 10μl,上游引物1μl,下游引物1μl,cdna 2μl,truescript enzyme mix 0.8μl以及rnase free h2o(无核酸酶水)10.2μl;rt
‑
pcr扩增程序:94℃5min;循环94℃30s,55℃30s,72℃1min,共30个循环;再72℃延伸10min。扩增完成后,所有产物用1%琼脂糖凝胶电泳鉴定。如图1所示。鉴定为阳性的pcr产物用天根的胶回收试剂盒进行纯化回收,连接到peasy
‑
t1载体并转化到dh5
ɑ
感受态细胞,挑取阳性克隆,用lb培养液摇菌扩增后,将菌液送到上海生工生物工程有限公司进行测序。
47.2、标准曲线的建立
48.用天根的质粒提取试剂盒提取标准质粒,用nanodrop 2000核酸浓度测定仪检测浓度为750ng/ul,换算稀释为终浓度为1.47
×
10
10
copise/μl,进行10倍梯度稀释后作为模板,取其中浓度为1.47
×
108、1.47
×
107、1.47
×
106、1.47
×
105、1.47
×
104、1.47
×
103、1.47
×
102、1.47
×
101、1.47
×
100copise/μl进行敏感度测定,按提供荧光定量的反应体系及程序进行荧光定量pcr,结果显示在稀释的现行浓度范围内,模板量与对应的ct值呈较好的线性关系,相关系数r2=1,ct值为9.5、12.9、16.0、19.6、22.7、26.0、29.8、34.1、0.0,标准曲线斜率为
‑
3.31,截距为35.994,直线方程y=
‑
3.31x+35.994。其中y表示ct值,x表示log(病毒数量),单位为copise/μl。结果参见图2和图3。
49.3、敏感性试验
50.荧光定量pcr的最低检测量为14.7copise/μl,因此本发明建立的荧光定量pcr具有较高的敏感性。
51.4、特异性试验
52.以发明人保存的猪流行性腹泻病毒、猪轮状病毒,传染性胃肠炎病毒,猪瘟病毒,猪伪狂犬病毒,猪蓝耳病毒和猪圆环病毒阳性样品作为模板,用本发明中的引物及探针进行荧光定量pcr扩增,结果显示,只有pedv出现特异性的s型扩增曲线为阳性,ct值为24.2,其他样品均无特异性扩增,结果如图4所示。表明本发明具有较强的特异性。
53.标准曲线的建立、敏感性试验和特异性试验过程中,荧光定量pcr的反应体系及程序如下:
54.试剂盒包括pcr mix(荧光探针引物组合)、阳性对照、阴性对照、反转录试剂和pcr扩增液。
55.pcr mix中:
56.上游引物pedv
‑
mf:5
’‑
ccaactggtgtaacgctaac
‑3’
,
57.下游引物pedv
‑
mr:5
’‑
gacatagaaagcccaaccag
‑3’
,
58.荧光探针pedv
‑
p:fax
‑
agggctataaggttgctactggcgt
‑
tamra;
59.上游引物pedv
‑
mf、下游引物pedv
‑
mr和荧光探针pedv
‑
p的摩尔比为1:1:1。
60.阳性对照为含有669bp的pedv基因序列的重组质粒,目的片段位于该序列中心区域。
61.阴性对照为双蒸水。
62.pcr扩增液包括荧光定量qpcr mix(2
×
)。
63.检测时:包括以下方法:
64.1)提取待测样品的rna,(rna4μg),利用反转录试剂反转录42℃ 45min,得到样品cdna备用;
65.2)配制反应体系:
66.取样品cdna、pcr mix、pcr扩增液,并用双蒸水定量至一定体积,配制反应体系;具体地,样品cdna 2μl,pcr mix 3μl,pcr扩增液10μl,并利用ddh2o10μl定量至25μl;
67.3)荧光定量pcr扩增:
68.扩增程序为:95℃ 1min,循环为95℃ 5s,60℃ 35s(采集荧光信号),共计40个循环,报告基团“fam”,淬灭基团“tamra”;
69.4)参照待测样品对阳性对照和阴性对照进行处理;
70.5)结果判定:
71.阳性对照ct值<30并出现特异的s型扩增曲线,阴性对照无ct值且无特异的扩增曲线,实验结果成立;待测样品ct值<35并出现特异的s型扩增曲线,判为猪流行性腹泻病毒核酸阳性;无ct值且无特异的扩增曲线,判为猪流行性腹泻病毒核酸阴性;35<ct值≤40并出现特异的扩增曲线,判为猪流行性腹泻病毒核酸可疑,可疑样品需重新取样提取rna,进行复检,ct值<40判为阳性,否则判为阴性;对于某些未呈现s型扩增曲线的待测样品,但本底较高的样品,判为阴性。上述提及的荧光定量qpcr mix(2
×
)(takara)、反转录试剂(takara)均采用市售的产品。
72.上述对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保
护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1