一种同时检测多种目标物的生化分析方法
本发明属于生化分析领域,涉及一种同时检测多种目标物的生化分析方法。
背景技术:
随着国家发展与人民生活水平提高,食品安全、体外诊断和环境监测等领域所面临的挑战与日俱增,高效的检测手段在保障食品安全、促进人类健康、生态环境安全等方面都具有极其重要的影响。传统检测方法大多都依赖于大型精密仪器设备,虽然具有精度高、准确性好等特点,但是大部分仪器造价昂贵且携带不便,使用前需要对检测样品进行复杂的前处理,对使用仪器设备的人员也有较为严格的要求。
基于抗体-抗原识别反应的免疫分析方法在食品安全和体外诊断领域应用广泛。传统的酶联免疫吸附法(elisa)具有灵敏度高、成本低等优点,但整个实验操作繁琐且耗时长,不能实现对同一样品中的多个目标物同时检测;胶体金试纸条法操作简便且检测速度快,但灵敏度比较低,仅适用于定性分析或半定量分析;荧光免疫检测法检测精度高、速度快,对多目标物检测具有良好的适应性,但检测所需仪器设备造价昂贵,且荧光试剂需要避光稳定性较差。
采用高分子微球作为信号探针,将颗粒计数和免疫分析相结合,能够实现高灵敏下的准确检测。目前颗粒计数已有多种实现方式,例如申请人前期研究中使用的库尔特小孔颗粒电阻法和差分阻抗法等,但是小孔颗粒电阻计数器造价昂贵,而且小孔管容易发生堵塞,相比之下,光学显微成像法能够直接读取颗粒数量,因此检测成本更低,操作也更加便捷。例如cn109521202a公开了一种基于数字免疫分析的蛋白质定量方法,该方法将捕获磁珠、目标抗原和检测颗粒进行免疫反应,形成免疫复合物,然后将免疫复合物中的检测颗粒洗脱并转移至微流控颗粒计数芯片,检测颗粒沉积固定在芯片上,对所有固定在芯片上的检测颗粒进行成像记录,统计芯片上检测颗粒的数量,即得到目标蛋白的分子数。该方法实现了疾病相关蛋白质的超灵敏、绝对定量分析,但是无法实现对多种目标物的同时检测。另外,该方法需要进行多次磁分离,并且需要加入酸性溶液将免疫复合物中的检测颗粒洗脱下来,多步的磁分离及洗涤过程不仅降低了分析效率,而且容易造成累积误差。
技术实现要素:
为解决上述问题,本发明提出了一种同时检测多种目标物的生化分析方法,该方法将生化反应与可视化微球计数、机器视觉与深度学习相结合,将与待测目标物对应的生物识别分子分别偶联在载体和信号探针表面,进行免疫反应或者dna分子杂交反应,然后根据载体和信号探针粒径大小的不同,使用毛细管或复合膜对其进行分离,最后直接对分离后的信号探针进行光学显微成像计数,本发明通过使用不同粒径或颜色的信号探针用于区分不同的检测对象,最终实现了多种目标物的同时检测。
上述目的是通过以下技术方案实现的:
一种同时检测多种目标物的生化分析方法,包括以下步骤:
1)以不同粒径和/或不同颜色的高分子微球为信号探针,将多种目标物的生物识别分子分别与不同粒径和/或不同颜色的信号探针偶联,每一种粒径和/或颜色对应一种目标物,同时以另一种大粒径的高分子微球为载体,将多种目标物对应的生物识别分子分别与载体偶联,将偶联有生物识别分子的信号探针和载体同时加入到待测样品进行生化反应;
2)将反应液通过毛细管或复合膜进行分离,收集含有未参与反应的信号探针的分离液;
3)将分离液滴加到划分网格的载玻片上,涂匀后盖上玻片,光学显微镜对焦后对不同网格的计数区域进行分别拍照,并将高清图像传送至计算机;
4)计算机对高清图像中的微球粒径和/或颜色进行区分,并在python机器视觉识别和深度学习的基础上得出每一种粒径和/或不同颜色的高分子微球数量,最后根据每一种高分子微球的数量计算待测样品中不同种类目标物的含量,实现多种目标物的定量检测。
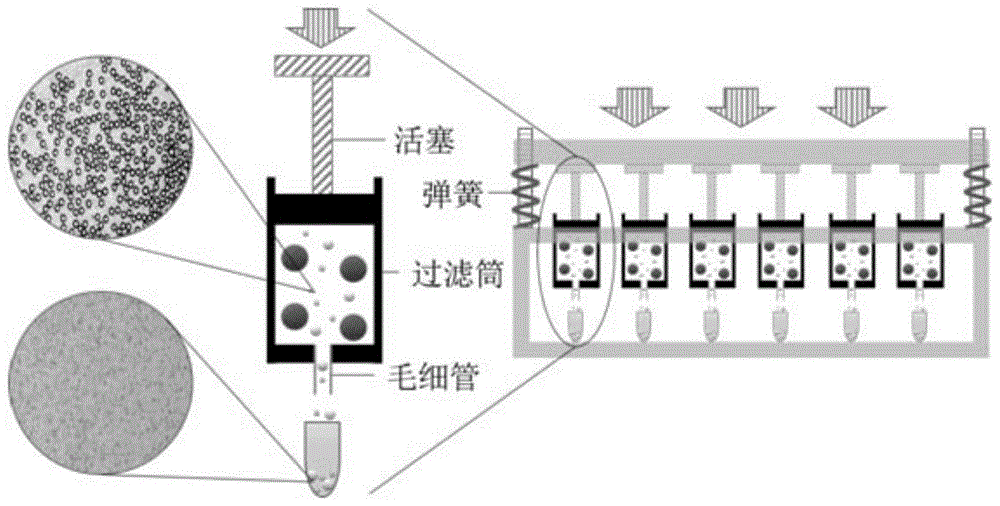
其中,所述作为信号探针的高分子微球其粒径小于毛细管或复合膜的孔径,所述作为载体的高分子微球其粒径大于毛细管或复合膜的孔径。
本发明的检测原理如下:
选择粒径大于毛细管或复合膜孔径的高分子微球(如聚苯乙烯微球,polystyrenemicrosphere,ps微球)作为载体,将针对不同目标物的生物识别分子(如捕获抗体、抗体、dna捕获探针)修饰在其表面;选择粒径小于毛细管或复合膜孔径的高分子微球(如ps微球)作为信号探针,根据其粒径、颜色的不同,分别与不同目标物对应的生物识别分子(如检测抗体、抗原、dna检测探针)偶联。待测样品中的目标物分别和对应的生物识别分子发生特异性识别结合,将诱导或抑制大粒径载体与小粒径信号探针的结合,结合后的信号探针不能通过毛细管或复合膜,而未发生反应的信号探针则可以随溶液通过毛细管或复合膜。未发生反应的信号探针数量与目标物含量相关,将含有信号探针的分离液通过光学显微镜进行成像,利用机器视觉识别获取信号探针的粒径、颜色及其对应的数量。由于不同粒径、颜色的信号探针分别对应于不同的目标物,如此即可实现样品中不同目标物的多元检测。
优选地,所述作为信号探针的高分子微球其粒径为1~10μm,所述作为载体的高分子微球其粒径为50~500μm。
优选地,所述毛细管或复合膜的孔径为10~50μm。
优选地,在将反应液通过毛细管进行分离时,还向反应液进行了施压和超声处理。
优选地,所述超声功率为400-800w,频率为10-50khz。最佳的,所述超声功率为600w,频率为25khz。
优选地,所述复合膜由上、中、下三层组成,上层膜的孔径大于作为载体的高分子微球粒径;中层膜的孔径等于作为载体的高分子微球粒径;下层膜的孔径小于作为载体的高分子微球粒径。
优选地,在将反应液通过复合膜进行分离时,还对反应液进行了抽滤,所述抽滤的真空度≥0.08mpa。
优选地,在将反应液通过复合膜进行分离时,所述反应液的体积与复合膜的直径比为20:1(μl:mm)。
为了使机器视觉能更准确的识别不同粒径的颗粒从而减少检测误差,所述不同粒径的高分子微球,它们的粒径倍数应≥2。
所述不同颜色的高分子微球,它们的的颜色分别为紫色、红色、橙色、黑色、蓝色、绿色、黄色或白色中的任一种。
所述生化反应包括免疫竞争反应、免疫夹心反应或dna分子杂交反应。
本发明中的生物识别分子及其对应的生物识别分子包括完全抗原/抗体、捕获抗体/检测抗体、dna捕获探针/dna检测探针等,以完全抗原/抗体为例,本发明的检测原理如下:将不同检测对象的抗体分别偶联在大粒径载体表面,将不同检测对象的完全抗原分别偶联在不同粒径和/或不同颜色的小粒径信号探针表面,将上述偶联物同时加入到待测样品并进行免疫反应,信号探针上结合的完全抗原和待测样品中的目标物竞争性地与载体上的抗体相结合,生成载体-抗体-抗原-信号探针复合物,当待测样品中的目标物含量越高则生成的复合物越少,而未参与反应的信号探针则越多,反之,当待测样品中的目标物含量越少则生成的复合物越多,而未参与反应的信号探针则越少,未参与反应的信号探针的数量与目标物的含量正相关。
接着将未参与反应的信号探针从反应体系中进行分离,然后对未反应的信号探针进行收集,分离液中的信号探针数量反映的是待测样品中目标物的含量,二者呈正相关。
由于一种粒径和/或颜色的高分子微球对应的是一种目标物,因此通过检测不同粒径和/或不同颜色的高分子微球数量得到不同目标物的含量。
本发明提出了一种机器视觉可视化的计数方法,该方法通过高倍光学显微镜拍照,并在python机器视觉识别颗粒的同时进行深度学习提高颗粒识别准确度。首先,基于光学成像原理对含有信号探针的待测液进行颗粒成像,取一定量待测液滴于划分网格的载玻片上涂匀,盖上载玻片后放置于高倍光学显微镜下完成自动对焦,载玻片放置于自动化导轨平台上可对载玻片实现xoy坐标系的定点平移,从而对不同的计数区域进行分别拍照,待测液中存在不同颜色和/或不同粒径的高分子微球。接着,高倍显微镜将所拍取的颗粒图像传送至计算机,通过机器视觉颗粒识别对高分子微球的颜色、粒径进行识别记录并同时结合深度学习,快速高效准确地识别颗粒数量。
与传统颗粒计数方法相比,本发明计数方法更加快捷直观高效,计数所用耗材成本更低,可实现一次性使用随用随弃,不同颜色与粒径的高分子微球组合可实现多目标物同时检测,根据实际需求可以应用于多种场景的快速检测,如食品安全快速检测、体外诊断、环境监测等。
所述多目标物检测的具体实现形式为不同粒径的信号探针相互组合、不同颜色的信号探针相互组合和不同颜色与不同粒径的信号探针二维信息的相互组合,但不仅限于此类组合形式。
当生物识别分子为捕获抗体/检测抗体、或dna捕获探针/dna检测探针时,检测原理与上述方法类似,区别在于所发生的反应为免疫夹心反应或dna分子杂交反应,经毛细管或复合膜分离后未参与反应的信号探针数量与待测样品中目标物的含量呈负相关。
本发明适合各种目标物的检测,包括病毒、生物标志物、抗生素分子、农药分子、兽药分子、生物毒素、细菌等,但不仅限于这些目标物。
本发明还适合各种基质成分的检测对象,例如全血、血清、牛奶、饮料等,且不仅限于这些检测对象。
本发明通过对反应产物进行一步分离处理即可直接用于计数分析,与现有计数方法相比,该方法无需对反应产物进行磁分离,也无需加入酸性溶液或有机试剂将免疫复合物中的信号探针裂解洗脱下来再进行测定,因此不仅提高了分析效率,而且减少了累积误差。
在使用毛细管分离时,大颗粒将被截留在悬浮液中,毛细管作为唯一的尺寸选择通道,对于不同粒径颗粒的分级分离极为关键。同时,大颗粒将被截留在悬浮液中,而非过滤介质上,从而有效避免了滤层的形成,解决了随过滤进行而造成过滤通量下降的问题。
在使用复合膜分离时,本发明通过优化复合膜的结构和孔径、反应液的体积与复合膜直径的比例关系,从而使信号探针得到更好的分离,防止滤孔堵塞,提高过滤通量,从而提高检测结果的准确性和灵敏性。
与现有技术相比,本发明具有以下优点:
(1)基于信号探针粒径和颜色的编码,多目标物同时检测的能力强。传统的检测方法为了实现多个目标物的检测,一般采用荧光微球、量子点、上转换材料或者在不同空间位置上实现多个目标物产生的信号位置不同加以区分。而本发明只需要改变高分子微球的粒径或者颜色,即可通过特异性免疫反应或者dna分子杂交反应和颗粒计数实现多目标物同时检测。高分子微球的粒径大小可控,悬浮稳定性很好,不同粒径的高分子微球不会发生信号重叠,更为重要的是粒径和颜色可以进行组合编码,可供选择的编码组合可以呈指数扩大。例如:3种不同粒径和3种不同颜色的高分子微球进行排列组合编码,种类数可以达到
(2)检测步骤少,速度快,操作简便,易自动化。本发明只需要对反应产物进行一步分离就能直接进行计数分析,不需要对反应产物进行特殊的磁分离和裂解处理,因此不仅提高了分析效率,而且减少了累积误差。高分子微球作为载体和信号探针,具有稳定性好、价格便宜等优点。基于python的机器视觉颗粒识别同时结合深度学习与传统颗粒计数器相比,识别速度更快准确度更高,颗粒识别度可达99%。当上一个待测样本完成拍照记录后随即下一个样本在输送装置带动下进入作业区,光学显微镜自动对焦拍照,高程度的自动化作业减少了人力物力,提高了检测效率,可更便捷高效地实现多样本检测。
(3)抗干扰能力强,结果准确性高。采用机器视觉识别信号探针信息,方法直观准确,不易受机器灵敏性和外界环境的干扰。
(4)应用范围广。可根据目标物类别采用不同的生物识别分子对ps微球进行修饰,以满足食品安全、体外诊断、环境监测等领域的生化分析需要。
附图说明
图1为毛细管分离装置结构示意图。
图2为复合膜分离装置结构示意图。
图3为本发明毛细管和复合膜分离的不同粒径或颜色的ps微球的正置光学显微镜成像图。
图4为本发明毛细管分离法检测四种炎症标志物的操作流程示意图。
图5为本发明复合膜分离法检测三种致病菌的操作流程示意图。
图6为ps微球载体与信号探针的浓度比例为2:1、1:1、1:2、1:3(信号探针粒径为1μm)和1:1、1:2、1:3、1:4(信号探针粒径为3μm)时测得的颗粒数目改变量与目标物浓度的相关性。
图7为本发明检测血液样品中四种炎症标志物的标准曲线。
图8为本发明检测三种致病菌的标准曲线。
具体实施方式
下面通过具体实施例对本发明作进一步详细说明。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
试验材料及相关术语说明
熔融石英毛细管,孔径25μm,购自河北永年锐丰色谱器件有限公司。
聚酰胺复合膜(自上而下孔径分别为75μm、50μm、25μm的三层滤膜),购自millipore。
羧基化ps微球:粒径1μm、3μm、6μm、50μm;颜色包括白色、黄色、黑色、绿色、蓝色;购自bangslaboratories,inc.。
白细胞介素-6(il-6)、降钙素原(pct)、c-反应蛋白(crp)、血清淀粉样蛋白a(saa)及其对应的捕获抗体和检测抗体购自abcam公司。沙门氏菌、单增李斯特菌、金黄色葡萄球菌捕获探针和检测探针由生工生物工程(上海)有限公司设计并合成。
1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(edc)、n-羟基硫代琥珀酰亚胺活泼酯(sulfo-nhs):购自上海阿拉丁生化科技股份有限公司。tween-20、牛血清白蛋白(bsa):购自amresco公司。
pbs缓冲液(10mm,ph=7.4):取8.00gnacl,0.20gkcl,0.20gkh2po4和2.90gna2hpo4·12h2o于1000ml容量瓶中定容,摇匀。
mes缓冲液(0.1m,ph=6.0):取21.325gmes溶于去离子水中定容至1000ml,为a液;取4gnaoh溶于去离子水中定容至1000ml,为b液;取1000mla液和400mlb液混合,摇匀。
pbst、mest:在配制好的1000mlpbs或mes缓冲液中加入0.5mltween-20,摇匀。
试验装置:
为实现不同粒径ps微球的分离,构建了一种以毛细管为分离通道的过滤装置,其结构如图1所示。整个装置由多个过滤单元组成,每个过滤单元包括毛细管、过滤腔、活塞三个部件。毛细管固定在过滤腔底部,过滤腔作为生物识别的反应场所,活塞与所述过滤腔尺寸匹配,可通过压缩活塞驱使溶液流经毛细管分离通道。为提高分离效率,设计了弹簧机械施压装置,可同时压缩多个活塞实现过滤操作。
另外,本发明还构建了一种以复合膜为分离通道的过滤装置,其结构如图2所示。该装置主要由进样瓶、反应瓶和收集瓶三部分组成,将待测样品加入进样瓶,通过抽滤除去杂质和干扰物后进入反应瓶,然后通过进料管加入偶联有生物识别分子的信号探针和载体,反应瓶内进行生化反应。反应结束后,将反应液通过复合膜进行抽滤,分离液贮存于收集瓶。
为验证装置的分离和成像效果,将粒径为50μm的ps微球和颜色为白色、粒径为1μm、3μm、6μm的ps微球混合,利用毛细管(直径25μm,长度5mm)和复合膜(自上而下孔径分别为75μm、50μm、25μm的三层滤膜)分离装置过滤,收集滤液,通过正置光学显微镜成像,图3a、图3c分别为经毛细管和复合膜分离装置过滤后的成像效果,成像区域内均未见粒径为50μm的ps微球,且粒径为1μm、3μm、6μm的ps微球可观测到明显粒径区别。将粒径为50μm的ps微球和粒径为3μm、颜色为白色、蓝色、黄色的ps微球混合,利用毛细管(直径25μm,长度5mm)和复合膜(自上而下孔径分别为75μm、50μm、25μm的三层滤膜)分离装置过滤,收集滤液,通过正置光学显微镜成像,图3b、图3d分别为经毛细管和复合膜分离装置过滤后的成像效果,成像区域内均未见粒径为50μm的ps微球,且颜色为白色、蓝色、黄色的ps微球可观测到明显颜色区别。以上结果说明毛细管和复合膜分离装置具有良好的分离效果,可有效将粒径大于其孔径的颗粒除去;且通过正置光学显微镜可区分ps微球的粒径、颜色等特征,为多元分析奠定了基础。
实施例1采用毛细管分离法对血液中多种炎症标志物的检测
采用夹心免疫法对血液样品中的四种炎性标志物白介素6(il-6)、降钙素原(pct)、c-反应蛋白(crp)、血清淀粉样蛋白(saa)进行多元检测,其原理图4所示:以粒径为50μm的ps微球为载体,表面分别修饰以il-6、pct、crp、saa对应的捕获抗体;以1μm红色ps微球、1μm蓝色ps微球、3μm红色ps微球、3μm蓝色ps微球为信号探针,分别与il-6、pct、crp、saa对应的检测抗体偶联。当目标物存在时,修饰在载体表面的捕获抗体、目标物、修饰在信号探针表面的检测抗体会形成夹心复合物,从而导致粒径为50μm的ps微球和不同粒径、颜色的ps微球偶联,引起溶液中自由ps微球信号探针减少。无目标物时,由于不会有夹心复合物的形成,粒径为50μm的ps微球和不同粒径、颜色的ps微球不会发生偶联,从而无法引起溶液中自由ps微球信号探针的数量变化。反应完成后进行毛细管分离,双抗夹心免疫复合物因为粒径大于毛细管的孔径将被截留在悬浮液中,而未反应的ps微球信号探针则可以通过毛细管,从而实现分离。利用机器视觉识别获取滤液中的ps微球信号探针颜色及其对应数目信息,即可对目标物进行多元定量分析。
具体过程如下:
1、利用生物识别分子修饰ps微球
以il-6的捕获抗体为例,对修饰过程进行说明,其余生物识别分子包括il-6的检测抗体、pct的捕获抗体和检测抗体、crp的捕获抗体和检测抗体、saa的捕获抗体和检测抗体也采用类似的方法。本发明所使用的修饰方法均为本领域所熟知的常规方法,具体如下:
取2mgps微球(粒径为50μm)于离心管中,用500μlmest(10mmmes,0.05%tween20,ph6.0)洗涤2次,离心(10000rpm,5min),去除上层清液;用10mmmes(ph6.0)配制5mg/mledc溶液和5mg/mlnhs溶液;向上述装有ps微球的离心管中分别加入100μledc(5mg/ml)和50μlnhs(5mg/ml),涡旋混匀使ps微球充分悬浮,用mes稀释至500μl,放置于旋转混匀仪上,37℃活化30min;离心(10000rpm,6min),去除上层清液,用500μlmest洗涤3次;将100μgil-6的捕获抗体加入到上述装有ps微球的离心管中,用pbst调节总体积至500μl,轻摇混匀ps微球和捕获抗体;将上述混合物置于旋转混匀仪上,37℃反应3h;离心(10000rpm,6min),去除上层清液,加入含1%bsa的pbst(ph7.4)500μl,重新悬浮ps微球,置于旋转混匀仪上,37℃封闭30min;离心(10000rpm,6min),除去上层清液,500μlpbst洗涤3次;离心(10000rpm,6min),除去上层清液,所得到的il-6的捕获抗体修饰的ps微球用1mlpbst(ph7.4,含0.02%nan3,0.5%bsa)重新悬浮,置于4℃保存。
为获得最佳的分析效果,对上述制备的il-6、pct、crp、saa对应的ps微球载体-捕获抗体偶联物与ps微球信号探针-检测抗体偶联物的比例进行了优化。图6a-d所示为ps微球载体与信号探针的浓度比例为2:1、1:1、1:2、1:3(信号探针粒径为1μm)和1:1、1:2、1:3、1:4(信号探针粒径为3μm)时测得的颗粒数目改变量与目标物浓度的相关性。从图中可以看出,ps微球载体-捕获抗体偶联物与ps微球信号探针-检测抗体偶联物的比例对分析性能具有显著影响。其中,对于粒径为1μm的信号探针,ps微球载体与其浓度比例为1:1时线性最佳;对于粒径为3μm的信号探针,ps微球载体与其浓度比例为1:3时线性最佳。
2、免疫反应与分离
分别将il-6、pct、crp、saa捕获抗体修饰的ps微球(50μm,50μg/ml)和il-6检测抗体修饰的ps微球(1μm,红色,50μg/ml)、pct检测抗体修饰的ps微球(1μm,蓝色,50μg/ml)、crp检测抗体修饰的ps微球(3μm,红色,150μg/ml)、saa检测抗体修饰的ps微球(3μm,蓝色,150μg/ml)混合;向上述混合液中分别加入一系列浓度的il-6、pct、crp、saa混合物,孵育5-15min;将上述反应液加入到过滤腔中,施加压力,同时对反应液进行超声处理(功率为600w,频率为25khz),驱使未反应的小粒径信号探针通过毛细管分离通道,并收集滤液。
3、显微镜拍照
显微镜拍照所用主要仪器为正置光学显微镜(lk50t,天津徕科光学仪器有限公司),取上述滤液10μl,均匀涂于设有网格参考线的载玻片上,待溶剂挥发微球定型后盖上盖玻片。将玻片样本置于自动化导轨平台,通过显微镜操作软件调节显微镜自动聚焦(软件运行系统为windows1064bit),设置放大倍数为1000x,自动化导轨平台按设定程序对玻片样本定点平移,随机选取10个计数网格进行拍照,设定对每个计数网格高速拍取10张尺寸为3840*2160高清图像并传至计算机保存,每个样本保存图片数量为100张。
4、机器视觉识别
ps微球识别模型选择windows1064bit操作系统下python环境,处理器选择intercorei910900k,独立显卡选择nvidiageforcertx3080,深度学习框架选择tensorflow。首先对显微镜捕获的图片进行自动分割处理,将每个微球所在区域单独切割划分成尺寸为227*227的图像,设置不同数量的像素点阈值,识别成像微球不同像素点的数量和设置微球阈值即可实现微球的粒径区分及计数;由于不同颜色所对应的rgb值不同,如:红色(255,0,0)、绿色rgb(0,255,0)、蓝色(0,0,255)等,通过计算机识别微球rgb值即可判断微球颜色。
分别设置单个1μm和3μm微球在显微镜下放大1000x所占用像素点为阈值a和阈值b,设置红色微球颜色阈值c1和蓝色微球颜色阈值c2。当待测微球像素点数量接近设置阈值a范围(a±5%)内时即判定为1个1μm微球,当待测微球像素点与设置阈值a偏离过大则与阈值b比对,接近设置阈值b范围(b±5%)内时判定为一个3μm微球,均不满足对该微球单独计数;随后将待测微球像素点颜色rgb值与红色微球颜色阈值c1进行识别比对,当待测微球像素点颜色接近设置阈值c1范围(c1±20%)内时即判定为1个红色微球并归类计数,若不满足红色颜色阈值条件则再与颜色阈值c2进行对比,接近设置阈值c2范围(c2±20%)内时即判定为1个蓝色微球,均不满足则单独计数;采用割补法对图像边缘区域的残缺微球进行像素点数量合并处理,先识别残缺微球颜色,对不同颜色的微球进行分类像素点数量合并,每当不同类合并像素点总数溢出阈值a或者阈值b时,则计数为1个微球;对于重叠、联结等微球采用重复识别法进行计数,先对未重合的微球部分识别颜色,随后叠加重叠部分和未重叠部分像素点数量与阈值a或阈值b对比,满足阈值范围则计数1次,重复过程直至识别所有重复区域微球;依次对每一个切割划分的图像进行识别计数并统计,对计数网格拍照的多张微球图像进行处理识别,同时基于tensorflow训练微球进行深度学习建立微球模型并记忆误差允许范围内的微球形状与颜色;最后对所有图像识别数据进行整合对比处理,当图像微球识别误差≤1%时则判断计数有效,反馈函数值到计算机,计算机输出1μm红色微球、1μm蓝色微球、3μm红色微球、3μm蓝色微球和其他颗粒数目。
5、机器视觉识别检测il-6、pct、crp、saa
机器视觉识别软件对导入计算机的显微镜拍照图像进行微球识别,记录识别不同粒径、颜色微球数量并通过函数返回给计算机,通过网格计数区微球数量估算整体测量样本的微球数量,从而计算待测目标物含量,1μm红色微球、1μm蓝色微球、3μm红色微球、3μm蓝色微球数目分别与il-6、pct、crp、saa含量相关。以炎症标志物浓度的对数值为横坐标,以目标物存在引起的微球数目改变量为纵坐标,得到二者之间的线性关系。如图7所示,在1-108pg/ml的浓度范围内,不同粒径、颜色微球数目改变量与目标物浓度对数值之间具有良好的线性关系。对于il-6,其线性回归方程为y=355.5x+430.2,r2=0.99;对于pct,其线性回归方程为y=356.0x+106.6,r2=0.99;对于crp,其线性回归方程为y=391.9x-403.7,r2=0.99;对于saa,其线性回归方程为y=371.3x-311.2,r2=0.99。上述结果表明,该方法能够用于多目标物同时检测。
6、血液中il-6、pct、crp、saa的检测
采用标准加入法对血液样品中的四种炎症标志物il-6、pct、crp、saa进行了检测。结果如表1所示,四种炎症标志物的回收率均在84%-106%之间,且相对标准偏差rsd均小于9%。以上结果表明,该方法具有较高的准确度和精密度,可用于复杂样品中多目标物的定量分析。
表1血液样品中il-6、pct、crp、saa的检测结果。
(1)将本方法与磁分离结合机器视觉识别方法进行对比
如表2所示,结果表明本方法具有更高的准确度和更快的分析速度。磁分离结合机器视觉识别方法,通过生物识别反应实现ps微球信号探针与磁颗粒的偶联,通过外加磁场进行磁分离,洗涤以除去未反应的信号探针;利用有机溶剂使免疫复合物裂解,再次进行磁分离,取上清液进行分析。多步的磁分离及洗涤过程不仅降低了分析效率,而且容易造成累积误差。而本方法直接以毛细管分离装置实现反应和未反应的ps微球信号探针的分离,整个过程无需洗涤,因此提高了分析效率,并且有效降低了累积误差的产生。
表2本方法和磁分离结合机器视觉识别方法对全血中crp检测分析性能对比。
(2)超声处理对检测结果的影响
为了保持反应液中微球的均匀悬浮并有效地消除粘连现象,在过滤的同时对其进行了超声处理。表3所示为在过滤过程中施加不同功率和频率的超声处理和不施加超声处理对血液中crp的检测结果。首先,超声功率越高,空化效果越强;超声频率越低,产生空化效果越容易。因此,过高的超声功率和过低的超声频率会导致已结合的微球载体和信号探针重新裂解,从而产生检测误差;而过低的超声功率和过高的超声频率空化作用太弱,无法保证微球的均匀悬浮和粘连现象的有效消除,结果表明超声功率为600w,频率为25khz时效果最佳。对比不施加超声处理的检测结果,证明采用适当功率和频率的超声处理,可进一步提高方法的准确度,原因在于超声处理进一步促进了反应液中微球的均匀悬浮,并且有效避免了微球之间的物理粘连,所得滤液中信号探针浓度更准确,从而使得检测结果更接近于真实值。
表3超声处理对血液中crp检测结果的影响
实施例2采用复合膜分离法对沙门氏菌、单增李斯特菌、金黄色葡萄球菌的多元检测
采用dna杂交反应对沙门氏菌、单增李斯特菌、金黄色葡萄球菌的多元检测,原理图5所示:以粒径为50μm的ps微球为载体,表面分别修饰以沙门氏菌、单增李斯特菌、金黄色葡萄球菌对应的捕获探针;以1μm、3μm、6μmps微球为信号探针,分别与沙门氏菌、单增李斯特菌、金黄色葡萄球菌对应的检测探针偶联。当目标物存在时,修饰在载体表面的捕获探针、目标物、修饰在信号探针表面的检测探针会通过dna杂交反应形成复合物,从而导致粒径为50μm的ps微球和不同粒径的ps微球偶联,引起溶液中自由ps微球信号探针减少。无目标物时,由于不会有dna杂交反应复合物的形成,粒径为50μm的ps微球和不同粒径的ps信号探针不会发生偶联,从而无法引起溶液中自由ps微球信号探针的数量变化。反应完成后进行复合膜分离,dna杂交反应复合物及ps微球载体因为粒径大于复合膜的孔径将被滤膜截留,而未反应的ps微球信号探针则可以通过复合膜,从而实现分离。利用机器视觉识别获取滤液中的ps微球信号探针颜色及其对应数目信息,即可对目标物进行多元定量分析。
具体过程如下:
1、利用生物识别分子修饰ps微球
以粒径为50μm的ps微球为载体,制备ps微球-捕获探针偶联物,包括制备ps微球-沙门氏菌捕获探针偶联物、ps微球-单增李斯特菌捕获探针偶联物、ps微球-金黄色葡萄球菌捕获探针偶联物,所使用的偶联方法为本领域所熟知的常规方法,具体如下:
取200μl浓度为10mg/ml粒径为50μm的羧基化ps微球,用mest(ph=6.0,含0.05%tween20)缓冲液洗涤两次,离心分离去掉上清液,用mes缓冲液重悬后,加入50μledc(10mg/ml)和25μlnhs(10mg/ml),充分混匀,在室温下活化20min;离心分离,去掉上清液中多余的edc和nhs,加入mest洗涤一至两次,用mes或pbst(ph7.4,含0.05%tween20)重悬活化后的ps微球;加入0.2mg沙门氏菌捕获探针,轻柔混匀后在4℃下偶联2小时,偶联过程中始终保持ps微球处于悬浮状态;离心分离,去掉上清液,ps微球用pbst缓冲液洗涤2至3次,用pbs缓冲液重悬偶联物,保存于4℃待用。
ps微球-单增李斯特菌捕获探针、ps微球-金黄色葡萄球菌捕获探针的制备也采用上述方法,所使用的ps微球的粒径均为50μm。
分别以粒径为1μm、3μm、6μm的ps微球为信号探针,制备ps微球-检测探针偶联物,包括制备ps微球-沙门氏菌检测探针偶联物、ps微球-单增李斯特菌检测探针偶联物、ps微球-金黄色葡萄球菌检测探针偶联物,方法与步骤1相同,将三种待测物对应的检测探针分别偶联在三种不同粒径大小的ps微球表面。
2、致病菌核酸的提取和pcr扩增
首先,用pbs缓冲液将三种致病菌(沙门氏菌、单增李斯特菌、金黄色葡萄球菌)标准品分别稀释至102、103、104、105、106、107cfu/ml。按照试剂盒方法对稀释后的沙门氏菌基因组dna进行提取,并按下述体系进行扩增:10×pcr缓冲液2.0μl,5.0μl上述基因组dna清液,上、下游引物各1.0μl(0.3μm),1.0μldna聚合酶(5u/μl),1.0μldntp(10mm),3.0μlmgcl2(2.25mm)和33μl超纯水。反应条件如下:95℃预变性10min,95℃变性30s,60℃退火50s,72℃延伸50s,扩增35个循环;72℃延伸10min。单增李斯特菌、金黄色葡萄球菌核酸的提取和pcr扩增同上述沙门氏菌核酸的提取和pcr扩增方法相同,均为本领域常规方法。
将同一浓度不同种类的三种致病菌(沙门氏菌、单增李斯特菌、金黄色葡萄球菌)pcr扩增产物等体积混合。将ps微球-不同种类致病菌捕获探针偶联物用pbs分别稀释2倍;将ps微球-不同种类致病菌检测探针偶联物用pbs分别稀释50倍。
3、dna杂交反应与分离
按混合后不同种类致病菌(沙门氏菌、单增李斯特菌、金黄色葡萄球菌)浓度梯度的数量,选择对应数量的反应管,在反应管中分别加入不同浓度混合致病菌pcr扩增产物60μl;沙门氏菌、单增李斯特菌、金黄色葡萄球菌捕获探针修饰的聚苯乙烯微球各50μl;沙门氏菌、单增李斯特菌、金黄色葡萄球菌检测探针修饰的聚苯乙烯微球各50μl;杂交缓冲液40μl。设置温度40℃,反应45min。dna杂交反应结束后进行膜分离。
分离时所使用的膜为聚酰胺复合膜,由三层滤膜叠加而成,三层滤膜的孔径自上而下逐层降低,孔径分别为75μm、50μm、25μm,分离的同时还对其进行抽滤处理,同时控制过滤过程中反应液的体积与复合膜的直径比为20:1(μl:mm)。
4、显微镜拍照
显微镜拍照所用主要仪器为正置光学显微镜(lk50t,天津徕科光学仪器有限公司),取上述滤液10μl,均匀涂于设有网格参考线的载玻片上,待溶剂挥发微球定型后盖上盖玻片。将玻片样本置于自动化导轨平台,通过显微镜操作软件调节显微镜自动聚焦(软件运行系统为windows1064bit),设置放大倍数为1000x,自动化导轨平台按设定程序对玻片样本定点平移,随机选取10个计数网格进行拍照,设定对每个计数网格高速拍取10张尺寸为3840*2160高清图像并传至计算机保存,每个样本保存图片数量为100张。
5、图像处理与机器视觉深度学习
微球识别模型选用windows1064bit操作系统(版本号1909)下python环境,处理器选用intercorei910900k,独立显卡选用nvidiageforcertx3080,深度学习框架选用tensorflow。首先对导入计算机待进行微球识别的图片进行自动分割处理,对每一个微球所在区域进行单独的切割划分成尺寸为227*227的图像,设置不同数量的像素点阈值,识别成像微球不同像素点的数量和设置微球阈值即可实现微球的粒径识别和数量统计。
对不同粒径同一颜色的高分子微球进行识别时,计算机直接对微球的粒径进行识别分类。识别并分别设置单个1μm、3μm和6μm微球在显微镜下放大1000倍所占用像素点为阈值a、阈值b和阈值c(a<b<c)。以1μm微球识别为例,当待测微球像素点数量接近设置阈值a范围(a±5%)内时即判定为1个1μm微球并计数1次,当待测微球像素点与设置阈值a偏离过大则与阈值b或阈值c对比计数,若与阈值b和阈值c对比均不满足范围条件,则对该微球单独计数。采用割补法对图像边缘区域的残缺微球进行相同粒径像素点数量合并处理,每当合并像素点总数溢出时,则计数为1个微球,减少边缘残缺微球造成的计数误差;对于重叠、联结等微球采用重复识别法进行计数,重叠微球区域像素点颜色会更深,对重复区域进行像素点数量识别后与非重复区域进行像素点数量合并再与阈值a进行比对计数,重复过程直至识别所有重复区域微球。同理,采用同样的方法通过待测微球像素点数量与阈值b或阈值c对比,对3μm和6μm的微球进行计数。依次对每一个切割划分的图像进行识别计数并统计,对计数网格拍照的多张微球图像进行处理识别,同时基于tensorflow训练微球进行深度学习建立微球模型并记忆误差允许范围内的微球形状。最后对所有图像识别数据进行整合对比处理,当图像微球识别误差≤1%时系统判断计数有效,反馈函数值到计算机,计算机输出1μm、3μm、6μm和其他微球数量。
6、机器视觉识别检测沙门氏菌、单增李斯特菌、金黄色葡萄球菌
机器视觉识别对导入计算机的显微镜拍照图像进行微球识别,记录不同粒径微球数量并通过函数返回给计算机,通过网格计数区微球数量估算整体测量样本的微球数量,从而计算待测目标物含量,1μm、3μm和6μm的微球数量分别代表沙门氏菌、单增李斯特菌、金黄色葡萄球菌含量。以检测到的ps微球数量为纵坐标,以沙门氏菌、单增李斯特菌、金黄色葡萄球菌浓度的对数值为横坐标,得到两者之间的线性关系。如图8为不同粒径的ps微球信号探针数量的改变量与不同种类致病菌(沙门氏菌、单增李斯特菌、金黄色葡萄球菌)浓度关系变化图,在102~107cfu/ml范围内,不同粒径微球个数与不同种类致病菌浓度之间具有良好的线性关系,沙门氏菌、单增李斯特菌、金黄色葡萄球菌的线性方程分别为y=127.3x+810.1、y=301x-349和y=211.7x+198(x为致病菌浓度的对数值),r2分别为0.967、0.999和0.999。
(1)将本方法与传统的单层膜分离结合机器识别识别方法进行比较
如表1所示,结果表明本发明在准确度及灵敏度上均优于传统单层膜过滤方法。传统的抽滤方法采用单层滤膜一步过滤,且未考虑滤膜与液体接触面积,极易导致滤层的形成,从而对过滤通量和准确度造成影响。而本发明采用多层复合滤膜,滤膜过滤孔径依次递减,实现了对干扰基质和目标被过滤物的多步过滤分离,不同过滤层截留的物质粒径不同,有效的避免了滤层的形成,保证了过滤通量和结果的准确性。
表1本方法和传统单层膜分离结合机器视觉识别方法对金黄色葡萄球菌检测分析性能对比
(2)液体体积与复合膜接触面积比对检测结果的影响
表2为在抽滤过程中液体体积与复合膜的不同接触面积比对金黄色葡萄球菌检测效果的影响。结果可见,液体体积与复合膜直径比越小,过滤效果越好;液体体积与复合膜直径比越大,过滤效果越差。当液体体积与复合膜直径比为20:1时,过滤效果最好;液体体积与滤膜直径比在20-30区间内,过滤通量和准确度可得到保证。
表2液体体积与复合膜的不同接触面积比对金黄色葡萄球菌检测效果的影响
- 还没有人留言评论。精彩留言会获得点赞!