一种检测DNA甲基化的荧光生物传感器、检测方法和应用
本发明涉及dna甲基化检测技术领域,具体为一种检测dna甲基化的荧光生物传感器、检测方法和应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
dna甲基化是哺乳动物基因组中最常见的表观遗传修饰之一,主要发生在胞嘧啶/鸟嘌呤二核苷酸(cpg)对中胞嘧啶残基的第五位碳原子上。通过将甲基共价添加到胞嘧啶上,dna甲基化影响基因表达的可遗传状态,而无需改变dna序列。正常的dna甲基化状态在各种生理过程中起着至关重要的作用,包括胚胎发育,基因组印记,分化,细胞记忆和衰老等。然而,异常的dna甲基化状态可能导致基因表达失调,从而引发多种疾病包括癌症,例如肺癌,肝癌,肾癌,结肠癌,乳腺癌和宫颈癌等。因此,准确而有效的检测dna甲基化对表观遗传学的研究及相关临床应用具有十分重要的意义。
迄今为止,已发展出多种dna甲基化检测方法,主要是基于对dna中胞嘧啶(c)和甲基胞嘧啶(mc)的区分。传统的检测方法包括液相色谱,毛细管电泳,质谱以及凝胶电泳等,虽然能够直接检测dna甲基化,但存在仪器昂贵,灵敏度低,特异性差,操作程序复杂等缺点。更重要的是,这些方法灵敏度低,因此需要大量的dna样品进行甲基化分析。考虑到人类基因组中甲基化的胞嘧啶仅占基因组dna总碱基数的1%这一实际情况,因此迫切需要发展一种操作简单、灵敏度高、选择性好的dna甲基化测定新方法。基于聚合酶链反应(pcr)已发展出多种扩增和灵敏检测dna甲基化的方法,包括甲基化特异性聚合酶链反应(ms-pcr)、甲基化敏感随机扩增聚合酶链反应(ms-ap-pcr)、连接介导的聚合酶链反应(lm-pcr)等,这些扩增方法不可避免存在一些明显的缺点,例如反应步骤复杂,酶/探针种类繁多,固有的非特异性扩增以及相对较高的背景信号,费时费力的预处理过程,严格的反应条件和引物设计,假阳性和非特异性扩增等,需精确控制反应温度和循环数的要求极大地限制了其广泛应用。
技术实现要素:
为了解决上述问题,本公开的目的是提供一种检测dna甲基化的荧光生物传感器、检测方法和应用,将核酸内切酶iv(endoiv)辅助信号放大与单分子荧光检测相结合,用于dna甲基化的超灵敏检测。该方法操作简单、灵敏度高、特异性好,甚至能够定量单个癌细胞中的dna甲基化水平,在疾病诊断和临床医学研究中具有巨大潜力。
具体地,本公开的技术方案如下所述:
在本公开的第一方面,提供一种检测dna甲基化的荧光生物传感器,包括限制性核酸内切酶hpaii、含有ap位点的信号探针、核酸内切酶iv和链霉亲和素修饰的磁珠;所述信号探针由生物素和cy5共同修饰。
在本公开的第二方面,提供一种检测dna甲基化检测试剂盒,所述试剂盒包括限制性内切酶hpaii、10×cutsmart缓冲液、牛血清白蛋白、生物素和cy5共修饰的含有ap位点的信号探针、链霉亲和素修饰的磁珠、1×b&w缓冲液、10×neb缓冲液3、核酸内切酶ⅳ。
在本公开的第三方面,一种检测dna甲基化的方法,所述方法包括:限制性核酸内切酶hpaii切割甲基化状态的dna得到单链dna,单链dna与含有ap位点的信号探针形成双链体,并通过生物素-链霉亲和素的相互作用,将双链体捕获到磁珠表面,添加核酸内切酶iv以裂解双链体中的ap位点,释放cy5标记的裂解信号探针和单链dna。
在本公开的第四方面,一种检测dna甲基化的荧光生物传感器或检测dna甲基化检测试剂盒或检测dna甲基化的方法在检测dna甲基化领域中的应用。
本公开中的一个或多个技术方案具有如下有益效果:
(1)、在这种生物传感器中,目标dna中的甲基化状态通过甲基化敏感限制性内切酶hpaii来区分,甲基化的dna随后可以触发信号探针在核酸内切酶iv(endoiv)辅助下的循环裂解,因此,甲基化dna的信号被有效的放大,进而可以通过基于全内反射(tirf)的单分子成像系统进行可视化和检测,大大提高了检测灵敏度。
(2)、已有方法为了提高检测灵敏度引入了多种核酸扩增方法,如指数等温扩增,链置换扩增,滚环扩增和超支化扩增等。尽管灵敏度提高了,但是这些方法通常涉及额外的模板或者特定的核酸内切酶识别序列,增加了核酸探针设计的复杂性。核酸内切酶iv(endoiv)无需特定的识别序列,即可实现对修饰有脱嘌呤/脱嘧啶(ap)位点的信号探针的切割,简化了实验方案,可以避免复杂的热循环以及非特异性扩增。
(3)、一种新型的荧光生物传感器,将核酸内切酶iv(endoiv)辅助信号放大与单分子荧光检测相结合,实现了无模板、低背景、高灵敏地检测dna甲基化,该方法简单、快速。反应在等温条件下进行,无需繁琐的操作步骤、昂贵的仪器以及放射性标记等。
(4)、核酸内切酶iv(endoiv)辅助信号放大与单分子荧光检测相结合,用于dna甲基化的超灵敏检测。单分子荧光检测与传统的荧光检测相比,具有明显优势,可实现简单灵敏的目标检测,样品消耗低,信噪比高,已成功应用于dna,microrna,蛋白,酶和细胞的生物传感。该方法能够以7.3×10-17摩尔的检测限灵敏地检测dna甲基化,并区分低至0.01%的甲基化水平,甚至可以在单个细胞水平上定量dna甲基化。
(5)、该方法灵敏度高,特异性强。检测限低至73阿摩尔,线性范围大,从100阿摩尔到100皮摩尔,可达6个数量级,检测灵敏度与等温扩增方法(0.78皮摩尔)相比提高了4个数量级,与超支化滚环扩增法(0.8飞摩尔)相比提高了10.9倍,相比基于fe@au纳米颗粒的纳米传感器方法(310阿摩尔)提高了4.2倍,并且可以区分混合物中低至0.01%的甲基化水平。
(6)、采用磁分离策略可以使来自复杂真实样本的干扰降到最低,并可以大大减少背景信号。
(7)、在一些实施方式中,基于全内反射(tirf)的单分子计数可实现目标dna甲基化信号的简单,灵敏和可视化检测,样品消耗量低且信噪比高。
附图说明
构成本公开的一部分的说明书附图用来提供对本公开的进一步理解,本公开的示意性实施例及其说明用于解释本公开,并不构成对本公开的不当限定。
以下,结合附图来详细说明本公开的实施方案,其中:
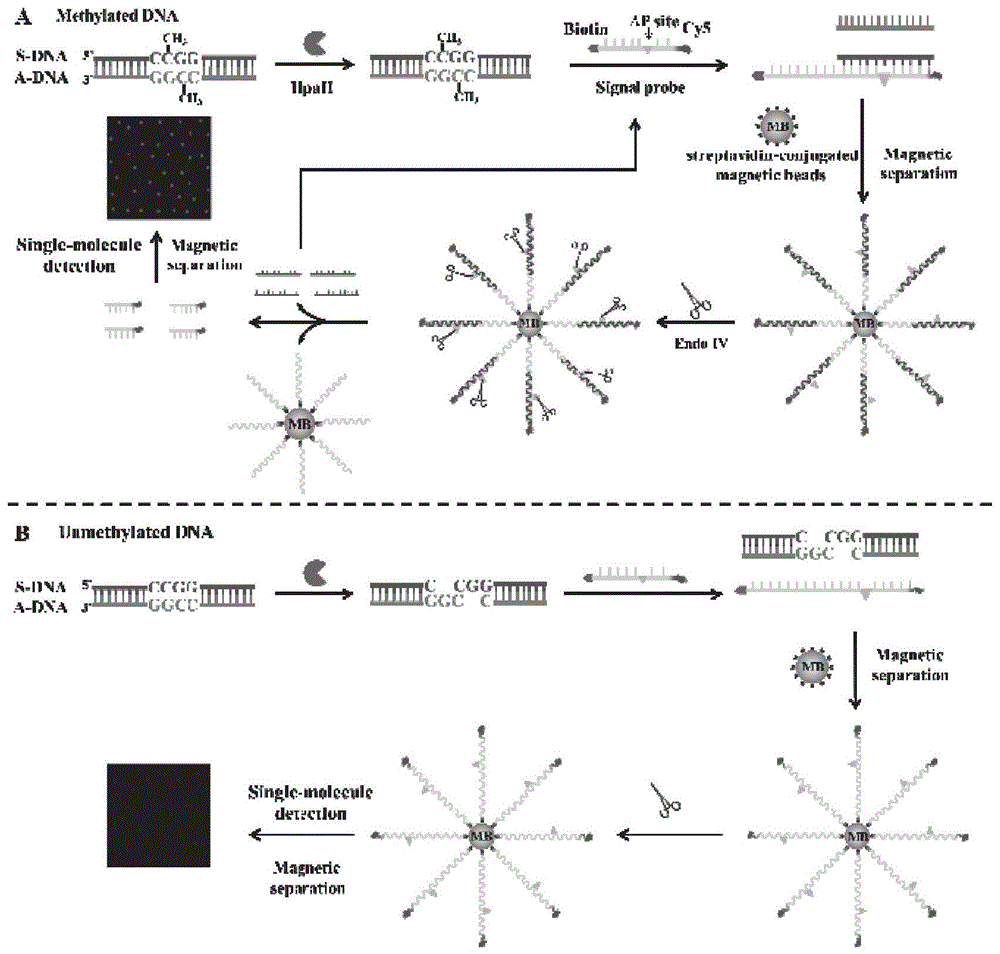
图1:单分子检测与核酸外切酶iv(endoiv)辅助信号放大相结合的dna甲基化生物传感器的原理示意图。
图2:(a)非变性聚丙烯酰胺凝胶电泳分析信号探针的裂解。泳道1,甲基化dna;泳道2,未甲基化dna;泳道3,信号探针。(b)cy5荧光发射光谱检测。上方线,甲基化dna,下方线,未甲基化dna。(c)在甲基化dna和未甲基化dna存在下的cy5单分子成像,比例尺为5微米。(d)cy5单分子计数。左侧,甲基化dna;右侧,未甲基化dna。甲基化dna的浓度为100纳摩尔,信号探针浓度为300纳摩尔,误差棒显示为三个实验的标准偏差。
图3:(a)不同浓度的信号探针对应的f/f0值。(b)不同hpaⅱ的量对应的f/f0值。(c)不同hpaⅱ反应时间对应的f/f0值。(d)不同endoiv的量对应的f/f0值。(e)不同endoiv反应时间对应的f/f0值。目标dna的浓度为100纳摩尔。误差棒显示为三个实验的标准偏差。
图4:cy5点数对应0到100纳摩尔不同浓度的甲基化dna的响应。插图显示在100皮摩尔到100纳摩尔甲基化dna浓度范围内的cy5点数与其浓度的对数呈线性相关。误差棒显示三个实验的标准偏差。
图5:(a)响应甲基化dna、未甲基化dna、随机1dna和随机2dna的cy5点数。所用dna浓度为100纳摩尔。(b)在甲基化dna和非甲基化dna的混合物中,测得的甲基化水平与输入的甲基化水平之间的相关性。甲基化和未甲基化的dna的总浓度为100皮摩尔。误差棒显示三个实验的标准偏差。
图6:(a)测定cy5点数对应分别从500个hepg2、mda-mb231、mcf-7、hela、a549和mcf-10a细胞中提取的基因组dna的响应。(b)cy5点数与hepg2细胞数的对数之间的线性关系。误差棒显示三个实验的标准偏差。
具体实施方式
下面结合具体实施例,进一步阐述本公开。应理解,这些实施例仅用于说明本公开而不用于限制本公开的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。本发明所使用的试剂或原料均可通过常规途径购买获得,如无特殊说明,本发明所使用的试剂或原料均按照本领域常规方式使用或者按照产品说明书使用。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本公开的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作和/或它们的组合。
正如背景技术所介绍的,目前的用于检测dna甲基化的方法,存在反应步骤复杂,酶/探针种类繁多,固有的非特异性扩增以及相对较高的背景信号,费时费力的预处理过程,严格的反应条件和引物设计,假阳性和非特异性扩增等技术问题,需精确控制反应温度和循环数的要求极大地限制了其广泛应用。为了解决这一些列的问题,本公开提供了一种检测dna甲基化的荧光生物传感器、检测方法和应用。
在本公开的一种实施方式中,提供一种检测dna甲基化的荧光生物传感器,包括限制性核酸内切酶hpaii、含有ap位点的信号探针、核酸内切酶iv和链霉亲和素修饰的磁珠;所述信号探针由生物素和cy5共同修饰。
进一步地,甲基化的dna的序列为5’-gctgcttcmcggctggtgc-3’
3’-cgacgaaggmccgaccacg-5’
其中加粗的mc是甲基化位点,浓度是一个梯度,不同浓度(0到100nm)的甲基化dna被检测。
进一步地,信号探针的序列为biotin-aaaaaaaaaagcaccagccxgaagcagc-cy5,其中x为无碱基位点即ap位点。
信号探针修饰有一个嘌呤/嘧啶(ap)位点,5'端和3'端分别用生物素和cy5荧光基团标记。
将核酸内切酶iv(endoiv)辅助信号放大与单分子荧光检测相结合,用于dna甲基化的超灵敏检测。选择源自细胞周期蛋白依赖性激酶抑制剂2a基因(p16)启动子区域的18碱基对的dna片段作为目标dna。dna甲基化测定的原理如图1所示,该生物传感器系统涉及四个基本要素,包括核酸内切酶hpaii,信号探针,核酸内切酶iv(endoiv)和磁珠。hpaii是一种甲基化敏感的限制性核酸内切酶,可切割含有5'-ccgg-3'对称hpaii识别位点的未甲基化dna,但胞嘧啶甲基化的5'-cmcgg-3'核苷酸序列不受影响。单链信号探针中间修饰有一个嘌呤/嘧啶(ap)位点,5'端和3'端分别用生物素和cy5荧光基团标记。核酸内切酶iv(endoiv)可以催化双链dna中ap位点的切割,但对单链dna没有活性。对于甲基化的目标dna,s-dna和a-dna均被甲基化,由于hpaii识别位点(5'-cmcgg-3')的cpg甲基化,使其对hpaii裂解具有抗性。甲基化dna的s-dna链与信号探针退火形成s-dna/信号探针双链体,并通过生物素-链霉亲和素的相互作用,将s-dna/信号探针双链体进一步捕获到磁珠表面。通过磁分离去除未结合的信号探针后,添加核酸内切酶iv(endoiv)以裂解s-dna/信号探针双链体中的嘌呤/嘧啶(ap)位点,从而释放cy5标记的裂解信号探针和s-dna。游离的s-dna随后可与新的信号探针杂交形成新的s-dna/信号探针双链体,并启动下一轮核酸内切酶iv(endoiv)诱导的信号探针裂解,释放更多cy5荧光团。通过基于全内反射荧光(tirf)的单分子成像对其进行定量。相反,未甲基化的dna在限制性核酸内切酶hpaii处理后将被完全消化。因为核酸内切酶iv(endoiv)在单链dna的嘌呤/嘧啶(ap)位点上没有活性,由于缺乏互补s-dna,信号探针不会被切割,因此无法检测到cy5信号。
在本公开的一种实施方式中,提供一种检测dna甲基化检测试剂盒,所述试剂盒包括限制性内切酶hpaii、10×cutsmart缓冲液、牛血清白蛋白(bsa)、生物素和cy5共修饰的含有ap位点的信号探针、链霉亲和素修饰的磁珠、1×b&w缓冲液、10×neb缓冲液3、核酸内切酶ⅳ。
其中,所述10×cutsmart缓冲液包括500毫摩尔醋酸钾(kac),200毫摩尔三(羟甲基)氨基甲烷-醋酸(tris-ac),100毫摩尔醋酸镁(mg(ac)2;
1×b&w缓冲液包括5毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),500微摩尔乙二胺四乙酸(edta),1摩尔氯化钠(nacl),ph7.5;
10×neb缓冲液3包括1摩尔氯化钠(nacl),500毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),100毫摩尔氯化镁(mgcl2),10毫摩尔二硫苏糖醇(dtt),ph7.9。
在本公开的一种实施方式中,一种检测dna甲基化的方法,所述方法包括:限制性核酸内切酶hpaii切割甲基化状态的dna(目标dna)得到单链dna,单链dna与含有ap位点的信号探针形成双链体,并通过生物素-链霉亲和素的相互作用,将双链体捕获到磁珠表面,添加核酸内切酶iv以裂解双链体中的ap位点,释放cy5标记的裂解信号探针和单链dna。
进一步地,形成双链体的具体过程包括:将甲基化的dna的序列、限制性内切酶hpaii混合物,进行第一次孵育,第一次孵育完成后,将生物素修饰的信号探针添加到反应混合物中,进行第二次孵育,第二次孵育完成后,缓慢冷却至室温以形成双链体。
所述第一次孵育的温度为30-45℃,有选的,为37℃。
所述第一次孵育的时间为60-100min,优选的,为80min。
所述第二次孵育的温度为90-105℃,优选的,为95℃。
所述第二次孵育的时间为3-8min,优选的,为5min。
进一步地,将链霉亲和素偶联的超顺磁珠添加到含有双链体的反应混合物中,在室温下进行第三次孵育,双链体通过生物素与链霉亲和素的相互作用连接到磁珠表面。
所述第三次孵育的时间为10-25min,优选的,为15min。
进一步地,将双链体捕获到磁珠表面之后,对磁珠进行洗涤,以去除未偶联的探针。
洗涤用的溶液为1×b&w缓冲液(5毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),500微摩尔乙二胺四乙酸(edta),1摩尔氯化钠(nacl),ph7.5),洗涤3-6次。
进一步地,磁珠洗涤之后,将磁珠重悬于含有核酸内切酶ⅳ(endoiv)的反应混合物中,进行第四次孵育。
所述第四次孵育的温度为30-45℃,优选的,为37℃。
所述第四次孵育的时间为1-3h;优选的,为1h。
进一步地,第四次孵育完成后,通过磁分离除去未释放的信号探针,对上清液进行单分子检测。
在本公开的一种实施方式中,一种检测dna甲基化的荧光生物传感器或检测dna甲基化检测试剂盒或检测dna甲基化的方法在检测dna甲基化领域中的应用。
为了使得本领域技术人员能够更加清楚地了解本公开的技术方案,以下将结合具体的实施例详细说明本公开的技术方案。
实施例1
dna甲基化的检测:
药品和材料:所有寡核苷酸都是由生工生物工程有限公司(上海,中国)进行合成和高效液相色谱法纯化。限制性内切酶hpaii(hpaii),10×cutsmart缓冲液(500毫摩尔醋酸钾(kac),200毫摩尔三(羟甲基)氨基甲烷-醋酸(tris-ac),100毫摩尔醋酸镁(mg(ac)2),100微克每毫升牛血清白蛋白(bsa),ph7.9),核酸内切酶iv(endoiv),10×neb缓冲液3(1摩尔氯化钠(nacl),500毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),100毫摩尔氯化镁(mgcl2),10毫摩尔二硫苏糖醇(dtt),ph7.9)和nebnextdna双链片段化酶(nebnextdsdnafragmentase)从新英格兰生物(伊普斯威奇,马萨诸塞州,美国)购买。链霉亲和素偶联的超顺磁珠(
首先,将含有不同浓度(100nm、50nm、10nm、100pm、10pm、1pm、100fm、10fm、1fm、100am)的甲基化的dna序列(目标dna),1微升10×cutsmart缓冲液(500毫摩尔醋酸钾(kac),200毫摩尔三(羟甲基)氨基甲烷-醋酸(tris-ac),100毫摩尔醋酸镁(mg(ac)2),100微克每毫升牛血清白蛋白(bsa),ph7.9)和8单位限制性核酸内切酶hpaii的10微升反应混合物于37摄氏度孵育80分钟。随后,将6微升1微摩尔的生物素修饰的信号探针添加到反应体系中,加水到20微升后,将反应混合物在95摄氏度下孵育5分钟,缓慢冷却至室温以形成s-dna-信号探针双链体。然后将60微升5毫克每毫升的链霉亲和素偶联的超顺磁珠添加到反应混合物中,在旋转混匀仪器上室温孵育15分钟,s-dna-信号探针双链体通过生物素与链霉亲和素的相互作用连接到磁珠表面。使用1×b&w缓冲液(5毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),500微摩尔乙二胺四乙酸(edta),1摩尔氯化钠(nacl),ph7.5)将磁珠洗涤3次,以去除未偶联的探针。之后,将磁珠重悬于含有2微升10×neb缓冲液3(1摩尔氯化钠(nacl),500毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),100毫摩尔氯化镁(mgcl2),10毫摩尔二硫苏糖醇(dtt),ph7.9)、5单位核酸内切酶ⅳ(endoiv)的20微升反应混合物中,在37摄氏度下孵育1小时。最后,通过磁分离除去未释放的信号探针,对上清液进行单分子检测。
其中,甲基化的dna的核苷酸序列为5’-gctgcttcmcggctggtgc-3’
3’-cgacgaaggmccgaccacg-5’
信号探针的核苷酸序列为biotin-aaaaaaaaaagcaccagccxgaagcagc-cy5,其中x为无碱基位点即ap位点。
单分子检测和数据分析:反应产物用成像缓冲液(10毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),50毫摩尔氯化钾(kcl),5毫摩尔氯化镁(mgcl2)、1毫摩尔6-羟基-2,5,7,8-四甲基色烷-2-羧酸(trolox),ph8.0)稀释10000倍。10微升样品滴在玻璃盖玻片上进行成像。通过全内反射荧光(tirf)显微镜(尼康,ti-e,日本)获得单个分子的图像。640纳米激光用于激发cy5荧光。使用油浸物镜(cfiapochromattirf100×)收集光子。cy5荧光成像到emccd相机上(photometrics,evolve512)。为了进行数据分析,使用imagej软件选择600×600像素的区域用于cy5分子计数,通过计算十帧获得平均cy5计数。
凝胶电泳和荧光检测:在1×tbe缓冲液(9毫摩尔三(羟甲基)氨基甲烷-盐酸(tris-hcl),9毫摩尔硼酸,0.2毫摩尔乙二胺四乙酸(edta),ph7.9)中,以1×sybrgold作为荧光指示剂,在室温、110伏恒定电压下进行20%非变性聚丙烯酰胺凝胶电泳(page)100分钟。该凝胶由chemidocmpimagingsystem(伯乐,马德里,西班牙)成像。用hitachif-7000荧光计(东京,日本)在635纳米的激发波长,650至800纳米范围内记录发射光谱。激发狭缝和发射狭缝均设置为5.0纳米,在665纳米的发射波长处的荧光强度用于数据分析。
检测混合物中dna甲基化水平:为了研究该方法准确测量混合物中dna甲基化水平的能力,通过将甲基化的dna和未甲基化的dna以不同比例混合制备了一系列混合液。甲基化和未甲基化的dna的总浓度为100皮摩尔,混合液分别包含0.01%,0.1%,1%,10%和100%的甲基化dna。测得的甲基化水平(methylationlevel)根据公式(1)计算:
其中m是通过该方法测得的甲基化dna的量,u是未甲基化dna的量。
细胞培养和基因组dna提取:人宫颈癌细胞系(hela细胞),人肺腺癌细胞系(a549细胞),人肝癌细胞系(hepg2细胞),人乳腺癌细胞系(mcf-7细胞),人乳腺癌细胞系(mda-mb231细胞)和人乳腺上皮细胞(mcf-10a细胞)获自中国科学院上海生物科学研究所细胞库(中国上海)。hela细胞、a549细胞、hepg2细胞、mda-mb231细胞和mcf-7细胞在添加了10%胎牛血清(fbs,gibco,grandisland,ny,usa)和1%青霉素-链霉素(california,ca,usa)的dulbecco改良eagle培养基(dmem,gibco,grandisland,usa)中培养。mcf-10a细胞在添加了10%胎牛血清和1%青霉素-链霉素的dulbecco改良eagle培养基/营养混合物f-12(dmem/f-12,gibco,grandisland,ny,美国)中培养。将所有细胞系在37摄氏度,含有5%二氧化碳的加湿培养箱中培养。使用qiaampdna微型试剂盒(qiagen,germany)从细胞中提取基因组dna。用nebnextdna双链片段化酶(nebnextdsdnafragmentase)将基因组dna消化至50-200碱基对。使用nanodrop2000分光光度计(thermoscientific,wilmington,u.s.a.)测定基因组dna的浓度。
验证可行性
为了证明该方法的可行性,首先利用20%的非变性聚丙烯酰胺凝胶电泳(page)通过直接激发cy5来分析核酸内切酶iv(endoiv)介导的信号探针的裂解过程。如图2a所示,在未甲基化dna存在的情况下,观察到一条完整的信号探针的带(图2a,泳道2),位置与仅有信号探针的带相同(图2a,泳道3),表明当存在未甲基化dna时,信号探针未被切割而保持完整。相反,在存在甲基化dna的情况下,信号探针的带消失了,出现一条具有较快迁移速率的被裂解的信号探针的条带,这表明在存在甲基化dna的情况下,可以有效启动核酸内切酶iv(endoiv)介导的信号探针的循环裂解。另外,进行了荧光检测,甲基化dna的存在会使荧光信号显著增强,出现最大发射波长为665纳米的cy5特征发射峰(图2b,上方线),而在未甲基化dna的情况下,则不会产生明显的荧光信号(图2b,下方线)。结果表明,dna甲基化可以诱导信号探针的循环裂解。
进一步利用基于全内反射(tirf)的单分子成像来检测信号探针的裂解。如图2c所示,甲基化dna的存在导致产生明显的cy5信号,而未甲基化dna存在时则没有观察到明显的cy5荧光信号。经计数,如图2d所示,甲基化dna的cy5计数比未甲基化dna的cy5计数高25.6倍。这些结果清楚的表明,cy5信号的单分子检测可应用于检测dna甲基化。
为获得最佳的实验效果,对信号探针的浓度进行探究,hpaii的量及其反应时间,endoiv的量及其反应时间。f/f0值用于评估测定性能,其中f和f0分别是存在和不存在甲基化dna时的cy5计数。如图3a所示,f/f0值随信号探针浓度从100到300纳摩尔的增加而增加,并在300纳摩尔的信号探针浓度时达到平台。这可以解释为,高浓度的信号探针可能导致目标s-dna-信号探针杂交体的杂交效率更高,从而提高endoiv的裂解效率,产生更多的cy5荧光基团。然而,当信号探针的浓度在循环裂解-杂交反应中达到饱和时,cy5计数没有得到明显提高。探针的浓度最佳为300纳摩尔。
甲基化敏感限制性核酸内切酶hpaii用于区分甲基化的dna和未甲基化的dna。如图3b所示,随着hpaii的量从5u增加到8u,f/f0值增加,在8u时达到最大值。如图3c所示,随着反应时间的延长,f/f0值增加,在80分钟时达到平稳(f和f0分别是存在和不存在甲基化dna时的cy5计数)。这些结果表明8uhpaii和80分钟hpaii反应时间足以用于hpaⅱ介导的靶信号识别,被选择为最佳的hpaii反应条件。
endoiv是此生物传感器中信号放大的核心酶。如图3d所示,f/f0值随着endoiv量的增加而增加,并在5u量时达到最大值。如图3e所示,f/f0值随30到60分钟的反应时间而增加,超过60分钟达到平稳状态。这些结果表明5uendoiv和endoiv60分钟反应时间足以用于endoiv介导的信号放大,因此被选择为最佳的endoiv反应条件。
检测灵敏度
在最佳的实验条件下,通过测量对不同浓度的甲基化dna的cy5计数来评估该传感器的检测灵敏度。如图4所示,cy5计数随着甲基化dna浓度从0到100纳摩尔的增加而增加。在100阿摩尔至100皮摩尔的6个数量级范围内,cy5计数与甲基化dna浓度的对数之间表现出良好的线性相关性。回归方程为n=308.74+41.14log10c,相关系数(r2)为0.9953,其中n代表cy5计数,c代表甲基化dna的浓度。通过计算对照组的平均响应值加三倍标准偏差,可计算检出限为73阿摩尔。值得注意的是,该生物传感器的灵敏度优于已报道的dna甲基化荧光检测方法,例如,与等温扩增方法(0.78皮摩尔)相比提高了4个数量级,与超支化滚环扩增法(0.8飞摩尔)相比提高了10.9倍,相比基于fe@au纳米颗粒的纳米传感器方法(310阿摩尔)提高了4.2倍。灵敏度的提高可归因于以下三个原因:(1)endoiv诱导的信号探针的循环裂解,(2)磁分离产生的近零背景信号,以及(3)单分子检测固有的高灵敏度。
特异性实验
为了评价该方法的检测特异性,使用了两个随机dna片段(随机1和随机2)作为干扰。如图5a所示,在目标甲基化dna存在的情况下检测到显着增强的cy5信号(图5a,红色柱)。相反,在随机1(图5a),随机2(图5a)以及未甲基化dna(图5a,)存在的情况下未检测到明显的cy5信号。
为了进一步研究所提出方法的特异性,将甲基化和未甲基化的dna混合成不同比例来制备一系列人混合物对dna甲基化水平进行分析,并根据等式(1)计算测得的甲基化水平:
其中m是测得的甲基化dna的浓度,u是未甲基化dna的浓度。如图5b所示,从0.01%到100%,测得的甲基化水平和实际输入的甲基化水平之间具有良好的线性关系,回归方程为y=1.044x-0.024,相关系数(r2)为0.9984,其中y是测得的甲基化水平(%),x是输入的甲基化水平(%)。值得注意的是,该方法甚至可以区分0.01%甲基化水平的样品。这些结果证明了所提出的方法对dna甲基化检测的良好选择性。
实际样品分析
为了验证所提出的方法进行实际样品分析的可行性,检测了从癌症和正常细胞(包括人肝癌细胞系(hepg2细胞),人乳腺癌细胞系(mda-mb231细胞),人乳腺癌细胞系(mcf-7细胞),人宫颈癌细胞系(hela细胞),人肺腺癌细胞系(a549细胞)和正常人上皮乳腺细胞(mcf-10a细胞)的基因组dna提取物。如图6a所示,在正常细胞系mcf-10a中没有观察到明显的cy5信号,而在hepg2细胞,mda-mb231细胞,mcf-7细胞,hela细胞和a549细胞中观察到了显著增强的cy5信号。研究表明,癌细胞中p16基因的启动子区域中dna甲基化水平升高。此外,cy5计数随着hepg2细胞数的增加而增加,并在1到10000个细胞范围内与hepg2细胞数的对数呈良好的线性关系,回归方程为n=36.46+36.94log10x,相关系数(r2)为0.9954,其中n代表cy5计数,x代表hepg2细胞的数量。这些结果表明,所提出的方法可用于准确、灵敏地定量人细胞中基因组dna甲基化,甚至可以在单个癌细胞水平上检测dna甲基化水平。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内
sequencelisting
<110>山东师范大学
<120>一种检测dna甲基化的荧光生物传感器、检测方法和应用
<130>202120009
<160>2
<170>patentinversion3.3
<210>1
<211>18
<212>dna
<213>未知
<400>1
gctgcttccggctggtgc18
<210>2
<211>27
<212>dna
<213>人工合成
<400>2
aaaaaaaaaagcaccagccgaagcagc27
- 还没有人留言评论。精彩留言会获得点赞!