一种基于即时检测试纸条的核酸检测方法、检测探针及其试剂盒
本发明涉及核酸检测技术领域,尤其涉及一种基于即时检测试纸条的核酸检测方法、检测探针及其试剂盒。
背景技术:
突发和一系列重大急性、慢性传染病一直是对人类健康危害最大、造成死亡人数最多的严重疾患。特别是一些基因型多样、结构蛋白复杂的传染性病毒,由于疫苗的研发周期较长,因此在寻找新药物的同时,现场即时精准检测(point-of-caretesting,poct)是有效排查和控制各种重大急、慢性传染病原的重要前提。目前,市面上对于突发性病毒传染病的检测方法主要为两种,一种是对病毒核酸进行检测,另一种是抗原抗体检测。由于这两种方法检测感染后的窗口期不同,核酸检测的窗口期明显短于抗原抗体检测,故更利于感染的早期筛查。因此,实现传染病的灵敏、特异、便携式的核酸检测仍然是目前不断完善和发展的目标。
近年来,随着分子诊断领域的蓬勃发展,为了开发便携式诊断系统,科学家们开创了一种新的传感理念,即利用商品化poct产品检测非原始待测物;这种方法不仅可以降低仪器开发成本,同时也可以真正实现核酸的便携式检测。该方法目前已被广泛认可,成为最有前途的便携式检测方法之一。到目前为止,借助不同的识别元件(核酸适配体和dna酶等),金属离子、小分子化合物、反式dna、蛋白质,甚至是癌细胞都可被转导至现有的poct商品化设备。在这些创新性的检测方法中,基于试纸条的便携式检测方法由于简单的操作方法和直观检测结果,在分析待测物的定性或定量分析应用中迅速发展。目前,现存的商品化早孕试纸条检测技术(angew.chem.int.ed.,2017,56,992-996)需添加多种核酸探针,且最终利用磁珠进行分离,实验过程复杂,无法达到较高的信号比。
crispr/cas系统是存在于细菌和古细菌中用于抵抗外源物质入侵的一种免疫系统。近年来,crispr/cas系统已逐渐成为基因工程中的重要工具广泛应用于基因编辑、基因表达调控及基因检测等。其中crispr/cas12a系统是一种新型的crispr/cas系统,具有rna引导的dna酶切割活性,在特异性切割双链dna(dsdna)同时能够激活cas12a的非特异性单链dna(ssdna)剪切活性。利用这一特点可针对目标dna人为设计crrna(crispr-derivedrna)与目标dna中pam(protospacer-adjacentmotif)区附近dna互补,实现对不同靶标dna的直接检测。引入带有标记的ssdna,通过激活cas12a的非特异性dna。doudna课题组(science2018,360,436-439)利用crispr/cas12a系统实现了对人乳头瘤病毒(hpv)的检测;当待测dna存在时,crrna能够特异性识别待测dna与cas12a蛋白形成三元复合体,从而激活cas12a非特异切割活性,通过切割两端分别带有荧光和猝灭基团的单链dna实现荧光检测。除应用荧光基团作为最终的输出方式外,还可利用电化学信号(angew.chem.int.ed.2019,58,17399-17405)和试纸条(natbiotechnol.2020,38,870-874)等作为表征。
目前已报道的利用早孕试纸进行基因诊断的方法仅限于待测核酸的环介导等温扩增(lamp)产物,利用一种三通型的核酸探针(为利于阐述分别以p1、p2和p3表示),其中p1的3’端标记上预表达的hcg蛋白,p2的5’端标记为磁球,3’端为立足点序列。p1、p2和p3三条单链核酸形成一个三通结构。当待测靶标的lamp产物存在时,其单链环序列lp1可与p2中的立足点序列结合,引发链取代反应,单链环序列lp3可与p3结合,三通探针的结构因此被破坏;最后利用磁铁的磁力,可将游离在溶液中的hcg与磁球分离开来,早孕试纸显阳性。相反,当不存在待测靶标的lamp产物时,探针保持三通结构,理论上溶液中无游离hcg蛋白,早孕试纸显阴性。该方法的缺陷在于:1.探针序列设计复杂,需要计算和平衡结合焓,保证链取代反应的顺利进行;2.组成三通探针的三条单链dna需优化体系浓度,保证检测反应的低背景;3.双标记探针,增加实验操作的复杂性,且不同批次磁球稳定性不同,每次更换磁球需重新优化条件;4.实验的整体设计限制了待测基因的扩增方式,仅可用于环介导等温扩增反应。5.该方法仅可进行核酸检测,不适用于小分子或蛋白质等检测。
目前,普遍采用的试纸条法对基于crispr/cas12a系统的核酸检测进行表征,主要是在检测探针两端分别标记fam以及biotin基团;这种方法使用的试纸条虽可商品化,也可以实现最终的便携式检测,但检测试纸条价格过于高昂,无形中增加了整个检测的成本,不利用大批量的进行样品检测。
技术实现要素:
有鉴于此,为了克服现有核酸检测技术的缺陷和不足,本发明提供了一种基于即时检测试纸条的核酸检测方法、检测探针及其试剂盒。该检测方法具有明显的靶标普适性,可实现多种传染性疾病的早期核酸筛查,特异性好、灵敏度高,且大大降低了检测成本。
本发明提供了一种基于即时检测试纸条的核酸检测方法,包括:
将待测核酸样本、hcg标记的单链dna探针、crrna和cas12a蛋白溶于缓冲液,反应,获得第一反应液;
在第一反应液中加入基底物质孵育,获得第二反应液;
将第二反应液滴加至早孕试纸条的样品垫上,等待5-8min,观察检测线和质控线的显色情况,判断是否含有待测核酸;
所述crrna为特异性结合待测核酸的crrna序列;
所述基底物质为能够与hcg标记的单链dna探针结合的大分子物质。
本发明中,所述待测核酸样本为:待测核酸的dna全长或片段、待测核酸的pcr产物或待测核酸的恒温扩增产物。
本发明检测方法能够应用于多种传染性疾病的早期核酸筛查,无需昂贵仪器设备和专业标准实验室,对传染性疾病的早期监测诊断与防控具有重要意义。
一些具体实施例中,利用本发明检测方法对hpv16、新冠病毒样本进行检测,具有较高的灵敏度,检测限可达2个分子拷贝数。
本发明中,hcg标记的单链dna探针简称为hcg探针。hcg探针由两部分组成,一部分为hcg蛋白,一部分为单链dna探针序列。一些实施方案中,hcg蛋白的氨基酸序列通过nh2c6修饰在所述单链dna探针的5'端。具体的,所述hcg标记的单链dna探针从5′端到3′端的组成为:hcgdna片段-nh2c6-单链dna探针。
一些具体实施例中,单链dna探针的核苷酸序列如seqidno:1所示:
seqidno:1:5-ttattttattttattctctctggatgatg-3′。
该单链dna探针的5端nh2c6为与hcg蛋白相连端,5′端第1~15nt为cas12a非特异性切割区,后14nt(第16~29nt)为lamp基底结合区。
一些实施方案中,所述基底物质为通过碱基互补与单链dna探针结合的任意序列的大分子量单链dna,或为通过化学键与单链dna探针结合的大分子物质。
一些实施方案中,所述基底物质为任意核酸序列的lamp扩增后全部产物基底。
一些实施方案中,所述缓冲液包括50-200mmnacl、10-40mmtris-hcl、10-40mmmgcl2和100-400μg/mlbsa。
一些具体实施例中,所述缓冲液包括200mmnacl、40mmtris-hcl、40mmmgcl2和400μg/mlbsa。
一些实施方案中,所述反应具体为25℃~37℃反应30~60min;所述孵育为25℃孵育20-40min。
一些具体实施例中,所述反应具体为37℃反应30min或25℃反应40-60min;所述孵育具体为25℃孵育40min。
本发明还提供一种用于核酸检测的hcg信号标记的单链dna探针,其核苷酸序列如seqidno:1所示。
本发明还提供一种核酸检测试剂盒,包含本发明所述的hcg标记的单链dna探针。
本发明核酸检测试剂盒还包括crrna、cas12a蛋白、缓冲液、rna酶抑制剂、lamp产物基底、早孕试纸条中的至少一种。
其中,所述缓冲液包括50-200mmnacl、10-40mmtris-hcl、10-40mmmgcl2和100-400μg/mlbsa。
一些具体实施例中,所述缓冲液包括200mmnacl、40mmtris-hcl、40mmmgcl2和400μg/mlbsa。
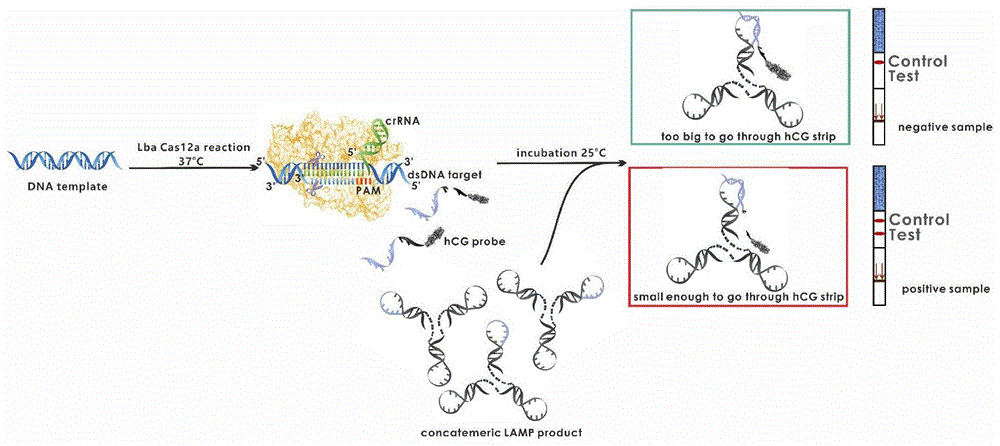
本发明核酸检测方法基于crispr/cas12a系统和早孕试纸联用,通过非特异性hcg检测探针与特异性识别待测序列的crrna序列对核酸进行检测,大大降低了检测成本,不仅能够保证检测的特异性,同时增加了整个检测的便携性。检测原理如图1所示:当待测核酸存在时,可与cas12a蛋白和crrna形成三元复合体,该复合物中cas12a的ruvc结构域行使dna酶活性,切割待测核酸dsdna。被激活的cas12a同时具有非特异性ssdna切割活性,切割带有人绒毛膜促性腺激素(hcg)信号标记的单链dna探针。未被切割的单链dna探针与结构复杂、体积较大的基底(例如lamp产物)的单链环进行特异性结合,由于基底过于庞大,故hcg不能够通过层析作用通过早孕试纸;相反,被切割的单链dna探针,由于hcg已完全游离于溶液中,即使基底存在,也能够利用层析作用通过早孕试纸。根据早孕试纸的显色情况判断样品中是否含有目标核酸。具体判定方法为:
与阴性样本的显色情况进行比较,若待测样本检测区的红色条带比阴性样本检测区的红色条带颜色深,则检测结果为阳性,表明待测样本中含有目标核酸;反之,与阴性样本检测区的颜色深浅一致或颜色更浅,则检测结果是阴性,表明样本中不含有待测核酸。
与传统试纸条法对于crispr/cas12a系统核酸检测系统的表征相比,本发明检测方法利用市场廉价的商品化早孕试纸条代替价格昂贵的检测试纸条,极大程度地降低了检测的成本;同时具有明显的检测靶标普适性,灵敏度高、特异性好,检测灵敏度可媲美荧光终点表征法,最低可检测至2个分子拷贝数。此外,本系统中所用的hcg探针及lamp基底均可进行干粉化处理,便于储存和运输。
附图说明
图1示本发明核酸检测方法的检测原理图;
图2示本发明检测方法对不同浓度的hpv-16-l1模拟双链dna的检测结果;
图3示待测基因经过恒温扩增反应后(此处以rpa反应为例)扩增产物激活crispr/cas12a系统后引发的非特异性ssdna剪切过程的示意图;
图4示实施例2早孕试纸对hpv-16-l1的检测结果;
图5示实施例3早孕试纸对新冠病毒的检测结果。
具体实施方式
本发明提供了一种基于即时检测试纸条的核酸检测方法、检测探针及其试剂盒。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的试材皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1利用本发明检测方法对hpv基因的进行检测
对hpv-16-l1模拟dna片段序列进行试纸条检测,同时对比荧光信号的输出方法,模拟dna序列如下:
attggttacaacgagcacagggccacaataatggcatttgttggggtaaccaactatttgttactgttgttgatactacacgcagtacaaatatgtcattatgtgctgccatatctacttcagaaactacatataaaaatactaactttaaggagtacctacgacatggggaggaatatgatttacagtttatttttcaactgtgcaaaataaccttaactgcagacgttatgacatacatacattctatgaattccac。
特异性结合上述模拟dna序列的crrna,其核苷酸序列为:5′-uaauuucuacuaaguguagauugaaguagauauggcagcac-3′(seqidno:2)
反应体系如下:1μmcas12a,2μmcrrna,20urnaseinhibitor(murine),14nmhcg探针,5nm/1nm/500pm/100pm/50pm/10pm/5pm/0pmhpv-16-l1模拟dna双链,共10μl混合液。将上述混合液溶于缓冲体系为200mmnacl,40mmtris-hcl,40mmmgcl2,400μg/mlbsa溶液中,37℃反应30min,加入30μl的lamp产物基底置于25℃孵育40min,取全部40μl反应液滴于早孕试纸条底部,静止5min后观察。
由图2b中所示的检测结果可以看出,在加入不同浓度核酸待测物引发cas12a切割后,试纸条检测线条带明显加深;与图2a中荧光标记的输出方式的最低检测浓度相比,早孕试纸条也可检测到5pm待测基因,同时随着待测核酸浓度的加深,检测线条带加深。
实施例2利用本发明检测方法对痕量hpv基因的进行检测
首先利用恒温扩增反应(如rpa或lamp扩增),以rpa扩增为例,对人工合成的hpv病毒的16-l1基因进行扩增,将扩增产物加入上述检测体系中,具体如图3所示。
所用的rpa扩增引物序列如下:
hpv-16-l1正向引物:ttgttggggtaaccaactatttgttactgtt(seqidno:3)。
hpv-16-l1反向引物:cctccccatgtcgtaggtactccttaaag(seqidno:4)。
rpa扩增与crispr/cas12a系统联用,反应体系如下:1μmcas12a,2μmcrrna,20urnaseinhibitor(murine),14nmhcg探针,不同拷贝数模板的rpa扩增产物2μl,共10μl混合液。将上述混合液溶于缓冲体系为200mmnacl,40mmtris-hcl,40mmmgcl2,400μg/mlbsa溶液中,37℃反应30min,加入30μl的lamp产物基底置于25℃孵育40min,取全部40μl反应液滴于早孕试纸条底部,静止5min后观察。
图4为rpa产物激活crispr/cas12a系统后引发的非特异性ssdna剪切,验孕试纸条显色图。其中阴性对照为rpa反应中模板浓度为0个分子拷贝数,阳性对照为模板浓度分别为2、20、200、2,000、20,000个分子拷贝数结果图可以看出,本发明最低可检测至2个分子拷贝数。
实施例3利用本发明检测方法对痕量新冠病毒进行检测
为了证明本发明检测方法的普适性,利用本发明检测方法对痕量的新型冠状病毒(sar-cov-2)反转录dsdna进行检测。
首先利用rpa扩增方法对新型冠状病毒中的orf1ab基因进行恒温扩增,将扩增产物直接引发crispr/cas12a系统。
新型冠状病毒orf1ab基因扩增探针序列如下:
orf1ab-f:cttgaaattccacgtaggaatgtggcaactttac(seqidno:5);
orf1ab-r:gtatgccaggtatgtcaacacataaaccttcag(seqidno:6)。
图5为orf1ab的rpa产物激活crispr/cas12a系统后引发的非特异性ssdna剪切,验孕试纸条显色图。其中,阴性对照为rpa反应中模板浓度为0个分子拷贝数,阳性对照为模板浓度分别为2、20、200、2,000、20,000个分子拷贝数。
以上结果表明,本发明检测方法具有明显的检测靶标普适性,试纸条终点检测最低可检测至2个分子拷贝数。同时加入hpv-16-l1基因的rpa扩增产物进行对照,发现该体系能够特异性检测orf1ab目标基因,即使在大量其他基因rpa产物的干扰下也不会产生假阳性的误诊情况。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中国科学院长春应用化学研究所
<120>一种基于即时检测试纸条的核酸检测方法、检测探针及其试剂盒
<130>mp21004429
<160>6
<170>siposequencelisting1.0
<210>1
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttattttattttattctctctggatgatg29
<210>2
<211>41
<212>rna
<213>人工序列(artificialsequence)
<400>2
uaauuucuacuaaguguagauugaaguagauauggcagcac41
<210>3
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>3
ttgttggggtaaccaactatttgttactgtt31
<210>4
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>4
cctccccatgtcgtaggtactccttaaag29
<210>5
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>5
cttgaaattccacgtaggaatgtggcaactttac34
<210>6
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>6
gtatgccaggtatgtcaacacataaaccttcag33
- 还没有人留言评论。精彩留言会获得点赞!