一种依他佐辛中间体的制备方法与流程
1.本发明属于化学合成及医药技术领域,具体涉及一种依他佐辛中间体的制备方法。
背景技术:
2.氢溴酸依他佐辛,由日本科研株式会社原研开发,主要用于治疗手术后疼痛以及癌症疼痛等。氢溴酸依他佐辛为阿片受体的部分激动剂,作用于k受体,选择性拮抗的方式阻断突触后受体,阻断传递疼痛信息的信使。在镇痛效果方面,依他佐辛的镇痛疗效是喷他佐辛的1
‑
2倍,临床效果良好。
3.日本专利jps60109555a、欧洲专利ep0384917a1公开了一条氢溴酸依他佐辛的合成路线(如下):以4
‑
溴苯甲醚(i
‑
2)为原料,经格氏反应再与1.3
‑
溴氯丙烷偶联制得i
‑
3,再经格氏反应、亲核加成反应制得i
‑
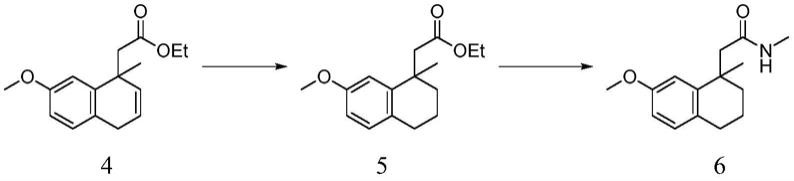
4,i
‑
4在三氯化铝催化下发生分子内关环反应制得i
‑
5,i
‑
5在丙酮中经l
‑
酒石酸拆分得到i
‑
6,i
‑
6经乙酰基保护得到i
‑
7,i
‑
7经三氧化铬/乙酸氧化制得i
‑
8,i
‑
8在氢氧化钾/甲醇中脱乙酰基保护基得到i
‑
9,i
‑
9经曼尼希缩合反应得到关环产物i
‑
10,i
‑
10经硼氢化钠还原得到i
‑
11,再经钯/碳催化下氢气还原制得i
‑
12,i
‑
12经47%氢溴酸脱甲基,成盐制得终产品氢溴酸依他佐辛(化合物1)。
[0004][0005]
其中,由4
‑
溴苯甲醚(化合物i
‑
2)至合成中间体1
‑
5【2
‑
(7
‑
甲氧基
‑1‑
甲基
‑
1,2,3,4
‑
四氢萘
‑1‑
基)
‑
n
‑
甲基乙烷
‑1‑
胺】的步骤,存在诸多不足:从原料上来看:原料如1
‑
2受到管制,不易得;1
‑3→1‑
4所使用的侧链结构无商业化供应,自制的原料来源困难;其次,从反应条件上来看:1
‑2→1‑
3、1
‑3→1‑
4等反应均涉及格氏反应,格氏试剂的使用增加了工业化生产中的危险性,且操作繁琐,条件苛刻,反应过程中存在较多副产物,收率低,不适合作为工业化生产,应用受限。
[0006]
因此,为后续制备终产品氢溴酸依他佐辛,需要一种操作较简易,条件温和,原料易得的生产2
‑
(7
‑
甲氧基
‑1‑
甲基
‑
1,2,3,4
‑
四氢萘
‑1‑
基)
‑
n
‑
甲基乙烷
‑1‑
胺路线,以适应工业化扩大生产的需求。
技术实现要素:
[0007]
为了克服上述现有技术的不足,本发明提供了一种依他佐辛中间体的制备方法。
[0008]
为实现上述目的,本发明所采用的技术方案为:
[0009]
一种依他佐辛中间体7的制备方法,所述制备方法通过化合物6,经过酰胺还原反应得到中间体7(2
‑
(7
‑
甲氧基
‑1‑
甲基
‑
1,2,3,4
‑
四氢萘
‑1‑
基)
‑
n
‑
甲基乙烷
‑1‑
胺):
[0010][0011]
以上酰胺还原反应优选采取以下路线进行:
[0012]
路线一:以路易斯酸和还原剂进行酰胺还原反应,所述路易斯酸为无水氯化钴、六水合氯化钴、无水氯化镍或六水合氯化镍,所述还原剂为硼氢化钠、硼氢化钾或硼氢化锂。
[0013]
路线二:以氢化铝锂为还原剂进行酰胺还原反应。
[0014]
其中,路线一所述路易斯酸与化合物6当量比为0.3~1.5:1;所述还原剂与化合物6当量比为0.5~5.0:1。反应溶剂选自醇类或醇醚混合;所述醇类溶剂为甲醇、乙醇、异丙醇中的一种或多种;所述醚类溶剂为四氢呋喃、2
‑
甲基四氢呋喃、甲基叔丁基醚、乙醚中的一种或多种,反应温度为
‑
20~25℃。
[0015]
路线二所述还原剂氢化铝锂与化合物6当量比为0.5~2.0:1;反应溶剂为四氢呋喃、2
‑
甲基四氢呋喃、甲基叔丁基醚或乙醚,反应温度为
‑
20~25℃。
[0016]
优选地,化合物6采用如下反应制得:室温下,化合物4以钯碳催化剂催化进行氢化还原反应,制备化合物5,然后除去催化剂,母液加入甲胺结构试剂和缚酸剂进行取代反应,制得化合物6:
[0017][0018]
所述氢化还原的反应压力0.1~25mpa;
[0019]
所述甲胺结构试剂为甲胺甲醇溶液、甲胺乙醇溶液或甲胺盐酸盐,其与化合物4当量比为2.0~10.0:1;
[0020]
所述缚酸剂为三乙胺、吡啶、n,n
‑
二异丙基乙基胺、乙二胺或4
‑
二甲氨基吡啶;其与化合物4当量比为1.0~5.0:1;取代反应温度为20~50℃。
[0021]
优选地,化合物4采用如下反应制得:化合物2经过还原反应制备化合物3,随后在碱和脱水剂的作用下,发生消除反应制备化合物4;
[0022][0023]
所述还原剂为硼氢化钠、硼氢化钾、硼氢化锂、氢化铝锂、二异丁基氢化铝或红铝,其与化合物2的当量比为0.3~1.5:1;
[0024]
所述还原反应温度为
‑
78℃~25℃;
[0025]
所述碱为吡啶、三乙胺、二乙胺、二异丙胺或1,8
‑
二氮杂二环十一碳
‑7‑
烯甲醇,其与化合物2的当量比为1.0~10:1,;
[0026]
所述脱水剂为三氯氧磷、二氯亚砜和五氧化磷中的一种,当量比为1.0~10:1;
[0027]
所述消除反应温度为50~180℃。
[0028]
更优选地,化合物4制备中还原反应的溶剂为甲醇、乙醇、异丙醇、甲基叔丁基醚、乙醚、异丙醚、四氢呋喃、2
‑
甲基四氢呋喃、1,4
‑
二氧六环中的至少一种。
[0029]
优选地,化合物2采用如下反应制得:化合物1,与碱和溴乙酸乙酯类似物,发生亲核取代反应,制备化合物2:
[0030][0031]
所述碱为氢化钠、乙醇钠、甲醇钠、叔丁醇钠、氢氧化钠、氢化钾或叔丁醇钾中的一种或多种,其与化合物1的当量比为0.8~1.8:1;
[0032]
所述溴乙酸乙酯类似物为溴乙酸乙酯、氯乙酸乙酯、碘乙酸乙酯、2
‑
(对甲苯磺酰氧基)乙酸乙酯、2
‑
(甲磺酰氧基)乙酸乙酯,其与化合物1的当量比为0.8~3:1;
[0033]
所述反应温度为
‑
30℃~50℃;反应溶剂为甲基叔丁基醚、乙醚、异丙醚、四氢呋喃、2
‑
甲基四氢呋喃、1,4
‑
二氧六环中的至少一种。
[0034]
本发明另外提供一种依他佐辛中间体7的制备方法,以化合物1作为起始原料,包含上述化合物6经过酰胺还原反应得到中间体7的步骤,该起始原料来源更为广泛,路线合成简单,包括如下步骤:
[0035]
(1)化合物1在碱的存在下,与溴乙酸乙酯发生亲核取代反应,得到化合物2:
[0036]
(2)化合物2在还原剂的作用下,经还原反应得到化合物3;
[0037]
(3)化合物3与碱和脱水剂经消除反应,得到化合物4;
[0038]
(4)化合物4在pd/c催化剂存在下经氢化还原反应,得到化合物5,
[0039]
(5)化合物5在甲胺醇溶液或甲胺盐酸盐存在下,与缚酸剂进行取代反应,得到化合物6:
[0040]
(6)化合物6在经过酰胺还原反应得到中间体7:
[0041]
合成路线如下:
[0042][0043]
本发明各反应步骤中原料易得,合成较简单,各反应条件温和,摒弃了采用格氏反应进行生产的缺陷,更易于实现工业化生产。
[0044]
优选地,步骤(1)中,碱与化合物1的当量比为0.8~1.8:1;所述溴乙酸乙酯与化合物1的当量比为0.8~3:1;所述反应温度为
‑
30℃~50℃。
[0045]
步骤(1)中碱为氢化钠、乙醇钠、甲醇钠、叔丁醇钠、氢氧化钠、氢化钾或叔丁醇钾;溴乙酸乙酯还可以被以下原料替代:氯乙酸乙酯、碘乙酸乙酯、2
‑
(对甲苯磺酰氧基)乙酸乙酯、2
‑
(甲磺酰氧基)乙酸乙酯。
[0046]
优选地,步骤(2)中,所述还原剂与化合物2的当量比为0.3~1.5:1;所述还原反应的温度为
‑
78℃~25℃。
[0047]
步骤(2)中的还原剂为硼氢化钠、硼氢化钾、硼氢化锂、氢化铝锂、二异丁基氢化铝或红铝。
[0048]
优选地,步骤(3)中,碱与化合物3的当量比为1.0~10:1,;脱水剂为与化合物3的当量比为1.0~10:1;所述消除反应的温度为50~180℃。
[0049]
步骤(3)中碱为吡啶、三乙胺、二乙胺、二异丙胺或1,8
‑
二氮杂二环十一碳
‑7‑
烯甲醇,脱水剂为三氯氧磷、二氯亚砜或五氧化磷。
[0050]
步骤(4)中,在室温条件下进行氢化还原反应,所述氢化还原反应的压力为0.1~25mpa。
[0051]
步骤(5)中,甲胺醇溶液或甲胺盐酸盐与化合物5当量比为2.0~10.0:1;缚酸剂与化合物5当量比为1.0~5.0:1;取代反应的温度为20~50℃。
[0052]
步骤(5)中甲胺醇溶液为甲胺甲醇溶液或甲胺乙醇溶液,缚酸剂为三乙胺、吡啶、n,n
‑
二异丙基乙基胺、乙二胺或4
‑
二甲氨基吡啶。
[0053]
优选地,步骤(5)中溶剂为甲醇或乙醇;步骤(3)中的溶剂为甲醇、乙醇和异丙醇、甲基叔丁基醚、乙醚、异丙醚、四氢呋喃、2
‑
甲基四氢呋喃、1,4
‑
二氧六环中的一种或多种;步骤(1)中的溶剂为甲基叔丁基醚、乙醚、异丙醚、四氢呋喃、2
‑
甲基四氢呋喃、1,4
‑
二氧六环中的一种或多种。
[0054]
与现有技术相比,本发明的有益效果是:
[0055]
本发明首次提供了一种全新的合成工艺路线用于合成依他佐辛中间体:2
‑
(7
‑
甲氧基
‑1‑
甲基
‑
1,2,3,4
‑
四氢萘
‑1‑
基)
‑
n
‑
甲基乙烷
‑1‑
胺,该工艺路线中所采用的关键起始物料均来源广泛,反应条件温和,克服了现有技术中该中间体合成方法物料可及性较差,多个工艺的反应条件较为苛刻,反应过程中存在较多的副产物,且在收率上较难提高,整体工
艺复杂,产业化生产放大受限等缺点。适合产业化生产的需求,应用价值高。
具体实施方式
[0056]
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
[0057]
下例实施例中所使用的原料、试剂等,如无特殊说明,均为可从常规市场等商业途径得到的原料和试剂,试剂均为分析纯。
[0058]
以下实施例反应过程如下:
[0059][0060]
实施例1
[0061]
称量190g的化合物1加入2l四氢呋喃,室温条件下搅拌溶解澄清,加入48g的氢化钠,搅拌分散并缓慢降温至
‑
10~0℃,随后称量217g的溴乙酸乙酯,通过恒压滴液漏斗缓慢滴加至上述料液中,期间控制料液内温在
‑
10~0℃,滴加完成后,料液保温
‑
10~0℃下反应4h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物1消耗完全,停止反应,反应液加入水淬灭,随后减压浓缩除去四氢呋喃,然后加入水和二氯甲烷萃取,分出有机相,有机相盐水洗涤后减压浓缩得到283g的粗品化合物2。
[0062]
将上一步所得的283g粗品化合物2,加入2.0l四氢呋喃,室温条件下搅拌溶解澄清,随后降温至0℃~25℃,保温0℃~25℃条件下分批多次地向体系中加入31.4g的硼氢化钠,加料完成后保温0℃~25℃下反应8h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物2消耗完全,停止反应,加入饱和氯化铵溶液淬灭,随后料液减压浓缩至无液体流出,加入二氯甲烷和水萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到258g粗品化合物3。
[0063]
室温条件下向该粗品化合物3加入815g的吡啶和316g的三氯氧磷,搅拌条件升温至100
‑
110℃下反应2h,tlc监控反应,在石油醚:乙酸乙酯=3:1(体积比)展开剂条件下,监测化合物3消耗完全,停止反应,料液倒入到冰水中淬灭,加入二氯甲烷和水,使用浓盐酸酸化水相ph=2,萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到230g粗品化合物4。
[0064]
将上一步所得的230g粗品化合物4,加入2l乙醇,室温条件下搅拌溶解澄清,随后加入24.2g的钯碳催化剂,加压至0.2mpa,常温下进行催化氢化反应12h,停止反应,料液过滤除去催化剂,过滤母液直接加入238g三乙胺和876g的33%甲胺甲醇溶液,室温条件下反应12h,随后料液减压浓缩,浓缩至无液体流出,加入乙酸乙酯携带残留溶剂继续浓缩至无液体流出,如此再重复两次,浓缩液室温条件下加入195g乙酸乙酯和290g的正庚烷搅拌溶
解澄清,随后升温至50~60℃,并保温50~60℃条件下滴加290g的正庚烷,滴加完毕后保温50~60℃搅拌1h,随后缓慢梯度降温至0~10℃下保温搅拌5h,过滤,滤饼45℃下减压干燥得到121g的化合物6,纯度96.4%,以化合物1计,经过5步反应收率为48.9%。
[0065]
将上一步所得的121g纯化品化合物6,加入1.2l的四氢呋喃,搅拌溶解澄清,随后降温至
‑
10~5℃,保温
‑
5~10℃条件下分批多次地加入18.6g氢化铝锂,加料完毕后保温
‑
5~10℃条件下反应5h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物6消耗完全,停止反应,加入十水合硫酸钠淬灭,过滤取滤液,滤液浓缩后加入二氯甲烷和水并使用盐酸酸化ph=2,分液取有机相,有机相加入水后使用30%氢氧化钠溶液碱化ph=11,萃取,有机相使用盐水洗涤,分出的有机相浓缩液后得到106g的化合物7,呈油状淡黄色液体,收率92.8%,纯度95.7%。
[0066]
实施例2
[0067]
称量190g的化合物1加入2l四氢呋喃,室温条件下搅拌溶解澄清,加入48g的氢化钠,搅拌分散并缓慢降温至0~10℃,随后称量184g的溴乙酸乙酯,通过恒压滴液漏斗缓慢滴加至上述料液中,期间控制料液内温在0~10℃,滴加完成后,料液保温0~10℃下反应3h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物1消耗完全,停止反应,反应液加入水淬灭,随后减压浓缩除去四氢呋喃,然后加入水和二氯甲烷萃取,分出有机相,有机相盐水洗涤后减压浓缩得到282g的粗品化合物2。
[0068]
将上一步所得的282g粗品化合物2,加入2.0l甲醇,室温条件下搅拌溶解澄清,随后降温至
‑
30℃~
‑
20℃,保温
‑
30℃~
‑
20℃条件下分批多次地向体系中加入31.4g的硼氢化钠,加料完成后保温
‑
30℃~
‑
20℃下反应2h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物2消耗完全,停止反应,加入饱和氯化铵溶液淬灭,随后料液减压浓缩至无液体流出,加入二氯甲烷和水萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到273g粗品化合物3。
[0069]
室温条件下向该粗品化合物3加入652g的吡啶和316g的三氯氧磷,搅拌条件升温至100
‑
110℃下反应2h,tlc监控反应,在石油醚:乙酸乙酯=3:1(体积比)展开剂条件下,监测化合物3消耗完全,停止反应,料液倒入到冰水中淬灭,加入二氯甲烷和水,使用浓盐酸酸化水相ph=2,萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到238g粗品化合物4。
[0070]
将上一步所得的238g粗品化合物4,加入2l乙醇,室温条件下搅拌溶解澄清,随后加入24.2g的钯碳催化剂,常温常压下进行催化氢化反应20h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物4消耗完全,停止反应,料液过滤除去催化剂,过滤母液直接加入190g三乙胺和701g的33%甲胺甲醇溶液,室温条件下反应12h,随后料液减压浓缩,浓缩至无液体流出,加入乙酸乙酯携带残留溶剂继续浓缩至无液体流出,如此再重复两次,浓缩液室温条件下加入195g乙酸乙酯和290g的正庚烷搅拌溶解澄清,随后升温至50~60℃,并保温50~60℃条件下滴加290g的正庚烷,滴加完毕后保温50~60℃搅拌1h,随后缓慢梯度降温至0~10℃下保温搅拌5h,过滤,滤饼45℃下减压干燥得到129g的化合物6,纯度96.4%,以化合物1计,经过5步反应收率为52.2%。
[0071]
将上一步所得的129g纯化品化合物6,加入0.75l的四氢呋喃和0.25l的甲醇,搅拌溶解澄清,室温条件下加入138g的六水合氯化镍,随后降温至
‑
5~10℃,保温
‑
5~10℃条件下分批多次地加入10g硼氢化钠,加料完毕后保温
‑
5~10℃条件下反应6h,tlc监控反应,在
石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物6消耗完全,停止反应,加入5%盐酸淬灭,随后料液浓缩,加入二氯甲烷和水并使用浓盐酸酸化ph=2,分液取有机相,有机相加入水后使用30%氢氧化钠溶液碱化ph=11,萃取,有机相盐水洗涤,分出的有机相浓缩液后得到92.0g的化合物7,呈油状淡黄色液体,收率75.0%,纯度94.5%。
[0072]
实施例3
[0073]
称量190g的化合物1加入2l四氢呋喃,室温条件下搅拌溶解澄清,加入82g的乙醇钠,搅拌分散并缓慢降温至
‑
10~0℃,随后称量217g的溴乙酸乙酯,通过恒压滴液漏斗缓慢滴加至上述料液中,期间控制料液内温在
‑
10~0℃,滴加完成后,料液保温
‑
10~0℃下反应6h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物1消耗完全,停止反应,反应液加入水淬灭,随后减压浓缩除去四氢呋喃,然后加入水和二氯甲烷萃取,分出有机相,有机相盐水洗涤后减压浓缩得到283g的粗品化合物2。
[0074]
将上一步所得的283g粗品化合物2,加入2.0l乙醇,室温条件下搅拌溶解澄清,随后降温至
‑
20℃~
‑
10℃,保温
‑
20℃~
‑
10℃条件下分批多次地向体系中加入31.4g的硼氢化钠,加料完成后保温
‑
20℃~
‑
10℃下反应5h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物2消耗完全,停止反应,加入饱和氯化铵溶液淬灭,随后料液减压浓缩至无液体流出,加入二氯甲烷和水萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到271g粗品化合物3。
[0075]
室温条件下向该粗品化合物3加入489g的吡啶和316g的三氯氧磷,搅拌条件升温至100
‑
110℃下反应2h,tlc监控反应,在石油醚:乙酸乙酯=3:1(体积比)展开剂条件下,监测化合物3消耗完全,停止反应,料液倒入到冰水中淬灭,加入二氯甲烷和水,使用浓盐酸酸化水相ph=2,萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到235g粗品化合物4。
[0076]
将上一步所得的235g粗品化合物4,加入2l甲醇,室温条件下搅拌溶解澄清,随后加入24.2g的钯碳催化剂,加压至0.2mpa,常温下进行催化氢化反应4h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物4消耗完全,停止反应,料液过滤除去催化剂,过滤母液直接加入143g三乙胺和626g的33%甲胺甲醇溶液,室温条件下反应12h,随后料液减压浓缩,浓缩至无液体流出,加入乙酸乙酯携带残留溶剂继续浓缩至无液体流出,如此再重复两次,浓缩液室温条件下加入195g乙酸乙酯和290g的正庚烷搅拌溶解澄清,随后升温至50~60℃,并保温50~60℃条件下滴加290g的正庚烷,滴加完毕后保温50~60℃搅拌1h,随后缓慢梯度降温至0~10℃下保温搅拌5h,过滤,滤饼45℃下减压干燥得到128g的化合物6,纯度95.9%,以化合物1计,经过5步反应收率为51.8%。
[0077]
将上一步所得的128g纯化品化合物6,加入0.75l的2
‑
甲基四氢呋喃和0.25l的甲醇,搅拌溶解澄清,室温条件下加入37g的六水合氯化钴,随后降温至
‑
5~10℃,保温
‑
5~10℃条件下分批多次地加入100g硼氢化钠,加料完毕后保温
‑
5~10℃条件下反应3h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物6消耗完全,停止反应,加入5%盐酸淬灭,随后料液浓缩,加入二氯甲烷和水并使用浓盐酸酸化ph=2,分液取有机相,有机相加入水后使用30%氢氧化钠溶液碱化ph=11,萃取,有机相盐水洗涤,分出的有机相浓缩液后得到102g的化合物7,呈油状淡黄色液体,收率83.2%,纯度91.5%。
[0078]
实施例4
[0079]
称量190g的化合物1加入2l四氢呋喃,室温条件下搅拌溶解澄清,加入82g的乙醇
钠,搅拌分散并缓慢降温至0~10℃,随后称量184g的溴乙酸乙酯,通过恒压滴液漏斗缓慢滴加至上述料液中,期间控制料液内温在0~10℃,滴加完成后,料液保温0~10℃下反应4h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物1消耗完全,停止反应,反应液加入水淬灭,随后减压浓缩除去四氢呋喃,然后加入水和二氯甲烷萃取,分出有机相,有机相盐水洗涤后减压浓缩得到285g的粗品化合物2。
[0080]
将上一步所得的285g粗品化合物2,加入1.8l四氢呋喃和0.2l乙醇,室温条件下搅拌溶解澄清,随后降温至
‑
10℃~10℃,保温
‑
10℃~10℃条件下分批多次地向体系中加入31.4g的硼氢化钠,加料完成后保温
‑
10℃~10℃下反应2h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物2消耗完全,停止反应,加入饱和氯化铵溶液淬灭,随后料液减压浓缩至无液体流出,加入二氯甲烷和水萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到275g粗品化合物3。
[0081]
室温条件下向该粗品化合物3加入652g的吡啶和316g的三氯氧磷,搅拌条件升温至100
‑
110℃下反应2h,tlc监控反应,在石油醚:乙酸乙酯=3:1(体积比)展开剂条件下,监测化合物3消耗完全,停止反应,料液倒入到冰水中淬灭,加入二氯甲烷和水,使用浓盐酸酸化水相ph=2,萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到242g粗品化合物4。
[0082]
将上一步所得的242g粗品化合物4,加入2l甲醇,室温条件下搅拌溶解澄清,随后加入24.2g的钯碳催化剂,常温常压下进行催化氢化反应16h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物4消耗完全,停止反应,料液过滤除去催化剂,过滤母液直接加入95g三乙胺和438g的33%甲胺甲醇溶液,室温条件下反应12h,随后料液减压浓缩,浓缩至无液体流出,加入乙酸乙酯携带残留溶剂继续浓缩至无液体流出,如此再重复两次,浓缩液室温条件下加入195g乙酸乙酯和290g的正庚烷搅拌溶解澄清,随后升温至50~60℃,并保温50~60℃条件下滴加290g的正庚烷,滴加完毕后保温50~60℃搅拌1h,随后缓慢梯度降温至0~10℃下保温搅拌5h,过滤,滤饼45℃下减压干燥得到130g的化合物6,纯度96.2%,以化合物1计,经过5步反应收率为52.6%。
[0083]
将上一步所得的130g纯化品化合物6,加入1l的乙醇,搅拌溶解澄清,室温条件下加入75g的无水氯化钴,随后降温至
‑
5~10℃,保温
‑
5~10℃条件下分批多次地加入80g硼氢化钠,加料完毕后保温
‑
5~10℃条件下反应3h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物6消耗完全,停止反应,加入5%盐酸淬灭,随后料液浓缩,加入二氯甲烷和水并使用浓盐酸酸化ph=2,分液取有机相,有机相加入水后使用30%氢氧化钠溶液碱化ph=11,萃取,有机相盐水洗涤,分出的有机相浓缩液后得到111g的化合物7,呈油状淡黄色液体,收率90.5%,纯度94.5%。
[0084]
实施例5
[0085]
称量190g的化合物1加入2l四氢呋喃,室温条件下搅拌溶解澄清,加入82g的乙醇钠,搅拌分散并缓慢降温至0~10℃,随后称量184g的溴乙酸乙酯,通过恒压滴液漏斗缓慢滴加至上述料液中,期间控制料液内温在0~10℃,滴加完成后,料液保温0~10℃下反应3h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物1消耗完全,停止反应,反应液加入水淬灭,随后减压浓缩除去四氢呋喃,然后加入水和二氯甲烷萃取,分出有机相,有机相盐水洗涤后减压浓缩得到285g的粗品化合物2。
[0086]
将上一步所得的285g粗品化合物2,加入2l四氢呋喃,室温条件下搅拌溶解澄清,
随后降温至
‑
10℃~10℃,保温
‑
10℃~10℃条件下分批多次地向体系中加入31.4g的硼氢化钠,加料完成后保温
‑
10℃~10℃下反应8h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物2消耗完全,停止反应,加入饱和氯化铵溶液淬灭,随后料液减压浓缩至无液体流出,加入二氯甲烷和水萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到275g粗品化合物3。
[0087]
室温条件下向该粗品化合物3加入652g的吡啶和316g的三氯氧磷,搅拌条件升温至100
‑
110℃下反应2h,tlc监控反应,在石油醚:乙酸乙酯=3:1(体积比)展开剂条件下,监测化合物3消耗完全,停止反应,料液倒入到冰水中淬灭,加入二氯甲烷和水,使用浓盐酸酸化水相ph=2,萃取分液,有机相盐水洗涤,分出有机相进行浓缩后得到242g粗品化合物4。
[0088]
将上一步所得的242g粗品化合物4,加入2l甲醇,室温条件下搅拌溶解澄清,随后加入24.2g的钯碳催化剂,常温常压下进行催化氢化反应16h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物4消耗完全,停止反应,料液过滤除去催化剂,过滤母液直接加入95g三乙胺和438g的33%甲胺甲醇溶液,室温条件下反应12h,随后料液减压浓缩,浓缩至无液体流出,加入乙酸乙酯携带残留溶剂继续浓缩至无液体流出,如此再重复两次,浓缩液室温条件下加入195g乙酸乙酯和290g的正庚烷搅拌溶解澄清,随后升温至50~60℃,并保温50~60℃条件下滴加290g的正庚烷,滴加完毕后保温50~60℃搅拌1h,随后缓慢梯度降温至0~10℃下保温搅拌5h,过滤,滤饼45℃下减压干燥得到130g的化合物6,纯度96.2%,以化合物1计,经过5步反应收率为52.6%。
[0089]
将上一步所得的130g纯化品化合物6,加入1.2l的四氢呋喃,搅拌溶解澄清,随后降温至
‑
10~5℃,保温
‑
5~10℃条件下分批多次地加入20g氢化铝锂,加料完毕后保温
‑
5~10℃条件下反应5h,tlc监控反应,在石油醚:乙酸乙酯=5:1(体积比)展开剂条件下,监测化合物6消耗完全,停止反应,加入十水合硫酸钠淬灭,过滤取滤液,滤液浓缩后加入二氯甲烷和水并使用盐酸酸化ph=2,分液取有机相,有机相加入水后使用30%氢氧化钠溶液碱化ph=11,萃取,有机相使用盐水洗涤,分出的有机相浓缩液后得到113g的化合物7,呈油状淡黄色液体,收率92.1%,纯度96.5%。
[0090]
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1