一种高产唾液酸乳糖的重组宿主菌及其构建方法和应用
本发明涉及代谢工程技术领域,尤其是涉及一种高产唾液酸乳糖的重组宿主菌及其构建方法和应用。
背景技术:
人乳寡糖(hmos)是人类母乳中仅次于乳糖和脂肪的第3大固体组分,不仅种类多,且含量较高,特别是在分娩后的初乳中,有着牛乳、羊乳等其他动物的母乳远所不如的寡糖含量。现已证实,hmos具有效益生元作用,可以选择性刺激肠道内有益菌的生长,间接抑制有害菌的生长,维持肠道微生态平衡,从而最大限度地降低消化道疾病的发生,进而改善宿主婴儿的健康状况,这种循序渐进、立体和全方位的保护兼培养性功能,为新生儿消化系统的发育和成熟提供了宝贵的时间和良好的环境。唾液酸寡糖就是含有一个或若干个唾液酸分子的一类寡糖化合物,广泛分布在各种生物组织中,具有重要的生物信息传递等功能。同时作为hmos中最主要的两种寡糖组成之一,唾液酸寡糖也表现出了独特的生理活性和优越的市场潜力。hmos中唾液酸寡糖的主要存在形式有两种:3’-sl和6’-sl,他们分别由α-2,3和α-2,6唾液酸糖基转移酶催化一分子唾液酸和一分子乳糖脱水缩合而成。
目前关于发酵法制备唾液酸乳糖,国内外已有相关专利和文献公布。根据发酵底物的不同,主要分为补救路径和从头合成路径。在补救路径中是以唾液酸和乳糖为合成底物制备唾液酸乳糖,2002年ericsamain使用补救合成路径,以e.colijm107为宿主,敲除neuac醛缩酶基因(nana)和β-半乳糖苷酶基因(lacz),过表达cmp-neuac合成酶和唾液酸转移酶,以唾液酸和乳糖为合成底物,甘油为碳源进行发酵,可生成2.6g/l3’-唾液酸乳糖。2008年ericsamain以从头合成路径制备3’-唾液酸乳糖(图2),通过敲除neuac转运子(nant),neuac醛缩酶基因(nana),n-乙酰甘露糖胺激酶基因(nank),n-乙酰甘露糖胺-6-6磷酸差向异构酶基因(nane),过表达乙酰神经氨酸合成酶基因(neub),cmp-乙酰神经氨酸合成酶基因(neua),n-乙酰葡萄糖胺异构酶基因(neuc)以及a-2,3-唾液酸转移酶,以乳糖为合成底物,甘油作为碳源发酵制备3’-唾液酸乳糖,可生成25.5g/l3’-唾液酸乳糖。2010年ericsamain课题组同样以从头合成构建6’-唾液酸乳糖路径,仅将3’-唾液酸乳糖从头合成路径中的a-2,3-唾液酸转移酶更改为a-2,6-唾液酸转移酶,发酵获得34g/l6’-唾液酸乳糖。
南开大学在2016年申请的发酵法生产唾液酸乳糖的技术方案是以葡萄糖为底物,利用分子生物学手段敲除7个基因,分别为neuac转运子(nant),neuac醛缩酶基因(nana),n-乙酰甘露糖胺激酶基因(nank),n-乙酰甘露糖胺-6-6磷酸差向异构酶基因(nane),葡萄糖胺-6-磷酸脱氨酶基因(nagb),n-乙酰葡糖胺-6-磷酸乙酰酶基因(naga),β-半乳糖苷酶基因(lacz)和过表达5个基因,分别为乙酰神经氨酸合成酶基因(neub),cmp-乙酰神经氨酸合成酶基因(neua),n-乙酰葡萄糖胺异构酶基因(neuc),β-半乳糖苷透性酶基因(lacy),唾液酸转移酶基因(lst)使唾液酸乳糖代谢流增加,通过该途径可发酵生成2-4g/l3’-唾液酸乳糖。此外,中科院微生物所2017年同样申请了唾液酸乳糖发酵制备的工程菌株构建方法,该方法敲除了大肠杆菌中聚唾液酸转移酶基因(neus),β-半乳糖苷酶基因(lacz)及分解n-乙酰神经氨酸相关的基因簇(nanketa),仅过表达唾液酸转移酶基因(nst)后即可进行唾液酸乳糖的发酵合成。
但是以上的技术方案得到的唾液酸乳糖的产量较低,达不到工业化生产的需求。
技术实现要素:
本发明的目的在于克服上述现有技术的不足之处而提供一种高产唾液酸乳糖的重组宿主菌及其构建方法和应用,本发明通过分子生物学手段,构建不同辅因子及不同拷贝数的再生菌株方案,优化细胞内辅因子ctp供应量,获得最佳唾液酸乳糖发酵产量。通过过表达ctp合成酶或利用不同拷贝数的表达载体串联表达cmk和ppk基因,优化底物ctp含量,实现唾液酸乳糖产量的提高。
为实现上述目的,本发明采取的技术方案为:
本发明的第一目的是提供一种高产唾液酸乳糖的重组宿主菌,所述重组宿主菌过表达pyrg基因和/或串联过表达一个或多个拷贝数的cmk和ppk的基因。
本发明采用ctp合成相关基因的再生过表达或减少ctp代谢消耗优化ctp在产物合成中的供应,进一步提高目的产物的发酵产量。其中胞苷单磷酸激酶(cmk)和多磷酸激酶(ppk)协同表达能够完成ctp的体内再生,增加底物ctp供应量,实现唾液酸乳糖产量的提高。
作为本发明所述重组宿主菌的优选实施方式,所述重组宿主菌包括(1)、(2)、(3)、(4)和(5)中的至少一种,其中:
(1)过表达pyrg基因;
(2)以petduet为载体串联表达cmk基因和ppk基因;
(3)以pacycduet为载体串联表达cmk基因和ppk基因;
(4)以pcdfduet为载体串联表达cmk基因和ppk基因;
(5)以prsfduet为载体串联表达cmk基因和ppk基因。
作为本发明所述重组宿主菌的优选实施方式,所述cmk基因和ppk基因拷贝数≤2。
ctp是唾液酸乳糖合成路径中关键底物,常规发酵过程是以细胞自身代谢过程产生的ctp用以于合成唾液酸乳糖。细胞自身代谢过程中ctp除了自身代谢需要外,用于唾液酸乳糖合成代谢流有限。所以提高细胞内ctp供应是提高唾液酸乳糖产量的首要考虑,但ctp含量过高会抑制cmp-sa合成酶活性,同样会影响唾液酸乳糖的合成,因此细胞中合适的ctp供应至关重要。
作为本发明所述重组宿主菌的优选实施方式,所述重组宿主菌以pacycduet为载体过表达一个pyrg基因和串联过表达一个cmk基因和一个ppk基因。
本发明的第二目的是提供了上述重组宿主菌的构建方法,包括以下步骤:
s1.在宿主菌中降低或消除基因nane、基因nant、基因nank、基因nana的活性;
s2.在宿主菌中降低或消除基因lacz的活性。
作为本发明所述重组宿主菌的构建方法的优选实施方式,所述构建方法还包括以下步骤:
s1.在宿主菌中降低或消除基因naga和基因nagb的活性;
s2.在宿主菌中过表达pyrg基因和/或过表达cmk基因和ppk基因。
作为本发明所述重组宿主菌的构建方法的优选实施方式,所述降低或消除n-乙酰甘露糖胺-6-磷酸差向异构酶、neu5ac转运子、n-乙酰甘露糖胺激酶、neu5ac醛缩酶活性分别是通过敲除基因nane、nant、nank、nana实现,降低或消除n-乙酰葡糖胺-6-磷酸乙酰酶和葡萄糖胺-6-磷酸脱氨酶是通过敲除基因naga和nagb实现,降低或消除β-半乳糖苷酶活性通过敲除基因lacz实现。
作为本发明所述重组宿主菌的构建方法的优选实施方式,所述nane基因的ncbi登录号为aac76255.1;所述nant基因的ncbi登录号为aac76256.2;所述nank基因的ncbi登录号为aac76254.2;所述nana基因的ncbi登录号为aac76257.1;所述naga基因的ncbi登录号为aac73771.1;所述nagb基因的ncbi登录号为aac73772.1;所述lacz基因的ncbi登录号为aac73447.1。
作为本发明所述重组宿主菌的构建方法的优选实施方式,所述基因nane、nant、nank、nana的敲除和鉴定引物的核苷酸序列如seqidno.1-seqidno.4所示,所述基因lacz的敲除和鉴定引物的核苷酸序列如seqidno.9-seqidno.12所示。
作为本发明所述重组宿主菌的构建方法的优选实施方式,所述基因nagb的敲除和鉴定引物的核苷酸序列如seqidno.5-seqidno.8所示。
所述基因nane、nant、nank、nana的敲除和鉴定引物的核苷酸序列如seqidno.1-seqidno.4所示,所述基因nagb的敲除和鉴定引物的核苷酸序列如seqidno.5-seqidno.8所示,所述基因lacz的敲除和鉴定引物的核苷酸序列如seqidno.9-seqidno.12所示。
在本发明的一种实施方式中,所述构建方法步骤s4如下:
将含有ctp合成酶的pyrg基因构建至表达载体pet-22b(+)bamhi和hindiii位点之间,形成重组质粒pet-pyrg,将重组质粒pet-pyrg转至宿主菌中。
在本发明的一种实施方式中,所述构建方法步骤s4如下:
1)分别以petduet-1、pacycduet-2、pcdfduet-2和prsfduet-2为载体,构建petduet-ppk-cmk、pacycduet-ppk-cmk、pcdfduet-ppk-cmk、prsfduet-ppk-cmk、pacycduet-ppk-ppk-cmk和pacycduet-ppk-cmk-cmk、pacycduet-ppk-cmk-pyrg、pacycduet-pyrg-ppk-cmk八种重组载体;
2)将上述六种重组载体分别转入宿主菌中。
作为本发明所述重组宿主菌的构建方法的优选实施方式,所述宿主菌为含t7rna聚合酶的大肠杆菌。
本发明的第三目的是提供了上述重组宿主菌或所述重组宿主菌的构建方法在生产唾液酸乳糖中的应用。
本发明还提供了所述重组宿主菌生产唾液酸乳糖的方法,是以5%接种量的重组宿主菌接种于培养基(采用文献nicolasfierfort,ericsamain.geneticengineeringofescherichiacolifortheeconomicalproductionofsialylatedoligosaccharides[j].journalofbiotechnology134(2008)261-265中所述培养基),待底料中甘油消耗完全,进行甘油补料及iptg诱导,同时乳糖补料速度5g/l/h,用氨水调节ph6.8,发酵90h。
与现有技术相比,本发明具有以下有益效果:
本发明通过优化代谢路径中底物辅因子ctp的供应量来进一步的提高目的产物在发酵液中的含量;通过辅因子ctp的再生或者过表达ctp合成酶基因优化细胞内的底物辅因子的供应,无需外源性的添加辅因子,降低生产成本,并且还可以利用不同拷贝数的表达载体串联表达编码胞苷单磷酸激酶基因和多磷酸激酶基因,优化底物ctp含量,实现唾液酸乳糖产量的提高。
附图说明
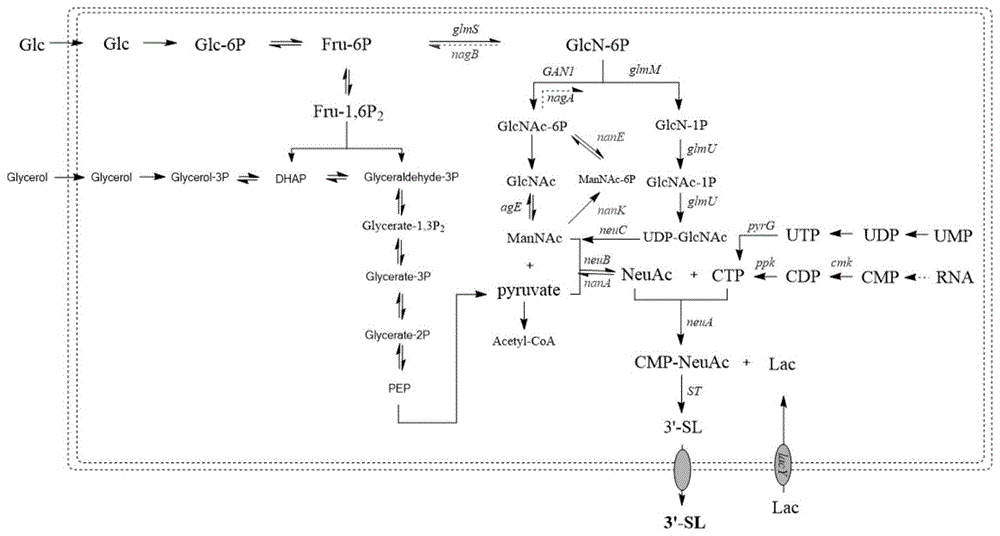
图1为宿主菌唾液酸乳糖代谢路径示意图;
图2为重组质粒构建流程图;
图3为各重组宿主菌的唾液酸乳糖产量示意图。
具体实施方式
为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
在以下实施例中,未注明具体条件者,按照常规条件或制造商建议的条件进行,所用仪器或试剂未注明生产厂商者,均为可以市售购买获得的常规产品。
在以下实施例中,培养基采用文献(nicolasfierfort,ericsamain.geneticengineeringofescherichiacolifortheeconomicalproductionofsialylatedoligosaccharides[j].journalofbiotechnology134(2008)261-265)所述的培养基)。
培养条件:
菌种培养:甘油管划线,然后挑取单菌落划线平板37℃培养,作为种子来源;
种子培养:平板挑取菌体,37℃,220r/min,根据要求添加氨苄青霉素100μg/ml,卡那霉素50μg/ml,链霉素50μg/ml,氯霉素34μg/ml,培养约12h,转接发酵培养基;
发酵培养:以5%接种量转接,待底料中甘油消耗完全,进行甘油补料及添加0.1mmiptg诱导,同时乳糖补料速度5g/l/h,用氨水调节ph6.8,37℃,220r/min培养,发酵90h。
在以下实施例中,α-2,3唾液酸转移酶基因、胞苷单磷酸激酶(cmk)和多磷酸激酶(ppk)其序列参照cn110396532a中的seqidno.2-seqidno.4。
唾液酸乳糖hplc分析方法:
利用高效液相色谱仪进行唾液酸乳糖含量检测,其设备要求如下:色谱柱:wondasilc18-wr(5μm,250×4.6mm),岛津高效液相色谱lc-15c,流速:0.6ml/min,柱温:30℃,波长:210nm,流动相:20mmph8磷酸盐溶液,进样量10μl,唾液酸乳糖保留时间在5.48min。
实施例1、大肠杆菌合成唾液酸乳糖相关重组宿主菌的构建
1、重组质粒的制备:利用限制性内切酶位点bamhi和noti将neubca基因(2832bp)构建至pcoladuet-1载体(3719bp)mcs1上,形成重组质粒pcoladuet-bca(6500bp)。涉及酶切位点为bglii和avrii的引物使得sialytransferase基因(α-2,3唾液酸转移酶基因)扩增后3’端带有6×his组氨基酸标签,利用限制性内切酶bglii和avrii分别对扩增产物和重组质粒pcoladuet-bca进行双酶切,利用限制性内切酶ndei和avrii将sialytransferase基因构建至pcoladuet-bcamcs2上,形成重组质粒pcoladuet-bca-st(7608bp)。将重组质粒转入e.colidh5a大肠杆菌感受态细胞中,孵育后涂布至含卡那霉素抗生素平板中,培养至可见单菌落后挑取进行pcr鉴定,得到阳性克隆保种备用,构建步骤如图2所示。
2、底盘细胞的构建:
采用λred同源重组法进行基因敲除以构建底盘细胞,每个基因敲除后均进行抗性基因的消除。敲除基因nana、nank、nane、nant的具体步骤为:
a)打靶片段制备,使用敲除引物,以pkd4质粒为模板,使用高保真聚合酶进行pcr扩增。目的产物经dpni限制性内切酶消化后除去模板质粒并经琼脂糖凝胶回收获得打靶片段。
b)制备电转感受态细胞,电击转入pkd46质粒,快速加入新鲜lb液体培养基并30℃孵育2h后涂板含氨苄抗性平板,30℃过夜培养至可见单菌落,挑取单菌落于含氨苄的lb液体培养基中培养过夜。按照1%接种量转接于含氨苄的lb液体培养基中,30℃培养2h后添加终浓度50mm的阿拉伯糖进行诱导,继续培养至菌液od约0.5左右进行bl21star(de3)/pkd46电转感受态制备。
c)混合打靶片段和bl21star(de3)/pkd46感受态细胞后进行电击转化,电击后快速加入新鲜lb液体培养基并37℃孵育2h后涂板含卡那抗性平板,37℃过夜培养至可见单菌落,挑取多个单菌落于含卡那的lb液体培养基中培养过夜,之后使用鉴定引物进行菌液pcr鉴定打靶片段是否成功插入基因组中。鉴定正确菌株保种备用并按照1%接种量转接于于含卡那的lb液体培养基中,37℃培养至菌液od约0.5左右进行bl21star(de3)nanetka::frt-kan-frt电转感受态制备。
d)电击转入pcp20质粒于bl21star(de3)nanetka::frt-kan-frt感受态中,电击后快速加入新鲜lb液体培养基并30℃孵育2h后涂板含氨苄抗性平板,30℃过夜培养至可见单菌落,挑取单菌落于无抗的lb液体培养基中42℃培养过夜以消除抗性基因片段,经鉴定引物扩增验证和测序后比对正确菌株保种备用(见表1)。
其余基因(基因nagb和基因lacz)敲除与上述敲除步骤相同,将上述7个基因敲除后的菌株转入重组质粒pcoladuet-bca-st进行发酵培养得bl21star(de3)δlaczδnanketaδnagb/pcoladuet-bca-st(命名为sl-1),以5%接种量接种二级种子液bl21star(de3)δlaczδnanketaδnagb/pcoladuet-bca-st于5l罐中,采用上述培养基及培养条件,得唾液酸乳糖含量25g/l。其中唾液酸乳糖代谢途径参考图1。
所述nane基因的ncbi登录号为aac76255.1;所述nant基因的ncbi登录号为aac76256.2;所述nank基因的ncbi登录号为aac76254.2;所述nana基因的ncbi登录号为aac76257.1。
表1基因敲除及鉴定引物
实施例2、大肠杆菌合成唾液酸乳糖相关重组宿主菌的构建
1、重组质粒的制备:与实施例1相同。
2、底盘细胞的构建:与实施例1相同。
3、将含有ctp合成酶的pyrg基因(登录号为aac75822.1)构建至表达载体pet-22b(+)bamhi和hindiii位点之间,形成重组质粒pet-pyrg,将重组质粒pet-pyrg转至bl21star(de3)δlaczδnanketaδnagb/pcoladuet-bca-st感受态细胞中,得到重组菌株bl21star(de3)δlaczδnanketaδnagb/pcoladuet-bca-st/pet-pyrg(命名为sl-2),使用上述实施例1中的培养基,按相同接种及培养方式,发酵90h后唾液酸乳糖含量30g/l。
实施例3、大肠杆菌合成唾液酸乳糖相关重组宿主菌的构建
1、重组质粒的制备:与实施例1相同。
2、底盘细胞的构建:与实施例1相同。
3、利用酶切位点bamhi和hindiii将胞苷单磷酸激酶(cmk)基因和多磷酸激酶(ppk)基因片段分别与表达载体petduet-1、pacycduet-2、pcdfduet-2和prsfduet-2连接,获得重组载体petduet-ppk-cmk(命名为sl-3)、pacycduet-ppk-cmk(命名为sl-4)、pcdfduet-ppk-cmk(命名为sl-5)、prsfduet-ppk-cmk(命名为sl-6),通过酶切位点bamhi和hindiii将胞苷单磷酸激酶(cmk)基因和多磷酸激酶(ppk)基因片段分别与表达载体pcdfduet-ppk-cmk连接,获得pcdfduet-ppk-ppk-cmk和pcdfduet-ppk-cmk-cmk,质粒构建过程可参见专利cn110396532a。
将重组载体petduet-ppk-cmk、pacycduet-ppk-cmk、pcdfduet-ppk-cmk、prsfduet-ppk-cmk转至bl21star(de3)δlaczδnanketaδnagb/pcoladuet-bca-st感受态细胞中,分别得到重组菌株sl-3、sl-4、sl-5和sl-6。
将重组载体pacycduet-ppk-ppk-cmk、pacycduet-ppk-cmk-cmk和pacycduet-pyrg-ppk-cmk转至bl21star(de3)δlaczδnanketaδnagb/pcoladuet-bca-st感受态细胞中,得到重组菌株sl-7、sl-8和sl-9。其中sl-1、sl-2、sl-3、sl-4、sl-5、sl-6、sl-7、sl-8和sl-9的基因型如表2所示。
表2
将重组菌株sl-2、sl-3、sl-4、sl-5、sl-6、sl-7、sl-8、sl-9和sl-1分别在上述的培养基及培养条件下发酵培养,发酵90h后检测上述重组菌株sl-2、sl-3、sl-4和sl-5的唾液酸乳糖含量,发现含重组质粒pacycduet-ppk-cmk的重组菌株(sl-4)含量最佳,可达37g/l;发酵90h后检测重组菌株sl-7和sl-8的唾液酸乳糖含量,结果发现含重组质粒pacycduet-pyrg-ppk-cmk的重组菌株(sl-9)含量最佳,可达45g/l,参照图3。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>中国科学院合肥物质科学研究院、武汉中科光谷绿色生物技术有限公司
<120>一种高产唾液酸乳糖的重组宿主菌及其构建方法和应用
<130>2021.01.19
<160>12
<170>patentinversion3.5
<210>1
<211>69
<212>dna
<213>nanaket-rf引物
<400>1
ggtataaaggtatatcgtttatcagacaagcatcacttcagaggtatttgtgtaggctgg60
agctgcttc69
<210>2
<211>69
<212>dna
<213>nanaket-rr引物
<400>2
aacgcaggatgtaacccagcagacggtaatgactgtacttcacccatcaatgggaattag60
ccatggtcc69
<210>3
<211>19
<212>dna
<213>nanaket-df引物
<400>3
tgccactttagtgaagcag19
<210>4
<211>19
<212>dna
<213>nanaket-dr引物
<400>4
ttgtcgccctgtaattcgt19
<210>5
<211>70
<212>dna
<213>nagb-rf引物
<400>5
aaagatgcctaatccgccaacggcttacattttacttattgaggtgaatagtgtaggctg60
gagctgcttc70
<210>6
<211>70
<212>dna
<213>nagb-rr引物
<400>6
attttaaaaaatattgccctgagcaaggagccagggcagggataacaattatgggaatta60
gccatggtcc70
<210>7
<211>20
<212>dna
<213>nagb-df引物
<400>7
tttgtcaccaaatatcgtta20
<210>8
<211>20
<212>dna
<213>nagb-dr引物
<400>8
cagttccgctaccggacaga20
<210>9
<211>70
<212>dna
<213>lacz-rf引物
<400>9
atgaccatgattacggattcactggccgtcgttttacaacgtcgtgactggtgtaggctg60
gagctgcttc70
<210>10
<211>70
<212>dna
<213>lacz-rr引物
<400>10
ttatttttgacaccagaccaactggtaatggtagcgaccggcgctcagctatgggaatta60
gccatggtcc70
<210>11
<211>20
<212>dna
<213>lacz-df引物
<400>11
tgtgtggaattgtgagcgga20
<210>12
<211>20
<212>dna
<213>lacz-dr引物
<400>12
aatggatttccttacgcgaa20
- 还没有人留言评论。精彩留言会获得点赞!