一种用于新型冠状病毒N蛋白表达的大肠杆菌表达培养基的制作方法
本发明属于生物技术领域,具体涉及一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基。
背景技术:
大肠杆菌是外源基因表达的主要宿主之一,它的应用非常广泛,且具有遗传背景清楚,技术操作简单,培养条件简单,抗污染能力强,大规模发酵经济等优点。2019-ncov蛋白分为:刺突糖蛋白(s蛋白)、包膜糖蛋白(e蛋白)、膜糖蛋白(m蛋白),和核衣壳蛋白(n蛋白)。为获得新型冠状病毒n蛋白,我们将带有能表达n蛋白的外源基因的质粒转化至大肠杆菌中进行诱导表达,并做纯化。通常大肠杆菌的发酵培养基配为lb培养基,但带有n蛋白外源基因的大肠杆菌在lb培养基中经诱导表达后,它所产生的蛋白除了n蛋白之外,还有大量杂蛋白,其中部分杂蛋白经多种纯化方式仍然无法除去。
技术实现要素:
针对现有技术普遍存在的缺陷,本发明提供了一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基。使用本发明制备的培养基培养的含有新型冠状病毒n蛋白基因的大肠杆菌bl21,其表达的蛋白中杂蛋白的量大大减少,降低了后期纯化难度。
为了达到上述目的,本发明采用的技术方案为:
一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基,包含蛋白胨,酵母提取物及a试剂。
优选地,所述蛋白胨的添加量为10g,所述酵母提取物的添加量为5g。
优选地,所述a试剂由磷酸氢二钠和磷酸二氢钾两种成分组成。
优选地,所述磷酸氢二钠的最终质量浓度为1.45-5.8g/l;所述磷酸二氢钾的最终质量浓度为0.13-0.52g/l。
优选地,所述a试剂为c4h11no3·hcl。
优选地,所述c4h11no3·hcl最终质量浓度为1.576-4.728g/l。
本发明还提供所述培养基的制备方法,制备过程如下:用天平称取培养基中各组分的量,用900ml的纯化水溶解,并混合均匀,然后用浓度为1mol/l的naoh溶液调节ph值至8.5,用纯化水定容至1l,于121℃下高压灭菌20min即得。
本发明提供的培养基是发明人通过大量试验,对lb液体培养基进行改良,去掉了lb液体培养基中本来含有的nacl,使大肠杆菌所表达的蛋白中杂蛋白的量减少,从而方便后续的蛋白的纯化。
与现有技术相比,本发明提供的培养基具有如下优势:使用本专利配方的培养基培养含有新型冠状病毒n蛋白基因的大肠杆菌bl21,其表达的蛋白中杂蛋白的量减少了,在23kd附近的一条杂带含量明显减弱。这减少了非特异性蛋白对后续纯化的影响,降低了后期纯化难度。
附图说明
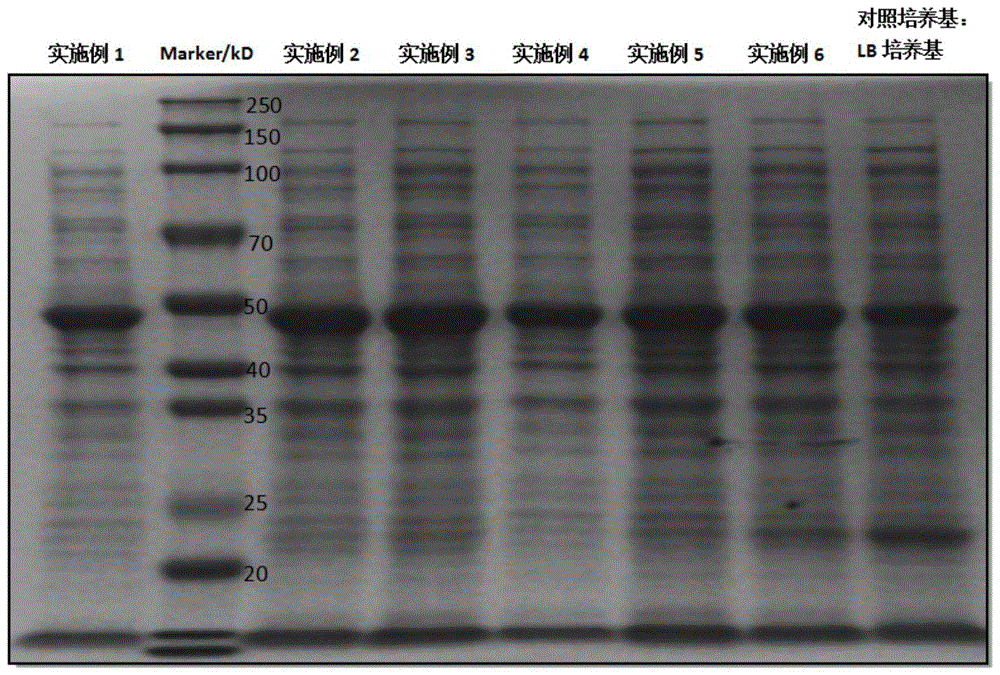
图1为本发明提供的大肠杆菌表达培养基的实施例的结果验证图。
具体实施方式
下面结合具体实施例对本发明作进一步解释,但是应当注意的是,以下实施例仅用以解释本发明,而不能用来限制本发明,所有与本发明相同或相近的技术方案均在本发明的保护范围之内。本实施例中未注明具体技术或条件者,按照本领域常规技术方法和仪器说明书内容进行操作;所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
本发明中涉及到的各试剂的制备过程如下:
①50mg/mlkan(卡那霉素)溶液配制:利用分析天平称取卡那霉素0.5g,经超纯水溶解并定容至10ml,0.22μm滤膜过滤除菌,分装至1.5ml离心管中,标记抗生素名称、储液浓度及配制日期,-20℃于不透光的容器中保存。工作液浓度为50μg/ml。
②1mol/liptg(异丙基-β-d-硫代半乳糖苷)溶液配制:利用分析天平称取iptg2.3830g,超纯水溶解并定容至10ml,0.22μm滤膜过滤除菌,分装至1.5ml离心管中,标记溶液名称、储液浓度及配制日期,-20℃保存。
③1llb固体培养基配制:10g蛋白胨+5g酵母提取物+10g氯化钠+15g琼脂粉,纯化水溶解并定容至1l。121℃,20min高压灭菌,冷却至55℃。根据需要的抗性浓度添加相应比例的抗生素溶液(kan),按无菌操作规范倒平板,晾干,标记平板抗性类型和配制日期,封口膜密封后,4℃倒置保存2个月。备注:加有抗生素的固体培养基4℃下可保存半个月,所述固体培养基仅用于细菌单菌落的培养,后面的细菌培养均是选择液体培养基。
④1llb液体培养基配制:10g蛋白胨+5g酵母提取物+10g氯化钠,纯化水溶解并定容至1l,于121℃,高压灭菌20min,即得。
⑤30%(w/v)丙烯酰胺配制:称取290g丙烯酰胺,10g甲叉双丙烯酰胺于烧杯中,加入600ml的去离子水,充分搅拌溶解,用去离子水定容至1l,避光4℃保存。注意:丙烯酰胺具有很强的神经毒性,可通过皮肤吸收,且作用具有积累性,配制时应带好手套等。
⑥分离胶缓冲液(1.5mtris,ph8.8)配制:称取181.6gtris于烧杯中,加入800ml的去离子水,充分搅拌溶解,加入盐酸调节ph至8.8,用去离子水定容至1l,室温保存。
⑦浓缩胶缓冲液(1mtris,ph6.8):称取121.1gtris于烧杯中,加入800ml的去离子水,充分搅拌溶解,加入盐酸调节ph至6.8,用去离子水定容至1l,室温保存。
⑧10%(w/v)sds:称取10gsds于烧杯中,加入100ml的去离子水,搅拌溶解。
⑨10%(w/v)过硫酸铵:称取1g过硫酸铵于离心管中,加入10ml的去离子水,搅拌溶解,储存于4℃或-20℃保存(4℃可保存2周,-20℃可保存1个月)。
⑩sds-page电泳缓冲液(10xtris-glycinebuffer):称取30.3gtris,144gglycine,10gsds置于烧杯中,加入约800ml的去离子水,搅拌溶解,加去离子水将溶液定容至1l后,室温保存。
sds-page上样缓冲液(5x):称取0.5gsds,25mg溴酚蓝置于塑料离心管中,吸取1.25mltris-hci(1m,ph6.8),2.5ml甘油于离心管中,加入去离子水溶解后定容至5ml,小份分装后,于室温包装。使用前加入5%(体积比)的β-巯基乙醇(可室温保存1个月)。
考马斯亮蓝r-250染色液:称取1g考马斯亮蓝r-250,置于烧杯中,量取250ml的异丙醇加入烧杯中,搅拌溶解,加入100ml的冰醋酸,搅拌均匀,加入650ml的去离子水,搅拌均匀,用滤纸除去颗粒物质后,室温保存。
考马斯亮蓝染色脱色液:量取100ml醋酸,50ml乙醇于烧杯中,加入850ml的去离子水于烧杯中,充分混合。
实施例1一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基
所述培养基包括10g蛋白胨,5g酵母提取物及1.576gc4h11no3·hcl。
所述培养基的制备过程为:将上述各组分用900ml纯化水溶解,然后用摩尔浓度为1mol/l的氢氧化钠溶液调节ph值至8.5,用纯化水稀释至1l,于121℃、0.12mpa的高压下灭菌20min,即得。
实施例2一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基
所述培养基包括10g蛋白胨,5g酵母提取物及3.152gc4h11no3·hcl;
所述培养基的制备过程与实施例1类似。
实施例3一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基
所述培养基包括10g蛋白胨,5g酵母提取物及4.728gc4h11no3·hcl;
所述培养基的制备过程与实施例1类似。
实施例4一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基
所述培养基包括10g蛋白胨,5g酵母提取物,1.45g磷酸氢二钠,0.13g磷酸二氢钾。
所述培养基的制备过程为:将所述组分加入至900ml纯化水中溶解,然后继续加纯化水定容至1l,置于121℃下高压灭菌20min,即得。
实施例5一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基
所述培养基包括10g蛋白胨,5g酵母提取物,2.9g磷酸氢二钠,0.26g磷酸二氢钾;
所述培养基的制备过程与实施例4类似。
实施例6一种用于新型冠状病毒n蛋白表达的大肠杆菌表达培养基
所述培养基包括10g蛋白胨,5g酵母提取物,5.8g磷酸氢二钠,0.52g磷酸二氢钾;
所述培养基的制备过程与实施例4类似。
试验例菌株培养及其验证过程
1.试验样品:实施例1-6组配制的培养基。
2.试验过程:具体试验过程如下:
在具体试验前,先将带有能表达n蛋白的外源基因的质粒转化至大肠杆菌,具体过程为:从genbank中查找登录的新冠n蛋白序列,将序列发送至纽克泰公司合成质粒。质粒载体为pet-28a(+),浓度为500ng/μl。通过热激法将1μl质粒转化至感受态大肠杆菌bl21,冰上孵育5分钟后加入300μl不含抗性的lb复苏10min(摇床37℃,220rpm)后涂布于含50μg/mlkan+的lb平板上,于37℃恒温箱中孵育过夜。次日,挑取1个阳性克隆至5ml新鲜的含50μg/mlkan+的lb液体培养基中,摇床37℃,220rpm孵育8小时后,取600μl菌液,加入300ul70%灭菌甘油,混合均匀,即为本发明所用的菌种,冻至-80℃冰箱。
(1)将2019-ncov-2-n菌种从-80℃冰箱中取出放在冰盒上;
(2)划平板:用灭菌后的接种针取部分菌种在固体卡那抗性平板上划线,划好后倒置于37℃的lb固体培养箱中培养14h;
(3)培养结束后,分别挑取单菌落于5ml,置于终浓度为50μg/mlkana的lb液体培养基(对照培养基)和6组实施例培养基中,将上述培养基置于37℃恒温震荡培养14h;
(4)将步骤(3)培养的各菌液按2%(v/v)的比例分别按顺序接种至新鲜的终浓度50μg/mlkana抗性、体积为50ml的lb液体培养基(对照培养基)和6组实施例培养基中,于37℃、260rpm恒温震荡培养(nano300测定菌液od600吸光度值);
(5)当od600达到0.6~0.8时加入50μl浓度为1mol/l的iptg,于37℃、220rpm下诱导10h;
(6)将诱导后的产物置于25℃,9000rpm转速下离心3min,回收菌体置于无菌50ml离心管中;
(7)向离心管中加入3ml、20mm的tris-hcl(ph8.5)洗涤菌体一次,涡旋震荡,于25℃,9000rpm转速下离心3min,收集菌体,标记菌种名称及实验日期;
(8)将1ml收集到的诱导后的菌体再次用20mmtris-hcl(ph8.5)洗涤一次后,于25℃,12000rpm转速下离心1min,重新收集菌体沉淀;
(9)向菌体沉淀内加入100μl、20mm的tris-hcl(ph8.5)重悬菌体;
(10)将sds-page上样缓冲液(5×)与菌体重悬液按1:4比例混匀,于干式加热仪上100℃加热10min,制成待测样品;
(11)sds-page蛋白电泳胶制备:按以下表1、表2所述的比例制备相应浓度的胶体。
表15%的page浓缩胶配制
表210%的page分离胶配制
(12)按顺序向胶孔中添加已制备好的样品各20μl,并做好相关实验记录;
(13)样品浓缩过程,将电泳条件设置:100v,80ma(10%的sds-page凝胶,所述sds-page凝结共两层,上层为浓缩胶,下层为分离胶,使用时,待下层分离胶凝固之后,再加上层浓缩胶凝固);
(14)当样品指示带电泳至浓缩胶与分离胶界面时,调整电泳条件至:130v,100ma;
(15)当指示带电泳至离胶板底部约1cm时,即可停止电泳,关闭电源;
(16)染胶:取出胶板,用起胶器分理出胶体,并将胶体置于染色液中,确保染色液量充足。将装有染色液的盒子置于旋转水平摇床中,室温80rpm振荡40min;(17)脱色:将染色液中的胶体取出,并用超纯水缓慢冲洗两遍,避免冲坏胶体,然后将胶体转移入盛有足量脱色液的盒子,并将盒子置于旋转水平摇床中,室温80rpm振荡2h,期间更换1~2次脱色液以便更快速的脱色。
3.试验结果:具体试验结果如图1所示,图1中,sds-page胶为浓缩胶5%,分离胶10%,对照培养基为液体lb培养基。marker购于上海雅酶生物公司;由表1可知,采用本发明实施例1-6培养基制成的菌液中,n蛋白杂带明显低于对照组培养基。
最后应当说明的是,上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!