一种检测新型冠状病毒的PNA探针结构及合成方法
本发明属于病毒技术领域,具体涉及一种检测新型冠状病毒的pna探针结构及合成方法。
背景技术:
所有生物除朊病毒外都含有核酸,核酸包括脱氧核糖核酸(dna)和核糖核酸(rna)。新型冠状病毒是一种仅含有rna的病毒,病毒中特异性rna序列是区分该病毒与其他病原体的标志物,即靶序列。
检测新型冠状病毒特异序列的方法中最常见的是荧光定量pcr(聚合酶链式反应)。核酸检测的试剂实际上是一段特异性寡核苷酸序列,该序列是与病毒中特异性rna靶序列相匹配的,两者通过碱基配对原理杂交后,释放出荧光信号,从而特异性识别病毒。
在众多的核酸探针中,荧光核酸探针主要采用荧光强度作为定量分析的信号,具有灵敏度高、设计多样化和定量分析能力强等特点,成为分析化学的研究热点之一。但荧光核酸探针也存在背景噪音大,识别特异性不十分理想,有假阳性信号等缺点。
pna是一种人工合成的具有多肽骨架的dna类似物,正因为与dna及其相似的结构,pna能够通过watson-crick碱基互补形式与单链核酸杂交形成双螺旋的稳定复合物。更重要的是,pna与dna、rna的亲和性也比dna更强,杂交稳定性大大提升,并且在watson-crick原则上不能允许一个碱基错配,特异性也大大提高,此外,对核酸酶与蛋白酶有着的良好的抗性。正是基于这三点,pna肽核酸探针有着更好的灵敏度,更强的稳定性和更高的选择性,更有发展意义。
核酸探针检测是诊断的主要和重要的测试手段,但其瓶颈在于检测速度,检测灵敏度及检测准确度(或特异性或选择性)需要提高。因此,现需要一种能够解决以上问题的检测新型冠状病毒的pna探针结构及合成方法。
技术实现要素:
本发明的目的是提供一种检测新型冠状病毒的pna探针结构及合成方法,能够提高新型冠状病毒的检测速度、灵敏度和准确度。
本发明提供了如下的技术方案:
一种检测新型冠状病毒的pna探针结构,以肽核酸(即pna)为骨架模拟和取代常规dna或rna中磷酸戊糖酯骨架,即探针骨架为pna骨架;pna侧链上用以杂交识别的碱基序列的正确顺序,即为下列顺序:5'-fam-ccgtctgcggtatgtggaaaggttatgg-bhq1-3'或者5‘-fam-ttgctgctgcttgacagatt-tamra-3’。
一种检测新型冠状病毒的pna探针结构的合成方法,制备0.1mmolpna的方法包括如下步骤:
s1:将0.1g树脂与适量dmf加入柱反应器中,振摇溶胀30min后抽干,dmf洗6次,每次振摇3min,抽干;将fmoc-肽核酸单体0.5mmol、dcc0.5mmol、hosu0.5mmol、dmap0.1mmol用适量dmf溶解,半小时后转移至固相反应器,加入适量dmf避光振摇反应3h,反应结束后抽干,用dmf、dcm、meoh分别洗3次,每次振摇3min,抽干;
s2:向s1制备的溶液中加入脱保护试剂20%(v/v)哌啶/dmf溶液,振摇30min脱下树脂上的首个pna单体的保护基fmoc,抽干,dmf洗6次,每次振摇3min,抽干;将从碱基序列3’→5’第二个fmoc-pna单体0.3mmol、dcc0.3mmol、hosu0.3mmol、dmap0.1mmol用适量dmf溶解,半小时后转移至装有肽核酸-树脂的固相反应器,加入适量dmf避光振摇反应3h;反应结束后抽干,用dmf、dcm、meoh分别洗3次,每次振摇3min,抽干;重复s2中的上述步骤,脱去n-末端的fmoc保护基,进入连接下一个肽核酸单体循环,不断两两缩合,直至合成预期得到的寡聚体;最后一次缩合完成后,得到的寡聚体-树脂以甲醇洗5次,每次振摇2min,抽干,抽真空干燥过夜,称重;
s3:称取s2步骤中制得的一定量寡聚体-树脂复合物放入反应器中,并按比例配好切割试剂,均放入冰箱中冷却数分钟;向反应器中缓慢加入切割剂,室温下磁力搅拌3h;过滤,加入4ml裂解溶液重复切割0.5h;过滤,用10ml90%tfa/dcm洗涤树脂,洗涤液与滤液一并转入烧瓶,35℃减压蒸馏;浓缩液逐滴滴入十倍体积的预冷乙醚,振荡,冰箱静置30min;高速离心,倒去上清液,真空干燥过夜,得粗产品;用重蒸水溶解,冻干,得到白色粉末,称重。
5’端头荧光团的键合包括如下步骤:
s1:fam-pna合成,
加入脱保护试剂20%(v/v)哌啶/dmf溶液,振摇30min脱下树脂上的fmoc保护基,抽干,dmf洗6次,每次振摇3min,抽干;将fam(5-羧基荧光素)0.3mmol、dcc0.3mmol、hosu0.3mmol、dmap0.1mmol用适量dmf溶解,转移至装有pna-树脂的固相反应器,加入适量dmf避光振摇反应3h;反应结束后抽干,用dmf、dcm、meoh分别洗3次,每次振摇3min,抽干;
s2:fam-pna-tamra合成,
将tamra(罗丹明)0.3mmol、dcc0.3mmol、hosu0.3mmol、dmap0.1mmol用适量dmf溶解,加入s1中切割下的粗pna中,避光振摇反应3h;反应结束后加水淬灭,减压旋干,加入乙醚振荡洗涤,冰箱静置30min;高速离心,小心倒去上清,真空干燥过夜,得粗产物;用重蒸水溶解,冻干,得到白色粉末,即fam-pna-tamra。
优选的,s1中fmoc-肽核酸单体0.5mmol为碱基序列3’端开始的首个碱基的肽核酸单体;s2中pna单体顺序按3’→5’逐个延长。
优选的,s2步骤中通过茚三酮显色法测定缩合反应的游离氨基,判断反应进行是否完全。
优选的,取s2步骤中制得的数十粒碱基-树脂复合物放入试管中,加入dmf洗涤3次;分别加入两滴茚三酮溶液;120℃加热3min;观察树脂的颜色。
优选的,s2步骤中5g水合茚三酮溶于100ml乙醇中,稍加热或搅拌促溶。
优选的,s1步骤中的树脂为1mmol/g。
优选的,s1和s2步骤中分别共加入5ml的dmf。
优选的,s3步骤中切割试剂tfa:edt:苯甲醚=38:1:1,时间为3.5h,温度为26℃,乙醚沉淀粗肽。
本发明的有益的效果:
本发明的pna与带有负电荷的dna和rna不同,pna的骨架为中性,与dna和rna之间不存在静电斥力,结合的稳定性大为提高;
pna的骨架与dna/rna不同,但与dna/rna的结合仍然严格遵守watson-crick原则,可用较短的序列(12~15mer)更快地形成杂交链,可识别单碱基错配,因此能够提高新型冠状病毒的检测速度、灵敏度和准确度;
pna几乎不与蛋白质作用,因而毒性作用很小;
pna与dna或rna的杂交几乎不受杂交体系盐浓度影响;
pna探针的高敏感性和特异性应用到微生物或病毒的检测方法中,其样品的前处理,与传统的检测技术非常相似,可以直接得到确切的结果,无需再进行其他检测;
pna的合成比dna合成难度低,且收率高;
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
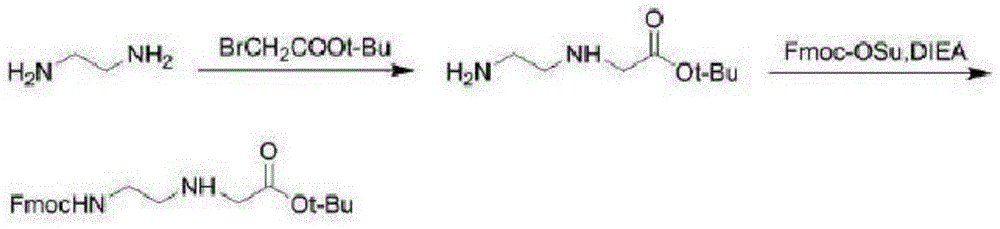
图1是本发明pna骨架合成示意图;
图2是本发明碱基乙酰化示意图;
图3是本发明pna单体合成示意图;
图4是本发明pna寡聚体的合成示意图。
具体实施方式
如图1至图4所示,一种检测新型冠状病毒的pna探针结构,以肽核酸(即pna)为骨架模拟和取代常规dna或rna中磷酸戊糖酯骨架,即探针骨架为pna骨架;pna侧链上用以杂交识别的碱基序列的正确顺序,即为下列顺序:5'-fam-ccgtctgcggtatgtggaaaggttatgg-bhq1-3'或者5‘-fam-ttgctgctgcttgacagatt-tamra-3’。
一种检测新型冠状病毒的pna探针结构的合成方法,制备0.1mmolpna的方法包括如下步骤:
s1:将0.1g1mmol/g树脂与适量dmf加入柱反应器中,振摇溶胀30min后抽干,dmf洗6次,每次振摇3min,抽干;将fmoc-肽核酸单体0.5mmol(按pna探针结构内所强调碱基序列3’端开始的首个碱基的肽核酸单体)、dcc0.5mmol、hosu0.5mmol、dmap0.1mmol用适量dmf溶解,半小时后转移至固相反应器,加入适量dmf(共5ml)避光振摇反应3h,反应结束后抽干,用dmf、dcm、meoh分别洗3次,每次振摇3min,抽干。
s2:向s1制备的溶液中加入脱保护试剂20%(v/v)哌啶/dmf溶液,振摇30min脱下树脂上的fmoc保护基,抽干,dmf洗6次,每次振摇3min,抽干;将从碱基序列3’→5’第二个fmoc-pna单体0.3mmol、dcc0.3mmol、hosu0.3mmol、dmap0.1mmol用适量dmf溶解,半小时后转移至装有肽核酸-树脂的固相反应器,加入适量dmf(共5ml)避光振摇反应3h;反应结束后抽干,用dmf、dcm、meoh分别洗3次,每次振摇3min,抽干;
通过茚三酮显色法测定缩合反应的游离氨基,判断反应进行是否完全,其原理是游离的α-氨基与茚三酮共热,引起氨基酸氧化脱氨、脱羧反应,然后,茚三酮与反应产物(氨)和还原茚三酮发生作用,生成一种紫色的物质(dyda);取s2步骤中制得的数十粒碱基-树脂复合物放入试管中,加入dmf洗涤3次;分别加入两滴茚三酮溶液(5g水合茚三酮溶于100ml乙醇中,稍加热或搅拌促溶);120℃加热3min;观察树脂的颜色;无色表明树脂上的游离氨已全部连接下一个fmoc-碱基,可以进行下一步操作;若树脂呈蓝紫色,则说明连接反应不完全,要延长反应时间,直到树脂呈无色,可进行下一步反应;
重复s2中的上述步骤,脱去n-末端的fmoc保护基,进入连接下一个肽核酸单体循环(pna单体顺序pna探针结构强调顺序3’→5’逐个延长),不断两两缩合,直至合成预期得到的寡聚体;最后一次缩合完成后,得到的寡聚体-树脂以甲醇洗5次,每次振摇2min,抽干,抽真空干燥过夜,称重。
s3:称取s2步骤中制得的一定量寡聚体-树脂复合物放入反应器中,并按tfa:edt:苯甲醚=38:1:1的比例配好切割试剂(时间为3.5h,温度为26℃),均放入冰箱中冷却10min;向反应器中缓慢加入切割剂,室温下磁力搅拌3h;过滤,加入4ml裂解溶液重复切割0.5h;过滤,用10ml90%tfa/dcm洗涤树脂,洗涤液与滤液一并转入烧瓶,35℃减压蒸馏;浓缩液逐滴滴入十倍体积的预冷乙醚,振荡,冰箱静置30min;高速离心,倒去上清液,真空干燥过夜,通过乙醚沉淀得粗肽;用重蒸水溶解,冻干,得到白色粉末,称重。
5’端头荧光团的键合包括如下步骤:
s1:fam-pna合成,
加入脱保护试剂20%(v/v)哌啶/dmf溶液,振摇30min脱下树脂上的fmoc保护基,抽干,dmf洗6次,每次振摇3min,抽干;将fam(5-羧基荧光素)0.3mmol、dcc0.3mmol、hosu0.3mmol、dmap0.1mmol用适量dmf溶解,转移至装有pna-树脂的固相反应器,加入适量dmf避光振摇反应3h;反应结束后抽干,用dmf、dcm、meoh分别洗3次,每次振摇3min,抽干;
s2:fam-pna-tamra合成,
将tamra(罗丹明)0.3mmol、dcc0.3mmol、hosu0.3mmol、dmap0.1mmol用适量dmf溶解,加入s1中切割下的粗pna中,避光振摇反应3h;反应结束后加水淬灭,减压旋干,加入乙醚振荡洗涤,冰箱静置30min;高速离心,小心倒去上清,真空干燥过夜,得粗产物;用重蒸水溶解,冻干,得到白色粉末,即fam-pna-tamra。
本发明的pna与带有负电荷的dna和rna不同,pna的骨架为中性,与dna和rna之间不存在静电斥力,结合的稳定性大为提高;pna的骨架与dna/rna不同,但与dna/rna的结合仍然严格遵守watson-crick原则,可用较短的序列(12~15mer)更快地形成杂交链,可识别单碱基错配,因此能够提高新型冠状病毒的检测速度、灵敏度和准确度;pna几乎不与蛋白质作用,因而毒性作用很小;pna与dna或rna的杂交几乎不受杂交体系盐浓度影响;pna探针的高敏感性和特异性应用到微生物或病毒的检测方法中,其样品的前处理,与传统的检测技术非常相似,可以直接得到确切的结果,无需再进行其他检测;pna的合成比dna合成难度低,且收率高。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!