一种NSC668394在制备提高猪精子授精能力的试剂中的应用
一种nsc668394在制备提高猪精子授精能力的试剂中的应用
技术领域
1.本发明涉及动物繁殖技术领域,特别涉及一种nsc668394在制备提高猪精子授精能力的试剂中的应用。
背景技术:
2.随着现代养猪业的发展,规模化养猪越来越多,规模化生产中繁殖效率很容易受到影响而下降,进而影响生产效益,一般提高猪繁殖效率主要是通过改善精液品质和母猪的繁殖力。随着我国畜牧业发展,人工授精(artificial insemination,ai)技术在动物生产和选育工作中得到了广泛的应用。要利用好ai技术,选择具有高繁殖力的公畜并把控好其精液质量十分关键。
3.目前在生产中种公猪精液的质控往往是利用光学显微镜或计算机辅助精液分析系统对精子活力、畸形率、密度等指标进行检查,这些方法在生产实际中对公猪精液质量的把控起到了非常重要的作用。但是利用光学显微镜或计算机辅助精液分析系统对种公猪精液进行质控体现的是精液的一些感官指标,无法判断精子授精能力。虽然在现代猪生产实际和ai流程中,公猪站的公猪及其精液都是经过了严格筛选和质控,但即便按照现有标准化的流程进行人工授精时,母猪也会出现因精液原因导致繁殖力下降,说明不同公猪精子授精能力存在差异(roca j,broekhuijse m l,parrilla i,et al.boar differences in artificial insemination outcomes:can they be minimized?[j].reprod domest anim.2015,50suppl 2:48
‑
55.)。如果无法及早发现精子授精能力低的公猪,则会导致生产上的重大损失。种公猪精子授精能力是影响ai最重要的因素之一,但目前我们对公猪精子授精能力的影响因素仍存在许多未知,需要进一步挖掘影响公猪精子授精能力的机制,用以改善畜牧繁殖效率,进而创造巨大的社会经济效益。
技术实现要素:
[0004]
为了克服现有技术的不足和缺点,本发明的首要目的在于提供一种nsc668394在制备提高猪精子授精能力的试剂中的应用。
[0005]
本发明的另一目的在于提供一种提高猪精子授精能力的试剂。
[0006]
本发明的再一目的在于提供一种提高猪精子授精能力的方法。
[0007]
本发明的目的通过如下技术方案实现:
[0008]
一种nsc668394在制备提高猪精子授精能力的试剂中的应用;
[0009]
一种提高猪精子授精能力的试剂,为含bsa和苯甲酸钠咖啡因的猪精子获能液和nsc668394的混合物;
[0010]
所述的nsc668394的终浓度优选为10~30μm;
[0011]
所述的nsc668394的终浓度进一步优选为30μm;
[0012]
所述的含bsa和苯甲酸钠咖啡因的猪精子获能液包含如下组分:kcl0.224g/l,cacl2·
2h2o 1.102g/l,nacl 6.611g/l,tris 2.324g/l,d
‑
葡萄糖1.982g/l,丙酮酸钠
0.550g/l,bsa 2g/l,苯甲酸钠咖啡因0.68g/l;
[0013]
一种提高猪精子授精能力的方法,包含如下步骤:
[0014]
(1)收集猪精液,离心,弃上清,得到精子沉淀;
[0015]
(2)将步骤(1)制得的精子沉淀用洗精液重悬精子并洗涤,然后再将精子沉淀置于含bsa和苯甲酸钠咖啡因的猪精子获能液中洗涤;
[0016]
(3)经过步骤(2)洗涤后将精子沉淀再次重悬于含bsa和苯甲酸钠咖啡因的猪精子获能液中,并在体系中加入nsc668394处理精子;
[0017]
步骤(1)中所述的猪精液优选采用手握法收集;
[0018]
步骤(1)中所述的猪精液优选采精量大于100ml、精子密度大于2
×
108/ml、精子活力在65%以上和形态正常大于80%的猪精液样品;
[0019]
步骤(2)中所述的洗精液优选为含1g/l bsa的pbs;
[0020]
步骤(2)中所述的洗精液洗涤的次数优选为2~3次;
[0021]
步骤(2)中所述的含bsa和苯甲酸钠咖啡因的猪精子获能液包含如下组分:kcl 0.224g/l,cacl2·
2h2o 1.102g/l,nacl 6.611g/l,tris 2.324g/l,d
‑
葡萄糖1.982g/l,丙酮酸钠0.550g/l,bsa 2g/l,苯甲酸钠咖啡因0.68g/l;
[0022]
步骤(3)中所述的nsc668394的终浓度优选为10~30μm;
[0023]
所述的nsc668394的终浓度进一步优选为30μm;
[0024]
步骤(3)中所述的处理的时间优选为3~6h;
[0025]
本发明相对于现有技术具有如下的优点及效果:
[0026]
(1)本发明通过不同浓度小分子化合物nsc668394处理猪精子,检测猪精子授精能力,具体操作为:首先从公猪站利用手握法获取符合生产要求的猪精液,送到实验室后将精液离心,用洗精液重悬精子,再将精子置于获能液中,通过添加不同浓度nsc668394处理猪精子,同时设置未处理的对照组,检测不同处理组之间的体外受精效率来综合评估精子的授精能力。结果显示:nsc668394处理精子后显著提高了精子的授精能力,并且囊胚发育质量也较对照组显著提升。
[0027]
(2)本发明提供了一种提高猪精子授精能力的试剂,该试剂以含bsa和苯甲酸钠咖啡因的猪精子获能液为基础液,添加合适浓度的nsc668394。该试剂可以提高精子的授精能力和囊胚发育质量,极大改善畜牧繁殖效率,进而创造巨大的社会经济效益。
[0028]
(3)本发明提供了提高猪精子授精能力的方法,该方法操作简单,只需在室温下进行即可,成本低,耗时短,可提高精子授精能力和囊胚发育质量,可应用于猪上精液的常温保存等。
附图说明
[0029]
图1是胚胎卵裂结果展示图。
[0030]
图2是hoechst 33342染色囊胚结果展示图。
具体实施方式
[0031]
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
[0032]
实施例中的双抗(货号为15140122)购自赛默飞世尔科技(中国)有限公司;
[0033]
实施例1
[0034]
1、猪精液收集
[0035]
(1)配制猪精液稀释液(bts):按照表1称取各组分溶解于超纯水,搅拌混匀后,调节ph至7.2,加入1%(v/v)双抗,定容至1l,0.22μm过滤器过滤,得到猪精液稀释液(bts),4℃保存;
[0036]
表1猪精液稀释液(bts)配制
[0037][0038]
(2)以公猪站杜洛克猪(由温氏种猪公司提供)为对象,手握法收集猪精液,收集采精量大于100ml、精子密度大于2
×
108/ml、精子活力在65%以上和形态正常大于80%的精液样品进行实验,收集的精液样品按照体积比1:1常温保存于bts中并在1h内送到实验室;
[0039]
2、猪精子获能
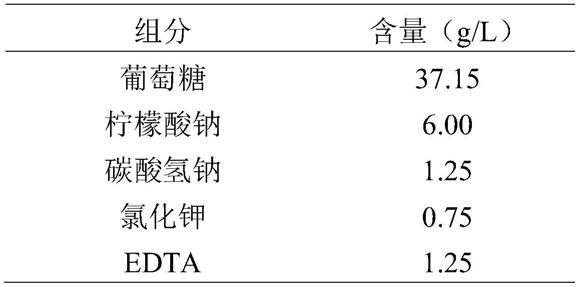
[0040]
(1)配制猪精子获能液(mtbm):按照表2称取各组分溶解于超纯水中,定容至100ml,0.22μm过滤,得到mtbm,4℃保存;获能前取20ml mtbm,加入0.04g bsa和0.0136g苯甲酸钠咖啡因,过滤除菌,得到含bsa和苯甲酸钠咖啡因的mtbm;
[0041]
表2猪精子获能液(mtbm)配制
[0042][0043]
(2)洗精液配制:称取0.1g bsa加入100ml pbs,搅拌混匀,0.22μm过滤,得到洗精液,4℃保存;
[0044]
(3)取1ml步骤1保存的精液样品(调整密度为2000万个精子/ml),800
×
g离心5min,弃上清,得到精子沉淀;
[0045]
(4)用步骤(2)制得的洗精液将步骤(3)制得的精子沉淀洗涤2次,再用步骤(1)制得的含bsa和苯甲酸钠咖啡因的mtbm洗涤一次;
[0046]
(5)用步骤(1)制得的含bsa和苯甲酸钠咖啡因的mtbm重悬步骤(4)洗涤后的精子
沉淀,重悬后精子浓度为2000万个精子/ml;然后加入nsc668394,其中,nsc668394的终浓度为5μm、10μm、20μm、30μm;同时设置未处理对照组(加入等量dmso),每组6个生物学重复;最后放入38.5℃、5%co2浓度、饱和湿度的培养箱中进行获能,处理时间为3小时;
[0047]
(6)将不同处理组的精子进行后续授精能力的检测。
[0048]
实施例2猪精子体外受精(in vitro fertilization,ivf)实验
[0049]
(1)猪体外受精相关培养液配制:
[0050]
①
猪卵泡液(porcine follicle fluid,pff)制备:挑取杜长大三元杂母猪的淡黄色卵泡,抽其泡液于离心管中;泡液静置,然后在3000rpm、4℃条件下离心25min,再取其上清液,用0.45μm过滤器过滤,得到猪卵泡液,分装,
‑
20℃保存;
[0051]
②
hm液配制:以配制500ml hm液为例,取495ml m199基础培养基,加入5ml双抗和0.5gbsa溶解,用0.22μm过滤器过滤,得到hm液,分装,4℃保存;
[0052]
③
pmsg(孕马血清促性腺激素)、hcg(人绒毛膜促性腺激素)、egf(表皮生长因子)和l
‑
cys(半胱氨酸)储存液配置:将pmsg、hcg、egf和l
‑
cys几种物质按照表3所示浓度分别溶解在1ml m199基础培养基中,依次得到pmsg、hcg、egf和l
‑
cys储存液,分装,
‑
20℃保存;
[0053]
表3 pmsg、hcg、egf和l
‑
cys储存液的配制
[0054][0055]
④
卵母细胞体外成熟培养液(in vitro maturation,ivm液)配制:按照表4配方配制好ivm液,然后分装到无菌离心管,封膜后4℃保存备用,使用时提前3h放培养箱平衡;
[0056]
表4卵母细胞体外成熟培养液配制
[0057][0058]
⑤
杜氏磷酸聚乙烯醇缓冲液(dpbs
‑
pva液)的配制:配制时,先将聚乙烯醇(pva)加入到100ml双蒸水中,加热溶解,冷却后再加入dpbs粉末搅拌混匀,定容至1l,用0.45μm过滤器过滤,得到dpbs
‑
pva液(表5),分装,封膜后4℃保存;
[0059]
表5杜氏磷酸聚乙烯醇缓冲液配制
[0060][0061]
⑥
操作液(hn液)配制:将各组分按照表6称量后倒入烧杯,加入50ml超纯水中搅拌溶解,溶解后加入500μl双抗及200μl酚红指示剂,调整ph至7.2~7.4,然后定容至100ml,保持渗透压为270~290mosm,0.22μm过滤器过滤,得到hn液,分装,4℃保存;
[0062]
表6操作液配制
[0063][0064]
⑦
0.1%透明质酸酶(脱卵丘液)配制:取0.1g透明质酸酶加入dpbs
‑
pva液中,溶解后定容至100ml,用0.22μm过滤器过滤,得到0.1%透明质酸酶(脱卵丘液),分装,
‑
20℃保存;
[0065]
⑧
猪精子获能培养液和洗精液配制,参考实施例1步骤2;
[0066]
⑨
猪胚胎培养液(porcine zygote medium,pzm)配制:将各组分按照表7称取后加入50ml胚胎培养专用水中,溶解后再加入500μl双抗、2ml必需氨基酸(eaa50
×
)、1ml非必需氨基酸(neaa 100
×
)、200μl酚红指示剂,调整ph至7.2~7.4,搅拌均匀然后定容至100ml,保持渗透压为288
±
2mosm,0.22μm过滤器过滤后,得到猪胚胎培养液,分装,4℃保存;
[0067]
表7猪胚胎培养液配制
[0068][0069]
(2)猪卵母细胞体外成熟培养
[0070]
①
从本地屠宰场收集杜长大三元杂母猪卵巢,装入37℃的0.9wt.%生理盐水保温瓶中,尽快送到实验室;
[0071]
②
用无菌注射器收集直径为3
‑
8mm的卵泡中的卵丘
‑
卵母细胞复合体(cumulus
‑
oocyte complexes,coc);抽取的卵泡液放入38.5℃离心管,静置15min,然后弃上清;加入预热后的dpbs
‑
pva液,再次静置5~10min后弃上清液,如此重复操作2~3次,直至液体澄清,弃上清,收集沉淀;
[0072]
③
将步骤
②
中的沉淀转移至一个10cm细胞皿,用体视镜挑选胞质均匀且至少被三层致密卵丘细胞包裹的卵母细胞,将挑出的卵母细胞用hm液洗涤2次,再用ivm液洗涤2~3次;将卵母细胞按40
‑
50个/孔转入nunclon四孔板中培养42~44小时,其中,培养孔每孔含ivm液500μl和200μl矿物油,培养环境为38.5℃,5%co2、95%空气的恒温恒湿培养箱;
[0073]
(3)成熟卵母细胞的准备
[0074]
①
体外培养约42
‑
44h后,即得到体外成熟的卵母细胞;卵母细胞体外成熟主要通过两方面进行判断:一是成熟程度较好的coc体积增大,且扩展均匀;二是观察卵母细胞第一极体是否排出,第一极体的排出可当作卵母细胞体外成熟的标志;
[0075]
②
将成熟的coc转移至0.1%透明质酸酶(脱卵丘液)中消化,用移液枪轻轻吹打除去卵丘细胞,然后用hn液洗涤卵母细胞2次,再用含bsa和苯甲酸钠咖啡因的mtbm洗涤3次;用巴氏吸管将成熟的卵母细胞按40
‑
50个卵母细胞/孔转入含mtbm溶液(含bsa和苯甲酸钠咖啡因)的四孔板中,每孔含mtbm液450μl及200μl矿物油,放入培养箱中;
[0076]
(4)体外受精
[0077]
①
取出放至在mtbm液中的成熟卵母细胞(步骤(3))和刚获能完成的精子(步骤2);将精子混匀后取50μl(约0.5
‑1×
106个精子)加入到步骤(3)制得的成熟卵母细胞液中,然后将含精子和成熟卵母细胞的mtbm溶液重新放入38.5℃,5%co2、95%空气的培养箱孵育6h完成ivf;
[0078]
②
6h后,用吸管将卵母细胞吸出轻轻吹打以去除透明带上多余的精子,然后用hn操作液洗涤3次,再用pzm液洗涤2~3次,处理完后将卵母细胞按照40
‑
50个/孔转入每孔含500μl pzm液和200μl矿物油的四孔板中培养,培养条件为38.5℃,5%co2、95%空气的恒温恒湿状态;
[0079]
ivf当天记为第0天,第2天(48h后)观察胚胎卵裂情况,统计胚胎分裂数,卵裂率=胚胎分裂数/卵母细胞总数。第7天观察囊胚发育情况并统计囊胚率,囊胚率=囊胚数/卵母细胞总数,同时囊胚hoechst 33342染色分析囊胚细胞数,评估囊胚发育情况。
[0080]
图1是胚胎卵裂结果展示图,图2是hoechst 33342染色囊胚结果展示图。
[0081]
根据表8ivf统计结果可知,nsc668394对猪精子体外受精能力有显著影响。与对照获能处理精子组相比较,5μm、10μm、20μm、30μm的nsc668394处理精子后对胚胎卵裂情况无显著性影响;但用30μm的nsc668394处理精子后,胚胎囊胚率得到显著提高(13.2%
±
1.7%vs.20.0%
±
3.9%,n=6),各囊胚细胞数明显增加(47
±
5vs.54
±
1,n=6)。该结果说明了利用30μm的nsc668394处理精子后显著提高了精子的授精能力,并且囊胚发育质量也较对照组显著提升。
[0082]
表8 nsc668394对精子体外受精能力的影响(mean
±
sd,n=6)
[0083][0084]
注:c
dmso
为添加dmso处理对照组,c
5μm
、c
10μm
、c
20μm
、c
30μm
为分别添加5μm、10μm、20μm、30μm的nsc668394处理精子组。统计差异结果为将处理组与对照组相比较,*代表p<0.05,差异显著。
[0085]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1