鉴定大肠杆菌菌毛抗原的探针引物组、试剂盒及应用
本发明涉及微生物检测
技术领域:
,更具体地说是涉及一种鉴定牛源性大肠杆菌的探针引物组、试剂盒及应用。
背景技术:
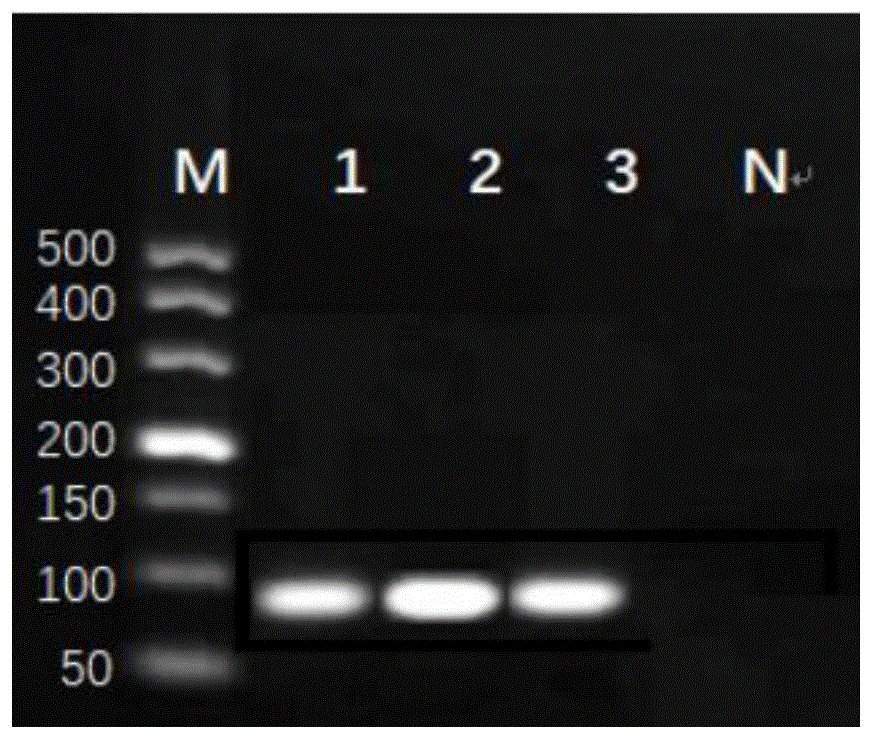
:大肠杆菌为革兰阴性无芽孢短杆菌,一些特殊血清型的大肠杆菌对人和动物,尤其对婴儿和幼龄动物有致病性,常引起严重腹泻和败血症。目前致病性大肠杆菌可分为产肠毒素大肠杆菌(etec)、产志贺毒素大肠杆菌(stec)、肠致病性大肠杆菌(epec)、肠侵袭性大肠杆菌(eiec)、肠出血性大肠杆菌(ehec)、肠聚集性大肠杆菌(eaec)、黏附和损伤性大肠杆菌(aeec)、广泛黏附性大肠杆菌(daec)、败血性大肠杆菌(sepec)、禽致病性大肠杆菌(apec)和尿道致病性大肠杆菌(upec)。其中etec是导致幼畜腹泻的主要病原菌之一,可引起仔猪白痢、仔猪黄痢、犊牛白痢等腹泻性疾病,严重者脱水,死亡,给养殖业造成巨大经济损失。调查发现,引起幼畜腹泻的致病性大肠杆菌常带有不同类型的菌毛,并借助菌毛的黏附作用定居在肠绒毛上皮细胞,分泌肠毒素产生致病作用。致病性大肠杆菌常见的菌毛抗原有f4、f5、f6、f41、f18,因此对编码这些菌毛的基因的快速检测有助于对大肠杆菌分离菌的致病性、菌毛血清型快速鉴定和疾病的快速诊断。目前国内虽有检测大肠杆菌菌毛基因的单一pcr和多重pcr方法,但是往往存在引物设计不合理,引物灵敏度低、或者引物与探针不能很好兼容的情况,致使检测结果准确性低。因此,如何提供一种鉴定大肠杆菌菌毛抗原的探针引物组、试剂盒是本领域技术人员亟需解决的问题。技术实现要素:有鉴于此,本发明利用多重pcr方法鉴定大肠杆菌菌毛抗原f4、f5基因,基于两种基因的保守序列设计了引物和探针,灵敏性好,检测准确性高。为了实现上述目的,本发明采用如下技术方案:一种鉴定大肠杆菌菌毛抗原的探针引物组,所述大肠杆菌菌毛抗原f4的引物如seqidno.1~seqidno.2所示,探针如seqidno.3所示;f4-forwardprimer:5’-ttctcggacagrttcaaagagt-3’,如seqidno.1所示;f4-reverseprimer:5’-cagttccatcagtgtactcca-3’,如seqidno.2所示;f4-probe:5’-(hex)-ttgttgacgtcgcaggttcttacaggga-(bhq1)-3’,如seqidno.3所示;所述大肠杆菌菌毛抗原f5的引物如seqidno.4~seqidno.5所示,探针如seqidno.6所示;f5-forwardprimer:5’-ggtcaatggtaatcgtacatcaac-3’,如seqidno.4所示;f5-reverseprimer:5’-actgttcatagaaccagaccag-3’,如seqidno.5所示;f5-probe:5’-(cy5)-cttgggcaggctgctattagtggtcatg(bhq3)-3’,如seqidno.6所示。上述探针引物组在制备鉴定大肠杆菌菌毛抗原f4、f5基因产品中的应用。一种鉴定大肠杆菌菌毛抗原f4、f5基因的试剂盒,包括:premixextaq、f4-forward-primer、f4-reverse-primer、f4-probe、f5-forward-primer、f5-reverse-primer、f5-probe、dna模板和灭菌水。作为本发明优选的技术方案,利用该试剂盒对大肠杆菌菌毛抗原f4、f5基因进行鉴定的反应体系为:作为本发明优选的技术方案,利用该试剂盒对大肠杆菌菌毛抗原f4、f5基因进行鉴定的反应程序为:44cycles。经由上述技术方案可知,本发明基于大肠杆菌菌毛抗原的f4、f5基因的保守序列进行引物和探针的设计,扩增产物长度分别为96bp、157bp;以设计出的引物和探针对大肠杆菌菌毛抗原的f4、f5基因进行鉴定,最低检出浓度为1*101copies/μl,且,在相同条件下,分别加入mh、pma、pmb、cpa、cpb、cpd、ibrv、bpiv、大肠杆菌参考菌株cvcc209株、大肠杆菌参考菌株cvcc216株、大肠杆菌参考菌株cvcc1345株、大肠杆菌参考菌株cvcc1527株、沙门氏菌参考菌株cvcc2184株、大肠杆菌质控菌株atcc25922株等阳性核酸作为模板进行检测,用1×107copies/μl的菌毛抗原f4、f5双重标准阳性质粒和dna作为阳性对照,并设立阴性对照,只有菌毛抗原f4、f5的阳性质粒和dna出现了扩增曲线,说明,本发明的引物和探针组合特异性良好。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。图1附图为实施例2中大肠杆菌菌毛抗原f4基因扩增结果图;其中,m为marker;1-3为f4核酸dna;n为阴性对照;图2附图为实施例2中大肠杆菌菌毛抗原f5基因扩增结果图;其中,m为marker;1-3为f5核酸dna;n为阴性对照;图3附图为实施例2中大肠杆菌菌毛抗原f4重组菌液扩增结果图;图4附图为实施例2中大肠杆菌菌毛抗原f5重组菌液扩增结果图;图5附图为实施例2中大肠杆菌菌毛抗原f4重组质粒扩增结果图;其中,m为marker;1-4为f4质粒dna;n为阴性对照;图6附图为实施例2中大肠杆菌菌毛抗原f5重组质粒扩增结果图;其中,m为marker;1-4为f5质粒dna;n为阴性对照;图7附图为实施例2中大肠杆菌菌毛抗原f4、f5基因双酶切鉴定结果图,其中,m为marker,1、4为19t载体,2-3为f4基因,5-6为f5基因,n为阴性对照;图8附图为实施例2中大肠杆菌菌毛抗原f4重组质粒测序结果图;图9附图为实施例2中大肠杆菌菌毛抗原f5重组质粒测序结果图;图10附图为实施例3中f4基因不同引物浓度下的扩增曲线图;图11附图为实施例3中f5基因不同引物浓度下的扩增曲线图图12附图为实施例3中f4基因不同探针浓度下的扩增曲线图;图13附图为实施例3中f5基因不同探针浓度下的扩增曲线图;图14附图为实施例4中大肠杆菌菌毛抗原f4荧光定量pcr标准曲线;其中,上图为不同拷贝下的扩增曲线图,1-8为1×108copies/μl~1×101copies/μl的扩增曲线,9为阴性对照;下图为标准曲线图;图15附图为实施例4中大肠杆菌菌毛抗原f5荧光定量pcr标准曲线;其中,上图为不同拷贝下的扩增曲线图,1-8为1×108copies/μl~1×101copies/μl的扩增曲线,9为阴性对照;下图为标准曲线图;图16附图为实施例5中以荧光定量pcr对不同浓度的大肠杆菌菌毛抗原f4进行检测时的扩增曲线图;其中,1-9为1×109copies/μl~1×101copies/μl的扩增曲线图,10为阴性对照;图17附图为实施例5中以常规pcr对不同浓度的大肠杆菌菌毛抗原f4进行检测时的凝胶图;其中,1-9为~×109copies/μl~1×101copies/μl,阳性质粒的扩增图,10为阴性对照;图18附图为实施例5中以荧光定量pcr对不同浓度的大肠杆菌菌毛抗原f5进行检测时的扩增曲线图;其中,1-9为1×109copies/μl~1×101copies/μl的扩增曲线图,10为阴性对照;图19附图为实施例5中以常规pcr对不同浓度的大肠杆菌菌毛抗原f5进行检测时的凝胶图;其中,1-9为1×109copies/μl~1×101copies/μl阳性质粒的扩增图,10为阴性对照;图20附图为实施例6中对大肠杆菌菌毛f4进行单重荧光定量pcr的特异性实验结果图;其中,1-3:cvcc209株、cvcc216株、cvcc1527株核酸,4:阳性质粒5:阴性对照、cvcc2184株、cvcc1345株、atcc25922株、mh、pma、cpa、cpb、cpd、ibrv、bpiv;图21附图为实施例6中对大肠杆菌菌毛f5进行单重荧光定量pcr的特异性实验结果图;1:cvcc209株核酸2:阳性质粒3:阴性对照、cvcc216株、cvcc1345株、cvcc1527株、cvcc2184株、atcc25922株、mh、pma、cpa、cpb、cpd、ibrv、bpiv;图22附图为实施例7中对大肠杆菌菌毛f4进行单重荧光定量pcr的重复性试验结果图;其中,1-3:1×106~1×104copies/μl,4:阴性;图23附图为实施例7中对大肠杆菌菌毛f5进行单重荧光定量pcr的重复性试验结果图;其中,1-3:1×106~1×104copies/μl,4:阴性;图24附图为实施例8中大肠杆菌菌毛f4、f5双重荧光定量引物浓度优化结果图;图25附图为实施例8中大肠杆菌菌毛f4、f5双重荧光定量探针浓度优化结果图;图26附图为实施例8中大肠杆菌菌毛抗原f4、f5双重荧光定量pc扩增标准曲线绘制结果图;上图为扩增曲线图,1~7分别为1×108copies/μl~1×102copies/μl的扩增曲线图,8为阴性对照;下图为标准曲线图;图27附图为实施例8中大肠杆菌菌毛抗原f4、f5双重荧光定量pcr敏感性试验图;1~8为×108copies/μl~1×101copies/μl的扩增曲线图,9为阴性对照;图28附图为实施例8中肠杆菌菌毛抗原f4、f5双重荧光定量pcr特异性试验结果图;其中,1、3为cvcc209株扩增曲线;4-5分别为cvcc216株、cvcc1527株的扩增曲线图2、6分别为阳性核酸粒扩增曲线图;7为阴性、mh、pma、pmb、cpa、cpb、cpd、ibrv、bpiv、cvcc1345株、cvcc2184株的扩增曲线图;图29附图为实施例8中肠杆菌菌毛抗原f4、f5双重荧光定量pcr重复性试验结果图;1-3为1×106~104copies/μl的扩增曲线图4:阴性;图30附图为实施例9中肠杆菌菌毛抗原f4双重荧光定量pcr对临床样品检测结果图;1为阳性质粒,2为临床样品,3为阴性对照;图31附图为实施例9中肠杆菌菌毛抗原f5双重荧光定量pcr对临床样品检测结果图;1为阳性质粒,2为临床样品,3为阴性对照。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中涉及的菌株均购自中国兽医微生物菌种保藏管理中心。实施例1引物和探针的设计与合成参考genbank上公布的大肠杆菌f4基因序列(登录号aj616236.1)、f5基因序列(登录号m35282.1),应用lasergener软件中megalign程序进行多序比较分析,再利用软件oligo7软件选择在其保守区设计2对特异性引物和探针。扩增产物长度分别为96bp、157bp,探针和引物全部由华大基因合成。引物和探针序列筛选结果如表1所示,表1荧光定量pcr引物与探针经过对多对引物和探针进行筛选,得出结果,f4基因的seqidno.1~seqidno.3所示的引物探针组合、f5基因的seqidno.4~seqidno.6所示的引物探针组合,扩增条带亮度较亮,效果最好。实施例2dna提取及重组质粒的鉴定(1)细菌dna提取用接种环沾取冻干的大肠杆菌参考菌株(购自中国兽医微生物菌种保藏管理中心)放于5ml营养肉汤中37℃过夜培养,参考试剂盒说明书,对上述过夜培养的增菌液进行dna提取。(2)常规pcr检测方法的建立将步骤(1)提取的dna作为模板,用实施例1中的的引物分别对f4和f5基因进行扩增,常规pcr扩增反应体系(25μl)如表2所示;表2常规pcr扩增反应体系试剂用量premixtaqtm12.5μl引物(10μmol/l)各1.0μl模板dna2.0μldd水8.5μl总计25μl扩增反应参数为:35cycles。将琼脂糖和10×tae电泳缓冲液按比例配制成凝胶,将dl500marker和步骤(2)中的pcr扩增产物分别加入点样孔中进行凝胶电泳,电泳条件为110v60min。电泳结束后观察结果,结果见图1和图2;(3)标准品的构建采用胶回收试剂盒将凝胶电泳后的琼脂糖进行回收,达到产物纯化的目的。电泳结束后,在紫外灯下切下含目的片段的凝胶,称取凝胶重量,然后加入等倍体积buffergdp,55℃水浴8min;准备置备管,把溶胶液转移至吸附柱中,12,000×g离心30sec,弃滤液;加入300μlbuffergdp至吸附柱中。静置1min。12,000×g离心30sec,弃滤液;加入700μlbuffergw至吸附柱中。12,000×g离心30sec,重复一次;2,000×g离心2min,最后将吸附柱放置在干净的离心管中,加入30μldd水。12,000×g离心30~60sec,得大肠杆菌菌毛抗原f4、f5基因回收产物;(4)目的基因与载体pmd-19t的连接取步骤(3)回收的大肠杆菌菌毛抗原f4、f5基因回收产物分别与大小为2692bp的pmdtm19-tvector进行连接,连接体系(10μl)如表3所示;表3试剂用量pmd19-tvector1μl胶回收产物4.0μlsolutioni5.0μl总计10μl16℃孵育30min,得连接产物;(5)克隆质粒的转化取-80℃环境保存的感受态细胞dh5α,随后将步骤(4)的连接产物加到100μltakaradh5α感受态细胞中,放入冰中30min后立即转移至入42℃水浴锅中进行45s的热激转化,再次冰内孵化1min。加入890μllb液体培养基,总量1000μl。37℃摇床中培养1h。取出混合液离心3min,吸出700μl上清液弃去,用剩下的300μl上清液反复吹打重悬沉淀,取适量涂布于含amp的lb固体培养基上,随后放入37℃恒温培养箱中静置培养10~12h左右(直至长出适宜大小的单个菌落)。(6)阳性克隆菌的筛选挑取3~5个单个菌落,转入于lb液体培养基中,37℃、200×g的恒温摇床中培养12~16h;(7)重组阳性质粒的提取将培养后的菌液作为模板,进行常规pcr扩增,扩增体系和条件同步骤(2),选取与目的基因片段相同所对应的菌液,参照试剂盒进行质粒提取,得重组质粒;(8)重组质粒的鉴定(81)菌液pcr鉴定:为了验证目的基因是否连接在载体上,模板为步骤(6)得到的的菌液,分别用实施例1中的引物进行pcr扩增,扩增体系和条件同步骤(2),观察结果,结果如图3和图4;同时设立阴性对照。反应体系如表4;表4试剂用量premixtaqtm12.5μl无菌水8.5μl上下游引物各1.0μl总计22μl反应程序35cycles。(82)质粒pcr鉴定:为了鉴定提取的质粒是否与目的基因大小一致,将步骤(7)中提出的质粒作为模板,分别用实施例1中设计的引物进行pcr扩增,扩增体系同步骤(81),观察结果,如图5好和图6所示;同时设立阴性对照。(83)双酶切鉴定:为了验证目的基因是否连接到质粒中,先选定两种内切酶,将重组质粒进行酶切,同时分别加入一个原始质粒和空载体作为对照。反应体系(20μl)如表5所示;表537℃孵育1h后进行凝胶电泳110v60min。结果如图7所示;(84)测序鉴定:将pcr扩增后与目的片段大小相符的阳性质粒,进行测序验证,测序结果与genbank上与公布的基因序列进行比对分析,确认与模板基因同源性均为100%。如图8和图9所示;置-20℃保存备用。(9)重组质粒dna拷贝数的计算及稀释提取质粒后取1μl测得f4、f5标准阳性质粒的浓度后并稀释浓度至100ng/μl并计算质粒拷贝数。制备阳性标准品时使用灭菌水对重组质粒f4、f5进行10倍倍比稀释。结果为:菌毛抗原f4、f5阳性质粒浓度分别为128.0ng/μl和180.8ng/μl,稀释至100ng/μl,根据公式计算出菌毛抗原f4、f5模板拷贝数分别为3.27×1010copies/μl和3.2×1010copies/μl。将标准品质粒按10倍梯度稀释,得到模板浓度1.0×1010copies/μl~1.0×100copies/μl。实施例3大肠杆菌菌毛抗原f4、f5基因单重荧光定量pcr检测方法的建立(1)反应参数的优化大肠杆菌菌毛抗原f4、f5单重荧光定量pcr反应参数为44cycles。(2)大肠杆菌菌毛抗原f4、f5单重荧光定量pcr初始反应体系(25μl)如表6所示;引物和探针为实施例1中的引物和探针;表6为了探索不同反应条件对f4、f5单重荧光定量pcr扩增的影响,需对以上几个条件进行摸索优化,来获取最佳的反应条件,并为双重荧光定量pcr各条件的优化提供适当的优化范围。(3)引物浓度优化分别吸取0.4μl~1μl,终浓度分别为160nmol/l、200nmol/l、240nmol/l、280nmol/l、320nmol/l、360nmol/l、400nmol/l7个梯度进行引物浓度优化,探针添加量暂固定为0.7μl。反应参数与体系,参考步骤(1)和步骤(2);结果见图10和图11:菌毛抗原f4引物浓度0.9μl(360nmol/l)ct值最小,扩增曲线良好。菌毛抗原f5引物浓度0.8μl(320nmol/l)ct值最小,扩增曲线良好。因此本试验菌毛抗原f4的最佳引物浓度选0.9μl(360nmol/l)。菌毛抗原f5的最佳引物浓度选0.8μl(320nmol/l)。(4)探针浓度优化以实施例2步骤(7)提取的质粒dna作为模板,分别吸取吸取0.4μl~1μl,终浓度分别为160nmol/l、200nmol/l、240nmol/l、280nmol/l、320nmol/l、360nmol/l、400nmol/l7个梯度进行探针浓度优化,引物添加量参考步骤(3)的优化结果。反应参数与体系,参考步骤(1)-(2);结果见图13和图14;菌毛抗原f4探针浓度0.6μl(240nmol/l)ct值最小,扩增曲线良好。菌毛抗原f5探针浓度0.8μl(320nmol/l)ct值最小,扩增曲线良好。因此本试验菌毛抗原f4的最佳探针浓度选0.6μl(240nmol/l)。菌毛抗原f5的最佳探针浓度选0.8μl(320nmol/l)。所以,菌毛抗原f4、f5荧光定量pcr反应体系为25μl,菌毛抗原f4的反应体系为premixextaq12.5μl、上下游引物各0.9μl(10umol/l)、探针0.6μl(10umol/l),dna模板2μl,加灭菌水8.1μl至25μl,混合均匀;菌毛抗原f5的反应体系为premixextaq12.5μl、上下游引物各0.8μl(10umol/l)、探针0.8μl(10umol/l),dna模板2μl,加灭菌水8.1μl至25μl,混合均匀。实施例4菌毛抗原f4、f5单重荧光定量pcr标准曲线的建立模板选用1×101copies/μl~1×108copies/μl共8个浓度的阳性质粒,每个模板作3个重复,设立阴性对照。引物和探针量参考实施例3步骤(3)和步骤(4)的优化结果进行反应,根据软件分析得到相关系数和扩增效率后绘制菌毛抗原f4、f5单重定量pcr标准曲线方程。结果见图14和图15;结果显示,从图12中显示菌毛抗原f4的标准曲线回归方程为y=-3.398x+44.166,相关系数r2达0.999,扩增效率e=96.9%。从图15中显示菌毛抗原f5的标准曲线回归方程为y=-3.274x+42.041,相关系数r2达0.999,扩增效率e=102.0%。实施例5菌毛抗原f4、f5单重荧光定量pcr的敏感性试验模板为1×100copies/μl~1×109copies/μl共10个标准阳性质粒,作3个重复,设立阴性对照。同时进行常规pcr(同实施例2步骤(2)的反应体系和条件)和定量pcr(同实施例3中步骤(3)-步骤(4)),得出常规pcr和定量pcr检测方法的最低检出浓度。见图16~图19;可知,建立的菌毛抗原f4荧光定量pcr最低能检出浓度为1×101copies/μl的质粒(图16),而常规pcr最低能检出浓度为1×104copies/μl的质粒(图17),两者相差1000倍。菌毛抗原f5荧光定量pcr最低能检出浓度为1×101copies/μl的质粒(图18),而常规pcr最低能检出浓度为1×103copies/μl的质粒(图19),两者相差100倍。实施例6菌毛抗原f4、f5单重荧光定量pcr的特异性试验验证该方法是否特异,体系不变,同实施例3步骤(3)-(4);模板分别加入牛曼氏杆菌mh、多杀性巴氏杆菌a型pma、多杀性巴氏杆菌b型pmb、牛传染性鼻气管炎病毒ibrv、牛副流感病毒bpiv、牛羊产气荚膜梭菌a型cpa、牛羊产气荚膜梭菌b型cpb、牛羊产气荚膜梭菌d型cpd、大肠杆菌参考菌株209株、大肠杆菌参考菌株216株、大肠杆菌参考菌株1345株、大肠杆菌参考菌株1527株、沙门氏菌参考菌株2184株、atcc25922株等阳性核酸,将菌毛抗原f4、f5标准阳性质粒分别作为阳性对照,并设立阴性对照。结果见图20和图21所示;只有菌毛抗原f4、f5质粒dna产生扩增曲线,其他都为阴性,说明该方法特异性良好。实施例7菌毛抗原f4、f5单重荧光定量pcr的重复性试验模板1×104copies/μl~1×106copies/μl,作三次重复,设立阴性对照,对实验数据分析,验证荧光定量pcr方法的稳定性,如图22和图23所示;模板浓度相同的菌毛抗原f4、f5ct值基本一致,扩增曲线基本相同;重复变异系数均低于2%,说明该方法重复性高、稳定性好。实施例8大肠杆菌菌毛抗原f4、f5双重荧光定量pcr检测方法的建立(1)引物浓度优化按照单重荧光定量pcr方法中已优化好的各项反应条件进行扩增(反应体系:25μl)。采用矩阵式,以单重引物确定量为参考,菌毛抗原f4引物添加量0.9μl,上下各取1个数0.7μl、0.9μl、1.1μl;菌毛抗原f5引物添加量0.6μl,上下各取1个数0.4μl、0.6μl、0.8μl;探针添加量暂时按单重确定量为准,进行优化,引物方阵优化表如表7;表7引物方阵优化表结果见图24,当菌毛抗原f4引物浓度1.1μl、菌毛抗原f5引物浓度0.6μl时ct值最小,扩增曲线良好。因此本试验菌毛抗原f4、f5的最佳引物浓度分别是1.1μl、0.6μl。(2)探针浓度优化采用矩阵式,以单重探针确定量为参考,菌毛抗原f4探针添加量0.9μl,上下各取1个数0.7μl、0.9μl、1.1μl,菌毛抗原f5探针添加量1μl,上下各取1个数0.8μl、1μl、1.2μl,引物添加量以优化后最适添加量为准,进行优化,探针方阵优化表见表8;表8针方阵优化表序号f4(f/r)f5(f/r)10.7μl0.8μl20.9μl0.8μl31.1μl0.8μl40.7μl1.0μl50.9μl1.0μl61.1μl1.0μl70.7μl1.2μl80.9μl1.2μl91.1μl1.2μl扩增结果见图25;当菌毛抗原f4探针浓度0.6μl、菌毛抗原f5探针浓度1μl时ct值最小,扩增曲线良好。因此本试验菌毛抗原f4、f5的最佳探针浓度分别是0.6μl、1μl(3)菌毛抗原f4、f5双重荧光定量pcr标准曲线的建立以1×102copies/μl~1×108copies/μl共7个双重标准阳性质粒为模板进行荧光定量pcr,参考实施例4,见图26,菌毛抗原f4的标准曲线回归方程为y=-3.218x+42.272,相关系数r2达0.999,扩增效率e=104.5%;菌毛抗原f5的标准曲线回归方程为y=-3.194x+41.566,相关系数r2达0.999,扩增效率e=105.6%。(4)菌毛抗原f4、f5双重荧光定量pcr的敏感性试验模板为双重质粒1×101copies/μl~1×108copies/μl共8个标准阳性质粒,进行荧光定量pcr参见实施例5,结果见图27,建立的菌毛抗原f4、f5双重荧光定量pcr最低检出浓度为1×101copies/μl。(5)菌毛抗原f4、f5双重荧光定量pcr的特异性试验参见实施例6,在相同条件下,分别加入mh、pma、pmb、cpa、cpb、cpd、ibrv、bpiv、大肠杆菌参考菌株cvcc209株、大肠杆菌参考菌株cvcc216株、大肠杆菌参考菌株cvcc1345株、大肠杆菌参考菌株cvcc1527株、沙门氏菌参考菌株cvcc2184株、大肠杆菌质控菌株atcc25922等阳性核酸作为模板进行检测,用1×107copies/μl的菌毛抗原f4、f5双重标准阳性质粒和dna作为阳性对照,并设立阴性对照;结果见图28;只有菌毛抗原f4、f5的阳性质粒和dna出现了扩增曲线。(6)菌毛抗原f4、f5双重荧光定量pcr的重复性试验选取质粒浓度为1×104copies/μl~1×106copies/μl3个稀释度作为模板分别进行3次重复扩增,同时设立2个阴性对照。结果见图29,结果表明,菌毛抗原f4、菌毛抗原f5同一模板ct值基本一致,扩增曲线也大致相同;组内重复变异系数均低于2%,表明试验重复性高,稳定性良好。实施例9荧光定量pcr方法的应用用本试验所建立的大肠杆菌菌毛抗原f4、f5双重荧光定量pcr检测方法,对136份粪便样品和3份肠内容物中提出的dna样品进行检测,结果如表9和图30、图31所示;136份粪便样品中检出菌毛抗原f4阳性32份,菌毛抗原f5阳性35份,双阳性14份;3份肠内容物中检出菌毛抗原f4阳性2份。将出现扩增曲线的对应临床样品采用了产物回收连接转化送科技公司测序,测序回来的序列和目的片段序列一致即可说明检测结果的准确性。表9本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。序列表<110>内蒙古农业大学内蒙古自治区动物疫病预防控制中心(内蒙古自治区兽药检验中心)<120>鉴定大肠杆菌菌毛抗原的探针引物组、试剂盒及应用<160>21<170>siposequencelisting1.0<210>1<211>22<212>dna<213>人工序列(artificialsequence)<400>1ttctcggacagrttcaaagagt22<210>2<211>21<212>dna<213>人工序列(artificialsequence)<400>2cagttccatcagtgtactcca21<210>3<211>28<212>dna<213>人工序列(artificialsequence)<400>3ttgttgacgtcgcaggttcttacaggga28<210>4<211>24<212>dna<213>人工序列(artificialsequence)<400>4ggtcaatggtaatcgtacatcaac24<210>5<211>22<212>dna<213>人工序列(artificialsequence)<400>5actgttcatagaaccagaccag22<210>6<211>28<212>dna<213>人工序列(artificialsequence)<400>6cttgggcaggctgctattagtggtcatg28<210>7<211>21<212>dna<213>人工序列(artificialsequence)<400>7ttctcggacagattcaaagag21<210>8<211>21<212>dna<213>人工序列(artificialsequence)<400>8tgctgcctatgcactgggtat21<210>9<211>28<212>dna<213>人工序列(artificialsequence)<400>9tctcttgttgacgtcgcaggttcttaca28<210>10<211>21<212>dna<213>人工序列(artificialsequence)<400>10ttctcggacagattcaaagag21<210>11<211>19<212>dna<213>人工序列(artificialsequence)<400>11atggagtacactgatggaa19<210>12<211>26<212>dna<213>人工序列(artificialsequence)<400>12ttacttctcttgttgacgtcgcaggt26<210>13<211>21<212>dna<213>人工序列(artificialsequence)<400>13tgttgacgtcgcaggttctta21<210>14<211>20<212>dna<213>人工序列(artificialsequence)<400>14tccactgagtgctggtagtt20<210>15<211>30<212>dna<213>人工序列(artificialsequence)<400>15acactgatggaactgttgtttctgctgcct30<210>16<211>20<212>dna<213>人工序列(artificialsequence)<400>16actgctgctaaaggatacca20<210>17<211>23<212>dna<213>人工序列(artificialsequence)<400>17tcactacggctgaatacactcac23<210>18<211>27<212>dna<213>人工序列(artificialsequence)<400>18acgttggaaatgggtctggtggtgcta27<210>19<211>22<212>dna<213>人工序列(artificialsequence)<400>19tacggctgaatacactcacact22<210>20<211>24<212>dna<213>人工序列(artificialsequence)<400>20acttcagcatccttcttagtcact24<210>21<211>28<212>dna<213>人工序列(artificialsequence)<400>21agatgaccgcgctccgtctaatggtgga28当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1