一种靶向人CD133的纳米抗体及其制备方法和应用
一种靶向人cd133的纳米抗体及其制备方法和应用
技术领域
1.本发明属于抗体制备技术领域,涉及一种靶向人cd133的纳米抗体及其制备方法和应用。
背景技术:
2.癌症干细胞(cscs)是肿瘤组织中的一小群细胞,其可诱导肿瘤的起始和分化,同时介导肿瘤对化疗和放疗的抵抗性,而这被认为是诱导肿瘤复发的重要原因。因此,靶向清除肿瘤干细胞可能是治愈肿瘤的重要途径。
3.cd133是一个细胞表面糖蛋白分子,主要定位于细胞质膜的凸起部分,尤其是基于胆固醇的脂质微结构域,其参与膜的组织。cd133通常被作为肿瘤干细胞分离和鉴定的标志物,相比cd44和乙醛脱氢酶(aldh)等csc标志物,cd133具有更为局限的表达。因此,cd133长期被作为不同实体瘤中恶性祖细胞最为严格的指示物。相比cd133
‑
细胞,cd133
+
细胞通常展现出更强的自我更新,增殖,分化和肿瘤起始能力。作为cscs的调节蛋白,cd133可以通过多种机制调节肿瘤的发生、存活、转移和对治疗的抵抗性,这些机制如下:(1)cd133是一个胆固醇结合蛋白,通过重塑细胞膜胆固醇来诱导脂筏形成从而影响脂质代谢;(2)cd133可以通过与egfr直接相互作用稳定egfr,上调egfr
‑
akt信号,从而促进肿瘤增殖;(3)cd133的胞质尾可以与p85亚基发生相互作用,激活pi3k
‑
akt信号,进而调节肿瘤发生;(4)cd133可通过与src激酶的相互作用激活fak,促进癌细胞迁移和转移;(5)cd133可从细胞膜释放进入胞质,诱导自噬小体的形成,促进肿瘤细胞在营养受限等不利条件下的存活;(6)cd133诱导的脂滴形成可以上调促进肿瘤发生的wnt/β
‑
catenin信号;(7)cd133可以上调gsh水平使cd133
+
细胞对活性氧应激产生抵抗,从而对化疗药物产生耐受性;综上所述,cd133调节着cscs在肿瘤发生、发展、转移和药物抵抗中的方方面面,有望成为肿瘤靶向治疗的潜在靶点,为肿瘤的治愈带来新的希望。
4.抗体药物偶联物是结合了抗体高度特异性和小分子药物细胞毒作用两种属性的新型药物,可以更低的给药剂量实现更好的肿瘤治疗效果,在肿瘤的靶向治疗中展现出了非常广阔的前景。因此,开发靶向cd133的抗体药物偶联物对肿瘤干细胞进行定向清除有望解决当前肿瘤治疗中面临的药物抵抗和复发难题,为复发和难治性肿瘤的治疗提供新的途径。
技术实现要素:
5.为了解决现有技术存在的不足,本发明的目的是提供一种靶向人cd133的纳米抗体、制备方法及其与dm1偶联物的制备,对cd133
+
细胞具有细胞毒作用。
6.本发明提供了一种靶向人cd133的单峰驼纳米抗体,所述纳米抗体的碱基序列如seq id no.1~2所示,所述纳米抗体的氨基酸序列如seq id no.3~4所示;所述纳米抗体的碱基序列seq id no.1~2和氨基酸序列seq id no.3~4均包含可变区。
7.所述纳米抗体为1g6、2c3。
8.所述纳米抗体为1)或2)所述的蛋白质:
9.1)含有可变区的如seq id no.1~2所示的碱基序列编码翻译,或如seq id no.3~4所示的氨基酸序列组成的蛋白质;
10.2)将如seq id no.1~2所示碱基序列或如seq id no.3~4所示的氨基酸序列中的可变区经过一个或几个碱基/氨基酸残基的取代和/或缺失和/或添加,获得的具有与1)中蛋白质相同功能的由1)衍生的蛋白质。
11.本发明还提供了一种编码所述纳米抗体的编码dna,所述编码dna序列为如下1)
‑
3)中任一所述:
12.1)如seq id no.1或seq id no.2中可变区所示的核苷酸序列;
13.2)与seq id no.1或2中序列限定的dna分子杂交且编码所述纳米抗体的dna序列;
14.3)与1)的dna序列具有90%以上的同源性且编码所述纳米抗体的dna序列。
15.本发明还提供了一种含有上述纳米抗体的重组表达载体或表达盒或转基因细胞系或重组菌。
16.本发明还提供了上述靶向人cd133的单峰驼纳米抗体或重组表达载体或表达盒或转基因细胞系或重组菌在a)
‑
c)中任一种中的应用:
17.a)制备特异性结合人cd133的细胞治疗产品;
18.b)制备治疗肿瘤的抗体药物、靶向人cd133的免疫毒素、抗体药物偶联物产品;
19.c)制备治疗肿瘤的细胞治疗产品。
20.本发明还提供了一种靶向人cd133纳米抗体的制备方法,利用稳定表达cd133的cho细胞系作为抗原,对天然纳米抗体噬菌体展示库进行筛选,之后使用野生型cho细胞进行负筛,所述方法具体包括如下步骤:
21.1)利用分子克隆的方法构建cd133全长的慢病毒包装质粒,与pspax2和pmd2g共转染hek293t细胞,获取慢病毒上清;经离心去除细胞碎片后,使用超滤管对慢病毒上清进行浓缩,得到慢病毒浓缩液;采用流式细胞术对慢病毒滴度进行检测;
22.2)将制备好的cd133慢病毒浓缩液感染cho细胞;
23.3)根据细胞是否携带绿色荧光蛋白egfp以及egfp的荧光强弱对感染后cho细胞进行流式分选,得到cd133高表达的细胞亚群,随后使用流式细胞术检测细胞表面cd133的表达水平,设置天然高表达cd133的阳性细胞对照;
24.4)以经过验证的cd133稳定表达的cho细胞作为抗原为高容量天然纳米抗体噬菌体展示库进行正筛,洗脱获得候选噬菌体;使用野生型cho细胞对候选噬菌体进行负筛,去除与非靶蛋白结合的噬菌体颗粒;
25.5)重复进行步骤4),使噬菌体展示库中与靶蛋白结合的噬菌体克隆得到富集;
26.6)根据筛选富集情况,利用具有富集倾向的候选噬菌体侵染对数期大肠杆菌tg1菌株,分别以稳定表达cd133的cho细胞和野生型cho细胞作为抗原进行单克隆噬菌体elisa筛选,获取结合cd133稳定表达cho细胞而不结合野生型cho细胞的克隆;
27.7)对获取的候选克隆进行测序和比对分析,明确得到的候选抗体的核苷酸和氨基酸序列数目;
28.8)根据获得的序列数目对候选纳米抗体进行原核表达和纯化;将包含候选纳米抗体编码序列的阳性克隆噬菌粒载体转化bl21(de3),使用1mm iptg对候选纳米抗体进行诱
导表达,随后通过渗透压冲击法提取周质,使用ni
‑
nta层析柱进行亲和纯化,得到具有高纯度的纳米抗体。
29.9)特异性和种属交叉反应性检测;使用流式细胞术以纯化获得的纳米抗体对天然表达cd133的肿瘤细胞、稳定表达cd133的cho细胞和野生型cho细胞进行结合检测,明确其结合活性和特异性。同时,以纳米抗体和商品化抗小鼠cd133抗体对鼠cd133
+
阳性细胞进行流式检测,明确所制备的抗cd133纳米抗体的种属交叉反应性。
30.10)抗cd133纳米抗体与人igg1 fc融合表达及纯化。将抗cd133纳米抗体编码序列构建到pcdna3.4载体,通过瞬时转染293f细胞获取表达上清,随后利用proteina对纳米抗体
‑
fc融合蛋白进行纯化,得到具有较高纯度的纳米抗体
‑
fc融合蛋白。
31.本发明还提供了前述制备方法获得的靶向人cd133的纳米抗体。
32.本发明提出的抗人cd133纳米抗体为本发明创新性首次提出的抗人cd133纳米抗体。本发明所采用的全细胞抗体筛选策略以稳定表达细胞系的构建取代抗原的表达与纯化,可规避膜蛋白及其他难以表达抗原的制备难题,具有普遍的适用性。
33.现有技术中,靶向cd133的抗体制备方法主要包括两类:其一,使用原核表达系统对cd133的胞外片段进行表达和纯化,并以其作为抗原对小鼠进行免疫,通过小鼠杂交瘤抗体制备技术得到靶向cd133的鼠源抗体。其二,以原核表达cd133胞外片段对噬菌体抗体展示库进行淘选获得抗cd133抗体。
34.本发明提出的方法因无需免疫动物,相比传统杂交瘤抗体制备技术,可明显缩短实验周期,传统杂交瘤抗体制备技术大致需要3个月才能获得抗体序列,而本发明仅需3周至1个月获就能得到抗体序列,并极大地降低了抗体制备的工作量和成本。
35.本发明还提供了一种靶向人cd133的纳米抗体与dm1的偶联物的制备方法,将纳米抗体
‑
fc融合蛋白与微管抑制剂dm1偶联,获得基于cd133纳米抗体的药物偶联物,以cck
‑
8检测cd133纳米抗体药物偶联物对cd133
+
细胞的细胞毒作用。
36.本发明还提供了前述制备方法获得的靶向人cd133的纳米抗体与dm1的偶联物。
37.本发明还提供了所述的靶向人cd133的纳米抗体与dm1的偶联物在制备肿瘤药物中的应用。
38.本发明的有益效果包括:本发明制备的抗cd133抗体为纳米抗体,拥有较小的分子量(分子量约为14kda),可利用大肠杆菌原核表达系统表达,为首个报道的抗人cd133纳米抗体。在生产、运输和给药方式上具有明显的优势;本发明获得的抗cd133纳米抗体药物偶联物相比常规全尺寸抗体偶联药物具有更小的分子量,理论上将具有更好的肿瘤组织穿透性,因而在实体瘤的治疗方面可能有独特的优势。
附图说明
39.图1:cd133纳米抗体全细胞筛选流程图。
40.图2:cd133表达水平流式细胞检测。以天然表达cd133的人肝癌细胞系huh7作为阳性对照,以不表达人cd133的cho细胞系作为阴性对照。上图左、中、右图分别为cho细胞、稳定表达cd133的cho细胞及huh7细胞上cd133的表达水平的流式细胞检测图。下图为三种细胞流式检测的平均荧光强度统计图。
41.图3:抗人cd133纳米抗体全细胞筛选富集情况。以稳定表达人cd133的cho细胞对
单峰骆驼(camelus dromedarius)天然纳米抗体噬菌体展示库进行正筛,随后以野生型cho细胞进行负筛,获得特异性靶向人cd133的纳米抗体序列。
42.图4:单克隆噬菌体elisa筛选cd133纳米抗体阳性克隆。上图和下图分别为随机挑取的96个单克隆的细胞elisa检测结果。
43.图5:cd133纳米抗体特异性检测。2c3和1g6为筛选获得的两条抗人cd133纳米抗体序列,左图和右图分别为两者与cho细胞和稳定表达cd133的cho细胞的流式细胞检测图。
44.图6:抗人cd133纳米抗体
‑
hfc融合蛋白纯度检测。左图为纳米抗体
‑
hfc融合蛋白的结构示意图。中图和右图分别为还原和非还原sds
‑
page检测抗人cd133纳米抗体
‑
hfc融合蛋白的纯度图。
45.图7:抗人cd133纳米抗体
‑
hfc融合蛋白与cd133阳性细胞的结合情况。左、中、右图分别为抗人cd133纳米抗体
‑
hfc融合蛋白与ht29、hct116和caco
‑
2细胞结合的流式检测图。
46.图8:基于抗人cd133纳米抗体的抗体偶联药物对cd133阳性细胞的细胞毒作用。左、中、右图分别为2c3
‑
dm1(2c3
‑
hfc与dm1偶联获得的抗体药物偶联物)和2c3
‑
hfc对ht29、hct116和caco
‑
2的细胞毒作用。
具体实施方式
47.结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
48.除非另有其他明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的元件或组成部分,而并非排除其他元件或其他组成部分。
49.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
50.下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径获得。
51.实施例1靶向人cd133纳米抗体的制备
52.1)构建稳定表达人cd133的cho细胞系;使用plvx
‑
ires
‑
zsgreen、pmd2g、pspax2三质粒慢病毒包装系统在hek293t细胞中进行cd133慢病毒包装,将获得的慢病毒上清离心去除细胞碎片后,使用超滤管对其进行浓缩,获得慢病毒浓缩液。随后,使用流式细胞术检测浓缩慢病毒的滴度。最后,使用慢病毒浓缩液感染cho细胞并通过绿色荧光蛋白(gfp)进行流式分选,获得稳定表达cd133的cho细胞系。经细胞传代和冻存后,使用商品化抗人cd133抗体通过流式细胞术对稳定表达cd133的cho细胞上cd133的表达水平进行检测,并与天然高表达cd133的人肝癌细胞系huh7进行比较。经检测,通过慢病毒感染结合流式分选方法,成功构建了表达cd133的cho细胞系(图2)。
53.2)抗人cd133纳米抗体的筛选与鉴定;以稳定表达人cd133的cho细胞为靶细胞,利用高容量单峰驼(camelus dromedarius)天然纳米抗体噬菌体展示库进行筛选,经封闭、结合、洗涤、洗脱步骤后获得富集候选噬菌体,随后利用野生型cho细胞对富集的噬菌体进行负筛,从而去除非靶向人cd133的噬菌体颗粒。重复进行3轮筛选,使与人cd133结合的噬菌体得到明显富集。将具有明显富集倾向筛选轮数的噬菌体侵染对数期大肠杆菌tg1菌株并涂布平板,从平板上挑取单克隆菌落接种至96孔深孔板,振摇培养至对数期后,使用m13ko7
辅助噬菌体进行侵染,随后30℃振摇培养过夜,获得候选单克隆噬菌体上清。以稳定表达人cd133的cho细胞和野生型cho细胞接种96孔细胞培养板,以候选单克隆噬菌体上清作为一抗,辣根过氧化物酶(hrp)偶联的抗m13抗体作为二抗进行细胞elisa检测,获得结合cd133稳定表达cho细胞而不结合野生型cho细胞的单克隆。将候选阳性克隆测序,对测序结果进行比对分析,明确具有不同核苷酸和氨基酸序列的候选抗人cd133纳米抗体数目。
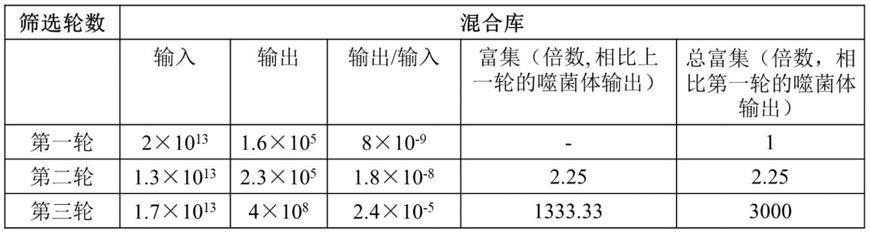
54.结果分析:随着筛选的进行,与人cd133结合的噬菌体得到明显富集,以第三轮筛选富集最为明显(表1,图3)。通过细胞elisa鉴定,获得了44个结合cd133稳定表达cho细胞而不结合野生型cho细胞的单克隆(图4)。对上述44个克隆进行测序和比对,最终获得两条cdr区存在明显差异的cd133纳米抗体序列,命名为1g6和2c3。
55.表1 cd133纳米抗体全细胞筛选富集检测
[0056][0057]
3)候选抗人cd133纳米抗体的特异性检测;将候选纳米抗体的噬菌粒载体转化bl21(de3)感受态细胞并涂布平板,挑取单克隆接种2yt+氨苄青霉素培养基,振摇培养过夜。按1:100比例将过夜培养菌液转接至大体积2yt+氨苄青霉素培养基,振摇培养至对数期后,加入iptg至终浓度为1mm,30℃培养过夜。离心获得菌体沉淀,使用含1mg/ml溶菌酶的1
×
tes重悬菌体并冰浴30min,随后12,000rpm,离心30min,获得周质提取液。使用pbs将周质提取液按1:3进行稀释,并使用ni
‑
nta亲和层析进行纯化,将洗脱获得的抗人cd133纳米抗体进行sds
‑
page检测。最后通过离心超滤去除纳米抗体溶液中的咪唑并进行浓缩。以候选纳米抗体为一抗,apc偶联的抗flag抗体为二抗通过流式细胞术检测候选纳米抗体1g6和2c3与稳定表达人cd133的cho细胞和野生型cho细胞的结合情况。
[0058]
结果分析:与单克隆噬菌体细胞elisa结果一致,筛选获得的候选抗人cd133纳米抗体1g6和2c3可以特异性结合cd133(图5)。
[0059]
实施例2融合蛋白及与dm1偶联物的制备
[0060]
1)纳米抗体
‑
fc融合蛋白表达与纯化;将纳米抗体编码序列构建到pinfuse
‑
higg1
‑
fc2表达载体并测序验证,将序列正确的纳米抗体表达载体瞬时转染293f细胞,培养大约5d后,离心收集培养上清并通过proteina进行亲和纯化,获得纳米抗体与人igg1 fc的融合蛋白。
[0061]
2)纳米抗体
‑
fc融合蛋白与美登素dm1的偶联及分析检测;偶联方式为将抗体存在的链间二硫键还原,产生游离的巯基,通过巯基与细胞毒化合物中存在的马来酰亚胺官能团反应,形成稳定的共价键。使用紫外分光光度法对抗体药物偶联物的浓度进行检测,以hic
‑
hplc检测抗体与药物的偶联比率,使用sec
‑
hplc对抗体药物偶联物中聚体含量进行检测。
[0062]
3)纳米抗体2c3药物偶联物的细胞毒作用检测;选择天然表达cd133的结直肠癌细
胞系caco
‑
2、hct116、ht
‑
29,肝癌细胞系huh7对cd133纳米抗体dm1药物偶联物的细胞毒作用进行检测。具体步骤为:将上述细胞使用各自完全培养基稀释至2
×
105个/ml,按50μl/孔接种至96孔板,随后使用各自完全培养基对cd133纳米抗体dm1偶联物和cd133纳米抗体
‑
fc进行二倍梯度稀释,将稀释液加入已接种有细胞的96孔板中,每个浓度3个重复,设置不加抗体或adc的对照孔,37℃培养72h后使用cck
‑
8进行检测。
[0063]
结果分析:经293f瞬时转染表达和proteina亲和纯化,获得了纯度较高的1g6和2c3与人igg1 fc的融合蛋白(图6)。流式检测结果显示,1g6
‑
hfc和2c3
‑
hfc融合蛋白可以与天然表达cd133的肿瘤细胞结合(图7)。细胞毒检测中,2c3
‑
dm1对cd133
+
人结直肠癌细胞ht
‑
29、hct116和caco
‑
2呈现剂量依赖的细胞毒性,而裸抗2c3
‑
hfc融合蛋白则对细胞没有毒性(图8)。
[0064]
应用实施例1抗人cd133纳米抗体在干细胞分离与鉴定中的应用
[0065]
cd133是正常干细胞和肿瘤干细胞鉴定和分离的一个标志物,基于纳米抗体稳定性高、易表达及分子量小等优势,将抗人cd133纳米抗体与磁珠、荧光素偶联后可应用于干细胞的磁珠分选、流式检测与分选。
[0066]
应用实施例2抗人cd133纳米抗体在肿瘤治疗中的应用
[0067]
cd133在部分肿瘤中高表达且与肿瘤的发生、发展和转移存在密切关联,靶向cd133的嵌合抗原受体t细胞或抗体药物偶联物均可特异性清除cd133+肿瘤细胞,清除肿瘤的“种子”——肿瘤干细胞,有望在一定程度上解决肿瘤治疗中的复发、转移和耐药难题。基于纳米抗体的天然特性,抗人cd133纳米抗体可以很容易地应用于嵌合抗原受体t细胞、抗体药物偶联物或免疫毒素,并且能够根据靶标的表达水平以及治疗的安全性要求进行相应的工程化设计,相比传统抗体具有明显优势。
[0068]
本发明的保护内容不局限于以上实施例。在不背离本发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1