一种可视报告基因及其载体的应用
1.本发明涉及基因工程技术领域,具体涉及一种能够在黄瓜中稳定遗传的可视报告基因及其载体的应用。
背景技术:
2.葫芦科作物是重要的经济作物,也是研究果实膨大、维管束长距离运输、性别分化等生物学问题的模式植物。目前,葫芦科几种重要作物,包括黄瓜、甜瓜、西瓜和南瓜的基因组测序已经完成,瓜类crispr/cas9基因编辑体系已经建立,进一步利用基因大数据、结合基因编辑工具挖掘功能基因,需要高效的遗传转化体系与之配合。然而,葫芦科作物遗传转化一直是世界范围内的难题,虽然近年来有所突破,但仍面临转化效率不高、技术难度大、费时费力等问题,难以大规模开展,缺乏高效遗传转化体系仍然是制约葫芦科作物生物学研究和分子育种最大的技术瓶颈之一。
3.另外,现有的转化体系转化成功后,一般是通过测序验证转化是否成功,而葫芦科作物的转化效率往往很低,有时甚至只有万分之几,这就导致阳性植株的检测周期较长、成本较高,进一步延长实验周期,增加实验难度。因此,开发一种葫芦科植物的可视报告基因并保证其良好的转化效率对于葫芦科植物的遗传转化研究具有重要意义。
技术实现要素:
4.本发明的目的之一在于提供一种可视报告基因在黄瓜遗传转化中的应用,其不同之处在于,所述可视报告基因为dsred。
5.被该可视基因转入后的黄瓜不仅幼苗呈现出红色表型,其果实和种子均呈现出红色表型,肉眼即可观察到该表型,很容易的判断出阳性转化苗。
6.本发明的目的之二在于提供一种含有上述可视报告基因的载体、细胞。
7.在本发明的一种实施方式中,所述载体含有35s:dsred
‑
terminal表达框。
8.在本发明的一种实施方式中,所述载体包含有g10
‑
90pro:xve
‑
e9t片段。
9.本发明的目的之三在于提供一种上述载体的制备方法,包括以下步骤:将扩增得到的35s:dsred
‑
terminal表达框插入到pbse401载体上得到中间载体pbse401r;将扩增得到的g10
‑
90pro:xve
‑
e9t片段插入到中间载体pbse401r中,即得。
10.本发明的一种实施方式中,所述35s:dsred
‑
terminal表达框以pcambia2300:35s:dsred2载体为模板扩增得到。
11.本发明的一种实施方式中,所述35s:dsred
‑
terminal表达框插入在pbse401载体的ecorⅰ酶切位点之间。
12.本发明的一种实施方式中,所述g10
‑
90pro:xve
‑
e9t片段以px6
‑
gfp
‑
af330636载体为模板扩增得到。
13.本发明的一种实施方式中,所述g10
‑
90pro:xve
‑
e9t片段插入在中间载体的hindⅲ酶切位点之间。
14.本发明的目的之四在于提供上述载体在黄瓜育种中的应用,即将所述载体通过农杆菌介导的方式转化到黄瓜中。
15.本发明首次将可视报告基因dsred2用于黄瓜的遗传育种中,经过研究发现,该基因可在黄瓜中稳定遗传且得到的黄瓜幼苗、植株、果实及种子均呈现出肉眼可见的红色表型,且该性状可以稳定遗传;将该基因通过特定的载体及农杆菌介导的方式转化到黄瓜中,转化效率可以高达0.25%。
附图说明
16.图1为vector p载体表达元件组;
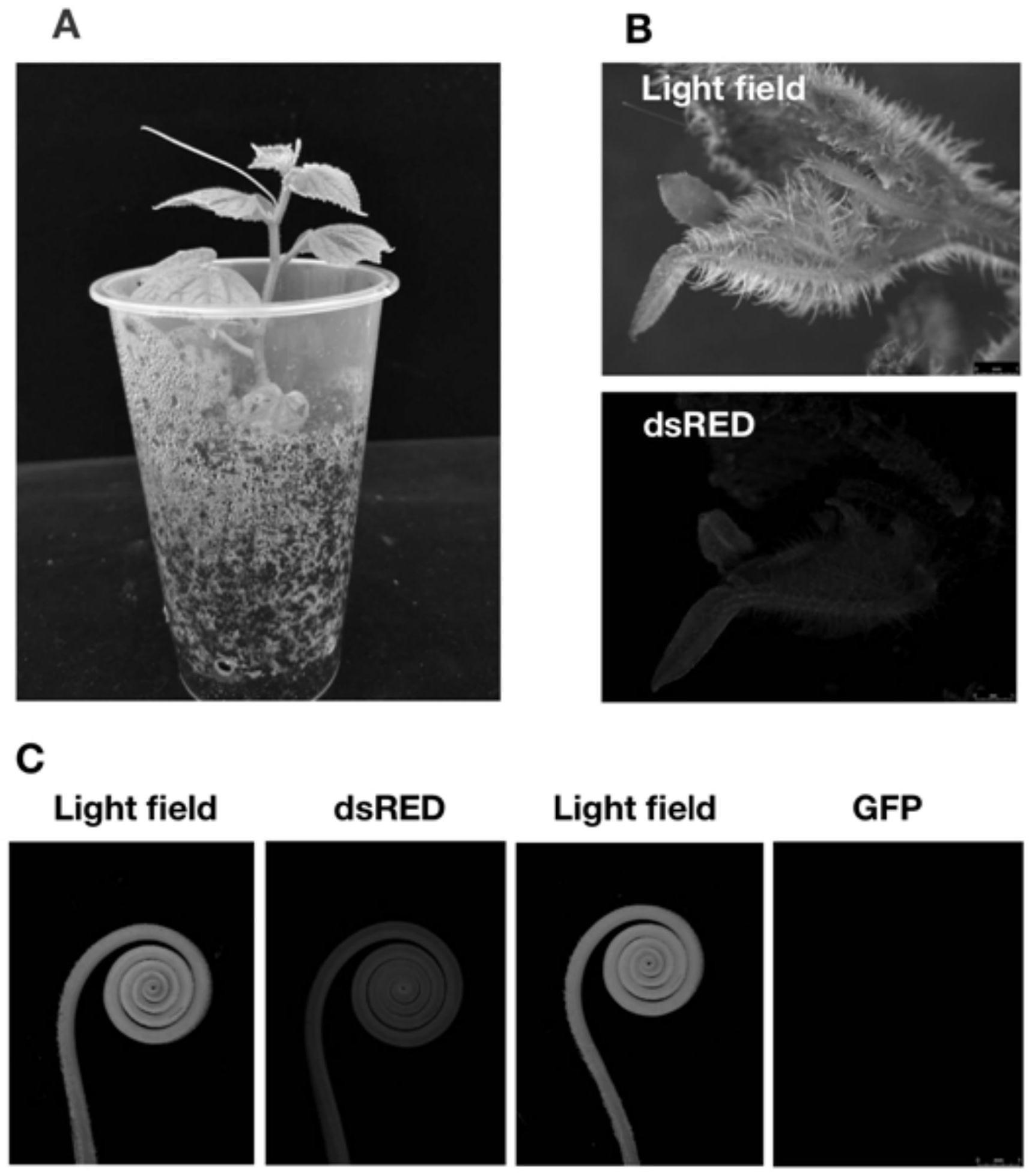
17.图2为稳定转化黄瓜苗及荧光显微镜下具有红色荧光的黄瓜芽和黄瓜卷须,其中a为奶茶杯中的红色荧光苗,,b为荧光显微镜下观察转化vector p的黄瓜芽,c为不同光源下荧光显微镜观察转化vector p的黄瓜卷须;
18.图3为稳定转化黄瓜苗所收红色黄瓜果实与种子,其中a为黄瓜果实,b为黄瓜种子;
19.图4为载体p的质粒图谱。
具体实施方式
20.下面结合具体实施例对本发明作进一步的详细说明,以使本领域的技术人员更加清楚地理解本发明。
21.以下各实施例,仅用于说明本发明,但不止用来限制本发明的范围。基于本发明中的具体实施例,本领域普通技术人员在没有做出创造性劳动的情况下,所获得的其他所有实施例,都属于本发明的保护范围。
22.本发明的发明构思是:
23.瓜类crispr/cas9基因编辑体系已经建立,进一步利用基因大数据、结合基因编辑工具挖掘功能基因,需要高效的遗传转化体系与之配合。然而,葫芦科作物遗传转化一直是世界范围内的难题,高效的遗传转化体系仍然是制约葫芦科作物生物学研究和分子育种最大的技术瓶颈之一。现有的转化体系转化成功后,一般是通过测序验证转化是否成功,而葫芦科作物的转化效率往往很低,有时甚至只有万分之几,这就导致阳性植株的检测周期较长、成本较高,进一步延长实验周期,增加实验难度。因此,发明人尝试开发一种葫芦科植物的可视报告基因,同时还要保证其良好的转化效率。
24.发明人首先收集了rfp、m cherry、dsred几个红光基因的载体用于转化实验,最终发现rfp和m cherry红光载体转化后红光表达均较弱,需要昂贵的仪器去观察且依旧很难与植物本身背景材料区分,而pcambia2300:35s:dsred2载体在黄瓜愈伤中所表达的红色荧光强度表型极为明显。
25.发明人进一步以pcambia2300:35s:dsred2载体作为模板扩增35s:dsred
‑
terminal表达框,插入到pbse401载体的ecori酶切位点之间,得到中间载体pbse401r;再以px6
‑
gfp
‑
af330636载体为模板扩增g10
‑
90pro:xve
‑
e9t片段,并去掉其中的loxp位点,通过infusion插入到pbse401r载体的hindiii酶切位点之间,得到载体p(vector p:pbse401
‑
cas9
‑
xve
‑
dsred)。将vector p转化农杆菌并采用子叶直接再生法转化黄瓜,在体式荧光显
微镜下dsred红色荧光明亮可见,与非转化背景能较好地区分,且其转化率能高达0.25%。
26.实施例1
27.载体p的构建方法,具体如下:
28.以pcambia2300:35s:dsred2载体作为模板经pcr扩增35s:dsred
‑
terminal表达框,插入到pbse401载体的ecori酶切位点之间,得到中间载体pbse401r;
29.以px6
‑
gfp
‑
af330636载体为模板,采用overlap pcr扩增g10
‑
90pro:xve
‑
e9t片段,并去掉其中的loxp位点,通过infusion插入到pbse401r载体的hindiii酶切位点之间,得到载体p(vector p:pbse401
‑
cas9
‑
xve
‑
dsred)。
30.实施例2
31.将实施例1中得到的载体p转入大肠杆菌感受态细胞dh5α中,提取质粒,再将vector p的质粒转入农杆菌中,为后续黄瓜遗传转化侵染实验作准备。
32.(1)转化大肠杆菌的方法:
33.a.在超净工作台中取1μl的载体p质粒加入100μl的大肠杆菌感受态细胞dh5α中,轻弹混匀;
34.b.冰浴5min,放入42℃水浴锅中热激90s,结束后立刻放入冰盒内2~3min;
35.c.在超净工作台中加入1ml lb溶液,混匀;37℃,200rpm摇床培养30min;
36.d.超净工作台中在固体lb平板上均匀涂布约100
‑
200μl转化菌,平板封口倒置于37℃培养箱中培养1d;
37.e.待长出单菌落后,挑取单克隆菌斑接入液体lb培养基(含卡那霉素50mg/l)中37℃摇床培养,进行pcr鉴定,鉴定出目的条带的菌液加入等体积甘油于
‑
80℃冰箱保存。
38.(2)提取质粒:在超净工作台中,取2μl的上述大肠杆菌菌液加入装有20ml的lb+kana液体培养基的锥形瓶中,在37℃摇床中培养过夜,然后用tianprep mini plasmid kit质粒小提试剂盒(购买厂家:tiangen,dp180123)提取质粒,测出每管的质粒浓度后标记保存。
39.(3)农杆菌转化方法:
40.a、超净工作台中取2μl质粒,加入100μl的eha105农杆菌感受态细胞中,轻弹混匀;
41.b、冰浴5min,放入液氮中冷冻1min,迅速置于37℃水浴锅中水浴5min;
42.c、加入800μl lb培养基,200rpm摇床上培养2h;
43.d、12000rpm离心1min以浓缩菌液,加入200μl lb液体培养基重悬,混匀,将其均匀涂在lb+kana的固体培养基中,28℃培养箱中培养2d;
44.e、挑出农杆菌单克隆菌斑,28℃,200rpm摇菌过夜,并进行pcr与琼脂糖凝胶电泳鉴定;
45.f、鉴定为阳性的菌液,置于
‑
80℃超低温冰箱中保存备用。
46.将上述得到的农杆菌转化载体p(包含cas9
‑
dsred
‑
xve元件),通过子叶直接再生法遗传。
47.实施例3
48.本实施例提供一种黄瓜遗传转化方法,所用的黄瓜材料为葫芦科甜瓜属黄瓜(cucumis sativus l.)种质cu2,具体步骤如下:
49.1.播种:取籽粒饱满、大小均一的cu2黄瓜种子,于55℃温水中浸泡半小时以上,除
去种皮。在超净工作台中,先用75%的酒精清洗30s,再用0.3%的naclo溶液浸泡15min,其间轻轻摇动,最后用无菌水冲洗5次。将消毒好的种子转移至事先准备好的种子萌发培养基上,每皿约播30粒种子。放于28℃烘箱中暗培养24h,待种子刚有一点棱,不那么泛白时,即可切取外植体;
50.2.外植体准备:取已萌发的种子,在超净台中切弃远端约1/3的子叶,去掉胚轴,将两片子叶分开,每片子叶在近端会形成一个u型的伤口,在u形口处用刀尖点上一点,即得到外植体;
51.(3)农杆菌侵染:取出
‑
80℃下保存的经鉴定转化成功的vector p农杆菌,接种于2ml lb液体培养基中(含50mg/l kana和50mg/l rif),28℃、200rpm摇床过夜。然后按照1:500的比例稀释,加入到新鲜的50ml lb液体培养基中(含50mg/l kana和50mg/l rif),28℃、200rpm摇床过夜。次日当菌液浓度达到od
600=
0.4~0.8时,于6000rpm离心8min,弃去上清液收集菌体,并用im液体培养基重悬菌体并稀释到od
600
为0.2。将注射器的活塞芯杆取出,将子叶外植体加入20ml注射器的针筒中,轻轻套入活塞芯杆并尽量排空注射器中多余的空气,从针孔处吸取大于10ml的农杆菌菌液,然后轻轻地向前推动活塞,使得气泡和多余的液体从注射器针孔处排出,直至活塞推至10ml刻度位置处停留。用橡胶皮塞密封住注射器的头部针孔,向后方用力地缓缓拔动活塞芯杆,并轻轻晃动针简,使各外植体体受力均匀,待活塞停留在20ml刻度时停留保持1.5min,以此到达施加真空负压的目的。轻轻松手,活塞慢慢回到10ml刻度位置,之后再重复施加真空负压1.5min/次;
52.(4)共培养:侵染结束后,将外植体摊放到滤纸上轻微吸干附着的菌液,然后将外植体转移到垫一层滤纸的共培养培养基上。于24℃、黑暗条件下共培养4d。在荧光体式显微镜下观察dsred发红光的情况,评估侵染效率;
53.(5)恢复培养:用无菌水清洗外植体7~8遍,用灭过菌的吸水纸吸干表面附着的液体,将外植体30度或45度斜插在恢复培养基上;
54.(6)分化培养:于光下培养7d后更换到分化培养皿上,再在光下培养三个星期,在体式荧光显微镜下,挑选含有dsred荧光芽的子叶,继代培养到含有再生培养基或含有伸长培养基的组培瓶中培养;
55.(7)伸长:当dsred荧光芽大于1cm时,切去子叶外植体、假阳性逃逸的叶和芽,将荧光芽在含有伸长培养基的组培瓶中,于光下培养;
56.(8)生根:当dsred荧光芽大于4cm时,将其继代到生根培养基上诱导生根;
57.(9)移裁:将生根良好的转基因阳性苗移栽到灭过菌的基质中,于光照培养箱中炼苗和蹲苗一个月后检测。
58.dsred红光测试的结果表明:载体p能够顺利转化到野生型黄瓜中,且在转化了2000个左右的外植体后获得了5株红色荧光苗,遗传转化效率约为0.25%。
59.将荧光苗移栽到温室中培育,大量繁种,结出了红色表皮的果实,这说明获得的转化植株是理想的转化植株。稳定转化黄瓜苗及显微镜下具有红色荧光的黄瓜芽和黄瓜卷须如图2所示,稳定转化的黄瓜苗所收获的红色黄瓜果实与种子如图3所示。
60.在此有必要指出的是,以上实施例仅限于对本发明的技术方案做进一步的阐述和说明,并不是对本发明的技术方案的进一步的限制,本发明的方法仅为较佳的实施方案,并非用于限定本发明的保护范围。凡在本发明的精神和原则之内,所作的任何修改、等同替
换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1