一种特异性结合人CTLA4的抗体及包含其的药物和试剂盒的制作方法
一种特异性结合人ctla4的抗体及包含其的药物和试剂盒
技术领域
1.本发明属于生物医药领域,具体涉及一种特异性结合人ctla4的抗体及包含其的药物和试剂盒。
背景技术:
2.细胞毒t淋巴细胞相关抗原4(ctla4),又名cd152,是细胞毒性t淋巴细胞中发现的第四种特异性抗原基因。该基因位于人类第2号染色体的2q33位置,基因全长6,174bp,含有3个外显子和2个内含子。ctla4蛋白的胞外段的主要功能是与其相关配体b7分子结合,现在已发现三种以上的b7分子,分别命名为b7
‑
1(cd80)、b7
‑
2(cd86)、b7
‑
3等。其胞内端只有36个氨基酸,这部分氨基酸序列构成了一种叫做itim(immune tyrosine inhibitory motif),这个结构是将与b7分子结合的外来信号转变成细胞的负调信号。
3.ctla4主要表达到t细胞上,是t细胞上的一种跨膜受体,与cd28共同享有b7分子配体,ctla4胞外区与b7分子的结合力比cd28大20至100倍,因此使其能够胜过cd28的配体。ctla4与b7分子结合后诱导t细胞无反应性,参与免疫反应的负调节,而cd28传递刺激信号。ctla4也在调节性t细胞(treg)中发现并有助于它们的抑制功能。
4.在肿瘤发生过程中,ctla4与其配体b7分子结合后产生抑制性信号,抑制t细胞激活,使肿瘤细胞免受t淋巴细胞攻击。因此,通过阻断ctla4与b7分子结合,可刺激免疫细胞大量增殖,从而诱导或增强抗肿瘤免疫反应。研究发现,靶向ctla4的分子产生抗肿瘤作用包括两种机制:
①
减少肿瘤特异性效应t细胞,如cd8+t细胞的免疫抑制性信号,导致其克隆扩增,并增强抑制肿瘤活性。
②
去除肿瘤诱导的调节性t细胞(treg),treg细胞可抑制肿瘤相关抗原的免疫反应。目前,靶向ctla4的ipilimumab和tremelimumab已用于临床,广泛用于治疗黑色素瘤、肾癌、前列腺癌、肺癌等,但两个抗体均是包含重链和轻链的传统igg抗体,且临床疗效并不突出。因此,开发新型的ctla4抗体,尤其是单结构域抗体,对于开发用于治疗肿瘤的免疫治疗药物具有极大意义。
技术实现要素:
5.本发明针对上述现有技术存在的不足,提供一种特异性结合人ctla4的抗体及包含其的药物和试剂盒。本发明是一种特异性结合ctla4的抗体,所提供的结合ctla4的分子展现出以下特性但不局限与以下性质:(1)与人ctla4具有高亲和性和特异性;(2)可以阻断ctla4与cd86或cd80的相互作用;(3)可以特异性地结合ctla4过表达细胞;(4)增强pbmc和/或t细胞的活化;(5)抑制肿瘤生长。
6.具体技术方案如下:
7.本发明的目的之一是提供一种特异性结合人ctla4的抗体,其特包括3个互补性决定区;
8.3个所述的互补性决定区分别为:氨基酸序列如seq id no:1所示的cdr1,氨基酸序列如seq id no:2所示的cdr2,以及氨基酸序列如seq id no:3所示的cdr3。
9.上述技术方案的有益效果是:本发明所提供的cdr区使得结合ctla4的抗体与人ctla4具有高亲和性和特异性。
10.进一步,所述的抗体为单结构域抗体,优选为重链单域抗体。
11.再进一步,所述的单结构域抗体包含如下任一氨基酸序列:seq id no:4,seq id no:8,seq id no:9,或seq id no:10。
12.再进一步优选,所述的单结构域抗体的氨基酸序列与氨基酸序列seq id no:4和seq id no:9具有至少90%的整体序列同一性。
13.上述技术方案的有益效果是:本发明所提供的结合ctla4的抗体,与人ctla4结合具有高亲和性和特异性,具有增强pbmc和/或t细胞的活化并抑制肿瘤生长。
14.进一步,所述的抗体还包含免疫球蛋白fc区。
15.再进一步,所述免疫球蛋白fc区是人免疫球蛋白fc区优选为人igg1或igg4的fc区。
16.再进一步优选,所述的抗体包含如下任一氨基酸序列:seq id no:11,seq id no:14,seq id no:15,seq id no:16,seq id no:17。
17.上述技术方案的有益效果是:本发明所提供的结合ctla4的抗体,与人ctla4具有高亲和性和特异性,具有增强pbmc和/或t细胞的活化并抑制肿瘤生长。所述单结构域抗体可通过结合靶细胞(例如treg细胞)的抗原位点和效应细胞的fc受体位点,介导adcc活性,达到杀伤靶细胞的目的。另一方面,所述单结构域抗体在体内具有较长的半衰期和更好的稳定性。
18.进一步,所述的抗体,其具有下述特征中的至少一个:
19.a.与人ctla4结合;
20.b.阻断ctla4与cd86或cd80的相互作用;
21.c.增强pbmc和/或t细胞的活化;
22.d.抑制肿瘤生长。
23.本发明的目的之二是提供一种药物组合物,其包含上述特异性结合人ctla4的抗体的药物,其用于治疗或缓解癌症和/或感染性疾病。
24.本发明的目的之三是提供一种上述特异性结合人ctla4的抗体在药物制备中的应用。
25.本发明的目的之四是提供一种包含上述特异性结合人ctla4的抗体的试剂盒,其用于诊断ctla4相关疾病;所述的ctla4相关疾病为ctla4高表达相关的肿瘤和/或感染性疾病。
26.采用上述技术方案的有益效果是:将本发明中结合ctla4的抗体应用到试剂盒,可有效检测和诊断相关疾病。
附图说明
27.图1为实施例4中抗体与ctla4重组蛋白结合活性结果;结果显示不同抗体与ctla4重组蛋白活性不同,其中ca1
‑
f4的ec50为6.775ng/ml,hca14
‑
f4的ec50为8.087ng/ml,hca14
‑
f1的ec50为0.6364ng/ml;
28.图2为实施例4中抗体与过表达ctla4细胞的结合活性结果;结果显示,ca1
‑
f4与过
表达ctla4细胞的ec50为42.64ng/ml,hca14
‑
f4的ec50为33.51ng/ml,hca14
‑
f1的ec50为36.74ng/ml;
29.图3为实施4中抗体抑制ctla4与配体结合的活性结果;结果显示,hca14
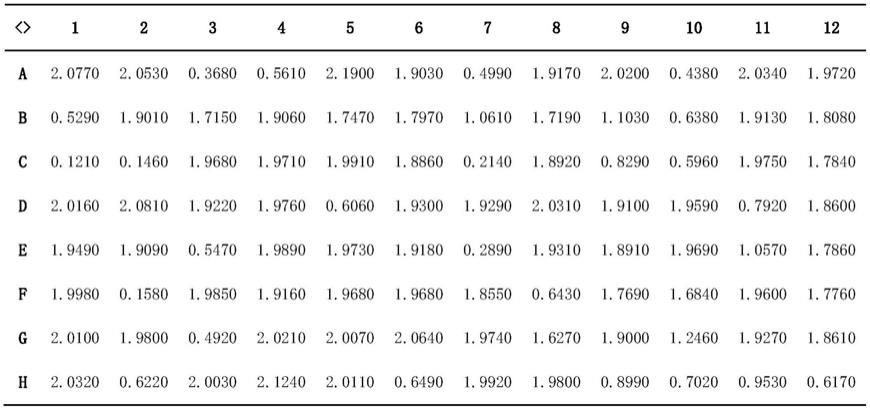
‑
f4抑制ctla4与cd86或cd80的结合,ic50值分别为0.84651nm和6.17nm左右;
30.图4为实施例4中抗体与ctla4重组蛋白亲和力检测结果;结果显示,hca14
‑
f4与ctla4重组蛋白的亲合力优于对照抗体;
31.图5为实施例5中抗体在混合淋巴细胞实验(mlr)中的活性检测结果;结果显示hca14
‑
f4刺激t细胞分泌il2;
32.图6为实施例5中抗体在seb实验中的活性检测结果;结果显示,hca14刺激pbmc细胞分泌il2,优于对照抗体;
33.图7为实施例6中抗体在的hpd1/hctla4转基因c57bl/6j小鼠模型的体内抑瘤活性;结果显示hca14
‑
f4显著抑制mc38移植瘤生长。
具体实施方式
34.以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
35.实施例1:ctla4抗体的筛选
36.1、羊驼免疫
37.构建ctla4
‑
fc融合蛋白(其氨基酸序列如seq id no:22所示)的表达质粒pcdna3.1
‑
ctla4
‑
fc,然后,瞬转该质粒至293f细胞,培养5天,收集上清,采用proteina(ge)亲和层析纯化上清,获得ctla4
‑
fc融合蛋白。
38.采用titermax gold佐剂与ctla4
‑
fc融合蛋白混合乳化进行免疫,在羊驼臀部两侧肌肉分别注射两个点,每个位点注射0.2ml,每周一次,第一次500μg,后续每次200μg,共免疫5周,第4周取血测定抗体滴度,第5周取20ml外周血。
39.2、vhh抗体文库构建
40.使用淋巴细胞分离液分离外周血的淋巴细胞,purelink rna micro kit(thermo)提取rna,使用primescript ii 1st strand cdna synthesis kit(thermo)逆转录制备cdna。以cdna为模板,以上游引物(核苷酸序列如seq id no:23所示,具体为5
’‑
gtcctggctgctcttctacaagg
‑3’
)和下游引物(核苷酸序列如seq id no:24所示,具体为5
’‑
ggtacgtgctgttgaactgttcc
‑3’
)为引物,扩增抗体片段,vhh片段大小700bp左右,正常vh片段1000bp左右。
41.胶回收试剂盒回收700bp左右vhh片段。以vhh片段为模板,vhh
‑
f(sfii)(核苷酸序列如seq id no:25所示,具体为5
’‑
accgtggcccaggcggcccaggtgcagctgcaggagtctggrggagg
‑3’
)和vhh
‑
r(sfii)(核苷酸序列如seq id no:26所示,具体为5
’‑
gtgctggccggcctggccgctggagacggtgacctgggt
‑3’
)为引物,扩增vhh可变区片段。
42.将vhh可变区通过sfii酶切位点酶连到pcomb3噬菌体质粒上,构建抗体库。
43.3、ctla4抗体的筛选
44.然后通过噬菌体展示进行ctla4抗体筛选,具体步骤如下:
45.a.电转化:取5μl抗体库到50μl大肠杆菌tg1感受态中,混匀,加入到电转杯中,电
转2200v,1次,加入950μl 2yt
‑
g,再吸入到9ml 2yt
‑
g。经过37℃,220rpm,1h的恢复。加入10μl氨苄青霉素钠(amp)培养1h。取50μl辅助噬菌体(helper phage)加入到菌液中,培养2h。离心去上清,加入10ml 2yt
‑
ak,吹悬,37℃培养过夜。
46.b.包被抗原:用包被缓冲液稀释抗原至2μg/ml,混匀加入到免疫管中,共2.5ml,4℃包被过夜。
47.c.重组噬菌体收集:步骤a获得的过夜培养菌液,6000g x 10min离心,上清用0.45μm滤头过滤。加入2ml peg/nacl,混匀放置冰上30
‑
60min,10000g
×
20min离心,去上清,用5ml pbs溶解噬菌体库。
48.d.封闭:步骤b获得的免疫管用pbs洗两次,加入封闭液,室温1h。另外,取1ml噬菌体库与等体积封闭液混合,室温封闭10
‑
15min。
49.e.孵育噬菌体库:步骤d获得的免疫管用pbs洗2次,加入封闭好的噬菌体库,37℃培养箱2
‑
3h。
50.f.洗脱:用pbst洗涤步骤e获得的免疫管8次,再用pbs洗2次,加入2.5ml洗脱液(0.2m glycine,ph 2.5),静置10min,转移洗脱液到15ml离心管,加入500μl 1m tris
‑
hcl缓冲液(ph8.0)中和。
51.g.感染:取上述洗脱液500ul,加入到10ml tg1菌液,37℃静置30min。梯度稀释菌液10倍,100倍和1000倍,上述稀释菌液各取100ul涂平板,余液各加5μl amp,37℃,220rpm,1h。
52.h.下-轮panning:取50μl helper phage加入上述菌液中,37℃,220rpm,2h。2500rpm x5min离心去上清,用10ml 2x yt
‑
ak吹悬菌泥,37℃,220rpm过夜培养。然后重复步骤b
‑
g,共进行3轮panning。
53.经过三轮筛选,挑选单克隆抗体,通过噬菌体elisa方法,检测phage活性,具体步骤如下:
54.a.包被ctla4蛋白,用包被缓冲液将其稀释至0.5μg/ml,混匀加入到96孔酶标板中,4℃过夜。
55.b.步骤a获得的96孔酶标板用pbst洗两次,加入50μl phage上清和50μl 1%bsa,37℃,放置1h。
56.c.步骤b获得的96孔酶标板用pbst洗三次,加入100μl 1:10000稀释的anti
‑
m13
‑
ab
‑
hrp(义翘神州),37℃,放置1h。
57.d.步骤c获得的96孔酶标板用pbst洗三次,加入100μl预热的tmb,室温放置10min;
58.e.加入50μl 1m h2so4中止反应,od450检测吸光值,结果如表1所示。
59.表1 噬菌体elisa od450检测结果
[0060][0061]
挑选部分od450>2.0的阳性克隆,送测序。测序结果显示,所有克隆的单结构域抗体序列一致,该单结构抗体命名为ca1。
[0062]
ca1序列包含seq id no:1、seq id no:2和seq id no:3所示的cdr。
[0063]
ca1全长单结构域氨基酸序列如seq id no:4所示,具体为:
[0064]
qvqlqesggglvqaggslrlscaasgsifsinhmawyrqapgkqrelvagvnsrgttnyvdsvkgrftisrdnaknmvyllmnslkpedtavyycralggavaawgqgtqvtvss。
[0065]
实施例2:ctla4单结构域抗体的人源化
[0066]
将实施例1中获取的特异性结合ctla4单结构域抗体ca1进行人源化,具体按照以下步骤进行:
[0067]
选择ighv3
‑
23*01(氨基酸序列如seq id no:5所示)和ighj1*01的构架序列为人源化构架序列。根据kabat编码法对序列进行编码和cdr区及fr区的界定。通过cdr
‑
grafting,将ca1的cdr并置到对应的人源fr区序列,然后对fr区进行v37y,w47l,s49a,k94a的回复突变,获得hca11(氨基酸序列如序列为seq id no:6所示)。在hca11基础上进行f27s和t28i的突变,获得hca12(氨基酸序列如seq id no:7所示)。在hca12基础上,进行a93r的突变,获得hca13(氨基酸序列如seq id no:8所示)。在hca13基础上,进行g44q和l45r的突变,获得hca14(氨基酸序列如seq id no:9所示)。另外,在hca13基础上,进行t77m和l78v的突变,获得hca15(氨基酸序列如seq id no:10所示)。
[0068]
实施例3:抗体及蛋白的表达制备
[0069]
将ca1与igg4的fc(其中igg4上228位氨基酸s突变为p)融合表达,抗体命名为ca1
‑
f4,其氨基酸序列如seq id no.11所示。通过pcr法,将抗体的ca1的dna片段和igg4的fc的dna片段连接,获得全长ca1
‑
f4片段。将ca1
‑
f4片段(包含信号肽),克隆入pcdna3.1(invitrogen)质粒。将ca1
‑
fc4表达质粒瞬转expi293细胞株,用protein a(ge)纯化上清,获取纯化抗体。
[0070]
根据上述方法,分别构建及制备hca11,hca12,hca13,hca14和hca15与igg4的fc(其中igg4上228位氨基酸s突变为p)融合表达的抗体,命名为hca11
‑
f4(氨基酸序列如seq id no:12所示),hca12
‑
f4(氨基酸序列如seq id no:13所示),hca13
‑
f4(氨基酸序列如seq id no:14所示),hca14
‑
f4(氨基酸序列如seq id no:15所示)和hca15
‑
f4(氨基酸序列如seq id no:16所示)。构建hca14与人igg1的fc融合表达的抗体,抗体命名为hca14
‑
f1,其氨
基酸序列如seq id no:17所示。
[0071]
另外通过knobs into holes(kih)技术,构建及制备单价hca14单结构域抗体的不对称fc融合蛋白,命合为hca14
‑
kh。hca14
‑
kh的knobs部分不含hca14单结构域,其knobs部分fc的氨基酸如seq id no.18所示。hca14
‑
kh的holes部分包含hca14单结构域,其氨基酸如seq id no:19所示。
[0072]
同时,通过常规的分子操作和expi293细胞瞬转表达,构建及制备可变区(重链可变区,其氨基酸序列如seq id no:20所示;以及轻链可变区,其氨基酸序列如seq id no:21所示)与ipilimumab一致的对照抗体,其igg1结构命名为ipilimumab(igg1),igg4结构命名为ipilimumab(igg4)。
[0073]
实施例4:ctla4抗体体外活性检测
[0074]
1、抗体与人ctla4重组蛋白结合活性测定
[0075]
包被人ctla4
‑
his重组蛋白于酶标板上,4℃过夜。封闭后加入梯度稀释的抗体,37℃反应1小时,pbst洗两次后,加入goatanti
‑
human
‑
igg
‑
hrp,每孔100μl,37℃反应1小时,最后,pbst洗三次后,加入tmb显色后终止,酶标仪于450nm读数。
[0076]
如图1所示,蛋白结合活性表明,不同抗体与ctla4重组蛋白活性不同,ca1
‑
f4和hca14
‑
f4与重组蛋白结合的ec50分别为6.775ng/ml和8.087ng/ml,hca14
‑
f1与重组蛋白结合的ec50为0.6364ng/ml。
[0077]
2、抗体与ctla4表达细胞结合活性测定
[0078]
采用pei转染法,将人ctla4表达质粒转染293细胞(takara,lenti
‑
x,632180),隔天使用。将过表达细胞置于反应板内,1%bsa封闭,室温孵育1小时;加入梯度稀释抗体,100ul/孔,室温孵育1小时,pbs洗一次,然后,加入羊抗人igg
‑
hrp(jackson immuno),每孔100ul,室温反应1小时,pbs洗两次,最后,加入tmb显色,后以1m硫酸终止,酶标仪于450nm读数。采用上述相同方法,检测抗体与猴ctla4表达细胞的结合活性。
[0079]
如图2所示,细胞结合实验表明,ca1
‑
f4和hca14
‑
f4与人ctla4表达细胞结合的ec50分别为42.64ng/ml和33.51ng/ml,hca14
‑
f4的细胞结合活性优于对照抗体ipilimumab(igg4)(ec50为64.37ng/ml)。另外,hca14
‑
f1的细胞结合的ec50为36.74ng/ml。hca14
‑
f4与猴ctla4表达细胞的结合活性的ec50为8.573ng/ml。
[0080]
3、抗体与抑制ctla4与配体结合的活性测定
[0081]
包被人ctla4
‑
fc重组蛋白于酶标板上,4℃过夜,pbst洗两次。1%bsa封闭,37℃反应1小时后,pbst洗两次。加入梯度稀释抗体,再加入等体积cd86
‑
fc
‑
his或cd80
‑
fc
‑
his蛋白,孵育1小时,pbst洗两次。加入1:10000稀释的anti
‑
his
‑
hrp,37℃,孵育1小时,pbst洗三次。加入tmb显色后,加入1m硫酸终止,酶标仪于450nm读数。
[0082]
如图3所示,结合实验表明,hca14
‑
f4即能抑制ctla4与cd86的结合,又能抑制ctla4与cd80的结合,抑制的ic50分别为0.8465nm和6.17nm。
[0083]
4、抗体的亲和力活性测定
[0084]
采用octet测定抗体与ctla4的亲合常数kd。首先,用protein a生物传感器固定待测抗体,将含有不同抗体的生物传感器,放入同样浓度的ctla4
‑
his(义翘神州)稀释液中,进行结合,持续4分钟;然后将生物传感器放入pbs,持续400秒。octet分析软件,分析抗体的亲合常数kd,kd为kd/ka。结果如图4、表2所示,双价抗体hca14
‑
f4的结合速度快于对照抗体
ipilimumab(igg4),解离速度慢于对照抗体ipilimumab(igg4)。经过分析后,hca14
‑
f4曲线拟合的亲合常数kd显示小于1.0e
‑
12m,亲和力优于ipilimumab(igg4),其亲合常数kd显示为3.51e
‑
09m。另外,单价抗体hca14
‑
kh也显示出快速结合和缓慢解离的特征。
[0085]
表2 抗体亲和力测定结果
[0086][0087]
实施例5:抗体功能活性检测
[0088]
1、混合淋巴细胞实验(mlr)活性测定
[0089]
采用混合淋巴细胞法(mlr)检测抗体对t淋巴细胞的刺激作用。分离pbmc,先用pbs缓冲液1:1稀释血液,移取3ml的淋巴细胞分离液至离心管内,加入稀释过的血液4ml,注意加入的时候,确保使稀释后的血液至于淋巴细胞分离液的上层,不可混匀。然后,400g,rt离心30
‑
40min。最后吸出分离的pbmc,300g离心10min。采用cd4+细胞分离试剂盒(bd公司)分离cd4+t细胞,dc细胞分离磁珠(bd公司)分离dc细胞。细胞铺板,每孔cd4+t细胞数量1
×
105个,dc数量1
×
104个,体积共计100μl。加入不同浓度抗体,培养5天后采用human il
‑
2htrf kit(cisbio,cat#64il2peb)检测il
‑
2的浓度。结果显示(图5),hca14
‑
f4具有刺激il2分泌的活性,活性与对照抗体相当。
[0090]
2、seb活性实验
[0091]
采用葡萄球菌肠毒素b(seb)刺激法检测抗体活性。首先,分离人pbmc,将pbmc与葡萄球菌肠毒素b(seb)混合,加入不同浓度待测抗体或对照抗体,培养3
‑
5天后,使用采用human il
‑
2htrf kit(cisbio,cat#64il2peb)检测il
‑
2。结果显示(图6),hca14刺激il2分泌,活性优于对照抗体ipilimumab。而阴性对照没有刺激活性。
[0092]
实施例6:使用ctla4抗体治疗体内肿瘤模型
[0093]
采用hpd1/hctla4转基因c57bl/6j小鼠为小鼠模型,检查ctla4抗体对肿瘤生长的体内效果。收集对数生长期的mc38细胞,去除培养液并用pbs洗两次后接种到小鼠,接种量为5
×
105/100μl/只(不添加基质胶)。待平均肿瘤体积达到100mm3左右,将肿瘤体积达到分组标准的小鼠随机分为2组,分别为vehicle control和待测药物(hca14
‑
f4 in pbs),然后开始给药,给药周期为q3d
×
8,给药方式为ip,给药剂量为1.2mg/kg。给药当日测量小鼠体重和肿瘤体积,每3天给药一次,给药8次。当肿瘤达到肿瘤终点(1500mm3)或显示体重下降超过15%时,实验终止,对全部小鼠执行安乐死。结果显示(图7),在转基因小鼠肿瘤模型中,hca14
‑
f4显著抑制mc38移植瘤生长,显示出显著的抑制肿瘤活性。
[0094]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
[0095]
本发明的抗体可用基因工程技术制得,因为编码本发明人源化抗体的dna序列可用本领域技术人员熟知的常规手段,如根据本发明公开的氨基酸序列人工合成或用pcr法扩增得到,因而也可用重组dna方法,可用本领域熟知的各种方法将该序列连入合适的表达载体中。
[0096]
一旦制得本发明的抗体分子,就可以通过本领域已知的纯化免疫球蛋白分子的任何方法对其进行纯化,例如,通过色谱法(例如,离子交换色谱,亲和色谱,特别是通过蛋白a的亲和色谱和其它色柱谱)、离心、利用溶解度差异,或通过任何其它纯化蛋白质的标准技术。在许多实施方案中,抗体从细胞分泌到培养基中,通过收集培养基并进行纯化得到抗体。
[0097]
本发明所述至少90%的整体序列同一性是指序列同一性为91%,92%,93%,94%,95%,96%,97%,98%,99%或100%,本发明中单结构域抗体氨基酸序列seq id no:4或seq id no:9具有至少90%的整体序列同一性,指的是抗体重链可变区或vhh单结构域抗体可变区的氨基酸序列的总和与氨基酸序列seq id no:4或seq id no:9的序列总和具有至少90%的整体序列同一性。
[0098]
本发明所述ctla4单结构域抗体,以及ctla4单结构域抗体还可以用于与ctla4相关的科学研究,如发育生物学、细胞生物学、代谢、结构生物学、功能基因组学等多个领域的科学研究、或肿瘤、自身免疫性疾病等医学和药学的应用研究。
[0099]
本发明所述ctla4抗体可以为单链抗体、双链抗体、嵌合抗体、人源化抗体、以及前述抗体的衍生物、功能等同物和同源物,也包括抗体片段和含有抗原结合结构域的任何多肽。
[0100]
本发明所述药物组合物中还含有药学上可接受的载体和/或稀释剂。
[0101]
本发明还可以是一种试剂或芯片,包含前述的ctla4抗体。
[0102]
本发明还公开了采用ctla4单结构域抗体用来结合靶细胞的抗原位点和刺激pbmc和t细胞的活性,抗肿瘤活性的方法,以及该抗体用于治疗相关疾病或使用含有该抗体的试剂盒进行相关诊断与检测。
[0103]
本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。参考标准手册,如sambrook等人,molecular cloning:a laboratory manual”(第2版),第1
‑
3卷,cold spring harbor laboratory press(1989);lewin,genes iv,oxford university press,new york,(1990);roitt等,immunology(第2版),gower medical publishing,london,new york(1989)。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作均为相关领域内广泛使用的术语和常规步骤。同时,为更好理解本发明,下面提供相关术语的定义和解释。
[0104]
抗体
[0105]
术语“抗体”广泛地指任何免疫球蛋白分子或其抗原结合部分,除非另有说明,否则可互换使用的术语“抗体”或“免疫球蛋白”,在本文中无论是指重链抗体还是指常规4链抗体,均用作一般术语以包括全长抗体、其单个的链以及其所有部分、结构域或片段(包括但不限于抗原结合结构域或片段,分别例如vhh结构域或vh/vl结构域)。
[0106]
可变区
[0107]
如本文所用的术语“可变区”是指基本上由本领域及下文中分别称为框架区1或fr1、框架区2或fr2、框架区3或fr3、及框架区4或fr4的四个框架区组成的抗体可变区,其中所述框架区由本领域及下文中分划称为互补决定区1或cdr1,互补决定区2或cdr2、及互补决定区3或cdr3的三个互补决定区或cdr间隔开。因此,抗体可变区的一段构或序列可如下表示为:fr1—cdr1—fr2
‑
cdr2—fr3—cdr3—fr4。抗体可变区因具有抗原结合位点而赋予
抗体对抗原的特异性。所述框架区采用β
‑
折叠构象,并且所述cdr可以形成连接所述β
‑
折叠结构的环。在每条链中的cdr通过框架区保持在它们的三维结构中,并且与另一条链的cdr一起形成抗原结合位点。
[0108]
结构域
[0109]
如本文所用,术语(多肽或蛋白的)“结构域”是指折叠蛋白结构,其能够独立于蛋白的其余部分维持其三级结构。一般而言,结构域负责蛋白的单个的功能性质,且在许多情况下可添加、移除或转移至其他蛋白而不损失蛋白的其余部分和/或结构域的功能。
[0110]
单结构域抗体
[0111]
本文所用的术语”单结构域抗体”是指能够在不与其他免疫球蛋白可变区配对的情况下特异性结合抗原表位的免疫球蛋白可变区。
[0112]
vhh
[0113]“vhh”,亦称为重链结构抗体、vhh结构域、vh抗体片段和vhh抗体,是称为”重链抗体”(即”缺乏轻链的抗体”)的抗原结合免疫球蛋白的可变结构域(hamers
‑
casterman c,atarhouch t,muyldemans s,robinson g,hankrs c,songa eb,bendahman n,hamer r.:naturally occurring antihodies devoid of light chains”;nature363,446—448(1993))。使用术语“vhh”以将所述可变区与存在于常规4链抗体中的重链可变区以及存在于常规4链抗体中的轻链可变区进行区分。vhh结构域特异性结合表位而无需其他抗原结合结构域(此与常规链抗体中的vh或vl结构域不同,在该情况下表位由vh结构域与vl结构域一起识别).vhh结构域为由单一免疫球蛋白结构域形成的小型稳定及高效的抗原识别单元。
[0114]
在本发明的上下文中,术语“重链单域抗体”、“vhh结构域”、“vhh”、“vhh抗体”、“vhh”抗体片段”可互换使用。
[0115]
对于骆驼科的vhh结构域所应用的氨基酸残基,根据kabat等人给出的vh结构域的一般编号法来编号(sequence of proteins of immunological interest,us public health services,nih bethesda,md,公开案第91号).根据该编号法,
[0116]
—fr1包含在位置1—30处的氨基酸残基,
[0117]
—cdr1包含在位置31—35处的氨基酸残基,
[0118]
—fr2包含在位置36—49处的氨基酸,
[0119]
—cdr2包含在位置50—65处的氨基酸残基,
[0120]
—fr3包含在位置66—94处的氨基酸残基,
[0121]
—cdr3包含在位置95—102处的氨基酸残基,且
[0122]
—fr4包含在位置103—113处的氨基酸残基。
[0123]
然而应注意,如本领域中对于vh结构域及vhh结构域所公知的,各cdr中的氨基酸残基的总数可能不同,且可能不对应于由kabat编号指示的氨基酸残基的总数(即根据kabat编号的一个或多个位置可能在实际序列中未被占据,或实际序列可能含有多于kabat编号所允许数目的氨基酸残基)。这意味着一般而言,根据kabat的编号可能对应或可能不对应于实际序列中氨基酸残基的实际编号。
[0124]
本领域中已知对vh结构域的氨基酸残基进行编号的替代方法,所述替代方法还可以类似地应用于vhh结构域。然而,除非另有说明,否则在本说明书、权利要求书及附图中,
将遵循如上所述的根据kabat且适于vhh结构域的编号。
[0125]
vhh结构域中的氨基酸残基的总数将通常在110至120范围内,常常介于112与115之间。然而应注意较小及较长序列也可适于本文所述的目的。
[0126]
vhh结构域及含有其的多肽的其他结构特性及功能性质可总结如下:vhh结构域(其已经天然”设计”以在不存在轻链可变结构域且不与轻链可变结构域相互作用的情况下与抗原功能性结合)可用作单一且相对较小的功能性抗原结合结构单元、结构域或多肽。此区分vhh结构域与常规4链抗体的vh及vl结构域,这些vh及vl结构域自身通常不适于作为单一抗原结合蛋白或免疫球蛋白单一可变结构域进行实际应用,但需要以某种形式或另一形式组合以提供功能性抗原结合单元(如以诸如fab片段等常规抗体片段的形式;或以由与vl结构域共价连接的vh结构域组成的scfv的形式)。vhh结构域仅需要单一结构域以高亲和力及高选择性结合抗原,从而使得既不需要存在两个单独结构域,也不需要确保该两个结构域以适当空间构象及构型存在(例如scfv一般需要使用经特别设计的接头)。
[0127]
vhh结构域可通过cdr移植的方式实现人源化,即将vhh结构域的cdr序列被移植到人常规4链抗体vh结构域的fr构架序列上。人源化vhh结构域可含有一个或多个完全人框架区序列,且在一具体实施方案中,可含ighv3的人框架区序列。同时在人构架序列内也可以进行其它的修饰。
[0128]
knobs into holes
[0129]
本文所用的术语“knobs into holes”,是指利用基因工程技术,使抗体的其中一条重链ch3上做一个钮(knob)的突变,在另一条重链ch3上做一个扣(hole)突变,便于两条重链咬合,形成异二聚体。
[0130]
序列
[0131]
本文所用的术语“序列”一般应解为既包括相关氨基酸序列,又包括编码所述序列的核酸序列或核苷酸序列,除非本文需要更限定的解释。
[0132]
特异性
[0133]
一般而言,术语“特异性”是指特定抗原结合分子或抗原结合蛋白(例如本发明的免疫球蛋白单一可变结构域)可结合的不同类型抗原或表位的数目。可基于抗原结合蛋白的亲和力和/或亲合力确定其特异性。由抗原与抗原结合蛋白的解离平衡常数(kd)所表示的亲和力,是表位与抗原结合蛋白上抗原结合位点之间结合强度的量度:kd值越小,表位与抗原结合蛋白之间的结合强度越强(或者,亲和力也可表示为缔合常数(ka),其为1/kd)。如本领域技术人员将了解,取决于具体感兴趣的抗原,可以以已知方式测定亲和力。亲合力为抗原结合蛋白(例如免疫球蛋白、抗体、单结构域抗体或含有其的多肽)与相关抗原之间结合强度的量度。亲合力与以下两者有关:与其抗原结合蛋白上的抗原结合位点之间的亲和力,以及存在于抗原结合蛋白上的相关结合位点的数目。
[0134]
表位
[0135]
术语“表位”指能够特异结合抗体的蛋白质决定簇。表位通常由分子的化学活性表面组如氨基酸或者糖侧链组成并且表位通常具有特定的三维结构特征,以及特定电荷特征。构象和非构象表位的区别在于在变性溶剂的存在下对前者的结合丧失,但是对后者的结合不丧失。
[0136]
术语“表位”是指能特异性结合抗体或者t细胞受体或者以另外方式与分子相互作
用的抗原部分。“表位”在本领域中也称为“抗原决定簇”。表位通常由分子如氨基酸或碳水化合物或糖侧链的化学活性表面集合组成。表位可以是“线性的”或“非线性的/构象的”。一旦确定希望的表位(例如通过表位定位确定),可以产生针对该表位的抗体。抗体的产生和表征也可以提供有关希望的表位的信息。根据该信息,继而可以例如通过进行交叉竞争研究筛选结合相同表位的抗体,以发现互相竞争结合的抗体,即竞争结合抗原的抗体。
[0137]
药物组合物
[0138]
本发明提供的药物组合物,其含有与药学上可接受的载体配制在一起的一种或组合的本发明的ctla4抗体。这样的组合物可以包含一种或组合的(例如两种或多神不同的)本发明的ctla4抗体,例如,本发明的药物组合物可以含有结合靶抗原上的不同表位的抗体分子组合。
[0139]
本发明的药物组合物也可以在联合治疗中施用,即与其他药剂联用。例如,联合治疗可包括本发明的ctla4抗体联合至少一种其他的抗肿瘤药物。例如,本发明的ctla4抗体可以与靶向其它肿瘤特异性抗原的抗体联合使用。所述靶向其它肿瘤特异性抗原的抗体包括但不限于,抗claudin18.2抗体、抗egfr抗体、抗vegf抗体、抗her2抗体、或抗c
‑
met抗体。优选所述抗体是单克隆抗体。本发明的ctla4抗体还可以与其它肿瘤免疫治疗手段、或肿瘤靶向性小分子类药物联用。所述其他肿瘤免疫治疗手段包括但不限于针对肿瘤免疫调节分子,如和lag3、pdl1/pd1、cd137等的治疗型抗体,或car
‑
t治疗手段等。
[0140]
本发明的药物组合物也可以与其他肿瘤治疗手段,如放疗、化疗,手术治疗等联合使用,或是在放疗、化疗、或手术治疗之前或之后使用。
[0141]
疾病预防和治疗
[0142]
在另一方面,本发明提供了本发明所述ctla4抗体及药物组合物在预防和/或治疗与ctla4相关的疾病中用途和方法。可用本发明的ctla4抗体预防和/或治疗的ctla4相关的疾病如下阐述。
[0143]
癌症
[0144]
本发明的ctla4抗体对ctla4的阻断可以增强患者中对肿瘤细胞的免疫应答。本发明的ctla4抗体可以单独使用,以抑制癌性肿瘤的生长。或者如以下所述,本发明的ctla4抗体可以与其它抗肿瘤治疗手段联合使用,例如与其他免疫原性剂、标准癌症疗法或其他抗体分子联合使用。
[0145]
使用本发明的ctla4抗体可以预防和/或治疗的优选的癌症包括一般对免疫治疗有应答的癌症。可治疗的优选癌症的非限制性的例子包括直肠癌、黑色素瘤(例如转移的恶性黑色瘤)、肺癌、卵巢、结肠癌、肾癌、膀胱癌、乳腺癌、肝癌、淋巴瘤、胃癌、鼻咽癌、喉癌、恶性血液病、头颈癌、胶质瘤、宫颈癌、子宫体瘤和骨肉瘤。可以用本发明的方法治疗的其他癌症的例子包括:子宫癌、肛区癌、骨癌、胰腺癌、皮肤癌、前列腺癌、皮肤或眼内恶性黑色瘤、睾丸癌、输卵管癌、子宫内膜癌、阴道癌、非何杰金氏淋巴瘤、食道癌、阴户癌、何杰金病、小影癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、慢性或急性白血病(包括急性细胞样白血病、慢性髓细胞样白血病、急性成淋巴细胞性白血病、慢性淋巴细胞性白血病)、淋巴细胞性淋巴瘤、膀胱癌、肾或输尿管癌、肾癌、中枢神经系统(cns)肿瘤、原发性cns淋巴瘤、脊柱肿瘤、脑干神经胶质瘤、垂体腺瘤、卡波西肉瘤、表皮状癌、鳞状细胞癌,t细胞淋巴瘤,以及所述癌症的组合。
[0146]
本发明的ctla4抗体也可以与免疫原性剂如癌细胞、纯化的肿瘤抗原(包括重组蛋白、肽和碳水化合物分子、用编码免疫刺激细胞因子的基因转染的细胞)联用,可以应用的免疫原性剂包括但不限于黑色素瘤抗原的肽,如trp
‑
2、gpl00的肽、mage抗原、mart1和/或酪氨酸酶,或转染后表达细胞因子gm
‑
csf的肿瘤细胞等。
[0147]
本发明的ctla4抗体也可以与肿瘤抗原、肿瘤疫苗、重组产生的肿瘤特异性蛋白和/或肽组合使用,以产生针对这些蛋白质的免疫应答。这些蛋白质在正常情况下被免疫系统看作自身抗原,因此对其耐受。肿瘤抗原也可以是癌细胞表达的新抗原,例如由于体胞突变改变蛋白质序列或产生两种无关序列的融合蛋白(例如,philadelphia染色体中的bcr
‑
abl)。其他肿瘤疫苗可以包括来自与人类癌症有关的病毒的蛋白质,如人类乳头瘤病毒(hpv)、肝炎病毒(hbv和hcv)和卡波西疱疹肉瘤病毒(khsv)。ctla4抗体也可以与肿瘤组织本身中分离的纯化的热休克蛋白(hsp)组合使用。这些热休克蛋白含有来自于肿瘤细胞的蛋白质的片段,在向抗原呈递细胞递送引发肿瘤免疫方面非常有效。
[0148]
本发明的ctla4抗体也可以与car
‑
t细胞疗法联合,激活更强的抗肿瘤应答。car
‑
t,全称是嵌合抗原受体t细胞免疫疗法(chimeric antigen receptor t
‑
cell immunotherapy)是一种有效的恶性肿瘤的细胞治疗方法。
[0149]
本发明的ctla4抗体也可以与标准癌症治疗组合。本发明的ctla4抗体可以与化疗方案有效地组合。本发明的ctla 4抗体和化学疗法联用的科学原理是细胞死亡,这是大多数化疗化合物的细胞毒性作用的结果,应会导致抗原呈递途径中的肿瘤抗原水平升高。血管发生抑制剂也可以与本发明的ctla 4抗体组合,血管发生的抑制导致肿瘤细胞死亡,这可以将肿瘤抗原提供给宿主的抗原呈递途径。
[0150]
本发明的ctla4抗体还可以与其他形式的免疫疗法如细胞因子治疗(例如干扰素、il
‑
2、il
‑
12、gm
‑
csf、g
‑
csf)或双特异性抗体治疗联合,增强肿瘤抗原的呈递。
[0151]
本发明的ctla4抗体还可以与靶向其它肿瘤特异性抗原的抗体联合使用。所述靶向其它肿瘤特异性抗原的抗体包括但不限于,抗pdl1抗体、抗egfr抗体、抗claudin18.2抗体、抗her2抗体、抗vegf抗体、或抗c
‑
met抗体。优选所述抗体是单克隆抗体。
[0152]
感染性疾病
[0153]
本发明的其他方法用于治疗暴露于特定毒素或病原体的患者。因此,本发明的另一方面提供一种预防和/或治疗对象中的感染性疾病的方法,包括给该对象施用本发明的ctla4抗体,使得所述对象的感染性疾病得到预防和/或治疗。
[0154]
类似于上所述的肿瘤的应用,ctla4抗体可以单独使用,或作为佐剂与疫苗组合使用来刺激对病原体、毒素和自身抗原的免疫应答,特别可以应用该治疗方法的病原体的实例包括当前没有有效疫苗的病原体,或常规疫苗不完全有效的病原体。其中包括但不限于covid
‑
19、肝炎病毒(甲、乙、丙)、hiv、流感病毒、疱疹病毒、贾第虫、疟疾、金黄色葡萄球菌、绿脓杆菌、利什曼原虫。ctla4抗体特别可用于对抗诸如hiv等病原体已建立的感染,其在感染过程中呈现改变的抗原。在抗人ctla4抗体给药时,这些新的表位被作为外源物识别,从而引起不受ctla4的负信号影响的强t细胞应答。
[0155]
引起可用本发明的方法治疗的感染性疾病的病原体病毒的一些实例包括covid
‑
19、腺病毒、流感病毒、虫媒病毒、埃可新毒、鼻毒、柯奇病毒、冠状病毒、hiv、肝炎(甲、乙、两)、疱疹病毒、呼吸道合胞病毒、流行性腮腺炎病毒、轮状病毒、乳头瘤病毒、麻疹病毒、风
瘆病毒、细小病毒、脊灰质炎病毒、狂犬病毒、痘苗病毒、htlv病毒、登革热病毒、jc病毒、软疣病毒和虫媒病毒脑炎病毒。
[0156]
引起可用本发明的方法治疗的感染性疾病的病原体细菌的一些实例包括葡萄球菌、衣原体、变形菌、雷氏菌、立克次氏体菌、分枝杆菌、链球菌、肺炎球菌、脑膜炎球菌和淋球菌、克雷伯氏杆菌、破伤风菌、肉毒杆菌、假单胞菌、军团杆菌、白喉杆菌、沙门氏菌、芽孢杆菌、霍乱菌、炭疽杆菌、鼠疫杆菌、钩端蝶旋体和菜姆病细菌。
[0157]
引起可用本发明的方法治疗的感染性疾病的病原体寄生虫的一些实例包括结肠小袋纤毛虫、溶组织内阿米巴、间日疟原虫、福氏耐格里阿米巴、棘阿米巴属的种、克氏锥虫、杜氏利什曼原虫、鼠弓形体、隐孢子虫属的种、卡氏肺囊虫、果氏巴贝虫、布氏锥虫、兰伯贾第虫和巴西日圆线虫。
[0158]
引起可用本发明的方法治疗的感染性疾病的病原体真菌的一些实例包括假丝酵母(白假丝酵母、克鲁斯假丝酵母、光滑假丝酵母、热带假丝酵母等)、皮炎芽生菌、毛霉属(毛霉、犁头霉、根霉)、新型隐球菌、巴西副球孢子菌、曲霉属(烟曲霉、黑曲霉等)、申克孢子丝菌、夹膜组织胞浆菌和粗球孢子菌。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1