一组用于检测小麦赤霉病主效抗病基因基因型的引物组合、试剂或试剂盒及应用和方法
genetics,2018,131(11):2371
‑
2380)。因此,建立一种新的基于pcr技术的基因分型法来快捷、准确、低成本地检测小麦主效抗赤霉病基因fhb1的基因型已成为育种应用中重要问题。
技术实现要素:
5.为了解决上述问题,本发明提供了一组用于检测小麦赤霉病主效抗病基因基因型的引物组合、试剂或试剂盒及应用和方法。本发明所述引物组合能够快捷、准确、低成本地检测小麦主效抗赤霉病基因fhb1的基因型。
6.为了实现上述目的,本发明提供如下技术方案:
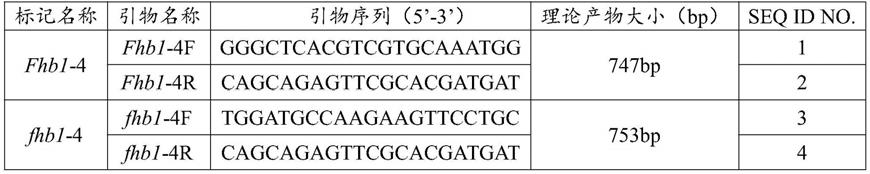
7.本发明提供了一组用于检测小麦赤霉病主效抗病基因基因型的引物组合,所述引物组合包括fhb1
‑
4引物对和fhb1
‑
4引物对;
8.所述fhb1
‑
4引物对包括fhb1
‑
4f和fhb1
‑
4r;所述fhb1
‑
4f的核苷酸序列如seq id no.1所示;所述fhb1
‑
4r的核苷酸序列如seq id no.2所示;
9.所述fhb1
‑
4引物对包括fhb1
‑
4f和fhb1
‑
4r;所述fhb1
‑
4f的核苷酸序列如seq id no.3所示;所述fhb1
‑
4r的核苷酸序列如seq id no.4所示。
10.本发明提供了上述引物组合在制备检测或辅助检测小麦赤霉病主效基因基因型的工具中的应用。
11.本发明提供给了一种用于检测小麦赤霉病主效基因基因型的试剂或试剂盒,所述试剂或试剂盒包括上述引物组合。
12.本发明提供了上述引物组合或上述的试剂或试剂盒在小麦抗赤霉病育种中的应用。
13.本发明提供了上述引物组合或上述试剂或试剂盒在检测或辅助检测小麦赤霉病主效基因基因型中的应用。
14.本发明提供给了一种用于检测或辅助检测小麦赤霉病主效基因基因型的方法,包括以下步骤:
15.以待测样品的dna为模板dna,与上述引物组合或上述试剂或试剂盒中的引物对中的fhb1
‑
4引物组混合进行pcr扩增;
16.以待测样品的dna为模板dna,与上述引物组合或上所述试剂或试剂盒中的引物对中的fhb1
‑
4引物组混合进行pcr扩增;
17.若引物对fhb1
‑
4能扩增出747bp条带且fhb1
‑
4不能扩增出753bp条带,则该样品为含有赤霉病主效抗病等位基因fhb1
‑
r的纯合样品;
18.若引物对fhb1
‑
4能扩增出747bp条带且引物对fhb1
‑
4能扩增出753bp条带,则该样品为含赤霉病主效抗病等位基因fhb1
‑
r的杂和样品;
19.若引物对fhb1
‑
4不能扩增出747bp条带且引物对fhb1
‑
4能扩增出753bp条带,则样品为不含赤霉病主效抗病等位基因fhb1
‑
r的纯合样品。
20.优选的,所述pcr扩增的反应程序包括:95℃预变性5min;95℃变性30s、60℃复性30s、72℃延伸1min,30次循环;然后72℃延伸10min,10℃冷却10min。
21.优选的,当采用fhb1
‑
4引物对进行pcr扩增时,所述pcr扩增的反应体系以20μl计,包括模板dna2.0μl、含25mmol/lmgcl2的10
×
pcr buffer 2.0μl、dntp 0.4μl、fhb1
‑
4f 0.4μl、fhb1
‑
4r 0.4μl、taq 0.4μl和ddh2o 14.4μl;
22.当采用fhb1
‑
4引物对进行pcr扩增时,所述pcr扩增的反应体系以20μl计,包括模板dna 2.0μl、含25mmol/lmgcl2的10
×
pcr buffer 2.0μl、dntp0.4μl、fhb1
‑
4f 0.4μl、fhb1
‑
4r 0.4μl、taq 0.4μl和余量的ddh2o。
23.优选的,所述fhb1
‑
4f、fhb1
‑
4r、fhb1
‑
4f和fhb1
‑
4r的工作浓度均为10μm;所述模板dna的工作浓度为100ng/μl;所述dntp的工作浓度为2.5mmol/l;所述taq的工作浓度为5u/μl。
24.优选的,所述待测样品优选包括小麦叶片。
25.有益效果:
26.本发明提供了本发明提供了一组用于检测小麦赤霉病主效抗病基因基因型的引物组合,所述引物组合具有快捷、准确、低成本地检测小麦主效抗赤霉病基因fhb1的基因型的优势,利用本发明提供的引物组合在种子发芽后即可进行植株的基因型检测,无需通过田间大群体鉴定筛选,从而提高选择筛选效率,降低育种成本。本发明提供的引物组合是根据小麦抗赤霉病基因fhb1抗感等位基因序列差异进行开发的,因此,利用该引物组合可以实现对赤霉病主效抗病基因fhb1不同基因型的准确鉴定。在抗赤霉病育种中,利用本发明提供的引物组合不存在由于标记和基因间的遗传交换而造成基因型鉴定的错误;而且本发明所述引物组合是根据基因内部序列开发而成,故在引物组合辅助选择育种的过程中不会造成目标基因丢失。同时,对杂交世代进行基因跟踪鉴定,能加快早代稳定,从而缩短育种年限,提高选育含fhb1基因的抗赤霉病小麦品种的选择效率。
27.此外,引物对fhb1
‑
4和引物对fhb1
‑
4扩增产物大小均在800bp以下,在目标基因检测过程中花费的时间相对较少且对引物、酶类、技术等没有特殊要求,具有操作简单、准确性高、成本低廉的优势,适合应用于对大量小麦资源和育种群体材料的检测和筛选。
附图说明
28.图1为检测fhb1抗感等位基因引物组合的检测与验证,其中m为dl2000dna marker(分子量100~2000bp),泳道1和泳道2是以泗1516为模板,用引物对fhb1
‑
4进行检测的结果;泳道3是以苏麦3号为模板,用标记fhb1
‑
4进行检测的结果,泳道4和泳道5是以苏麦3号为模板,用引物对fhb1
‑
4进行检测的结果,泳道6是以泗1516为模板,用引物对fhb1
‑
4进行检测的结果;
29.图2为fhb1
‑
4引物对、fhb1
‑
4引物对对不同小麦品种(系)的fhb1等位基因检测,其中m表示dl2000 dna marker(分子量100~2000bp),1为苏麦3号,2为宁麦9号,3为泗1516;4为宁麦13;5为矮抗58,6为迁麦2号,7为百农207,8为宁麦14,9为周麦18,10为宁麦资119,11为淮麦20,12为花培8号,13为济麦22,14为扬麦30,15为淮麦33,16为信麦69,17为淮麦18,18为烟农836,19为扬麦18,20为豫麦69,21为烟农1212,22为徐麦dh9,23为新麦26,24为红阳麦1号;
30.图3为fhb1
‑
4引物对检测泗1516/苏麦3号的bc1f2群体单株,其中m为dl2000 dna marker,1为苏麦3号,2为泗1516,3~312为泗1516和苏麦3号杂交后得到的310个bc1f2群体单株;
31.图4为fhb1
‑
4引物对检测泗1516/苏麦3号的bc1f2群体单株,其中m为dl2000 dna marker,1为苏麦3号,2为泗1516,3~312为泗1516和苏麦3号杂交后得到的310个bc1f2群体
单株。
具体实施方式
32.如无特殊限定,本发明采用的所述的试剂和材料均为本领域技术人员常规购买所得即可。
33.本发明提供了一组用于检测小麦赤霉病主效抗病基因基因型的引物组合,所述引物组合包括fhb1
‑
4引物对和fhb1
‑
4引物对;所述fhb1
‑
4引物对包括fhb1
‑
4f和fhb1
‑
4r;所述fhb1
‑
4f的核苷酸序列如seq id no.1所示:gggctcacgtcgtgcaaatgg;所述fhb1
‑
4r的核苷酸序列如seq id no.2所示:cagcagagttcgcacgatgat;所述fhb1
‑
4引物对包括fhb1
‑
4f和fhb1
‑
4r;所述fhb1
‑
4f的核苷酸序列如seq id no.3所示:tggatgccaagaagttcctgc;所述fhb1
‑
4r的核苷酸序列如seq id no.4所示:cagcagagttcgcacgatgat。
34.利用本发明提供的引物组合在种子发芽后即可进行植株的基因型检测,无需通过田间大群体鉴定筛选,从而提高选择筛选效率,降低育种成本。同时该引物组合是根据小麦抗赤霉病基因fhb1抗感等位基因序列差异进行开发的,而且fhb1是最早发现于我国小麦品种苏麦3号中的一个持久、稳定抗病基因,该基因对大多数赤霉病小种均具有较好抗性,是目前公认的赤霉病抗性效应最大的位点,有很好的育种应用前景。可见,利用该引物组合可以实现对赤霉病主效抗病基因fhb1不同基因型的准确鉴定。在抗赤霉病育种中,利用本发明提供的引物组合不存在由于标记和基因间的遗传交换而造成基因型鉴定的错误;而且本发明所述引物组合是根据基因内部序列开发而成,故在引物对辅助选择育种的过程中不会造成目标基因丢失。同时,对杂交世代进行基因跟踪鉴定,能加快早代稳定,从而缩短育种年限,提高选育含fhb1基因的抗赤霉病小麦品种的选择效率。引物对fhb1
‑
4和fhb1
‑
4扩增产物大小均在800bp以下,在目标基因检测过程中花费的时间相对较少且对引物、酶类、技术等没有特殊要求,具有操作简单、准确性高、成本低廉的优势,适合应用于对大量小麦资源和育种群体材料的检测和筛选。因此,本发明所述引物组合能够用于检测或辅助检测小麦赤霉病主效基因基因型和检测小麦抗赤霉病育种。
35.本发明提供了上述引物组合在制备检测或辅助检测小麦赤霉病主效基因基因型的工具中的应用。
36.本发明提供了一种用于检测小麦赤霉病主效基因基因型的试剂或试剂盒,所述试剂或试剂盒包括上述引物组合。该试剂或试剂盒能够快捷、准确、低成本地检测小麦主效抗赤霉病基因fhb1的基因型。
37.本发明提供了上述引物组合或上述的试剂或试剂盒在小麦抗赤霉病育种中的应用。
38.本发明提供了上述引物组合或上述的试剂或试剂盒在检测或辅助检测小麦赤霉病主效基因基因型中的应用。
39.本发明提供了一种用于检测或辅助检测小麦赤霉病主效基因基因型的方法,包括以下步骤:
40.以待测样品的dna为模板dna,上述引物组合或上述试剂或试剂盒中的引物对中的fhb1
‑
4引物组混合后进行pcr扩增;以待测样品的dna为模板dna,与上述引物组合或上述试剂或试剂盒中的引物对中的fhb1
‑
4引物组混合后进行pcr扩增;
41.若引物对fhb1
‑
4能扩增出747bp条带且fhb1
‑
4不能扩增出753bp条带,则该样品为含有赤霉病主效抗病等位基因fhb1
‑
r的纯合样品;若引物对fhb1
‑
4能扩增出747bp条带且引物对fhb1
‑
4能扩增出753bp条带,则为含赤霉病主效抗病等位基因fhb1
‑
r的杂和样品,即该样品在fhb1位点为杂合体;若引物对fhb1
‑
4不能扩增出747bp条带且引物对fhb1
‑
4能扩增出753bp条带,则样品为不含赤霉病主效抗病等位基因fhb1
‑
r的纯合样品。
42.本发明以待测样品的dna为模板dna,上述引物组合或上述试剂或试剂盒中的引物对中的fhb1
‑
4引物组混合后进行pcr扩增;以待测样品的dna为模板dna,与上述引物对或上述试剂或试剂盒中的引物组合中的fhb1
‑
4引物组混合后进行pcr扩增。
43.在本发明中,所述待测样品优选包括小麦叶片。
44.在本发明中,所述待测样品的dna的提取方法优选为ctab法,具体参考《rapid isolation ofhigh weightplant dna》(murray m g,thompsonw f.rapid isolation of high weight plant dna[j].nucleic acids research,1980,8(19):4321
‑
4325);所述ctab法的步骤优选为:对叶片样品进行真空冷冻、研磨,得到研磨样品;将研磨样品与基因组提取液混合后,进行温育,得温育样品;将温育样品与含氯仿、异丙醇混合液混合后依次进行静止和第一离心;将第一离心后所得上清液与异丙醇混合,进行沉降和第二离心;将第二离心所得沉淀物用乙醇水溶液清洗后风干;将风干所得沉淀物与te缓冲液混合后,得待测样品的dna。
[0045]
本发明优选对叶片样品进行真空冷冻、研磨,得到研磨样品。本发明对所述叶片没有特殊要求,采用任何生育期的叶片即可,即发芽后长出叶片后任意时期即可。在本发明中,所述真空干燥优选在冷冻干燥机中进行;所述真空冷冻的时间优选为6h;所述真空干燥的温度优选为
‑
40℃;所述研磨优选在研磨仪中进行;所述研磨的频率优选为40.00hz;所述研磨的时间优选为240s;所述研磨所得样品的粒径优选为≤5μm。
[0046]
所述真空冷冻前,本发明优选还包括在叶片中添加钢球。在本发明中,所述钢球的数量优选为1个;所述钢球的直径优选为5mm。
[0047]
本发明优选将研磨样品与基因组提取液混合后,进行温育,得温育样品。在本发明中,所述基因提取液优选为含ctab的提取液;所述基因提取液中ctab的质量百分含量优选为2%;所述基因提取液的温度优选为65℃;所述研磨样品与基因提取液的质量体积比优选为20mg:600μl。本发明对混合的方式没有任何限定,采用本领域技术人员所熟知的方式即可;在本发明具体实施例中,所述混合的方式优选为震荡摇匀。在本发明中,所述温育优选在恒温水浴锅中进行;所述温育的温度优选为恒温65℃;所述温育的时间为30min;本发明在温育过程中,优选每隔10min取出样品进行摇匀。
[0048]
本发明优选将温育样品与含氯仿、异丙醇混合液混合后依次进行静置和第一离心。在本发明中,所述含氯仿、异丙醇混合液中氯仿和异丙醇的体积比优选为24:1;所述含氯仿、异丙醇混合液的用量优选为600μl。在本发明中,所述静止的时间优选为10min;所述第一离心的转速优选为12000rpm;所述第一离心的时间优选为15min。
[0049]
本发明优选将第一离心后所得上清液与异丙醇混合,进行沉降和第二离心。在本发明中;所述上清液与异丙醇的体积比优选为1:1;所述异丙醇的温度优选为
‑
20℃;所述沉降的时间优选为30min;所述沉降的温度优选为
‑
20℃;所述第二离心的转速优选为12000rpm;所述第二离心的时间优选为10min。
[0050]
本发明优选将第二离心所得沉淀物清洗后风干。在本发明中,所述清洗优选包括第一清洗和第二清洗;所述第一清洗和第二清洗优选采用乙醇水溶液进行清洗;所述乙醇水溶液中乙醇的体积百分含量优选为75%;第一清洗和第二清洗过程中所述乙醇水溶液的用量均优选为400μl;所述风干的温度优选为25℃;所述风干的时间优选为18h。
[0051]
本发明优选将风干所得沉淀物与te缓冲液混合后,得待测样品的dna。在本发明中,所述te缓冲液的用量优选为200μl。本发明优选将所得待测样品的dna置于
‑
20℃保存。
[0052]
在本发明中,所述pcr扩增的反应程序优选包括:95℃预变性5min;95℃变性30s、60℃复性30s、72℃延伸1min,30次循环;然后72℃延伸10min,10℃冷却10min。
[0053]
在本发明中,当采用fhb1
‑
4引物对进行pcr扩增时,所述pcr扩增的反应体系以20μl计,优选包括模板dna 2.0μl、含25mmol/l mgcl2的10
×
pcr buffer 2.0μl、dntp 0.4μl、fhb1
‑
4f 0.4μl、fhb1
‑
4r 0.4μl、taq 0.4μl和ddh2o14.4μl;当采用fhb1
‑
4引物对进行pcr扩增时,所述pcr扩增的反应体系以20μl计,优选包括模板dna2.0μl、含25mmol/lmgcl2的10
×
pcr buffer 2.0μl、dntp 0.4μl、fhb1
‑
4f 0.4μl、fhb1
‑
4r 0.4μl、taq 0.4μl和余量的ddh2o;所述fhb1
‑
4f、fhb1
‑
4r、fhb1
‑
4f和fhb1
‑
4r的工作浓度均优选为10μm;所述模板dna的工作浓度优选为100ng/μl;所述dntp的工作浓度优选为2.5mmol/l;所述taq的工作浓度优选为5u/μl。
[0054]
本发明所述pcr扩增后,优选还包括对pcr扩增所得产物进行凝胶电泳检测;所述凝胶电泳检测优选为2.5%的琼脂糖凝胶进行电泳检测;所述琼脂糖凝胶中琼脂糖的质量百分含量为2.5%;所述电泳检测的电压优选为130v;所述电泳检测的时间优选为30min。
[0055]
在本发明中,所述凝胶电泳的检测结果为:若引物对fhb1
‑
4能扩增出747bp条带且fhb1
‑
4不能扩增出753bp条带,则该样品为含有赤霉病主效抗病等位基因fhb1
‑
r的纯合样品;若引物对fhb1
‑
4能扩增出747bp条带且引物对fhb1
‑
4能扩增出753bp条带,则该样品在fhb1位点为杂合体;若引物对fhb1
‑
4不能扩增出747bp条带且引物对fhb1
‑
4能扩增出753bp条带,则样品为不含赤霉病主效抗病等基因fhb1
‑
r的纯合样品。
[0056]
本发明所述检测方法能够用于用于鉴定待测小麦植株是否含有赤霉病主效抗病基因fhb1,可用于含fhb1抗病等位基因型的抗赤霉病小麦育种。
[0057]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的一组用于检测小麦赤霉病主效抗病基因基因型的引物组合、试剂或试剂盒及应用和方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
[0058]
下面实施例中采用的试验材料:
[0059]
含fhb1纯合基因型的材料:苏麦3号(江苏省苏州地区农业科学研究所)、宁麦9号(江苏省农业科学院粮食作物研究所)、宁麦13(江苏省农业科学院粮食作物研究所)、宁麦14(江苏省农业科学院粮食作物研究所)、宁麦资119(江苏省农业科学院资源与生物技术研究所)、扬麦30(江苏里下河地区农业科学研究所)、扬麦18(江苏里下河地区农业科学研究所)、徐麦dh9(江苏徐淮地区徐州农业科学研究所)、红阳麦1号(淮安银宇作物育种中心);
[0060]
不含fhb1纯合基因型的材料:泗1516(江苏省农业科学院宿迁农科所)、矮抗58(河南科技学院小麦育种中心)、迁麦2号(江苏省农业科学院宿迁农科所)、百农207(河南百农种业有限公司、河南华冠种业有限公司)、周麦18(周口市农业科学院)、淮麦20(江苏省徐淮地区淮阴农业科学研究所)、花培8号(河南省农业科学院重点试验室)、济麦22(山东省农业
科学院作物研究所)、淮麦33(江苏徐淮地区淮阴农业科学研究所)、信麦69(信阳市农业科学院)淮麦18(江苏省徐淮地区淮阴农业科学研究所)、烟农836(烟台市农业科学研究院)、豫麦69(新乡市农科所)、烟农1212(烟台市农业科学研究院)、新麦26(新乡市农业科学院);
[0061]
其它植物材料包括以感病半冬性小麦品种泗1516为母本,抗病春性小麦品种苏麦3号为父本杂交配组的310个bc1f2单株。
[0062]
赤霉病人工抗性接种鉴定所采用的菌液由江苏省农业科学院植物保护研究所提供,参照《小麦抗赤霉病评价技术规范》(ny/t 1443.4
‑
2007)进行病害抗性鉴定。
[0063]
实施例1
[0064]
fhb1抗感等位基因序列分析及分子标记设计
[0065]
苏麦3号fhb1位点的fhb1
‑
r基因序列全长为825bp,编码一种富含组氨酸的钙离子结合蛋白,是被证实的具有赤霉病抗性效应的等位基因,称为fhb1
‑
r(序列如seq id no.5所示:atgtgtatatttggacaaccatgtagacaagctgttggacgtctgttttgggctcacgtcgtgcaaatggtcgaggacaagaagaagagactccttgagaagaaggaagctccactgaaatggcagcagaaactggaaggggcaattaaggccactgaagaaaaggagaagaagctcaagtcgaaaaagcacaggaggcgaagctattcttcctcagaatccgacagtgaatccgagagcgacagtgatcggaaacgcaggaagaggaaggaccgcaaaaggcacaaaaaacatggccactctgactctgatggtgccaggaggcgcaagcacaggtcaaagaggaggagctcggactctagcgatgagagcgacagtgatgaatatgatagcgaatctgaagaggatcgccgaaggaagaagcactcgcacaggaggaagcatcgccggcactcttcaaggtcagagtctgatgcttcagattacagcagcgatgatgatgagcggagatcaaccaggaaggaccacactaggagccgcaggcgtcgccaccgatcctcagacgatgaatctgaggagaagatcaggttgaggcataggaagcgtcacagatcaagtgacgaggacaagccgtcagattctgacaaccataagcgtcacaggagccgctctatgtccttggatgacggtgctgctggcgagccagacaagatgaatgatggcaaggggtctcacaaaagccggcaccaccgccgccaccaccatcaccatcatgatcatcgtgcgaactctgctgaacccagtgacgggaagcaactcgtgtaa),而在泗1516、矮抗58等品种或种质资源中为感病基因,称为fhb1
‑
s(序列如seq id no.6所示:atgtgtatatttggacaaccatgtagacaagctgttggacgtctgttttgggctcacgtcgtgcaaaacgagtatagacatccatatagacaagctattggagatgctcttaccttcggtttaaacatgtctcactttgtcatggtcacttgtatttgctgattccaagcatgttcttcaggggaaagaaaatatcagtagtcccttgatttctttcagaattgggattacatttgaatttaaactgatgcactatgtgttaacaatcaatagaccttgtcacatctgtctggttaattagtttgtttgtgtacagttaccagagccgtatatgattttggtaggatctgaatggctagcaggttggaaccttcaagttactgttttggtgttaagcggctgtcatgtatcagcttagtgttactttggtgttaatcttttcttagacatgccaagctctgtccagtatttgttggttgtaaggattagcttcactatgcttcgaaatgcctgctactgaatgtcacttggttgcctaaatatctttgtttgagttgtttactaaatctatcactctacttattgacttggttgcctaaatatctttgtttgagttgtttactaaatctaccactctacttattgattggatatagacacttgcttttccgctagcattgtatataatcctacatgttcagtaaactaacagtgttttctctcttctatgagatgcacttccttgcatcatttcacggccctgcaggttttgagcttttgtctgtttcgctgggatggatgccaagaagttcctgcagatggtcgaggacaagaagaagagactccttgagaagaaggaagctccactgaaatggcagcagaaactggaaggggcaattaaggccactgaagaaaaggagaagaagctcaagtcgaaaaagcacaggaggcgaagctattcttcctcagaatccgacagtgaatccgagagcgacagtgatcggaaacgcaggaagaggaaggaccgcaaaaggcacaaaaaacatggccactctgactctgatggtgccaggaggcgcaagcacaggtcaaagaggaggagctcggactctagcgatgagagcgacagtgatgaatatgatagcgaatctgaagaggatcgccgaaggaagaagcactcgcacaggaggaagcatcgccggcactcttcaaggtca
gagtctgatgcttcagattacagcagcgatgatgatgagcggagatcaaccaggaaggaccacactaggagccgcaggcgtcgccaccgatcctcagacgatgaatctgaggagaagatcaggttgaggcataggaagcgtcacagatcaagtgacgaggacaagccgtcagattctgacaaccataagcgtcacaggagccgctctatgtccttggatgacggtgctgctggcgagccagacaagatgaatgatggcaaggggtctcacaaaagccggcaccaccgccgccaccaccatcaccatcatgatcatcgtgcgaactctgctgaacccagtgacgggaagcaactcgtgtaa)。本发明根据fhb1抗感等位基因序列存在差异的位点,利用primer premier 5.0软件设计出2对特异检测引物对(表1),其中fhb1
‑
4用于特异检测抗病等位基因fhb1
‑
r,fhb1
‑
4用于特异检测感病等位基因fhb1
‑
s。
[0066]
表1引物对的具体信息
[0067][0068]
实施例2
[0069]
分子标记的检测及相互验证
[0070]
(1)小麦基因组dna的提取
[0071]
在小麦播种后40天,收集苏麦3号和泗1516的单株叶片,采用ctab法提取基因组dna(murray m g,et al.,rapid isolation ofhigh molecular weight plant dna,nucleicacids res,1980,8(19):4321
‑
4325)。
[0072]
具体步骤为:剪取2~3cm幼嫩的小麦叶片装入2ml离心管中,向离心管中加入直径5mm的钢珠一枚,将准备好的样品离心管放入冷冻干燥机中
‑
40℃真空冷冻6h,然后用研磨仪研磨至粒径≤5μm的粉末,其中研磨仪的频率为40.00hz,时间为240s;向研磨好的样品离心管中加入基因组提取液(65℃恒温预热的含质量浓度比2%的ctab的基因提取液),其中研磨样品与基因提取液的质量体积比为20mg:600μl,震荡摇匀后置于65℃的恒温水浴锅中温育30min,期间每间隔10min取出摇匀;温育结束后取出离心管,在通风橱中加入600μl含氯仿、异丙醇的混合溶液(氯仿与异丙醇的体积比为24:1),充分混匀后静置10min;静置后的离心管放入离心机内12000rpm离心15min,使其分为三层;吸取400μl上清液于另一个1.5ml的灭菌离心管中;加入
‑
20℃预冷的异丙醇400μl,轻轻混匀后置于
‑
20℃冰箱内沉降30min,然后12000rpm离心10min,弃上清;向管中加入体积质量百分含量为75%的乙醇水溶液400μl,轻摇洗涤沉淀,弃上清,再向管中加入体积质量百分含量为75%的乙醇水溶液400μl,轻摇洗涤沉淀,弃上清后25℃风干沉淀18h;加入200μl的te缓冲液溶解沉淀,置于
‑
20℃保存;
[0073]
(2)分子标记的检测与验证
[0074]
以苏麦3号和泗1516的基因组dna为模板,利用表1中设计的引物对进行pcr检测及验证。
[0075]
20μl的pcr反应体系为100ng/μl基因组dna 2.0μl、含25mmol/l mgcl2的10
×
pcr buffer2.0μl、2.5mmol/l的dntp 0.4μl、fhb1
‑
4引物对中10μm的fhb1
‑
4f和10μm的fhb1
‑
4r各0.4μl或fhb1
‑
4引物对中10μm的fhb1
‑
4f和10μm的fhb1
‑
4r各0.4μl,5u/μl的taq 0.4μl和
ddh2o 14.4μl。
[0076]
反应程序包括:95℃预变性5min;然后95℃变性30s、60℃复性30s、72℃延伸1min,30次循环;然后72℃延伸10min,10℃冷却10min后,将扩增产物加入上样缓冲液终止反应。
[0077]
反应产物在2.5wt.%的琼脂糖凝胶上130v电泳30min,经dured核酸染色后于凝胶成像仪中拍照、记载,结果如图1所示,结果发现fhb1
‑
4在苏麦3号中能扩增出747bp的目标条带而在迁麦3号中不能扩增出该条带;fhb1
‑
4能在泗1516中扩增出753bp的目标条带而在苏麦3号中扩增不出该条带,故选取fhb1
‑
4对抗病等位基因fhb1
‑
r进行检测,fhb1
‑
4对感病等位基因fhb1
‑
s进行检测。
[0078]
实施例3
[0079]
fhb1
‑
4引物对和fhb1
‑
4引物对对不同小麦品种(系)的fhb1等位基因检测
[0080]
24份小麦品种(系)(苏麦3号、宁麦9号、宁麦13、宁麦14、宁麦资119、扬麦30、扬麦18、徐麦dh9、红阳麦1号、泗1516、矮抗58、迁麦2号、百农207、周麦18、淮麦20、花培8号、济麦22、淮麦33、信麦69、淮麦18、烟农836、豫麦69、烟农1212、新麦26)的小麦基因组dna的提取,其中提取方法与实施例2提取方法相同。
[0081]
利用引物对fhb1
‑
4引物对和fhb1
‑
4引物对分别对24份小麦品种(系)的基因组dna进行pcr扩增检测,pcr扩增体系和程序同实施例2,扩增产物经2.5%的琼脂糖凝胶电泳分离,检测结果见图2,结果表明fhb1
‑
4在宁麦9号、宁麦13、宁麦14、宁麦资119、扬麦30、扬麦18、徐麦dh9和红阳麦1号中扩增出与苏麦3号相同的带型,在泗1516、矮抗58、迁麦2号、百农207、周麦18、淮麦20、花培8号、济麦22、淮麦33、信麦69、淮麦18、烟农836、豫麦69、烟农1212和新麦26中未扩增出目标条带;fhb1
‑
4引物对在泗1516、矮抗58、迁麦2号、百农207、周麦18、淮麦20、花培8号、济麦22、淮麦33、信麦69、淮麦18、烟农836、豫麦69、烟农1212和新麦26均扩增出753bp左右的目标条带,而在苏麦3号、宁麦9号、宁麦13、宁麦14、宁麦资119、扬麦30、扬麦18、徐麦dh9和红阳麦1号中均无条带,可见fhb1
‑
4引物对和fhb1
‑
4引物对具有很好的特异扩增特性。由条带显示结果可以确定宁麦9号、宁麦13、宁麦14、宁麦资119、扬麦30、扬麦18、徐麦dh9和红阳麦1号为含有赤霉病主效抗病等位基因fhb1
‑
r的纯合样品;而泗1516、矮抗58、迁麦2号、百农207、周麦18、淮麦20、花培8号、济麦22、淮麦33、信麦69、淮麦18、烟农836、豫麦69、烟农1212和新麦26为不含有赤霉病主效抗病等位基因fhb1
‑
r的纯合样品。
[0082]
实施例4
[0083]
泗1516和苏麦3号杂交所得的bc1f2群体fhb1不同基因型检测
[0084]
分蘖盛期采集泗1516/苏麦3号的310个bc1f2单株叶片并提取基因组dna,利用fhb1
‑
4引物对和fhb1
‑
4引物对分别对310个单株进行pcr扩增检测,其基因组提取方法、检测方法和条件参照实施例2。pcr扩增检测结果如图3和图4所示,310个单株中扩增出和苏麦3号带型相同的有39株,和泗1516带型相同的有190株,fhb1
‑
4引物对和fhb1
‑
4引物对均能扩增出目标条带的有81株,田间观察各单株的农艺性状表现,将株叶形态好,幼苗冬性强的单株挂牌标记。
[0085]
表2单株的农艺性状表现
[0086]
[0087]
[0088]
[0089]
[0090]
[0091][0092]
注:1为苏麦3号,2为泗1516;3~312为泗1516/苏麦3号bc1f2群体单株
[0093]
由表2记载的可知,310个bc1f2群体单株中抗寒性好、叶片上冲、穗部结实性好的单株有41个。本发明通过此实施例筛选得到41个抗寒性好、叶片上冲、穗部结实性好的单株,后续对这41个单株与赤霉病抗性的关系进行研究。
[0094]
实施例5
[0095]
泗1516/苏麦3号bc1f2群体fhb1不同基因型单株与赤霉病抗性的关系
[0096]
根据前期fhb1
‑
4引物对和fhb1
‑
4引物对检测的结果,参照《小麦抗赤霉病评价技术规范》(ny/t 1443.4
‑
2007),采用赤霉病人工接种鉴定的方法对感病品种泗1516、抗病品种苏麦3号和泗1516/苏麦3号bc1f2群体中田间农艺性状表现好的单株(该单株的编号如表3所示)的部分麦穗进行赤霉病抗性接种鉴定,抗病检测结果如表3所示。
[0097]
对表3中的编号的样品进行赤霉病人工接种鉴定,利用fhb1
‑
4引物对和fhb1
‑
4引物对分别对310个单株进行pcr扩增检测,其基因组提取方法、检测方法和条件参照实施例2,扩增结果如表3所示。
[0098]
表3田间农艺性状表现好的单株的抗病评价
[0099]
[0100][0101]
注:1为苏麦3号,2为泗1516;9~312为泗1516/苏麦3号bc1f2群体中部分单株,“+”表示扩增出该引物目的条带,
“‑”
表示未扩增出该引物目的条带。
[0102]
由表3记载的可知,含有抗病等位基因fhb1
‑
r的单株大多表现中感及以上抗性水平,明显优于不含有fhb1
‑
r抗病等位基因的感病单株。成熟后按单株收获田间农艺性状表现较好和检测含fhb1抗病等位基因的单株留种。
[0103]
由上述实施例记载的可知,本发明所述引物组合具有快捷、准确、低成本地检测小麦主效抗赤霉病基因fhb1的基因型的优势,利用本发明提供的引物组合在种子发芽后即可进行植株的基因型检测,无需通过田间大群体鉴定筛选,从而提高选择筛选效率,降低育种成本。本发明提供的引物对是根据小麦抗赤霉病基因fhb1抗感等位基因序列差异进行开发的,因此,利用该引物对可以实现对赤霉病主效抗病基因fhb1不同基因型的准确鉴定。在抗赤霉病育种中,利用本发明提供的引物对不存在由于标记和基因间的遗传交换而造成基因型鉴定的错误;而且本发明所述引物对是根据基因内部序列开发而成,故在引物对辅助选择育种的过程中不会造成目标基因丢失。同时,该对杂交世代进行基因跟踪鉴定,能加快早代稳定,从而缩短育种年限,提高选育含fhb1基因的抗赤霉病小麦品种的选择效率。此外,引物对fhb1
‑
4和fhb1
‑
4扩增产物大小均在800bp以下,在目标基因检测过程中花费的时间相对较少且对引物、酶类、技术等没有特殊要求,具有操作简单、准确性高、成本低廉的优势,适合应用于对大量小麦资源和育种群体材料的检测和筛选
[0104]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护
范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1