治理汞污染的真菌、生物菌剂及应用和除汞方法以及鉴定治理汞污染能力真菌的方法
1.本发明属于生物除汞技术领域,具体涉及治理汞污染的真菌、生物菌剂 及应用和除汞方法以及鉴定治理汞污染能力真菌的方法。
背景技术:
2.汞是地壳中天然存在的组成成分,在环境中持续存在,它是常温常压条 件下唯一存在的液态重金属元素。汞在环境中以无机汞或有机汞的形式存 在。无机汞主要包括金属汞、亚汞(hg
22+
)、二价汞离子(hg
2+
)。二价汞离 子还可以和碳原子以共价键的形式结合形成有机汞化合物,如甲基汞 (mehg)等。二价汞离子(hg
2+
)具高度电子亲和性,能与含有硫、氧、 氮等电子供体的基团如巯基、羰基、羧基、羟基、氨基、磷酰基等以共价键 的形式结合,而这些基团均是生物内最重要的活性基团,它们与hg
2+
以共价 结合后即失去活性,因此hg
2+
对机体生理生化功能产生巨大影响,对包括人 类在内的生命体造成巨大的危害。甲基汞也与蛋白巯基发生反应,使得蛋白 子分子发生“硫汞化”,进而失去活性。对于人类而言,甲基汞具有极强的 神经毒性。甲基汞容易被动植物吸收而在食物链和生物圈中富集放大,污染 农产品、淡水和海产品,严重威胁着人类的食品安全和生命健康。由于汞具 有高毒性、持久性、生物富集性以及远距离传播的特点,被认为是三大最危 险的金属元素之一,美国环保署把汞列为129种危险化学品之一,并已被列 入世界卫生组织国际癌症研究机构致癌清单中。
3.目前对于汞污染的治理,多以钝化剂或细菌为主,并没有关于真菌治理 汞污染的记载。
技术实现要素:
4.有鉴于此,本发明的目的在于提供治理汞污染的真菌、生物菌剂及应用 和除汞方法以及鉴定治理汞污染能力真菌的方法,利用发现的野生型真菌进 行汞污染的治理,不存在基因污染,并且清除环甲基汞和二价汞污染的效率 高。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了治理汞污染真菌,所述真菌表达甲基汞去甲基酶mmd和 二价汞还原酶mir;
7.所述真菌包括绿僵菌属(metarhizium)真菌和非绿僵菌属真菌,所述非 绿僵菌属真菌包括尖孢镰刀菌(fusarium oxysporum),大孢树粉孢 oidiodendron maius,所述烧土火丝菌pyronema omphalodes,煤油霉菌 amorphotheca resinae,cadophora malorum,hyaloscypha bicolor, pseudogymnoascussp和exophiala oligosperma。
8.优选的,所述甲基汞去甲基酶mmd的编码基因的genbank accessionnumber为xp_007825874;所述二价汞还原酶mir的编码基因的genbankaccession number为xp_007824121。
9.优选的,所述绿僵菌属真菌包括罗伯茨绿僵菌(metarhizium robertsii)、 金龟子绿僵菌(metarhizium anisopliae)、褐色绿僵菌(metarhizium brunneum)、贵州绿僵菌(metarhiziumguizhouense)、大孢绿僵菌(metarhizium majus)和蝗绿僵菌(metarhizium acridum);
10.所述罗伯茨绿僵菌的保藏编号为usdaarsef2575,所述金龟子绿僵菌 的保藏编号为usdaarsef549,所述褐色绿僵菌的保藏编号为usda arsef3297,所述贵州绿僵菌的保藏编号为usdaarsef977,所述大孢绿 僵菌的保藏编号为usdaarsef297,所述蝗绿僵菌的保藏编号为usda arsef324;
11.所述尖孢镰孢菌的保藏编号为nrrl 32931,所述cadophora malorum 的保藏编号为bio-12245,所述oidiodendron maius的保藏编号为atcc 60377,所述hyaloscypha bicolor的保藏编号为cbs144009,所述 pseudogymnoascus sp.的保藏编号为atcc mya-4855,所述pyronemaomphalodes的保藏编号为atcc 14881,所述exophiala oligosperma的保藏 编号为atcc28180,所述amorphotheca resinae的保藏编号为atcc 22711。
12.本发明还提供了一种去甲基汞甲基和还原二价汞的生物菌剂,所述生物 菌剂包括上述真菌中的至少一种。
13.本发明还提供了上述真菌,或上述生物菌剂在除汞污染中的应用。
14.本发明还提供了一种去甲基汞甲基和还原二价汞的滤芯,所述滤芯以上 述真菌中的至少一种菌丝为填充物。
15.本发明还提供了一种去除水体中甲基汞和二价汞的过滤装置,所述过滤 装置包括上述滤芯。
16.本发明还提供了一种去除水体中甲基汞和二价汞的方法,包括以下步 骤:将上述生物菌剂置于水体中搅拌48h以上,或将所述水体中的水通过上 述滤芯或上述过滤装置。
17.本发明还提供了一种去除土壤中甲基汞和二价汞的方法,包括以下步 骤:在所述土壤中种植与上述真菌具有共生关系的植物,而后接种所述真菌。
18.本发明还提供了一种鉴定具备去甲基汞甲基能力的非绿僵菌属真菌的 方法,其特征是,包括以下步骤:鉴定所述非绿僵菌属真菌的基因组中是否 含有绿僵菌甲基汞去甲基酶mmd和二价汞还原酶mir或甲基汞去甲基酶 mmd和二价汞还原酶mir的同源基因。
19.有益效果:本发明提供了一种治理汞污染的真菌,并具体发现了野生型 绿僵菌属真菌和8种非绿僵菌属真菌能清除环境甲基汞和二价汞污染,并发 现了负责清除甲基汞和二价汞的基因/蛋白酶(甲基汞去甲基酶mmd和二价 汞还原酶mir),本发明所述基因/蛋白酶的发现为以后重组菌治理汞污染提 供了基因基础。
20.本发明提供的所述真菌或生物菌剂,当将其应用于水体时,可通过培养 和过滤等的方法清除水体中的重金属汞,当应用于土壤时,将能与真菌形成 共生关系的植物种植在污染的土壤上,接种真菌后,真菌能利用根际分泌的 营养物质在植物根际生长,消除土壤中甲基汞和二价汞,降低植物体内甲基 汞和二价汞的累积量,从而达到治理汞污染的效果。
21.在本发明实施例中,当淡水或海水中甲基汞的浓度为50μg/l,用绿僵菌 处理能将水中甲基汞完全清理。当甲基汞浓度提高至1mg/l时,用绿僵菌能 完全清除淡水或海水中的甲基汞。甲基汞浓度高达5mg/l的淡水,用绿僵菌 处理,50%的甲基汞被清除;处理含甲
基汞(5mg/l)海水,70%的甲基汞被清 除。用绿僵菌处理二价汞。当二价汞浓度为0.5mg/l,用绿僵菌能完全清除 水体中的二价汞。当二价汞浓度提升至1mg/l时,能清除70%的二价汞。在 浓度高达5mg/l和10mg/l的淡水和海水,50%的二价汞被绿僵菌清除。
22.在土壤中接种绿僵菌后,显著降低了甲基汞和二价汞在植物内部的累 积;与未接种绿僵菌的植物相比,接种绿僵菌的植物组织中甲基汞含量下降 了2.58倍,其中地上部分下降2倍,地下部分下降2.52倍。同样,植物组 织中二价汞的含量下降了4.19倍,其中地上部分下降3倍,地下部分下降 6.2倍。接种绿僵菌后,植物根际土壤中甲基汞含量下降了1.2倍,根际土壤 中二价汞含量下降了1.1倍。
23.生物保藏信息
24.罗伯茨绿僵菌保藏编号为arsef2575,金龟子绿僵菌保藏编号为 arsef549,大孢绿僵菌保藏编号为arsef297,褐色绿僵菌保藏编号为 arsef3297,蝗绿僵菌保藏编号为arsef324,贵州绿僵菌保藏编号为 arsef977。上述六株绿僵菌均保藏于美国农业部昆虫病原真菌菌种保藏中 心(arsef),隶属于美国农业研究菌种保藏中心nrrl(1815n.universitystreet peoria,il 61604)。
25.尖孢镰刀菌(fusarium oxysporum)的保藏编号为nrrl 32931,保藏于 德克萨斯州圣安东尼奥得克萨斯大学健康科学中心。
26.cadophora malorum的保藏编号为bio-12245,原始编号cbs 100591, 原始来源为荷兰菌种保藏中心cbs。
27.煤油霉菌(amorphotheca resinae)保藏编号为bio-104132,原始编号为cbs 186.54,来源地为荷兰。
附图说明
28.图1为以菌丝为基质的过滤器;
29.图2为过滤器的清除汞能力,其中a表示三次过柱后,每次收集液中甲 基汞的含量,b表示三次过柱后,每次收集液中hg
2+
的含量;
30.图3为基因mmd和mir敲除突变体和回补菌株构建的验证结果,其中 a表示mmd敲除突变体的验证结果,b表示为mir敲除突变体的验证结果, 上图为引物bar-up和cf-2进行pcr扩增结果,下图为引物cf-1和cf-2 进行pcr扩增结果;c表示为回补菌株的验证结果,左图使用引物cc-mmd-5 和cc-mmd-3进行pcr扩增,右图使用引物cc-mir-5和cc-mir-3进行扩增; d表示基于同源重组原理发生的基因敲除,上图为目的基因在真菌基因组的 位置,下图为基因敲除质粒图谱;e表示双敲突变体中mmd和mir的验证 结果,使用引物与a和b中一致;
31.图4为在含有甲基汞或二价汞的土壤中的玉米植株接种或未接种罗伯茨 绿僵菌孢子的生长情况(地上部分幼苗伸长量);a图为在含有甲基汞土壤 中,接种和未接种罗伯茨绿僵菌孢子的生长情况;b图为在含有二价汞土壤 中,接种和未接种罗伯茨绿僵菌孢子的生长情况;
32.图5为在含有甲基汞或二价汞的土壤中玉米植株的地上部分(幼苗)和 地下部分(根部)的干重和鲜重测定;其中a图为在甲基汞土壤中玉米植株 地下部分(根)的干重和鲜重;b图为在甲基汞土壤中玉米植株地上部分(幼 苗)的干重和鲜重;c图为在二价汞土壤中
玉米植株地下部分(根)的干重 和鲜重;d图为在二价汞土壤中玉米植株地上部分(幼苗)的干重和鲜重;
33.图6为菌株的甲基汞和二价汞耐受力分析,其中a表示在不含甲基汞的 1/2sdy液体培养基培养,b表示在含0.1μg/ml甲基汞的1/2sdy液体培养 基培养,c表示在含0.2μg/ml甲基汞的1/2sdy液体培养基培养;d表示在 含10μg/ml二价汞的1/2sdy液体培养基中进行培养,e表示在含15μg/ml 二价汞的1/2sdy液体培养基中进行培养,f表示在含20μg/ml二价汞的 1/2sdy液体培养基中进行培养;各图中每组数据从左到右依次表示:wt、 δmmd、c-δmmd、δmir、c-δmir和δmmd::mir;
34.图7为菌丝体对甲基汞的耐受力,比例尺为7mm;
35.图8为菌丝体对二价汞的耐受力,比例尺为7mm;
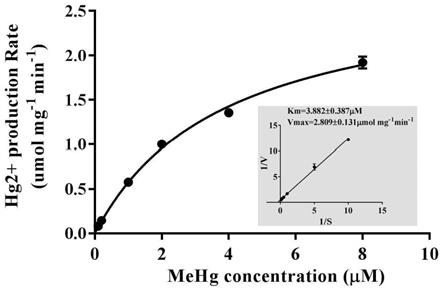
36.图9为mmd酶促反应米氏方程图和双倒数作图法计算出的米氏常数 km和最大反应速度vmax。
具体实施方式
37.本发明提供了治理汞污染真菌,所述真菌表达甲基汞去甲基酶mmd和 二价汞还原酶mir;所述真菌包括绿僵菌属(metarhizium)真菌和非绿僵菌 属真菌,所述非绿僵菌属真菌包括尖孢镰刀菌(fusarium oxysporum),大孢 树粉孢oidiodendron maius,所述烧土火丝菌pyronema omphalodes,煤油霉 菌amorphotheca resinae,cadophora malorum,hyaloscypha bicolor, pseudogymnoascussp和exophiala oligosperma。
38.本发明所述真菌包括绿僵菌属真菌和非绿僵菌属真菌,所述绿僵菌属真 菌表达甲基汞去甲基酶mmd和二价汞还原酶mir;所述非绿僵菌属真菌含 有甲基汞去甲基酶mmd的同源蛋白和二价汞还原酶mir的同源蛋白。
39.本发明所述绿僵菌属真菌优选包括罗伯茨绿僵菌(metarhizium robertsi i)、金龟子绿僵菌(metarhizium anisopliae)、褐色绿僵菌(metarhizium br unneum)、贵州绿僵菌(metarhizium guizhouense)、大孢绿僵菌(metarhizi um majus)和蝗绿僵菌(metarhizium acridum)。6种绿僵菌属真菌现已经保 存在美国农业部昆虫病原真菌菌种保藏中心(arsef),隶属于美国农业研 究菌种保藏中心nrrl(1815n.university street peoria,il 61604),编号 分别为arsef2575,arsef549、arsef3297、arsef977、arsef297和 arsef324,上述六株绿僵菌均保藏于美国农业部昆虫病原真菌菌种保藏中 心(arsef),可通过网址查询:http://arsef.fpsnl.cornell.edu/4daction/w_search/accessions。
40.本发明所述的8种非绿僵菌属真菌包括尖孢镰孢菌(fusarium oxyspor um),cadophora malorum,大孢树粉孢(oidiodendron maius),hyaloscyp ha bicolor,pseudogymnoascus sp,烧土火丝菌(pyronema omphalodes),e xophiala oligosperma,煤油霉菌(amorphotheca resinae)。其中所述尖孢镰刀 菌fusarium oxysporum保藏编号为nrrl32931,可通过网址查询:https:// nrrl.ncaur.usda.gov/cgi-bin/usda/fungi/results_public.html?mv_action=back&mv _click=query_sort&sfd=substrate%2clocation_detail%2ccountry;所述cadopho ra malorum的保藏编号为bio-12245(购于北京百欧博伟生物技术公司,htt ps://www.biobw.org/china-strain/bio-12245.html);所述煤油霉菌保藏编号为a tcc 22711。煤油霉菌(amorphotheca resinae)的保藏编号为
bio-104132, 原始编号为cbs 186.54,来源地为荷兰,购买于北京百欧博伟生物技术公 司(https://www.biobw.org/china-strain/bio-104132.html)。
41.在本发明中,上述6种绿僵菌属真菌和8种非绿僵菌属真菌能除去甲基 汞上的甲基,并能还原二价汞。
42.在本发明中,所述罗伯茨绿僵菌的基因组中还表达甲基汞去甲基酶 mmd和二价汞还原酶mir,所述甲基汞去甲基酶mmd的编码基因的 genbank accession number为xp_007825874;所述二价汞还原酶mir的编码 基因的genbank accession number为xp_007824121。一些细菌的merb酶功 能已经得以验证,例如alphaproteobacteriaxanthobacter autotrophicus,但是 mmd与这些功能已知的细菌merb的相似性很低,例如,用ncbi的blastp 分析发现,mmd与alphaproteobacteria细菌merb基因(wp_159587663) 最高的相似性为33.85%(1e-09
),与mmd最相似的细菌merb同源基因为 来自actinobaceria bacterium的一个功能未分析基因(hypothetical protein, accession number:mbo0836585),它们的相似性为41.99%(6e-62
)。罗伯茨 绿僵菌的mmd与褐绿僵菌的同源基因(xp_014548844)相似性为96.1%(e 值为0),与金龟子绿僵菌的(kfg84668)相似性为96.1%(e值为0),与大 孢绿僵菌的(kie02702)相似性为94.04%(e值为0),与贵阳绿僵菌 (kid85335)的相似性为93.93%(e值为0),与蝗绿僵菌的(xp_007815236) 相似性为74.4%(5e-40
)。mmd与非绿僵菌属真菌尖孢镰孢菌(fusariumoxysporum)的同源基因的相似性为65.02%(5e-136
),与非绿僵菌属真菌 cadophora malorum的同源基因相似性为51.96%(7e-99
),与非绿僵菌属真 菌大孢树粉孢oidiodendron maius zn的同源基因相似性为50.18%(1e-90
), 与非绿僵菌属真菌hyaloscypha bicolore的同源基因相似性为60%(2e-30
), 与非绿僵菌属真菌烧土火丝菌(pyronema omphalodes)的同源基因相似性为 27.98%(8e-10),与非绿僵菌属真菌exophiala oligosperma的同源基因相似 性为27.27%(2e-07
),与非绿僵菌属真菌pseudogymnoascus destructans的同 源基因相似性为29.24%(3e-06
),与非绿僵菌属真菌煤油真菌amorphothecaresinae同源基因相似性为26.22%(2e-05
)。
43.本发明实施例了构建了罗伯茨绿僵菌mmd编码基因mmd的敲除突变 体δmmd,和它的回补菌株c-δmmd。与野生型菌株相比,突变体δmmd消 除环境中甲基汞能力显著下降,菌丝中累积更多的甲基汞。在大肠杆菌中表 达并纯化得到mmd蛋白,mmd蛋白能移除甲基汞上甲基,产生二价汞, mmd成为首个报导的真菌甲基汞去甲基酶。本发明还对mmd进行相似性 分析,其内包含有存在于细菌的烷基汞裂解酶merb中的pfam03243 domain,但是罗伯茨绿僵菌的mmd与细菌的merb相似性很低。
44.在一些细菌中,除了有去甲基汞甲基的merb蛋白之外,还有二价汞还 原酶mera,它们组成一个操纵子。以细菌的mera为query,通过blastp 在罗伯茨绿僵菌发现了与之同源的基因(genbank accession number: xp_007824121),命名为mir(mercury ion reductase)。尽管还未见有真菌 二价汞还原酶的报道,但是mir的同源基因在真菌中广泛存在。与罗伯茨 绿僵菌mir相似性最高的细菌二价汞还原酶来自于chloroflexi bacterium的 基因(genbank accession number:mbn9390035),它们的相似性为55.49%(e 值为0)。与mmd基因类似,敲除mir基因显著降低了罗伯茨绿僵菌的二价 汞还原力,mir也成为在真菌首次报导的二价汞还原酶。生物化学分析在大 肠杆菌中表达并纯化的mir蛋白,
表明它具有将二价汞还原为零价汞的能 力。
45.本发明还提供了一种去甲基汞甲基和还原二价汞的生物菌剂,所述生物 菌剂包括上述真菌中的至少一种。
46.本发明利用所述绿僵菌属真菌和8种非绿僵菌属真菌中的任意一种或多 种的组合,都可用于去除甲基汞甲基和还原二价汞,因此可将所述绿僵菌属 真菌和8种非绿僵菌属真菌用于制备生物菌剂。
47.本发明对所述生物菌剂的制备方法并没有特殊限定,利用本领域的常规 真菌培养方法即可,实施例中以绿僵菌为例进行说明,但是不能将其认定为 本发明的全部保护范围,优选包括:将在pda上培养14d的所述绿僵菌属 真菌的孢子均匀悬浮在0.01%(v/v)的tritonx-100水溶液中,制成浓度为 1
×
108个/ml的孢子悬液。将1
×
108个孢子接入sdy培养基(萨式液体培 养基,含体积百分含量为1%的酵母抽提物)培养36h,无菌环境下真空抽 滤获取菌丝。
48.本发明还提供了上述绿僵菌属真菌,8种非绿僵菌属真菌,或上述生物 菌剂在除汞污染中的应用。
49.本发明还提供了一种去甲基汞甲基和还原二价汞的滤芯,所述滤芯以上 述真菌中的至少一种菌丝为填充物。
50.本发明以上述菌丝为填充物,可用于制备除水体中甲基汞和二价汞的滤 芯。本发明对所述滤芯的制备方法和规格并没有特殊限定,利用本领域的常 规方法进行制备即可。
51.本发明还提供了一种去除水体中甲基汞和二价汞的过滤装置,所述过滤 装置包括上述滤芯。
52.本发明在所述过滤装置中设置所述滤芯,可设置成多滤芯串联以保证过 滤效果,也可设置成单一滤芯,循环往返通过所述滤芯。本发明对所述过滤 装置的具体造型和结构并没有特殊限定。
53.本发明还提供了一种去除水体中甲基汞和二价汞的方法,包括以下步 骤:将上述生物菌剂置于水体中搅拌48h以上,或将所述水体中的水通过上 述滤芯或上述过滤装置。
54.本发明优选将所述菌丝置于待处理水体中,于26℃环境中进行搅拌,所 述搅拌的速率优选为100rpm,经48h的搅拌后可取得显著的去甲基汞和二 价汞的效果。本发明所述水体优选包括淡水或海水。在本发明中,所述水体 与所述生物菌剂的体积质量比优选为20ml:0.2g(湿重)。在甲基汞浓度为 1mg/l时,水体中所有甲基汞均能被清除;当甲基汞浓度高达5mg/l时,绿 僵菌菌丝处理仍能清除水体中50-70%左右的甲基汞。当二价汞浓度为 10mg/l时,绿僵菌菌丝处理能清除56%的二价汞。在本发明实施例中,以8 种非绿僵菌属真菌中的三株真菌为例进行说明,尖孢镰刀菌(fusariumoxysporum),cadophora malorum和煤油霉菌(amorphotheca resinae),前两 种真菌含有与罗伯茨绿僵菌mmd相似性最高的同源基因,而煤油霉菌中含 有与mmd相似性最低的同源基因。这三株非绿僵菌属真菌同样能清除淡水 或者海水中的甲基汞和二价汞,其在甲基汞浓度为50μg/l的淡水中,尖孢镰 刀菌,cadophora malorum和煤油霉菌分别能清除水体中90%、95%和97% 的甲基汞,在相同浓度甲基汞的海水中分别能清除水体中90%、95%和94%, 在该浓度下基本能清除水体中的甲基汞,只残留痕量的甲基汞。在含有 10mg/l二价汞的淡水或海水,在淡水中,三株菌能清除水体中50%左右的二 价汞;在海水中,三株菌分别能清除水体中55-60%的二价汞。
55.本发明还可将所述水体直接通过所述滤芯或过滤装置,实施例中通过模 拟,将所述生物菌剂填充进一个直径为3cm的玻璃柱,构建成一个以菌丝 为基质的过滤器,利用所述装置可处理含有100μg/l甲基汞或10mg/l hg
2+
的 自来水。过滤器流速设置为0.1ml/min,30ml含有100μg/l甲基汞的自来水 经过一次过滤后,水体中残留80%的甲基汞,经过二次过滤后基本完全清除 水体中的甲基汞。相同流速下,30ml含有10mg/l hg
2+
的自来水经过一次过 滤后,水体中二价汞含量下降60%,二次过滤后二价汞含量下降67%,三次 过滤后二价汞含量下降80%。
56.本发明还提供了一种去除土壤中甲基汞和二价汞的方法,包括以下步 骤:在所述土壤中种植与上述真菌具有共生关系的植物,而后接种所述真菌。 本发明实施例中以接种绿僵菌为例进行说明,在土壤中接种绿僵菌后,显著 降低了甲基汞和二价汞在植物内部的累积;与未接种绿僵菌的植物相比,接 种绿僵菌的植物组织中甲基汞含量下降了2.58倍,其中地上部分下降2倍, 地下部分下降2.52倍。同样,植物组织中二价汞的含量下降了4.19倍,其 中地上部分下降3倍,地下部分下降6.2倍。接种绿僵菌后,植物根际土壤 中甲基汞含量下降了1.2倍,根际土壤中二价汞含量下降了1.1倍。
57.本发明所述植物优选包括玉米和象草等禾本科植物和桑树和枫树等木 本植物,更具体的所述草本植物包括象草和/或玉米,所述木本植物优选包括 桑树和枫树。本发明对所述种植的方法和行间距等并没有特殊限定,利用本 领域的常规种植方法即可。
58.本发明所述接种优选包括利用所述绿僵菌属真菌的孢子悬液进行一次 灌根,每株植物灌根10ml孢子悬液(1
×
105个孢子/ml)。
59.本发明还提供了一种鉴定具备去甲基汞甲基能力的真菌的方法,包括以 下步骤:通过ncbi提供的blastp(basic local alignment search tool)方 法分析比较绿僵菌属真菌mmd的同源蛋白,寻找含有mmd同源蛋白的其 他属真菌。
60.下面结合实施例对本发明提供的一种治理汞污染的真菌、生物菌剂及应 用和除汞方法以及鉴定治理汞污染能力真菌的方法进行详细的说明,但是不 能把它们理解为对本发明保护范围的限定。
61.实施例1绿僵菌属6种真菌和3种非绿僵菌属真菌在培养基中去甲基 汞甲基能力和去二价汞能力分析
62.菌丝培养与制备:分别将在pda上培养14d的绿僵菌孢子(罗伯茨绿 僵菌、金龟子绿僵菌、褐色绿僵菌、贵州绿僵菌、大孢绿僵菌和蝗绿僵菌) 均匀悬浮在0.01%的tritonx-100水溶液中,制成浓度为1
×
108个/ml的孢子 悬液。将1
×
108个孢子接入sdy培养基(萨式液体培养基,含1%的酵母 抽提物)培养36h,无菌环境下真空抽滤获取菌丝。对于上述8种非绿僵菌 属真菌,选取了3种分析去甲基汞甲基和去二价汞的能力,其中尖孢镰刀菌 (fusarium oxysporum)和cadophora malorum含有与罗伯茨绿僵菌mmd 相似性最高的同源基因,而煤油霉菌(amorphotheca resinae)中含有与mmd 相似性最低的同源基因。另外使用不含mmd同源基因的白僵菌和酵母作为 阴性对照。上述真菌菌丝制备方法与绿僵菌菌丝制备方法相同。
63.酵母培养:将空载对照菌株by4741接种在平板上,所用培养基为ypm。 于30℃培养3~4天后,挑选单菌落于相应的液体培养基中,30℃,220rpm 培养16~24h,此时od
600
到1.0~1.5。将菌液浓度调至od
600
nm为1之后, 取1ml菌液进行离心收集菌体(800rpm,10min),然
后用同体积含甲基汞的 液体培养基重悬细胞,220rpm处理24h后,离心培养物,分别收集上清液 和菌体,进行检测甲基汞的降解情况。
64.菌丝处理含甲基汞:将上述制备的菌丝(0.2g湿重)分别转接至20ml 含有0.05μg/ml甲基汞的sdy液体培养基中(在体积为50ml的三角瓶中), 均匀分散后在处理培养48h(26℃,100rmp),真空抽滤分别收集上清和菌 丝。
65.菌丝和上清液总汞含量分析:将上述上清液和菌丝冻干后,加入5ml浓 硝酸(6m),于110℃处理2h后,加超纯水至总体积50ml。然后用icp-ms (perkinelmer nexion 300x,agilent technologies 7800)检测样品中的hg 离子,即得到总汞含量。
66.icp-ms条件:射频功率为1550w,喷雾器pfa为100μl/min,雾化室为 石英,scott双通道,取样深度为4.5mm,载气流速为0.75l/min,尾吹气流 速为0.4l/min。
67.用hplc-icp-ms[agilent infinity 1260 ii(hplc),agilent technologies7800 icp-ms(icp-ms)]检测甲基汞和二价汞含量,其中的icp-ms分析条件 如上所述。hplc的条件为:流动相【a液(10mmol/l的醋酸铵,0.12%的 l-半胱氨酸水溶液,ph7.5)和b液(甲醇)按92:8比例混合】,色谱柱为 zorbax eclipse plus c-18 150mmx4.6mm(内径为5μm),以流速为1ml/min 进行等度洗脱。为了检测上清中甲基汞和二价汞,用流动相将上清液稀释10 倍,经0.22μm滤膜过滤后进行hplc-icp-ms分析。
[0068]
为了检测菌丝体中甲基汞和二价汞,首先将菌丝体在5ml菌丝浓盐酸 (6m)处理过夜,用常温超声水浴处理60min后,加入超纯水定容为50ml, 混匀后进行hplc-icp-ms分析。
[0069]
结果如表1所示,用6种绿僵菌菌丝分别处理含甲基汞(50μg/l)的sdy 培养液48h后,在3种绿僵菌(罗伯茨绿僵菌,贵州绿僵菌,褐色绿僵菌) 培养物的上清液中没有检测到甲基汞,在蝗绿僵菌,金龟子绿僵菌和大孢绿 僵菌的培养物的上清液只检测到痕量的甲基汞。在贵州绿僵菌和褐色绿僵菌 培养物的菌丝体中没有检测到甲基汞,在4种绿僵菌(罗伯茨绿僵菌,金龟 子绿僵菌,大孢绿僵菌,蝗绿僵菌)培养物的菌丝中能检测到痕量的甲基汞。 (表1a)。在罗伯茨绿僵菌的上清液中检测痕量的二价汞,6种真菌的总汞 含量与未接种真菌的阴性对照类似(表1)。在6种绿僵菌培养物的上清和菌 丝体中均能检测到一定量的二价汞,其中罗伯茨绿僵菌产生的二价汞含量最 高,而金龟子绿僵菌产生的二价汞含量最低(表1)。
[0070]
用非绿僵菌属真菌分别处理含甲基汞(50μg/l)的sdy培养液48h后, 在cadophora malorum煤油霉菌(amorphotheca resinae)培养物的上清液中只 检测到了痕量的甲基汞,并且检测到了二价汞的产生。而在尖孢镰刀菌 nrrl32931和rae3的上清培养物中仍有17.5%和29.6%的甲基汞残留,但 两者都具备降解甲基汞能力(表1)。而白僵菌和酵母则没有降解甲基汞的能 力(表1)。
[0071]
表1绿僵菌属6种真菌和三株非绿僵菌属真菌以及不含mmd同源基因的白 僵菌和酵母去甲基汞甲基能力分析
[0072][0073]
菌丝处理含二价汞:将上述制备的菌丝(0.2g湿重)分别转接至20ml 含有10mg/l二价汞的sdy液体培养基中(在体积为50ml的三角瓶中),均 匀分散后在处理培养48h(26℃,100rmp),真空抽滤分别收集上清和菌丝。 后续处理检测步骤与菌丝处理甲基汞步骤相同。
[0074]
结果如表2所示,用6种绿僵菌菌丝分别处理含二价汞(10mg/l)的sdy 培养液48h后,6种绿僵菌培养物的上清中二价汞含量相对于未接种对照都 下降了将近60%,6种绿僵菌去上清中二价汞的能力并没有显著差异。在褐 色绿僵菌和金龟子绿僵菌培养物的菌丝中检测到二价汞的含量显著低于其 他4种绿僵菌,6种真菌的总汞含量与未接种真菌的阴性对照类似(表2)。
[0075]
用非绿僵菌属真菌分别处理含二价汞(10mg/l)的sdy培养液48h后, 非绿僵菌属的三株真菌培养物的上清中的二价汞含量相对于未接种对照都 有不同程度的下降,不同种的真菌清除二价汞的能力存在显著差异,其中煤 油霉菌(amorphotheca resinae)清除水体中60%的二价汞,尖孢镰刀菌 (fusarium oxysporum)和cadophora malorum清除水体中50%左右的二价 汞。三者的总汞含量无明显差异(表2)。
[0076]
表2为绿僵菌属6种真菌和非绿僵菌3种真菌去二价汞能力分析
[0077][0078]
实施例2绿僵菌属真菌和3种非绿僵菌属真菌菌丝体消除淡水和海水 甲基汞和二价汞污染
[0079]
实验过程:以罗伯茨绿僵菌为绿僵菌属的代表。对于上述8种非绿僵菌 属真菌,选取了尖孢镰刀菌(fusarium oxysporum),cadophora malorum和 煤油霉菌(amorphotheca resinae)为代表,前两种真菌含有与罗伯茨绿僵菌 mmd相似性最高的同源基因,而煤油霉菌(amorphotheca resinae)中含有 与mmd相似性最低的同源基因。将上述在sdy培养基中培养获得菌丝处 理不含营养物质的淡水(自来水)和海水(在自来水中加入2.24%的海盐redsea fish pharm ltd.)中甲基汞。
[0080]
将上述制备的菌丝(0.2g湿重)转接至20ml含有0.05mg/l、0.5mg/l、 1mg/l、2mg/l、5mg/l甲基汞的淡水或海水中,在26℃,轻微振荡(100rpm), 处理48h后,按上述方法分析水体中的甲基汞含量。
[0081]
结果如表3所示,培养48h后,在甲基汞浓度为0.05mg/l、0.5mg/l、1mg/l 的自来水中甲基汞的基本清除完毕。在2mg/l和5mg/l的甲基汞的自来水中, 水体中的甲基汞还有12%和50%的甲基汞的残留(表4),总汞含量与未接 种的没有显著差异。类似地,处理48h后,在甲基汞浓度为0.05mg/l的海水 中甲基汞清除完毕,在甲基汞浓度为0.5mg/l、1mg/l的海水中也基本清除完 毕,只能检测到痕量的甲基汞。当甲基汞浓度提升至2mg/l和5mg/l后,菌 丝处理48h后,海水中还残留20%和32%的甲基汞(表3)。
[0082]
将上述制备的菌丝(0.2g湿重)转接至20ml含有10mg/l二价汞的自来 水或海水中,在26℃,轻微振荡(100rpm),处理48h后,按上述方法分析 水体中的二价汞的含量。
[0083]
结果如表4所示,培养48h后,在二价汞浓度为0.5mg/l的自来水或海 水中的二价汞基本清除完毕;在二价汞浓度为1mg/l的自来水或海水中的二 价汞被清除70%以上;而当二价汞浓度提升至5mg/l和10mg/l后,真菌菌丝 能清除水体中50%的二价汞。
[0084]
结果如表5所示,三株非绿僵菌属真菌均具有清除淡水或海水中甲基汞 和二价汞的能力。
[0085]
表3罗伯茨绿僵菌清除淡水或海水中甲基汞的能力分析
[0086][0087]
表4表示罗伯茨绿僵菌清除淡水或海水中二价汞的能力分析
[0088][0089]
表5表示非绿僵菌属真菌清除淡水或海水中甲基汞和二价汞的能力分析
[0090][0091][0092]
实施例3通过菌丝体填充柱处理清除自来水和海水中的甲基汞
[0093]
将上述在sdy培养基中培养获得的菌丝填充进一个直径为3cm的玻璃 柱(图1),构建成一个以菌丝为基质的过滤器。将含有100μg/l甲基汞或 10g/ml hg
2+
的自来水加入基质上方,使之穿过菌丝基质,流速为0.1ml/min。
[0094]
结果如图2所示,一次过滤后,水中甲基汞含量下降了20%,二次过滤 甲基汞的含量降低了20倍,基本清理干净,第三次过滤并没有进一步降低 甲基汞含量。对于二价汞,一次过滤将水中二价汞降低了60%,二次过滤进 一步下降,达到67%,三次过滤将二价汞含量降低了80%。
[0095]
实施例4通过植物种植和释放罗伯茨孢子消除土壤中的甲基汞和二价 汞
[0096]
用含有甲基汞的土壤种植玉米,并在玉米根部加入绿僵菌的孢子悬液, 培养10d或20d后取样检测根际土壤以及植物体内汞形态和总汞含量。
[0097]
1)玉米甲基汞和二价汞耐受性分析
[0098]
在土壤添加甲基汞,设置0、2.5、5、7.5和10μg/kg五个浓度。对于二 价汞,设置0、20、30、40和50mg/kg五个浓度。将土装入到培养器皿(高 度为14cm,直径为7cm)。
[0099]
种子消毒及培养:将玉米种子在1%的次氯酸钠中消毒5min,无菌水清 洗三遍,每次1min。然后用15%的h2o2消毒10min,同样用无菌水清洗三 遍,每次1min。消毒完成后放置于2%的水琼脂培养基,并于4℃春化过夜。 然后,将预处理好的种子接种到土中,每个器皿中接种10粒象草种子或5 粒玉米种子。
[0100]
在含2.5μg/kg甲基汞的土壤中,玉米的萌发率仍然为100%,而浓度为 10μg/kg时,萌发率为80%。用玉米和绿僵菌治理甲基汞时,浓度定为 10μg/kg。
[0101]
在含20mg/kg二价汞的土壤中,玉米种子的萌发率为100%,而浓度为 30mg/kg时,玉米的萌发率为80%;在40mg/kg时,萌发率只有60%。在下 一步实验中,用玉米和绿僵菌治理二价汞时,浓度定为20mg/kg。
[0102]
玉米和绿僵菌治理土壤甲基汞和二价汞
[0103]
在土壤中分别添加10μg/kg的甲基汞和20mg/kg的二价汞,并将提前一 天消毒好的玉米种子种植进含有甲基汞或二价汞的土壤中。培养条件为 25℃,16h光照,8h黑暗。培养4天后,加入10ml浓度为1
×
105个/ml的绿 僵菌孢子悬液(孢子总数为1
×
106个)。共培养10天后,分别收集植物样品 和土壤样品。土壤样品分别为植物根部根际土和非根际土,植物样品分为地 上部分-幼苗和地下部分-根。将土壤样品和植物样品分别冻干后,加入5ml 的盐酸(6m)进行消解,消解过夜后常温条件下超声提取。提取获得的样 品加水至50ml,样品经0.22μm滤膜过滤后,进行hplc-icp-ms检测。总 汞的检测方法为样品加入5ml硝酸(6m)在110℃消解1h后,加水至50ml, 经0.22μm滤膜过滤后,进行icp-ms检测。
[0104]
结果如表5和表6所示,绿僵菌促进植物抗甲基汞和二价汞,减少了植 物体内甲基汞和二价汞累积,并且有效清除了土壤内部的甲基汞和二价汞的 含量。绿僵菌分别降低了土壤内部30%和25%的甲基汞和二价汞,并且降低 了植物内部61%的甲基汞和77%的二价汞。
[0105]
检测了植物的生理指标,分别测量了幼苗和根部的湿重及干重以及植物 接种孢子悬液后每天的生长速率,结果显示接种了绿僵菌孢子后,植物生长 速率显著快于未接种植物(图4)。在含有甲基汞的土壤中,接种wt的植 物幼苗和根的鲜重显著高于未接种植物;在含有二价汞的土壤中,接种wt 的植物幼苗和根的干重显著高于未接种植物(图5)。
[0106]
表5土壤中和植物内部的甲基汞和总汞含量
[0107][0108]
表6土壤中和植物内部的二价汞和总汞含量
[0109][0110]
实施例5甲基汞去甲基酶mmd和二价汞还原酶mir的功能研究
[0111]
1)突变体菌株的构建。
[0112]
为了研究mmd和mir的功能,本发明基于同源重组和酶切连接的方 式构建了它们编码基因的敲除突变体δmmd和δmir,以及它们的双基因敲除 突变体δmmd::δmir。并构建了突变体δmmd和δmir各自的回补菌株c-δmmd 和c-δmir。用于构建敲除基因所用质粒的引物见表7。
[0113]
构建mmd和mir单基因敲除突变体所用载体分别为ppk2-bar-gfp-mm d和ppk2-bar-gfp-mir,抗性基因为除草剂抗性基因bar。mmd单基因敲除 载体通过同源重组构建,方法按参考文献进行(xu c,zhang x,qian y,e t al.a high-throughput gene disruption methodology for the entomopathoge nic fungus metarhizium robertsii.plos one.2014;9(9):e107657.published2014 sep 15.doi:10.1371/journal.pone.0107657)。mir单基因敲除载体通过 酶切连接构建,载体和5’同源臂片段分别用xbai和ecori酶切连接后,再 用drai分别酶切载体和3’同源臂并进行连接。
[0114]
构建mmd和mir双敲突变体(δmmd::δmir)的方法是在mmd基因单 敲除突变体δmmd中进一步敲除mir基因。为此,构建抗性基因ntc的mir 基因敲除载体ppk2-ntc-gfp-mir,所有转化子筛选剂为诺尔斯菌素 (nourseothricin)(zhang q,chen x,xu c,et al.horizontal gene transferallowed the emergence of broad host range entomopathogens.proc natl acad sciusa.2019;116(16):7982-7989.doi:10.1073/pnas.1816430116)。载体构建方法 与mir单基因敲除载体相同。
[0115]
构建回补菌株c-δmmd和c-δmir所用质粒分别为pfbengfp-gmmd和 pfbengfp-gmir,抗性基因均为苯菌灵抗性基因(fang w,pei y,bidochka mj. transformation of metarhizium anisopliae mediated by agrobacterium tumefaciens.can j microbiol.2006;52(7):623-626.doi:10.1139/w06-014)。根癌 农杆菌介导的真菌遗传转化按参考文献进行(xu c,zhang x,qiany,et al.ahigh-throughput gene disruption methodology for the entomopathogenic fungusmetarhizium robertsii.plos one.2014;9(9):e107657.published 2014 sep 15. doi:10.1371/journal.pone.0107657)。各个突变体和回补菌株的验证如图8所 示。
[0116]
表7基因敲除、回补及验证所用引物
[0117][0118]
2)菌株甲基汞和二价汞耐受力分析
[0119]
在1/2sdy液体培养基中,突变体菌株δmmd,δmir和δmmd::δmir, 与回报菌株c-δmmd和c-δmir,野生型菌株wt的孢子萌发速度没有差异 (图6中a)。
[0120]
在含0.1μg/ml甲基汞的1/2sdy液体培养基中,培养12h后,δmmd和 δmmd::δmir的孢子均未萌发,而菌株wt,δmir,c-δmmd和c-δmir孢子 萌发率为20%左右。培养36h时,菌株wt,δmir,c-δmmd和c-δmir的 孢子基本全部萌发,而此时δmmd和δmmd::δmir只有20%左右的孢子萌发 (图6中b)。
[0121]
在含0.2μg/ml甲基汞的1/2sdy液体培养基中,δmmd和δmmd::δmir 的孢子不能萌发,而培养48h后,菌株wt,δmir,c-δmmd和c-δmir的 孢子萌发率为40%左右(图6中c)。
[0122]
在含15μg/ml二价汞的1/2sdy液体培养基中,培养12h时,δmmd,δmir, δmmd::δmir的孢子基本没有萌发,wt的萌发率(15%)与c-δmmd和c-δmir 没有显著差异。培养24h时,δmmd::δmir仍然没有萌发,δmmd和δmir的 萌发率在25%左右,比wt,c-δmmd和c-δmir菌株显著降低(40%)。培 养48h时,δmmd::δmir的萌发率为10%,比δmmd和δmir显著降低(~50%), 而δmmd和δmir的萌发率有显著比wt,c-δmmd和c-δmir菌株低(~70%) (图6中e)。
[0123]
在含20μg/ml二价汞的1/2sdy液体培养基中,突变体δmmd::δmir, δmmd和δmir均不能萌发,而培养40h后,wt,c-δmmd和c-δmir的萌 发率为10%左右,60h时萌发上
升到~25%(图6中f)。
[0124]
进一步观察了菌丝体对甲基汞的耐受力。检测的基本过程为,将100μl 的孢子悬液(107孢子/ml)均匀地铺在直径为9cm的pda平板上,在26℃ 培养3天后,用直接为5mm的打孔器取含培养基的菌丝体饼,接种到含甲 基汞或二价汞的pda平板上继续培养,每天测量菌落直径。
[0125]
在普通的pda培养基上,突变体菌株δmmd,δmir和δmmd::δmir,与 回报菌株c-δmmd和c-δmir,野生型菌株wt的菌落生长没有差异(图6)。
[0126]
在含1μg/ml甲基汞的pda培养基上,与wt相比,δmmd和δmmd::δmir 的菌落生长明显受到抑制,而菌株δmir,c-δmmd和c-δmir与wt没有差 异(图7)。
[0127]
在含2μg/ml甲基汞的pda培养基上,δmmd和δmmd::δmir的菌落不 能生长,菌株δmir,c-δmmd和c-δmir与wt的菌落生长没有差异(图7)。
[0128]
在含12μg/ml二价汞的pda培养基上,δmmd,δmir和δmmd::δmir菌 落生长与wt没有差异(图8)。
[0129]
在含16μg/ml二价汞的pda培养基上,δmmd,δmir和δmmd::δmir菌 落产孢相对于wt有一定减少,c-δmmd和c-δmir与wt的菌落生长没有 差异(图8)。
[0130]
在含30μg/ml二价汞的pda培养基上,δmir和δmmd::δmir菌落无法 生长,菌株δmmd和c-δmmd与wt菌落生长没有差异。c-δmir菌落生长 比wt更快(图8)。
[0131]
3)菌株清除环境中甲基汞和二价汞能力分析
[0132]
分析了wt菌株,突变体δmmd,δmir和δmmd::δmir,与回补菌株 c-δmmd和c-δmir菌丝体消除sdy培养基中甲基汞和二价汞的能力。菌丝 体准备,接种,以及培养物上清液和菌丝体中甲基汞,二价汞和总汞的含量 分析如上所述。
[0133]
将菌丝体(0.2g湿重)接种到20ml含甲基汞(0.05μg/ml)的sdy培养 基中,处理48h后,在wt菌株培养物的上清液中未能检测到甲基汞,在菌 株δmir,c-δmmd和c-δmir也只检测到痕量的甲基汞,而在突变体δmmd 和δmmd::δmir的上清液中检测到大量的甲基汞(仍有30-40%左右甲基汞残 留)(表8)。在突变体δmmd和δmmd::δmir的上清液中没有检测到二价汞; 而在菌株wt,δmir,c-δmmd和c-δmir的上清液中均检测到二价汞,且δmir 的二价汞比另外三个菌株高。在所有菌株的菌丝体中均检测到甲基汞,突变 体δmmd和δmmd::δmir菌丝体甲基汞含量没有差异,但是比菌株wt,δmir, c-δmmd和c-δmir显著高,而后4个菌株之间没有显著差异。在δmmd和 δmmd::δmir菌丝体中不含二价汞。菌株wt,δmir,c-δmmd和c-δmir的 菌丝体均含有二价汞,其中δmir含量最高,其它三者菌株之间没有显著差 异(表8)。
[0134]
将菌丝体(0.2g湿重)接种到20ml含二价汞(10mg/ml)的sdy培养 基中,处理48h后,δmir和δmmd::δmir菌株培养物上清液中二价汞含量没 有差异,但是均显著比菌株wt,δmmd,c-δmmd和c-δmir高,δmmd也 显著高于wt,c-δmmd和c-δmir,后三个菌株之间也没有显著差异。所有 菌株的菌丝体中均含有二价汞,除了两株回补菌株c-δmmd和c-δmir相对 其他菌株较少外,其他菌株之间没有显著差异(表9)。
[0135]
表8 sdy中上清和菌丝中的甲基汞和总汞含量
[0136][0137]
表9 sdy中上清和菌丝的二价汞含量和总汞含量
[0138][0139]
实施例6 mmd蛋白表达、纯化和活性分析
[0140]
1)在大肠杆菌bl21菌株表达并纯化mmd蛋白
[0141]
mmd的原核表达载体构建的过程如下:(1)pcr扩增mmd的编码序 列,所用引物见表1。(2)扩增产物和载体pet-28a-sumo均用ecor i和bamhi酶切,回收酶切产物后进行连接,并转入e.coli dh5α菌株。对阳性克隆进 行测序验证,得到载体pet-28a-sumo-mmd。(3)制备载体 pet-28a-sumo-mmd的dna并转入e.coli菌株bl21进行原核表达。
[0142]
原核表达条件为:将含载体pet-28a-sumo-mmd的e.coli菌株bl21接 种于lb液体培养基中(含卡那霉素),于37℃,以220rpm转速振荡培养菌 液od
600
为0.6~1.0。然后添加iptg(0.8mm),于18℃培养12~16h诱导表 达mmd。
[0143]
蛋白纯化步骤如下。(1)诱导蛋白表达完毕后,于4℃,4500rpm离心25min收集细胞,并用ph 7.0的lysis buffer重悬菌体细胞后,超声破碎细胞 (70khz,25min)。于4℃,12000rpm离心50min,收集上清液,并用镍柱 亲和层析法初步分离纯化融合蛋白sumo::mmd。层析柱填料为 hispurtmni-nta resin。用洗柱液(ph7.0)冲去杂蛋白后,用elution buffer (ph7.0)将柱子上的融合蛋白sumo::mmd冲洗下来。(2)用蛋白酶 ulp1切除融合蛋白sumo::mmd上的sumo标签。(3)再次通过镍柱亲 和层析法将ulp和sumo蛋白与mmd蛋白分离,得到mmd纯蛋白。(3) 用amino ultra-15(10kda)超滤管离心浓缩上述得到了mmd纯蛋白,并 清除蛋白纯化过程遗留在溶液中的咪唑。在所得蛋白溶液中加入甘油至终浓 度为10%,并于-80℃保存。
[0144]
2)mmd去甲基汞甲基活性检测
[0145]
(1)活性测定。反应体系:50mm磷酸钠缓冲液(ph 7.4),5mm edta, 0.2mm醋酸镁,0.5mm l-cysteine,0.5mg/ml牛血清蛋白(bsa),浓度梯 度甲基汞(0.5,1,2,4,8μm)和5μgmmd蛋白,总体积为200μl。于37℃保温 1h后,用hplc-icp-ms检测产生反应液中甲基汞和
二价汞含量。
[0146]
结果:hplc-icp-ms检测到在酶促反应体系中有二价汞的产生,确认 mmd具有降解甲基汞的活性,结果如图9所示。
[0147]
(2)vmax和km分析。为了检测mmd酶的vmax和km值,上述反 应体系中除了蛋白和甲基汞有变化之外,其它条件均不变。甲基汞浓度和蛋 白浓度的设置如表2所示。结果如图9所示。
[0148]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普 通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润 饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1