一株具有共聚幽门螺杆菌能力的嗜酸乳杆菌及其应用
1.本发明涉及一株具有共聚幽门螺杆菌能力的嗜酸乳杆菌及其应用,属于微生物技术领域以及医药技术领域。
背景技术:
2.幽门螺杆菌(helicobacter pylori,hp)是一种呈s型或者弧形弯曲的革兰氏阴性细菌,具有较强的耐酸能力,可以定殖在人体的胃粘膜表面和十二指肠部位。1994年,幽门螺杆菌被世界卫生组织定为i类致癌原。幽门螺杆菌能在人体中长期存活,是现阶段全球最主要的流行性致病菌之一,幽门阳性在全球的检出率已经超过50%。幽门螺杆菌的感染率随着年龄的增加而上升,并与社会经济卫生状况和种族等因素有关。
3.幽门螺杆菌感染是一个长期且慢性的过程,感染后人体一般难以自发清除,除非进行根除治疗或人体胃黏膜发生严重肠化生时,幽门螺杆菌才会在人体自动消失。研究表明幽门螺杆菌在胃部的定殖量直接影响胃病的发展进程,一般情况下,患者体内幽门螺杆菌密度越高,其导致胃病的可能性及程度越高。因此,降低幽门螺杆菌在患者体内的载量对预防和/或治疗幽门螺杆菌感染引起的胃部病变具有重要意义。
4.目前,maastricht-5共识及京都共识并中国2016年第五次全国幽门螺杆菌感染处理共识均推荐铋剂四联(ppi+铋剂+2种抗菌药物)作为主要的经验治疗根除hp方案。除此之外,某些化学组合物和中药成分对治疗幽门螺杆菌感染也具有相应的有益效果。
5.例如,公开号为专利文献cn111184867a的中国发明专利申请文件中公开发明了一种口服治疗成人幽门螺杆菌感染的化学药物组合物,组合物中至少包含成人常用剂量的磷霉素或其可药用盐、磷霉素氨丁三醇及一种氨基糖苷类药物。但是由于组合物由化学药物组成,对人体健康有相应不可消除的副作用。
6.又如,公开号为专利文献cn112641891a公开了一种治疗幽门螺杆菌的大蒜素制剂,该大蒜素制剂的成分包括大蒜素、黄连、丁香叶、薄荷叶、蒲公英、黄芩、麦芽、甘草、茯苓、益生菌粉、党参和山药,该大蒜素制剂对幽门螺杆菌具有较高敏感度,可以有效地抑制幽门螺杆菌的繁殖,维护胃肠道菌群平衡。但是该专利制剂成分较多,且制作原理复杂,成本较高。
7.自动聚集和协同共聚集是乳杆菌常见的生物学特性,也是发挥益生作用的重要途径。乳杆菌与宿主原生菌或致病菌的共聚是实现致病菌控制或减少的重要策略。例如,公开号为cn102690768b的中国发明专利中公开发明了一株分离自口腔的短乳杆菌(lactobacillus brevis)bbe-y52,这株短乳杆菌能够产生胞外多糖,在口腔环境中促进乳酸菌与其他微生物共聚集形成生物膜,从而抵制病原菌的定殖。另一方面,专利文献公开号为cn112662791a中国发明专利申请文件中公开了具有降胆固醇功能的屎肠球菌132和副干酪乳杆菌201对6种食源性致病菌防控的应用潜力,其中副干酪乳杆菌201与致病菌的共聚作用较强,其对大肠杆菌、鼠伤寒沙门氏菌、阪崎克罗诺杆菌、金黄色葡萄球菌、单增李斯特氏菌和蜡样芽孢杆菌的共聚抑制率达20%-40%。
8.乳杆菌与植物提取物的复配也是开发抑菌药物的常见思路,益生菌具有抑制幽门螺旋杆菌的能力,各添加的组分有助于益生菌的定殖和改善胃部环境,因此能有效根除幽门螺旋杆菌,如专利文献cn111632084a提供了一种抑制幽门螺旋杆菌的复合益生菌组合物及其应用,所述复合益生菌组合物包含罗伊氏乳杆菌、约氏乳杆菌、低聚果糖、抗性糊精、低聚半乳糖、甘草提取物、草莓提取物和麦芽糊精。
9.罗伊氏乳杆菌dsm17648(pylopasstm)是目前最广泛被使用的具有共聚集幽门螺杆菌的益生菌,临床试验表明灭活状态下的菌粉仍然可以降低患者体内的幽门螺杆菌的载量。紧接着专利文献cn103648511a公开发明了一种改进dsm17648与幽门螺杆菌共聚体形成的方法,使其共聚效果更优。
10.因此,我们可以利用乳杆菌识别幽门螺旋杆菌,附着在其表面,形成共聚合细菌体。共聚合细菌体最后被排泄掉,促使幽门螺杆菌在胃里的繁殖减少。因此可以显著抑制幽门螺旋杆菌活性,具有调节胃酸能力,帮助杀灭hp,有效的胃部定植能力和优异的耐胃酸胆盐特性,肠胃通过率高。而这种共聚反应能显著改善慢性胃炎、胃肠溃疡引起的胃痛、胃酸、胃胀等现象,是恢复慢性胃炎和胃肠溃疡的关键环节。
11.因此,得到一种能够有效的与幽门螺旋杆菌形成共聚合细菌体的乳杆菌,成为研究的重点和难点。
技术实现要素:
12.本发明提供了一株嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208,所述嗜酸乳杆菌ccfm1208保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:62012,保藏日期为2021年10月27日。
13.所述嗜酸乳杆菌ccfm1208来源于健康人群新鲜粪便样品,该菌株经测序分析,其16s rdna序列如seq id no.1所示,将测序得到的序列在genebank中进行核酸序列比对,与乳杆菌属的同源度为:97.92%;结果显示菌株为嗜酸乳杆菌,命名为嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208。
14.所述嗜酸乳杆菌ccfm1208在mrs固体培养基上的菌落呈白色透明、圆形或略不规则、凸起、表面粗糙。
15.本发明还提供了一种含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208的微生物制剂。
16.在本发明的一种实施方式中,所述微生物制剂中,嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208的含量至少为5
×
109cfu/ml或5
×
109cfu/g。
17.本发明还提供了上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208在制备预防和/或治疗幽门螺杆菌感染的产品中的应用,所述应用不以疾病的诊断和治疗为目的。
18.在本发明的一种实施方式中,所述产品为食品、药品或保健品。
19.在本发明的一种实施方式中,所述产品中,嗜酸乳杆菌的含量至少为5
×
109cfu/ml或5
×
109cfu/g。
20.本发明的一种实施方式中,所述药品含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208、药物载体和/或药用辅料。
21.本发明的一种实施方式中,所述药物载体包含微囊、微球、纳米粒和/或脂质体。
22.本发明的一种实施方式中,所述药用辅料包含赋形剂和/或附加剂。
23.本发明的一种实施方式中,所述赋形剂包含黏合剂、填充剂、崩解剂和/或润滑剂。
24.本发明的一种实施方式中,所述附加剂包含增溶剂、助溶剂、潜溶剂和/或防腐剂。
25.本发明的一种实施方式中,所述药品的剂型为粉剂、颗粒剂、胶囊剂、片剂、丸剂或口服液。
26.本发明的一种实施方式中,所述食品为保健食品;或所述食品为使用含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208的发酵剂生产得到的乳制品、豆制品或果蔬制品;或所述食品为含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208的饮料或零食。
27.本发明的一种实施方式中,所述发酵剂的制备方法为将上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208按照占培养基总质量2~4%的接种量接种到培养基中,于37℃下培养18h,得到培养液;将培养液离心,得到菌体;将菌体用生理盐水清洗3次后用冻干保护剂重悬,得到重悬液;将重悬液采用真空冷冻法进行冻干,得到发酵剂。
28.本发明的一种实施方式中,所述冻干保护剂和菌体的质量比为2:1。
29.本发明的一种实施方式中,所述冻干保护剂包含130g/l的脱脂奶粉。
30.本发明的一种实施方式中,所述培养基包含占培养基总质量87.7%的水、占培养基总质量10%的脱脂乳、占培养基总质量0.5%的葡萄糖、占培养基总质量1.5%的胰蛋白胨以及占培养基总质量0.3%的酵母浸膏。
31.本发明的一种实施方式中,所述培养基的ph为6.8。
32.本发明还提供了一种产品,所述产品中上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208。
33.在本发明的一种实施方式中,所述产品为食品、药品或保健品。
34.在本发明的一种实施方式中,所述产品中,嗜酸乳杆菌的含量至少为5
×
109cfu/ml或5
×
109cfu/g。
35.本发明的一种实施方式中,所述药品含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208、药物载体和/或药用辅料。
36.本发明的一种实施方式中,所述药物载体包含微囊、微球、纳米粒和/或脂质体。
37.本发明的一种实施方式中,所述药用辅料包含赋形剂和/或附加剂。
38.本发明的一种实施方式中,所述赋形剂包含黏合剂、填充剂、崩解剂和/或润滑剂。
39.本发明的一种实施方式中,所述附加剂包含增溶剂、助溶剂、潜溶剂和/或防腐剂。
40.本发明的一种实施方式中,所述药品的剂型为粉剂、颗粒剂、胶囊剂、片剂、丸剂或口服液。
41.本发明的一种实施方式中,所述食品为保健食品;或所述食品为使用含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208的发酵剂生产得到的乳制品、豆制品或果蔬制品;或所述食品为含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208的饮料或零食。
42.本发明的一种实施方式中,所述发酵剂的制备方法为将上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208按照占培养基总质量2~4%的接种量接种到培养基中,于37℃下培养18h,得到培养液;将培养液离心,得到菌体;将菌体用生理盐水清洗3次
后用冻干保护剂重悬,得到重悬液;将重悬液采用真空冷冻法进行冻干,得到发酵剂。
43.本发明的一种实施方式中,所述冻干保护剂和菌体的质量比为2:1。
44.在本发明的一种实施方式中,所述冻干保护剂包含130g/l的脱脂奶粉。
45.本发明的一种实施方式中,所述培养基包含占培养基总质量87.7%的水、占培养基总质量10%的脱脂乳、占培养基总质量0.5%的葡萄糖、占培养基总质量1.5%的胰蛋白胨以及占培养基总质量0.3%的酵母浸膏。
46.本发明的一种实施方式中,所述培养基的ph为6.8。
47.本发明还提供了上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208在共聚集幽门螺杆菌方面不以疾病的诊断和治疗为目的的应用。
48.本发明还提供了一种降低幽门螺杆菌载量的抑制剂,所述幽门螺杆菌抑制剂含有上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208。
49.本发明的一种实施方式中,所述抑制剂中,上述嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208的活菌数为不低于5
×
109cfu/ml或5
×
109cfu/g。
50.有益效果
51.1、本发明提供了一株嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208,此嗜酸乳杆菌ccfm1208能够特异性地结合胃部已存在的游离的幽门螺杆菌,阻止其继续生长形成定殖在胃部的致病菌生物膜。具体体现在:
52.嗜酸乳杆菌ccfm1208具有共聚集致病菌幽门螺杆菌的能力,120分钟共聚率可达48.98%,形成肉眼可见的絮状共聚体。
53.由此可见,嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208在降低幽门阳性患者体内幽门螺杆菌载量(不以疾病的诊断和治疗为目的)以及制备幽门螺杆菌特异性结合拮抗剂方面具有巨大的应用前景。
54.2、本发明提供了一株嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208,此嗜酸乳杆菌ccfm1208具有预防和/或治疗幽门螺杆菌感染的作用,具体体现在:
55.通过体外模拟人胃液环境进行共聚集试验,嗜酸乳杆菌ccfm1208具有较强的耐酸性,可以有效地聚集幽门螺杆菌,在短时间内达到较高共聚率、形成絮状的共聚体;
56.同时,不同孵育转速试验测试共聚集作用的稳定性,该试验证明嗜酸乳杆菌ccfm1208能够在0-150r/min的孵育转速下发挥较好的共聚幽门的作用,这表明共聚集作用可以克服人在进食、消化等生理过程中形成的剪切力。
57.由此可见,嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208在制备预防和/或治疗幽门螺杆菌感染的产品(如食品或药品等)中具有巨大的应用前景。
58.3、嗜酸乳杆菌(lactobacillus acidophilus)是益生菌的一种,目前嗜酸乳杆菌已被纳入卫生部下发的《可用于食品的菌种名单》,可见,本发明的有效成分为嗜酸乳杆菌ccfm1208的产品不会使得幽门螺杆菌产生耐药性,同时,在治疗过程中不会导致患者产生不良反应。
59.生物材料保藏
60.一株嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208,分类学命名为lactobacillus acidophilus,已于2021年10月27日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:62012,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省科学
微生物研究所。
附图说明
61.图1:乳杆菌与幽门螺杆菌共聚作用的筛选。
62.图2:乳杆菌与幽门螺杆菌共聚作用的种间差异。
63.图3:嗜酸乳杆菌与幽门螺杆菌共聚作用株间差异。
64.图4:嗜酸乳杆菌与幽门共聚的时间曲线。
65.图5:嗜酸乳杆菌ccfm1208的生长曲线。
66.图6:嗜酸乳杆菌ccfm1208与幽门螺杆菌共聚的宏观视图。
67.图7:嗜酸乳杆菌ccfm1208与幽门螺杆菌共聚的扫描电镜;其中,(a)为微观的扫描电子显微镜下的幽门螺杆菌;(b)为微观的扫描电子显微镜下的嗜酸乳杆菌ccfm1208;(c)和(d)为微观的扫描电子显微镜下的幽门螺杆菌和嗜酸乳杆菌的聚集体。
68.图8:嗜酸乳杆菌ccfm1208的表层蛋白分析。
具体实施方式
69.下述实施例中涉及的幽门螺杆菌为来源于ntcc国家典型培养物保藏中心的幽门螺杆菌ss1;下述实施例中涉及的nacl购自国药集团;下述实施例中涉及的哥伦比亚培养基购自英国oxoid公司;下述实施例中涉及的无菌脱纤维绵羊血购自杭州新锐公司;下述实施例中涉及的bhi液体培养基购自青岛海博公司;下述实施例中涉及的胎牛血清购自南京森贝伽公司。
70.下述实施例中所涉及的39株乳杆菌及其来源分别为:
71.罗伊氏乳杆菌17648公开于专利wo2007073709a1中;
72.嗜酸乳杆菌s2又叫嗜酸乳杆菌ccfm 720,公开于已发表文献《产细菌素乳酸菌对小鼠肠道微生态的影响》中;
73.干酪乳杆菌gl1-gl13、罗伊氏乳杆菌lys1、lys3、lys4、lys5、鼠李糖乳杆菌slt3-slt6、嗜酸乳杆菌s1、s3、s6、s8和发酵乳杆菌fj1-fj12均来源于江南大学生物技术研究中心。
74.下述实施例中涉及的培养基如下:
75.mrs固体培养基(g/l):蛋白胨10g/l、牛肉膏10g/l、葡萄糖20g/l、乙酸钠2g/l、酵母粉5g/l、柠檬酸氢二铵2g/l、k2po4·
3h2o 2.6g/l、mgso4·
7h2o 0.1g/l、mnso
4 0.05g/l、吐温80 1ml/l、琼脂20g/l、半胱氨酸氨酸盐0.5g/l。
76.mrs液体培养基(g/l):蛋白胨10g/l、牛肉膏10g/l、葡萄糖20g/l、乙酸钠2g/l、酵母粉5g/l、柠檬酸氢二铵2g/l、k2po4·
3h2o 2.6g/l、mgso4·
7h2o 0.1g/l、mnso
4 0.05g/l、吐温80 1ml/l、半胱氨酸氨酸盐0.5g/l。
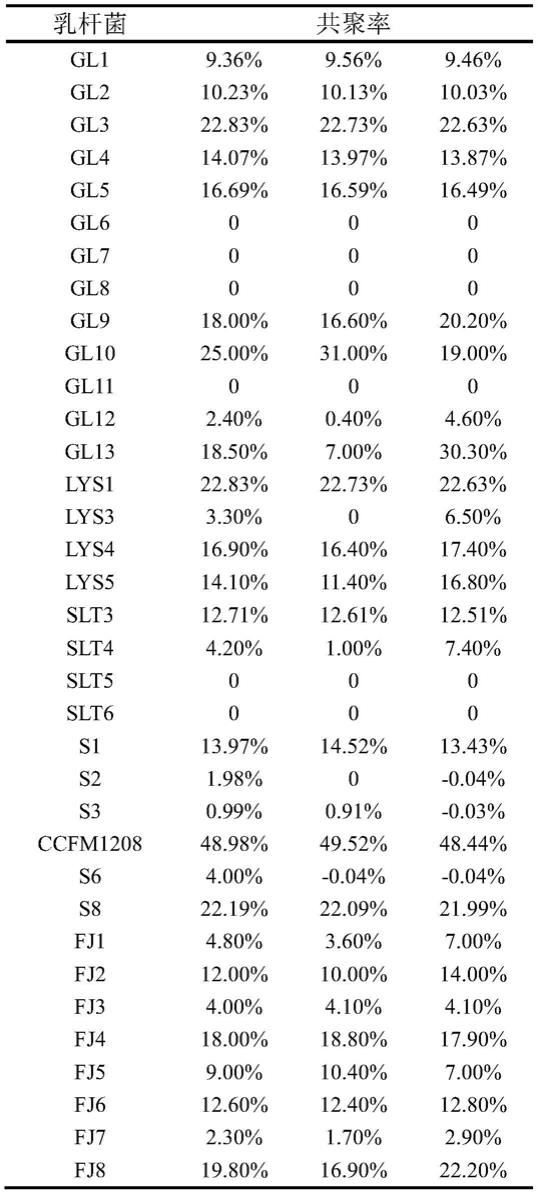
77.人工胃液(g/l):胃蛋白酶(猪胃蛋白酶)3g/l,氯化钠5g/l,调节ph值为4.0
±
0.2。
78.哥伦比亚血平板:39g哥伦比亚培养基固体粉末溶于1l水中,121℃灭菌15min,待冷却到55℃~60℃后加入7.5%(v/v)的无菌脱纤维绵羊血,混匀后倒板。
79.bhi液体培养基(g/l):胰蛋白胨10.0g/l、牛心浸粉17.5g/l、氯化钠5.0g/l、葡萄糖2.0g/l、磷酸氢二钠(12h2o)2.5g/l、ph值7.4
±
0.2。
80.下述实施例中涉及的检测方法如下:
81.活菌数的检测方法:采用国标《gb 4789.35-2016食品安全国家标准食品微生物学检测乳酸菌检测》。
82.共聚率的检测及计算方法:
83.分别测定乳杆菌、混合菌液反应前/后(0min/t min)的od值,根据以下公式计算共聚率:共聚率(%)=[(od
600乳杆
+od
600幽门
)-2
×
od
600混合t min
]/(od
600乳杆
+od
600幽门
)
×
100。(共聚率测定法具体可参见文献:chen x,tian f,liu x,et al.in vitro screening of lactobacilli with antagonistic activity against helicobacter pylori from traditionally fermented foods.[j].journal of dairy science,2010,93(12):5627-5634)。
[0084]
下述实施例中涉及的幽门螺杆菌菌体的制备方法如下:
[0085]
将幽门螺杆菌在哥伦比亚血平板上划线后,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养3天,得到单菌落;挑取单菌落接种于含5%(v/v)胎牛血清的bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天得到种子液;将种子液以2%(v/v)的接种量接种于bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天,得到幽门螺杆菌菌液;将幽门螺杆菌菌液8000g离心10min,得到幽门螺杆菌菌体;
[0086]
其中,哥伦比亚血平板:39g哥伦比亚培养基固体粉末溶于1l水中,121℃灭菌15min,待冷却到55℃~60℃后加入7.5%(v/v)的无菌脱纤维绵羊血,混匀后倒板。
[0087]
下述实施例中涉及的其他乳杆菌菌体的制备方法如下:
[0088]
将各乳杆菌划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到各乳杆菌菌体。
[0089]
下述实施例中涉及的嗜酸乳杆菌菌体的制备方法如下:
[0090]
将嗜酸乳杆菌划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到嗜酸乳杆菌菌体。
[0091]
实施例1:嗜酸乳杆菌的筛选及鉴定
[0092]
1、筛选
[0093]
以来源于健康人群新鲜粪便为样本,将样本经预处理后,在30%左右甘油中保存于-80℃冰箱,取出解冻后,混匀样本吸取0.5ml样本加到4.5ml 0.9%生理盐水进行梯度稀释,选择合适的梯度稀释液涂布在mrs固体培养基上,于37℃培养48h,挑取典型菌落至mrs平板上划线纯化,挑取单菌落转接至液体mrs液体培养基增菌,30%甘油保藏,得到菌株ccfm1208。
[0094]
2、鉴定
[0095]
提取ccfm1208的基因组,将ccfm1208的16s rdna进行扩增和测序(由上海美吉生物医药科技有限公司完成),经测序分析,该菌株的16s rdna序列如seq id no.1所示,将该序列在genbank中进行比对,与乳杆菌属的同源度为:97.92%;结果显示菌株为嗜酸乳杆
菌,命名为嗜酸乳杆菌(lactobacillus acidophilus)ccfm1208。
[0096]
将嗜酸乳杆菌ccfm1208接入mrs固体培养基中于37℃培养48h后,观察其菌落并在显微镜下对其菌体进行观察,发现其菌落呈白色透明、圆形或略不规则、凸起、表面粗糙。
[0097]
将嗜酸乳杆菌ccfm1208接入mrs液体培养基中分别于10~50℃下培养48h,培养过程中,间隔一段时间通过酶标仪测量培养液的od
600
,发现嗜酸乳杆菌ccfm1208在30~37℃生长最佳,培养14~24h达到生长稳定期,结果如图1所示。
[0098]
实施例2:与幽门螺杆菌具有共聚集作用乳杆菌的筛选
[0099]
具体步骤如下:
[0100]
(1)幽门螺旋杆菌的培养:
[0101]
将幽门螺杆菌在哥伦比亚血平板(哥伦比亚血平板:39g哥伦比亚培养基固体粉末溶于1l水中,121℃灭菌15min,待冷却到55℃~60℃后加入7.5%(v/v)的无菌脱纤维绵羊血,混匀后倒板)上划线后,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养3天,得到单菌落;
[0102]
挑取单菌落接种于含5%(v/v)胎牛血清的bhi液体培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天得到种子液;将种子液以2%(v/v)的接种量接种于bhi液体培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天,得到幽门螺杆菌菌液;将幽门螺杆菌菌液8000g离心10min,得到幽门螺杆菌菌体,用人工胃液(ph=4)调节菌溶液浓度为od
600
=0.5,得到幽门螺杆菌菌悬液。
[0103]
(2)将待测试的乳杆菌划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到乳杆菌菌体,用pbs(ph=7.42)调节菌溶液浓度为od
600
=0.5。
[0104]
分别将39株乳杆菌按照上述方法,制备得到菌悬液。
[0105]
(3)取调好菌浓度的幽门螺杆菌分别同39株乳杆菌菌悬液各2ml,等体积比混合,并充分震荡10s以混合均匀。室温26℃条件下,静置孵育120min。分别测定乳杆菌与幽门螺旋杆菌的混合菌液反应后(t min)的od值,并计算共聚率,结果如图2及表1所示。
[0106]
表1:不同乳杆菌与幽门螺旋杆菌的混合菌液反应后的共聚率
[0107][0108][0109]
结果显示,从五种乳杆菌(干酪、罗伊氏、鼠李糖、嗜酸和发酵乳杆菌)的39株菌株
中筛选具有与幽门螺杆菌交互凝集能力的益生菌,其中嗜酸乳杆菌ccfm1208对幽门螺杆菌表现出最强的共聚指标。进一步研究发现乳杆菌与幽门螺杆菌交互凝集的能力不具备明显的种间差异(图3),但株间差异较大(图4)。这恰好说明乳杆菌与幽门螺杆菌共聚集的特性具有显著的株间差异,因此嗜酸乳杆菌ccfm1208是一株不可多得的具有特异性黏附并聚集幽门螺杆菌的益生菌。
[0110]
实施例3:与幽门螺旋杆菌孵育时间对嗜酸乳杆菌与幽门螺杆菌共聚作用的影响
[0111]
具体步骤如下:
[0112]
(1)幽门螺旋杆菌的培养:
[0113]
将幽门螺杆菌在哥伦比亚血平板(哥伦比亚血平板:39g哥伦比亚培养基固体粉末溶于1l水中,121℃灭菌15min,待冷却到55℃~60℃后加入7.5%(v/v)的无菌脱纤维绵羊血,混匀后倒板)上划线后,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养3天,得到单菌落;挑取单菌落接种于含5%(v/v)胎牛血清的bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天得到种子液;
[0114]
将种子液以2%(v/v)的接种量接种于bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天,得到幽门螺杆菌菌液;将幽门螺杆菌菌液8000g离心10min,得到幽门螺杆菌菌体,用人工胃液(ph=4)调节菌溶液浓度为od
600
=0.5,得到幽门螺杆菌菌悬液。
[0115]
(2)嗜酸乳杆菌的培养
[0116]
分别将嗜酸乳杆菌ccfm1208、嗜酸乳杆菌s1、s2、s3、s6划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,分别得到活化液;分别将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到嗜酸乳杆菌菌体,用pbs(ph=7.42)调节菌溶液浓度为od
600
=0.5,分别制备得到嗜酸乳杆菌菌悬液。
[0117]
(3)分别取步骤(1)制备得到的调好菌浓度的幽门螺杆菌菌悬液,分别与步骤(2)制备得到的嗜酸乳杆菌菌悬液2ml(等体积比)进行充分震荡混合。
[0118]
在室温26℃条件下,静置孵育0min,4min,10min,30min,60min,90min,120min,150min,180min。分别测定乳杆菌、混合菌液反应后(t min)的od值及计算共聚率,结果如表2及图5所示。
[0119]
表2:不同孵育时间对乳杆菌同幽门螺杆菌共聚的影响
[0120][0121]
(注:混合前的幽门螺杆菌溶液od
600
=0.572;表中-代表共聚率计算为零或负值,
表示不共聚)
[0122]
结果显示,嗜酸乳杆菌s2、s3、s6在0~180min对幽门螺杆菌均未出现强共聚作用,而嗜酸乳杆菌ccfm1208与幽门螺杆菌的共聚,在第60min时混合液的od值开始下降,共聚率可达16%左右,并且随着时间的延长,混合液上清液的od值逐渐降低,共聚率最高可达48.98%。因此,表明嗜酸乳杆菌ccfm1208具有短时间内黏附并聚集幽门螺杆菌的能力。
[0123]
实施例4:孵育转速对嗜酸乳杆菌与幽门螺杆菌共聚作用的影响
[0124]
具体步骤如下:
[0125]
(1)幽门螺旋杆菌的培养:
[0126]
将幽门螺杆菌在哥伦比亚血平板(哥伦比亚血平板:39g哥伦比亚培养基固体粉末溶于1l水中,121℃灭菌15min,待冷却到55℃~60℃后加入7.5%(v/v)的无菌脱纤维绵羊血,混匀后倒板)上划线后,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养3天,得到单菌落;挑取单菌落接种于含5%(v/v)胎牛血清的bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天得到种子液;
[0127]
将种子液以2%(v/v)的接种量接种于bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天,得到幽门螺杆菌菌液;将幽门螺杆菌菌液8000g离心10min,得到幽门螺杆菌菌体,用人工胃液(ph=4)调节菌溶液浓度为od
600
=0.5,得到幽门螺杆菌菌悬液。
[0128]
(2)嗜酸乳杆菌的培养
[0129]
分别将嗜酸乳杆菌s1、s2、s3、ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到嗜酸乳杆菌菌体,用pbs(ph=7.42)调节菌溶液浓度为od600=0.5,得到嗜酸乳杆菌ccfm1208菌悬液。
[0130]
(3)取步骤(1)制备得到的调好菌浓度的幽门螺杆菌菌悬液与嗜酸乳杆菌ccfm1208菌悬液各2ml,进行充分震荡和混合。
[0131]
室温26℃,分别在静置0r/min、150r/min、300r/min条件下,孵育120min。分别测定乳杆菌、混合菌液反应前/后(0min/t min)的od值及计算共聚率,结果如表3所示:
[0132]
表3孵育转速对共聚集的影响
[0133][0134]
(注:表格中的ab表示每一行的显著性,abcd表示每一列的显著性,p《0.05)
[0135]
不同孵育转速试验测试不同剪切力对共凝集作用稳定性的影响,由上表显示,0~150r/min条件下,嗜酸乳杆菌ccfm1208对幽门螺杆菌的共聚率始终在40%以上,二者共聚率无显著差异,转速250r/min条件下共聚率最低。乳杆菌与幽门的共聚集能力对0~150r/
min的转速未表现出敏感性,人在进食和消化等生理过程中,胃部的蠕动会形成一定大小的剪切力和转速,该试验证明嗜酸乳杆菌与幽门螺杆菌发生共凝集作用具有稳定性,适用于口服益生菌等的开发。
[0136]
实施例5:嗜酸乳杆菌与幽门螺杆菌共聚集作用的电镜图
[0137]
具体步骤如下:
[0138]
(1)幽门螺旋杆菌的培养:
[0139]
将幽门螺杆菌在哥伦比亚血平板上划线后,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养3天,得到单菌落;挑取单菌落接种于含5%(v/v)胎牛血清的bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天得到种子液;
[0140]
将种子液以2%(v/v)的接种量接种于bhi液体培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天,得到幽门螺杆菌菌液;
[0141]
将幽门螺杆菌菌液8000g离心10min,得到幽门螺杆菌菌体,用人工胃液(ph=4)调节菌溶液浓度为od600=0.5,得到幽门螺杆菌菌悬液。
[0142]
(2)嗜酸乳杆菌ccfm1208的培养
[0143]
将嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;
[0144]
将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,制备得到嗜酸乳杆菌菌体,用pbs缓冲液(ph=7.42)调节,制备得到菌溶液浓度均为od600=0.5的嗜酸乳杆菌ccfm1208菌悬液。
[0145]
(3)分别取步骤(1)制备得到的调好菌浓度的幽门螺杆菌菌悬液,与步骤(2)制备得到的乳杆菌菌悬液各2ml,进行充分震荡和混合。室温26℃条件下,静置120min后嗜酸乳杆菌ccfm1208与幽门螺杆菌的混合液出现如图6所示的分层。离心混合液得到聚集体,将聚集体置于2.5%的戊二醛溶液中4℃固定过夜,收集固定后的聚集体经70%-100%乙醇梯度脱水后进行冷冻干燥48h,得到待拍摄的聚集体样品。经过钯溅射喷金处理,利用冷场发射扫描电子显微镜进行拍摄,得到图7。
[0146]
图6显示嗜酸乳杆菌ccfm1208与幽门螺杆菌共同孵育120min后的宏观表现,二者形成的共聚体在混合液中发生了沉降,上层溶液吸光度下降,而不发生共聚的嗜酸乳杆菌并未出现此现象。图7(a)~(d),分别代表微观的扫描电子显微镜下的幽门螺杆菌、嗜酸乳杆菌ccfm1208和二者的聚集体。由扫描电镜可以看出,低倍和高倍下均显示嗜酸乳杆菌ccfm1208与多个幽门螺杆菌发生聚集作用,形成结合的共聚体团块,进一步验证了共聚集作用是发生在菌体表面的物理作用。
[0147]
实施例6:嗜酸乳杆菌的表面蛋白对共聚集的影响
[0148]
具体步骤如下:
[0149]
(1)嗜酸乳杆菌ccfm1208的培养
[0150]
将嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于mrs液体培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,制备得到嗜酸乳杆菌菌体。
[0151]
(2)嗜酸乳杆菌ccfm1208的表面蛋白提取
[0152]
将使用细菌总蛋白提取试剂盒提取的嗜酸乳杆菌全蛋白上清液收集到干净的试管中,各取10ul 2
×
sds gel-loading buffer与10ul的蛋白上清液混合煮沸,通过10%浓度的sds-page电泳实验,上样量20μl分析提取物分子量大小。对蛋白凝胶进行染色脱色处理后得到图8。由图可知,嗜酸乳杆菌ccfm1208在25~71kda间存在大量的表层蛋白,因此本试验提示乳杆菌与幽门螺杆菌之间的这种共聚集作用与其表层蛋白相关。
[0153]
(3)幽门螺旋杆菌的培养:
[0154]
将幽门螺杆菌在哥伦比亚血平板上划线后,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养3天,得到单菌落;挑取单菌落接种于含5%(v/v)胎牛血清的bhi培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天得到种子液;将种子液以2%(v/v)的接种量接种于bhi液体培养基中,于37℃三气培养箱中(85%n2、10%co2、5%o2)培养4天,得到幽门螺杆菌菌液;
[0155]
将幽门螺杆菌菌液8000g离心10min,得到幽门螺杆菌菌体,用人工胃液(ph=4)调节菌溶液浓度为od600=0.5,得到幽门螺杆菌菌悬液。
[0156]
(4)licl去除嗜酸乳杆菌ccfm1208表面蛋白的共聚作用
[0157]
取步骤(1)中培养好的嗜酸乳杆菌ccfm1208用最初培养液1/20体积的5mol/l licl处理乳杆菌30min(37℃),离心弃上清,细菌细胞悬液用pbs洗涤两次,并用pbs制备得到菌溶液浓度均为od600=0.5的嗜酸乳杆菌ccfm1208菌悬液,与步骤(3)得到的幽门螺杆菌菌悬液各2ml,进行充分震荡和混合,室温静置孵育120min。分别测定乳杆菌、混合菌液反应前/后(0min/t min)的od值及计算共聚率,结果如表4所示:
[0158]
表4.乳杆菌表面蛋白对共聚集的影响
[0159][0160]
由上表可知,去除乳杆菌表面蛋白后,共聚集率发生了一定的下降,因此可以判断,嗜酸乳杆菌ccfm1208的表面蛋白参与了乳杆菌与幽门螺杆菌的共聚集的作用。本发明的菌株对于幽门螺杆菌的共聚集能力还基于其本身具备的表层蛋白结构。
[0161]
实施例7:嗜酸乳杆菌ccfm1208的应用
[0162]
嗜酸乳杆菌ccfm1208可用于制备菌粉,菌粉的具体制备过程如下:
[0163]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;将菌悬液在温度37℃下预培养60min后冻干,得到嗜酸乳杆菌ccfm1208菌粉;
[0164]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基;
[0165]
保护剂的成分包含:130g/l脱脂奶粉。
[0166]
实施例8:嗜酸乳杆菌ccfm1208的应用
[0167]
嗜酸乳杆菌ccfm1208可用于制备胶囊制品,胶囊制品的具体制备过程如下
[0168]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;菌悬液添加至浓度为30g/l的海藻酸钠溶液中至浓度为2
×
109cfu/ml后,充分搅拌,使得嗜酸乳杆菌ccfm1208的细胞均匀地分散于海藻酸钠溶液中,得到混合液;将混合液挤压到浓度为20g/l的氯化钙溶液中形成胶粒;待形成的胶粒静止固化30min后,过滤收集胶粒;将收集得到的胶粒进行冷冻干燥48h,得到粉剂;将粉剂装入到药用胶囊中,得到胶囊制品;
[0169]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基。
[0170]
实施例9:嗜酸乳杆菌ccfm1208的应用
[0171]
嗜酸乳杆菌ccfm1208可用于制备片剂,片剂的具体制备过程如下:
[0172]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;将菌悬液在温度37℃下预培养60min后冻干,得到嗜酸乳杆菌ccfm1208菌粉;
[0173]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基;
[0174]
保护剂的成分包含:130g/l脱脂奶粉。
[0175]
称取嗜酸乳杆菌ccfm1208菌粉25.7重量份、淀粉55.0重量份、纤维素衍生物4.5重量份、羧甲基淀粉钠12.0重量份、滑石粉0.8重量份、蔗糖1.0重量份与水1.0重量份,得到原材料;将原材料混合,得到湿颗粒;将湿颗粒用中南制药机械厂的压片机进行压片后使用青州市益康中药机械有限公司的小型药物干燥机进行干燥,得到片剂。
[0176]
实施例10:嗜酸乳杆菌ccfm1208的应用
[0177]
嗜酸乳杆菌ccfm1208可用于制备发酵乳,发酵乳的具体制备过程如下:
[0178]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;将菌悬液在温度37℃下预培养60min后冻干,得到嗜酸乳杆菌ccfm1208菌粉;
[0179]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱
脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基;
[0180]
保护剂的成分包含:130g/l脱脂奶粉。
[0181]
将嗜酸乳杆菌ccfm1208菌粉与商业干粉发酵剂保加利亚乳杆菌和商业干粉发酵剂嗜热链球菌按照质量比1:1:1的比例混合,得到发酵剂;将糖添加至鲜奶中至浓度为50g/l,得到混合液;将混合液在65℃、20mpa的条件下进行均质后在95℃下保温杀菌5min,得到发酵原料;将发酵原料降温至35℃后以0.03%(v/v)的接种量将发酵剂接种至发酵原料中,于35℃下保温发酵16h,得到发酵乳;将发酵乳于42℃下放置4h进行凝乳后,在4℃下冷藏24h进行后熟,得到发酵乳成品。
[0182]
实施例11:嗜酸乳杆菌ccfm1208的应用
[0183]
嗜酸乳杆菌ccfm1208可用于制备豆奶,豆奶的具体制备过程如下:
[0184]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;将菌悬液在温度37℃下预培养60min后冻干,得到嗜酸乳杆菌ccfm1208菌粉;
[0185]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基;
[0186]
保护剂的成分包含:130g/l脱脂奶粉。
[0187]
将大豆在温度80℃下浸泡2h后去除大豆皮,得到去皮大豆;将去皮大豆沥去浸泡水后加沸水磨浆,得到豆浆;将豆浆在高于80℃的温度条件下保温12min,得到熟豆浆;将熟豆浆用150目筛网过滤后离心分离,得到粗豆奶;将粗豆奶加热到温度140~150℃后迅速导入真空冷却室进行抽真空,使得粗豆奶中的异味物质随着水蒸汽迅速排出,得到熟豆奶;将熟豆奶降温至约37℃后在熟豆奶中添加嗜酸乳杆菌ccfm1208菌粉至浓度为不低于1
×
106cfu/ml,得到豆奶(豆奶需在4℃下冷藏保存)。
[0188]
实施例12:嗜酸乳杆菌ccfm1208的应用
[0189]
嗜酸乳杆菌ccfm1208可用于制备果蔬饮料,果蔬饮料的具体制备过程如下:
[0190]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;将菌悬液在温度37℃下预培养60min后冻干,得到嗜酸乳杆菌ccfm1208菌粉;
[0191]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基;
[0192]
保护剂的成分包含:130g/l脱脂奶粉。
[0193]
将新鲜水果和蔬菜洗净后榨汁,得到果蔬汁;将果蔬汁在温度140℃下高温热杀菌2秒,得到杀菌后的果蔬汁;将杀菌后的果蔬汁降温至约37℃后在杀菌后的果蔬汁中添加嗜酸乳杆菌ccfm1208菌粉至浓度为不低于1
×
106cfu/ml,得到果蔬饮料(果蔬饮料需在4℃下冷藏保存)。
[0194]
实施例13:嗜酸乳杆菌ccfm1208的应用
[0195]
嗜酸乳杆菌ccfm1208可用于制备乳饮品,乳饮品的具体制备过程如下:
[0196]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;将菌悬液在温度37℃下预培养60min后冻干,得到嗜酸乳杆菌ccfm1208菌粉;
[0197]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基;
[0198]
保护剂的成分包含:130g/l脱脂奶粉。
[0199]
将脱脂奶在95℃热杀菌20min后冷却至4℃,得到原料;在原料中添加嗜酸乳杆菌ccfm1208菌粉至浓度为不低于1
×
106cfu/ml,得到乳饮品(乳饮品需在4℃下冷藏保存)。
[0200]
实施例14:嗜酸乳杆菌ccfm1208的应用
[0201]
嗜酸乳杆菌ccfm1208可用于制备巧克力,巧克力的具体制备过程如下:
[0202]
嗜酸乳杆菌ccfm1208划线于mrs固体培养基上,37℃条件下培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,37℃条件下培养18h进行活化,连续活化两代,得到活化液;将活化液按2%(v/v)的接种量接种于培养基中,37℃条件下培养18h,得到菌液;将菌液经8000g离心10min,得到菌泥;将菌泥用生理盐水清洗3次后用保护剂重悬至浓度为1
×
10
10
cfu/ml,得到菌悬液;将菌悬液在温度37℃下预培养60min后冻干,得到嗜酸乳杆菌ccfm1208菌粉;
[0203]
其中,培养基的制备方法为:使用以培养基总重量计87.7%的水将10%酶水解脱脂乳、0.5%葡萄糖、1.5%胰蛋白胨与0.3%酵母浸膏溶解,然后调整其ph为6.8,得到培养基;
[0204]
保护剂的成分包含:130g/l脱脂奶粉。
[0205]
将可可块和白砂糖以1:1~1:3的质量比混合后加热,搅拌均匀,得到巧克力融浆;先将乳化剂(液体卵磷脂、大豆磷脂、山梨醇酐单月桂酸酯)与嗜酸乳杆菌ccfm1208菌粉以乳化剂:菌粉=80~90:10~20的质量比混合均匀,再进行精磨、除酸、除水、结晶、调温,最后选择合适的模型浇注成型,得到巧克力(巧克力需在4℃下冷藏保存)。
[0206]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1