滋养层细胞表面抗原2(TROP2)特异性抗体的制作方法
滋养层细胞表面抗原2(trop2)特异性抗体
1.本技术为分案申请,其母案的中国专利申请申请号为201980052411.6,母案的申请日为2019年06月26日。
背景技术:
2.滋养层细胞表面抗原2(trophoblast antigen 2,trop2),又称为胃肠道肿瘤相关抗原ga7331、胰腺癌标志物蛋白ga733-1/ga733、膜组分1号染色体表面标志物1m1s1、上皮糖蛋白-1、egp-1、caa1、胶滴状角膜营养不良(gelatinous drop-like corneal dystrophy)gdld以及ttd2,为一种跨膜糖蛋白,其功能为一种细胞内钙信号转导子,且被认为是epcam信号传导的调节剂。据报导,trop2在许多癌症中过度表达,例如腺癌、肺癌、乳腺癌、结肠癌以及胃癌。因此,该受体可作为治疗和/或诊断此类癌症的靶标。
3.因此,开发有效的trop2拮抗剂如抗trop2抗体用于癌症治疗及诊断非常重要。
技术实现要素:
4.本公开至少部分基于trop2特异性的多种抗体的开发。这类抗体显示出对目标trop2抗原的高结合亲和力和/或对trop2
+
细胞的高抑制活性。
5.因此,本公开一方面的特征在于一种与trop2结合的分离的抗体(抗trop2抗体),其中所述抗体与参照抗体结合相同的人trop2表位,所述参照抗体为trop2-ab7、trop2-ab8、trop2-ab22、trop2-ab40、trop2-ab46、trop2-ab50或trop2-ab51,其各自的结构特征将在本文提供。
6.在一些实施方案中,本文所述的抗trop2抗体可包含重链可变区(vh),其包含以下一个或多个:
7.(a)重链互补决定区1(hc cdr 1),表示为gyx1ftx2yx3,其中x1为r或t,x2为d、s或n,且x3为v或w;
8.(b)重链互补决定区2(hc cdr2),表示为ix1px2x3x4x5x6,其中x1为y或f,x2为g或s,x3为s、h或g,x4为d或s,x5为s、y、t或g,且x6为f或t;以及
9.(c)重链互补决定区3(hc cdr3),表示为x1rx2x3x4x5x6x7y,其中x1为a或t,x2为f、g或s,x3为f或s,x4为e、y或不存在,x5为g或不存在,x6为l、f或不存在,且x7为a或d。
10.这样的抗trop2抗体可包含重链可变区(vh),其中hc cdr1、hc cdr2以及hc cdr3总体上与所述参照抗体的hc cdr1、hc cdr2以及hc cdr3至少85%(例如,至少90%、至少95%、至少98%或更多)相同。在一些情况下,所述抗体可包含vh,所述vh包含与上述参照抗体之一相同的hc cdr1、hc cdr2以及hc cdr3。在其他实施方案中,本文所述的抗trop2抗体可以包含vh,其包含hc cdr1、hc cdr2以及hc cdr3,其相对于所述参照抗体的hc cdr1、hc cdr2以及hc cdr3总体上包含最多5、4、3、2或1个突变。
11.替代地或另外地,本文所述的抗trop2抗体可包含轻链可变区(v
l
),其包含以下一个或多个:
12.(a)轻链互补决定区1(lc cdr 1),表示为qx1ix2x3x4,其中x1为g、n或d,x2为n或g,
x3为n、t或w,且x4为y或s;
13.(b)轻链互补决定区2(lc cdr 2),表示为x1x2x3,其中x1为r或y,x2为a或s,且x3为n或s;以及
14.(c)轻链互补决定区3(lc cdr 3),表示为x1x2x3x4x5x6px7t,其中x1为l或q,x2为q或h,x3为y或s,x4为d、y或e,x5为e、s或t,x6为f或w,且x7为l或f。
15.这样的抗体可包含v
l
,其中lc cdr1、lc cdr2以及lc cdr3总体上与所述参照抗体的lc cdr1、lc cdr2以及lc cdr3至少85%(例如,至少90%、至少95%、至少98%或更多)相同。在一些情况下,所述抗体可包含与上述参照抗体之一相同的lc cdr1、lc cdr2以及lc cdr3。在其他实施方案中,本文所述的抗trop2抗体可包含lc cdr1、lc cdr2以及lc cdr3,其相对于所述参照抗体的lc cdr1、lc cdr2以及lc cdr3总体上包含最多5、4、3、2或1个突变。
16.在一些示例中,本文所述的抗trop2抗体包含与上述参照抗体之一相同的重链和/或轻链cdr。在一些情况下,这样的抗trop2抗体可包含与所述参照抗体相同的vh和/或v
l
。
17.本文所述的任何抗trop2抗体可特异性结合人trop2。在一些情况下,所述抗trop2抗体可与人trop2以及非人trop2(例如啮齿类动物trop2或灵长类动物trop2)交叉反应。所述抗体可为人抗体或人源化抗体。在一些示例中,它可为嵌合抗体。
18.在一些实施方案中,所述抗trop2抗体可为全长抗体(例如,igg分子)或其抗原结合片段。或者,它可为单链抗体。
19.在另一方面,本公开特征在于总体上编码本文所述的任何抗trop2抗体的核酸或核酸集(例如,两个核酸),以及包含编码所述抗trop2抗体的核酸的载体或载体集(例如,两个载体)。在某些情况下,所述载体或载体集可为表达载体。本文还提供包含所述核酸或载体的宿主细胞。此外,本公开提供制备如本文所述的抗trop2抗体的方法,其包括培养宿主细胞并收获由此产生的抗体(例如,从所述宿主细胞或培养基中),所述宿主细胞包含载体或载体集,所述载体或载体集包含所述抗体的编码序列,其中所述编码序列与合适的启动子可操作地连接。
20.另外,本公开提供抗体-药物缀合物(adc),其包含:本文所述的任何抗trop2抗体,以及与所述抗体共价缀合的至少一种治疗剂。在一些实施方案中,所述治疗剂可为细胞毒性剂,例如,单甲基奥利斯达汀e(monomethyl auristatin e)。
21.一些实施方案中,所述抗体与所述治疗剂可通过连接子缀合。在一些实施方案中,所述连接子可为可裂解的连接子,例如,蛋白酶敏感的连接子、ph敏感的连接子或谷胱甘肽敏感的连接子。在一些情况下,所述连接子可为蛋白酶敏感的连接子,其可包含具有2-5个氨基酸的肽。所述肽可包含天然存在的氨基酸残基、非天然存在的氨基酸残基或其组合。在一示例中,所述肽可包含缬氨酸-瓜氨酸。在其他示例中,所述连接子可为不可裂解的连接子。这种不可裂解的连接子可包含任选经取代的烷烃或硫醚。
22.在一些实施方案中,所述连接子可包含在抗体与连接子之间形成共价键的官能基团。示例性的官能基团包括,但不限于,马来酰亚胺基团、碘乙酰胺基团、乙烯基砜基团、丙烯酸酯基团、丙烯酰胺基团、丙烯腈基团以及甲基丙烯酸酯基团。在一示例中,所述连接子可进一步为式i的分子间隔子:
[0023][0024]
其中
[0025]
r1为任选经取代的c1-6烷基、任选经取代的苯基、任选经取代的c2-6亚烷基、任选经取代的c2-6亚烯基、任选经取代的c2-6亚炔基或任选经取代的三唑;且x为o、s或n。
[0026]
此外,本公开提供一种嵌合抗原受体(car),其可包含:(i)胞外结构域,其包含结合trop2的抗原结合片段,(
ⅱ
)跨膜结构域,以及(
ⅲ
)一个或多个细胞内刺激结构域。所述抗原结合片段可结合与本文所述的任何参照抗体相同的人trop2表位。在一些示例中,所述抗原结合片段可包含与任何所述参照抗体相同的hc cdr和/或lc cdr。这样的抗原结合片段可包含与所述参照抗体相同的vh及v
l
。在一些示例中,所述抗原结合片段可为单链抗体(scfv)。
[0027]
在本文所述的任何car中,所述跨膜结构域可包含衍生自cd28或cd8的跨膜结构域。替代地或另外地,所述一个或多个细胞内刺激结构域可包含来自cd3ζ的信号传导结构域以及任选存在的共刺激信号传导结构域,其可来自4-1bb、cd7、cd27、cd28、cd40、ox40、icos、gitr、hvem、tim1或lfa-1。编码本文所述的任何car的核酸,包含这样的核酸的载体,以及表达所述car的宿主细胞也在本公开的范围内。在一些示例中,表达所述car的宿主细胞为免疫细胞,例如t细胞。
[0028]
在另一方面,本公开提供一种药物组合物,其包含(i)一种或多种本文所述的抗trop2抗体、编码所述抗体的核酸或核酸集、如本文所述的抗体-药物缀合物或表达本文所述任何car构建体的宿主细胞,以及(
ⅱ
)药学上可接受的载剂。
[0029]
此外,本公开特征在于一种减少trop2
+
细胞数量的方法,所述方法包括向有此需要的对象给药有效量的本文所述的任何药物组合物。在一些实施方案中,所述对象可为患有或疑似患有癌症(例如,上皮癌)的人患者。也包括在本公开范围内的是如本文所述的药物组合物,其用于治疗也如本文所述的任何目标疾病(例如,癌症,例如上皮癌)或用于制造用于治疗目标疾病的药物。
[0030]
另外,本公开特征在于一种检测trop2
+
细胞存在的方法,所述方法包括:(i)使疑似具有trop2
+
细胞的样品与本文所述的任何抗trop2抗体接触,所述抗体与标记试剂缀合;以及(
ⅱ
)基于所述抗体与样品中细胞的结合来检测样品中trop2
+
细胞的存在。在某些情况下,所述样品来自患有癌症或疑似患有癌症(例如上皮癌)的人患者。
[0031]
在以下的描述中阐述了本发明的一个或多个实施方案的细节。从以下附图以及几个实施方案的详细描述,以及从所附权利要求书,本发明的其他特征或优点将变得显而易见。
附图说明
[0032]
图1a-1g显示多个抗trop2抗体,包括trop2-ab7、trop2-ab8、trop2-ab22、trop2-ab40、trop2-ab46、trop2-ab50以及trop2-ab51,其与表面表达trop2的细胞结合。
[0033]
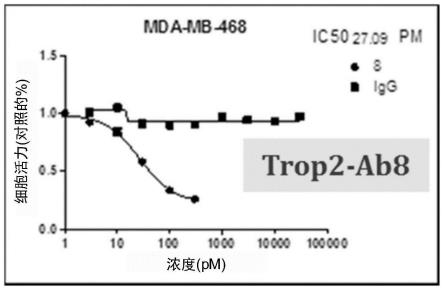
图2a-2g示例性显示抗trop2抗体对mda-468细胞的抑制作用,所述mda-468细胞为trop2
+
。
具体实施方式
[0034]
本文公开多个抗trop2抗体,其显示出优异的特征,包括对目标trop2抗原的高结合亲和力和/或对trop2
+
细胞的高抑制活性。
[0035]
因此,本文提供能够结合trop2的抗体,编码这样的抗体的核酸,包含所述抗trop2抗体的抗体-药物缀合物(adcs)与嵌合抗原受体(car),以及其在治疗及诊断目的中的用途。本文还提供用于所述抗体和/或adc和包含这样的car的治疗和/或诊断用途的试剂盒,以及用于产生所述抗trop2抗体的方法。
[0036]
与trop2结合的抗体
[0037]
本公开提供结合滋养层细胞表面抗原2(trop2)的抗体。作为跨膜糖蛋白,trop2的功能为细胞内钙信号转导子,并被认为是epcam信号传导的调节剂。在人体中,trop2由tacstd2基因所编码。trop2被发现在多种肿瘤,例如,肺癌与胃癌,中过度表达。因此,这个受体可作为治疗及诊断目标癌症的靶标和/或生物标志物。因此,本文所公开的抗trop2抗体可单独或与其他部分缀合用于治疗和/或诊断本文所述的目标癌症,例如,与治疗剂缀合以形成抗体-药物缀合物或在嵌合抗原受体中作为胞外抗原结合结构域。
[0038]
抗体(与复数形式可互换使用)是一种免疫球蛋白分子,其能够通过位于免疫球蛋白分子的可变区的至少一个抗原识别位点特异性结合至靶标,例如碳水化合物、多核苷酸、脂质、多肽等。如本文所用,术语“抗体”不仅涵盖完整的(即,全长)多克隆或单克隆抗体,还包括其抗原结合片段(例如fab、fab'、f(ab')2、fv)、单链(scfv)、其突变体、包含抗体部分的融合蛋白、人源化抗体、嵌合抗体、双抗体、纳米抗体、线性抗体、单链抗体、多特异性抗体(例如,双特异性抗体)以及免疫球蛋白分子的任何其他修饰的构型,其包含具有所需特异性的抗原识别位点,包括抗体的糖基化变体、抗体的氨基酸序列变体以及共价修饰的抗体。抗体包括任何类别的抗体,例如igd、ige、igg、iga或igm(或其亚类),且抗体不必为任何特定类别。根据其重链恒定结构域的抗体氨基酸序列,免疫球蛋白可分为不同类别。免疫球蛋白有五种主要类别:iga、igd、ige、igg以及igm,其中一些可进一步分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1与iga2。对应于不同类别的免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ,以及μ。不同类别的免疫球蛋白的亚基结构与三维构型是众所周知的。
[0039]
典型的抗体分子包含重链可变区(vh)以及轻链可变区(v
l
),其通常与抗原结合有关。vh与v
l
区域可进一步细分为高变区,又称为“互补决定区”(“cdr”),穿插着较为保守的区域,即“框架区”(“fr”)。每个vh与v
l
通常由三个cdr以及四个fr所组成,按以下顺序从氨基端到羧基端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。可使用本领域已知的方法,例如通过kabat定义、chothia定义、abm定义和/或接触定义来精确地识别框架区与cdr的范围,所有这些都是在本领域中众所周知的。参见,例如,kabat,e.a.等人(1991年)sequences of proteins of immunological interest,第五版,美国卫生暨人力服务部,nih出版编号91-3242,chothia等人(1989年)nature 342:877;chothia,c.等人(1987年)j.mol.biol.196:901-917,al-lazikani等人(1997年)j.molec.biol.273:927-948;以及almagro,j.mol.recognit.17:132-143(2004年)。还参见hgmp.mrc.ac.uk以及bioinf.org.uk/abs。
[0040]
在一些实施方案中,本文所述的抗trop2抗体可结合并抑制trop2的活性至少50%(例如,60%、70%、80%、90%、95%或更高)。表观抑制常数(ki
app
或k
i,app
)提供了抑制剂效力的量度,与降低酶活性所需的抑制剂浓度有关,而与酶浓度无关。可通过本领域已知的常规方法确定本文所述的抗trop2抗体的抑制活性。
[0041]
抗体的k
i,app
值可通过测量不同浓度的抗体对反应程度(例如,酶活性)的抑制作用来确定;将准一级速率常数(v)的变化随抑制剂浓度的函数拟合到修改后的morrison方程(方程式1)可得出表观ki值的估计值。对于竞争性抑制剂,可从y截距中获得ki
app
,该截距为从k
i,app
对底物浓度的图的线性回归分析中得到的。
[0042][0043]
其中a等于vo/e,不存在抑制剂(i)时酶促反应的初始速度(v0)除以总酶浓度(e)。
[0044]
在一些实施方案中,本文所述的抗trop2抗体的ki
app
值对于trop2抗原或其抗原表位可为1000、900、800、700、600、500、400、300、200、100、50、40、30、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5pm或更小。在一些实施方案中,相对于第二靶标,抗trop2抗体对于第一靶标可具有较低的ki
app
。ki
app
的差异(例如,针对特异性或其他比较)至少可以为1.5、2、3、4、5、10、15、20、37.5、50、70、80、91、100、500、1000、10,000或105倍。
[0045]
本文所述的抗体可为小鼠、大鼠、人或任何其他来源的抗体(包括嵌合或人源化抗体)。此类抗体为非天然存在的,即在没有人为行为(例如,以期望的抗原或其片段免疫这类动物)的情况下不会在动物中产生。
[0046]
本文所述的任何抗体可为单克隆的或多克隆。“单克隆抗体”是指同质抗体群,“多克隆抗体”是指异质抗体群。这两个术语并不限制抗体的来源或制备方式。
[0047]
在一示例中,本文所述的方法所用的抗体为人源化抗体。人源化抗体是指非人(例如,鼠)抗体的形式,其为含有来自非人免疫球蛋白的最小序列的特异性嵌合免疫球蛋白、免疫球蛋白链或其抗原结合片段。在大多数情况下,人源化抗体为人免疫球蛋白(受体抗体),其中来自受体的互补决定区(cdr)的残基被来自非人物种(供体抗体)的cdr的残基替代,例如具有期望的特异性、亲和力与能力的小鼠、大鼠、或兔。在一些情况下,人免疫球蛋白的fv框架区(fr)残基被相应的非人残基代替。此外,人源化抗体可包含不在受体抗体中、也不在引进的cdr或框架序列中发现的残基,这些残基被包括以进一步改进及优化抗体性能。通常,人源化抗体会包含基本上所有、至少一个、通常为两个可变结构域,其中所有或基本上所有的cdr区域对应于非人免疫球蛋白与全部或基本上所有的fr区域为人免疫球蛋白共有的序列。人源化抗体最佳还会包含免疫球蛋白恒定区或结构域(fc)的至少一部分,通常为人免疫球蛋白的恒定区或结构域(fc)。抗体可以具有如wo 99/58572中所述的修饰的fc区。其他形式的人源化抗体具有相对于原始抗体改变的一个或多个cdr(一个、二个、三个、四个、五个和/或六个),其也被称为一个或多个“衍生自”一个或多个来自原始抗体的cdr。人源化抗体也可能涉及亲和力成熟。
[0048]
在另一示例中,本文所述的抗体可为嵌合抗体,其可包括来自人抗体的重链恒定区与轻链恒定区。嵌合抗体是指具有来自第一物种的可变区或可变区的部分以及来自第二物种的恒定区的抗体。通常,在这些嵌合抗体中,轻链及重链的可变区都模仿衍生自一种哺乳动物(例如,非人哺乳动物,例如小鼠、兔以及大鼠)的抗体的可变区,而恒定部分与来自
另一种哺乳动物,例如人抗体中的序列同源。在一些实施方案中,可以在可变区和/或恒定区中进行氨基酸修饰。
[0049]
在一些实施方案中,本文所述的抗trop2抗体特异性结合相应的目标抗原或其表位。“特异性结合”抗原或表位的抗体是本领域众所周知的术语。如果分子与特定目标抗原的反应比与其他目标抗原的反应更频繁、更快速、持续时间更长和/或具有更大的亲和力,则其表现出“特异性结合”。如果抗体以比与其他物质结合的更大的亲和力、亲合力(avidity),更容易和/或以更长的持续时间结合,则与目标抗原或表位“特异性结合”。例如,特异性地(或优先地)结合于trop2抗原或其中的抗原表位的抗体是这样的抗体,其以与比其他抗原或相同抗原中的其他表位结合的更大的亲和力、亲合力,更容易和/或更长的持续时间结合这个目标抗原。通过这个定义还应理解,例如,特异性结合第一目标抗原的抗体可以特异性或优先或者可以非特异性或不优先结合第二目标抗原。如此,“特异性结合”或“优先结合”并不一定需要(尽管可以包括)排他结合。在一些示例中,“特异性结合”目标抗原或其表位的抗体可能不结合其他抗原或相同抗原中的其他表位。在一些实施方案中,本文所述的抗trop2抗体特异性结合人trop2。在一些示例中,其与非人trop2抗原的结合活性在常规测定中不可检测或非常低,以至如本领域技术人员所知,其不会具有显著的生物学意义。在其他示例中,本文所述的抗trop2抗体可与来自不同物种的trop2交叉反应,例如,在人trop2与非人trop2之间(例如,来自实验动物例如非人的灵长类、小鼠或大鼠的trop2)。
[0050]
如本文所用,术语“trop2”或“滋养层细胞表面抗原2”是指任何合适物种的trop2蛋白,例如人、非人哺乳动物,例如非人灵长类动物或啮齿动物(例如,小鼠或大鼠)。trop2为单链膜蛋白,主要功能为转导细胞内钙信号。以下提供了示例性人trop2的氨基酸序列(还参见genbank登录号p09758):
[0051][0052]
来自其他物种的trop2分子是本领域中众所周知的,且其氨基酸序列可从公众可获得的数据库,例如genbank中获得。
[0053]
在一些实施方案中,本文所述的抗trop2抗体对目标抗原(例如,人trop2)或其抗原表位具有合适的结合亲和力。如本文所用,“结合亲和力”是指表观缔合常数或ka。ka为解离常数(kd)的倒数。本文所述的抗trop2抗体对目标抗原或抗原表位的结合亲和力(kd)至少为10-5
、10-6
、10-7
、10-8
、10-9
、10-10
m或更低。结合亲和力增加对应于kd降低。相对于第二抗原,抗体对第一抗原的更高亲和力结合可通过与结合所述第二抗原的ka(或数值kd)相比,与第一抗原结合的ka更高(或较小数值的kd)。在这样的情况下,抗体相对于第二抗原(例如,相同的第一蛋白的第二构象或其模拟物;或第二蛋白)对第一抗原(例如,第一蛋白的第一构象或其模拟物)具有特异性。在一些实施方案中,相较于对不同物种的trop2的结合亲和力,本文所述的抗trop2抗体对人trop2具有更高的结合亲和力(更高的ka或较小的kd)。结合亲和力的差异(例如,针对特异性或其他比较)可至少为1.5、2、3、4、5、10、15、20、37.5、50、70、
80、91、100、500、1000、10,000或105倍。在一些实施方案中,任何抗trop2抗体可进一步亲和力成熟以增加抗体对目标抗原或其抗原表位的结合亲和力。
[0054]
结合亲和力(或结合特异性)可通过多种方法确定,包括平衡透析、平衡结合、凝胶过滤、elisa、表面等离振子共振或光谱法(例如,使用荧光测定法)。用于评估结合亲和力的示例性条件为在hbs-p缓冲液(10mm hepes ph7.4,150mm nacl,0.005%(v/v)表面活性剂p20)中。这类技术可用于将结合的结合蛋白的浓度测量为目标蛋白浓度的函数。结合的结合蛋白([bound])的浓度通常与游离的目标蛋白([free])的浓度有关,其关系式如下:
[0055]
[bound]=[free]/(kd+[free])。
[0056]
但是,并非总是必须精确地确定ka,因为有时足以获得亲和力的定量测量(例如,使用elisa或facs分析等方法测定)与ka成正比,因此可用于比较,例如确定较高的亲和力是否例如高2倍,以获取对亲和力的定性测量,或例如通过功能测定(例如体外或体内分析)的活性来推断亲和力。
[0057]
一些实施方案中,本文所述的抗trop2抗体与本文提供的参照抗体之一结合至trop2抗原(例如,人trop2)中的相同表位,或与参照抗体竞争结合至trop2抗原。本文提供的参照抗体包括trop2-ab7、trop2-ab8、trop2-ab22、trop2-ab40、trop2-ab46、trop2-ab50以及trop2-ab51,其各自的结构特征在本文中提供。与本文所述的参照抗体结合相同表位的抗体可以与参照抗体结合完全相同的表位或基本上重叠的表位(例如,包含少于3个非重叠氨基酸残基、少于2个非重叠氨基酸残基或仅1个非重叠氨基酸残基)。两种抗体是否由于结合同源抗原而彼此竞争,可通过竞争测定法来确定,这是本领域众所周知的。可以如本领域技术人员已知的来鉴定这类抗体,例如,具有基本相似的结构特征的那些(例如,互补决定区),和/或通过本领域已知的测定法鉴定的那些。例如,可使用参照抗体之一进行竞争测定,以确定候选抗体是否与参照抗体结合相同的表位或竞争其与trop2抗原的结合。
[0058]
本文所述的抗trop2抗体可包含重链可变区(vh),其可包含(a)重链互补决定区1(hc cdr 1),表示为gyx1ftx2yx3,其中x1为r或t,x2为d、s或n,且x3为v或w;(b)重链互补决定区2(hc cdr2),表示为ix1px2x3x4x5x6,其中x1为y或f,x2为g或s,x3为s、h或g,x4为d或s,x5为s、y、t或g,且x6为f或t;(c)重链互补决定区3(hc cdr3),表示为x1rx2x3x4x5x6x7y,其中x1为a或t,x2为f、g或s,x3为f或s,x4为e、y或不存在,x5为g或不存在,x6为l、f或不存在,且x7为a或d;或(d)(a)-(c)的任何组合。在一些情况下,所述抗体可包含(a)的hc cdr1、(b)的hc cdr2以及(c)的hc cdr3。
[0059]
在一些示例中,hc cdr1基序gyx1ftx2yx3可包含在位置x1处的r,在位置x2处的d和/或在位置x3处的v。替代地或另外地,hc cdr2基序ix1px2x3x4x5x6可包含在位置x1处的y,在位置x2处的g,在位置x3处的s,在位置x4处的d,在位置x5处的s和/或在位置x6处的f。替代地或另外地,hc cdr3基序x1rx2x3x4x5x6x7y可包括在位置x1处的a,在位置x2处的f,在位置x3处的f,在位置x4处的e,在位置x5处的g,在位置x6处的f和/或在位置x7处的a。
[0060]
表1提供了示例性抗trop2抗体的重链cdr的氨基酸序列(通过imgt定义)。具有与那些示例性抗trop2抗体相同的重链cdr1、cdr2以及cdr3区域的抗体也在本公开的范围内。
[0061]
表1:抗trop2抗体的重链cdr序列
[0062]
示例性抗体cdr1cdr2cdr3trop2-ab7gyrftdyviypgsdtfarffegfay
trop2-ab8gyrftdyviypgsdsfarffeglaytrop2-ab22gytftdyviypgsdgtarffegfaytrop2-ab40gyrftdyviypgsdsfarffeglaytrop2-ab46gytftsywifpshsyttrgsgfdytrop2-ab50gytftnywifpggdytarssydytrop2-ab51gyrftdyviypgsdsfarffegfay
[0063]
替代地或另外地,本文所述的抗trop2抗体可包含轻链可变结构域(v
l
),其包含轻链可变区(v
l
),其包含(a)轻链互补决定区1(lc cdr 1),表示为qx1ix2x3x4,其中x1为g、n或d,x2为n或g,x3为n、t或w,且x4为y或s;(b)轻链互补决定区2(lc cdr 2),表示为x1x2x3,其中x1为r或y,x2为a或s,且x3为n或s;(c)轻链互补决定区3(lc cdr 3),表示为x1x2x3x4x5x6px7t,其中x1为l或q,x2为q或h,x3为y或s,x4为d、y或e,x5为e、s或t,x6为f或w,且x7为l或f;或(d)(a)-(c)的任何组合。
[0064]
在一些示例中,lc cdr1基序qx1ix2x3x4包含在位置x1处的g,在位置x2处的n,在位置x3处的n和/或在位置x4处的y。替代地或另外地,lc cdr2基序x1x2x3包含在位置x1处的r,在位置x2处的a和/或在位置x3处的n。替代地或另外地,lc cdr3基序x1x2x3x4x5x6px7t包含在位置x1的l,在位置x2处的q,在位置x3处的y,在位置x4处的d,在位置x5处的e,在位置x6处的f和/或在位置x7处的l。
[0065]
表2提供了示例性抗trop2抗体的轻链cdr的氨基酸序列。具有与那些示例性抗trop2抗体相同的轻链cdr1、cdr2以及cdr3区域的抗体也在本公开的范围内。
[0066]
表2:抗trop2抗体的轻链cdr序列
[0067]
示例性抗体cdr1cdr2cdr3trop2-ab7qginnyranlqydefplttrop2-ab8qginnyranlqydefplttrop2-ab22qdinwyranlqyeefplttrop2-ab40qginnyranlqydefplttrop2-ab46qnigtsyasqhsyswpfttrop2-ab50qnigtsyssqhsytwpfttrop2-ab51qginnyranlqydefplt
[0068]
本文提供的参照抗体的重链及轻链cdr基于imgt方法确定,这是本领域众所周知的。在一些情况下,本文公开的抗trop2抗体可包含与本文公开的任何参照抗体相同的重链及轻链cdr。具有相同vh和/或v
l cdr的两种抗体表示,当通过相同方法确定时,它们的cdr是相同的(例如,本文所述和/或本领域已知的那些)。
[0069]
在一些示例中,本文公开的抗trop2抗体可包含与参照抗体之一相同的vh和/或v
l
序列,其在以下提供(cdr以粗体字表示):
[0070]
trop2-ab7
[0071]
vh:vh:
[0072]
vl:vl:
[0073]
trop2-ab8trop2
[0074]
vh:
[0075][0076]
vl:vl:
[0077]
trop2-ab22
[0078]
vh:vh:
[0079]
vl:vl:
[0080]
trop2-ab40trop2
[0081]vh
::
[0082]vl
::
[0083]
trop2-ab46trop2
[0084]
vh:
[0085][0086]
vl:
[0087][0088]
trop2-ab50trop2
[0089]
vh:
[0090][0091]
vl:vl:
[0092]
trop2-ab51trop2
[0093]
vh:
[0094][0095]
vl:vl:
[0096]
同样在本公开范围内的是本文公开的任何参考抗-trop2抗体的功能变体(例如,以上表1与表2中所列出的)。功能变体可在参照抗体的一个或多个重链及轻链cdr区域中包
cell mediated cytotoxicity,adcc)。可以使用在美国专利号5,500,362中公开的方法评估adcc活性。于其他实施方案中,恒定区以如eur.j.immunol.(1999年)29:2613-2624;pct申请号pct/gb99/01441;和/或英国专利申请号9809951.8所述方式进行修饰。
[0102]
本文所述的任何抗trop2抗体可进一步包含轻链,其包括轻链可变区以及任选地存在的轻链恒定区(cl),其可为本领域已知的任何cl。在一些示例中,cl为κ轻链。在其他示例中,cl为λ轻链。抗体重链与轻链恒定区是本领域众所周知的,例如,在imgt数据库(www.imgt.org)或在www.vbase2.org/vbstat.php中提供的那些,其均援引加入本文。
[0103]
抗trop2抗体的制备
[0104]
如本文所述的能够结合trop2的抗体可通过本领域已知的任何方法来制备。参见,例如,harlow与lane,(1998年)antibodies:a laboratory manual,冷泉港实验室,纽约。
[0105]
在一些实施方案中,可通过常规杂交瘤技术制备目标trop2抗原(例如,人trop2)特异性的抗体。全长目标抗原或其片段,任选地与载体蛋白如klh偶联,可用于免疫宿主动物以产生与那个抗原结合的抗体。如本文进一步所述,宿主动物的免疫途径及时间表通常与建立的且常规的抗体刺激及产生技术一致。产生小鼠抗体、人源化抗体以及人抗体的通用技术是本领域已知的,并在本文中进行描述。预期可操纵包括人或由其产生抗体的细胞在内的任何哺乳动物对象,以作为哺乳动物包括人杂交瘤细胞系产生的基础。通常,以一定量的免疫原对宿主动物进行腹膜内、肌肉内、口服、皮下、足底内和/或皮内接种,包括如本文所述的。
[0106]
可以使用kohler、b.与milstein,c.(1975年)nature 256:495-497所述的一般体细胞杂交技术从淋巴细胞与永生化骨髓瘤细胞制备杂交瘤,或由buck,d.w.等人,in vitro,18:377-381(1982年)所改进的方式进行。适用的骨髓瘤细胞系包括,但不限于,x63-ag8.653与来自美国加州圣地亚哥细胞配送中心的salk研究所(salk institute,cell distribution center,san diego,calif.,usa)的那些骨髓瘤细胞系,均可用于杂交。通常,该技术涉及使用融合剂(如聚乙二醇),或以本领域技术人员众所周知的电击方式,来融合骨髓瘤细胞与淋巴细胞。融合后,将细胞与融合培养基分离,并在选择性生长培养基如次黄嘌呤
–
氨基蝶呤-胸腺嘧啶核苷(hat)培养基中生长,以除去未杂交的亲本细胞。如本文所述的任何补充有或不含血清的培养基可用于培养分泌单克隆抗体的杂交瘤。作为细胞融合技术的另一替代方法为ebv永生化b细胞,可用于产生如本文所述的抗trop2的单克隆抗体。如果期望,扩增并亚克隆杂交瘤,并以常规免疫分析程序(例如,放射免疫分析、酶免疫分析或荧光免疫分析)测定上清液中的抗免疫原活性。
[0107]
可作为抗体来源的杂交瘤包括产生能够干扰trop2活性的单克隆抗体的所有衍生物、亲本杂交瘤的后代细胞。产生这类抗体的杂交瘤可使用已知的方法在体外或体内生长。如果期望,可通过常规的免疫球蛋白纯化方法,如硫酸铵沉淀、凝胶电泳、透析、色谱以及超滤从培养基或体液中分离出单克隆抗体。可以去除不期望的活性(如果存在),例如,通过将制备品与固相连接的免疫原所制成的吸附剂作用,并将期望的抗体从免疫原上洗脱或释放出来。用目标抗原或含有目标氨基酸序列的片段免疫宿主动物可产生抗体群(例如,单克隆抗体),所述目标抗原或含有目标氨基酸序列的片段可通过使用双功能或衍生化试剂(例如马来酰亚胺基苯甲酰基磺基琥珀酰亚胺酯(通过半胱氨酸残基缀合)、n-羟基琥珀酰亚胺(通过赖氨酸残基)、戊二醛、琥珀酸酐、socl或r1n=c=nr,其中r与r1为不同的烷基)缀合
至在要免疫的物种中具有免疫原性的蛋白(例如,钥孔血蓝蛋白、血清白蛋白、牛甲状腺球蛋白或大豆胰蛋白酶抑制剂)。
[0108]
如果期望,可以测序感兴趣的(例如,由杂交瘤产生)抗体(单克隆或多克隆),然后可以将多核苷酸序列克隆至用于表达或增殖的载体中。编码感兴趣的抗体序列可以在宿主细胞中的载体内维持,然后可扩增并冷冻所述宿主细胞以供将来使用。或者,多核苷酸序列可用于通过遗传操作以使抗体“人源化”或改善抗体的亲和力(亲和力成熟)或其他特征。例如,如果抗体用于临床试验及人的治疗,则恒定区可改造为更类似于人的恒定区以避免免疫反应。可能期望遗传操作抗体序列以获得对目标抗原的更大亲和力以及在抑制trop2活性方面更大的功效。对本领域技术人员而言显而易见的是,可对抗体进行一个或多个多核苷酸的改变,且仍保持其与目标抗原的结合特异性。
[0109]
在其他实施方案中,可通过使用已经被工程化以表达特定之人免疫球蛋白的市售小鼠来获得全人抗体。设计用于产生更期望(例如,全人抗体)或更强健的免疫反应的转基因动物也可用于产生人源化或人抗体。这种技术的实例为来自amgen,inc.(fremont,calif.)的xenomouse
rtm
以及来自medarex,inc.(princeton,n.j.)的humab-mouse
rtm
与tc mouse
tm
。在另一个替代方案中,可通过噬菌体展示技术或酵母菌技术重组制备抗体。参见,例如,美国专利第5,565,332号、第5,580,717号、第5,733,743号;以及第6,265,150号;以及winter等人(1994年)annu.rev.immunol.12:433-455。或者,可使用噬菌体展示技术(mccafferty等人,(1990年)nature 348:552-553)从来自未被免疫的供体的免疫球蛋白可变(v)结构域基因库中体外产生人抗体与抗体片段。
[0110]
在一些实施方案中,可从抗体库,例如噬菌体展示抗体库或酵母展示抗体库中分离能够结合trop2抗原的抗体。在一示例中,可以从单克隆抗体库中分离本文所述的抗trop2抗体,例如,依照us 2015/0153356中公开的方法,为了本文引用的目的或主题,其相关公开内容援引加入本文。
[0111]
可通过常规方法制备完整抗体(全长抗体)的抗原结合片段。例如,可以通过胃蛋白酶消化抗体分子产生f(ab')2片段,以及可通过还原f(ab')2片段的二硫键以产生fab片段。
[0112]
遗传工程改造的抗体,如人源化抗体、嵌合抗体、单链抗体以及双特异性抗体可通过例如常规重组技术产生。在一示例中,可使用常规方法(例如,通过使用能够特异性结合编码单克隆抗体的重链与轻链的基因的寡核苷酸探针)容易地分离并测序编码目标抗原特异性的单克隆抗体的dna。杂交瘤细胞是作为这种dna的优选来源。一经分离,可将dna置于一个或多个表达载体中,然后将其转染至宿主细胞内,如大肠杆菌细胞、猿猴cos细胞、中国仓鼠卵巢(cho)细胞或不另外产生免疫球蛋白的骨髓瘤细胞,以获得重组宿主细胞中单克隆抗体的合成。参见,例如,pct公开号wo 87/04462。然后可以修饰dna,例如,通过以人重链与轻链恒定结构域的编码序列取代同源鼠序列,morrison等人(1984年)proc.nat.acad.sci.81:6851,或通过共价连接非免疫球蛋白多肽的全部或部分编码序列到免疫球蛋白编码序列。以那样的方式,可以制备具有目标抗原结合特异性的遗传工程化抗体,例如“嵌合”或“杂合”抗体。
[0113]
为生产“嵌合抗体”所开发之技术是本领域众所周知的。参见,例如,morrison等人(1984年)proc.natl.acad.sci.usa 81,6851;neuberger等人(1984年)nature 312,604;以
及takeda等人(1984年)nature 314:452。
[0114]
构建人源化抗体的方法也是本领域众所周知的。参见,例如,queen等人,proc.natl.acad.sci.usa,86:10029-10033(1989年)。在一示例中,依照本领域已知的方法,对亲本非人抗体的vh及v
l
的可变区进行三维分子模型分析。接着,使用相同的分子模型分析来鉴定预测对正确的cdr结构的形成重要的框架氨基酸残基。平行地,使用亲本vh及v
l
序列作为搜索查询,从任何抗体基因数据库中鉴定具有与亲本非人抗体的氨基酸序列同源的氨基酸序列的人vh及v
l
链。然后选择为人vh及v
l
受体基因。
[0115]
所选择的人受体基因内的cdr区域可被来自亲本非人抗体或其功能变体的cdr区域取代。必要时,可使用预测在与cdr区域相互作用中具有重要作用的亲本链框架区域内的残基(参见上述说明)取代人受体基因中的相应残基。
[0116]
通过连接编码重链可变区的核苷酸序列与编码轻链可变区的核苷酸序列,可以通过重组技术制备单链抗体。优选地,在两个可变区之间包括柔性连接子。或者,描述的用于生产单链抗体的技术(美国专利第4,946,778号与第4,704,692号)可适用于产生噬菌体或酵母菌scfv文库,并且可以依照常规程序从文库中鉴定出trop2特异性的scfv克隆。可对阳性克隆进行进一步筛选以鉴定出抑制trop2活性的克隆。
[0117]
可以使用本领域众所周知的方法对依照本领域已知的及本文所述的方法所获得的抗体进行表征。例如,一种方法为鉴定抗原所结合的表位或“表位作图”。本领域已知许多方法用于作图及表征蛋白上的表位的定位,包括解决抗体-抗原复合物的晶体结构、竞争测定、基因片段表达测定以及基于合成肽的测定,例如,如harlow与lane,using antibodies,a laboratory manual,冷泉港实验室出版社,冷泉港,纽约,1999年,一书第11章所描述的。在另一示例中,表位作图可用于确定抗体结合的序列。表位可为线性表位,即,包含在单段(single stretch)氨基酸中,或由不一定包含在单段(一级结构线性序列)中的氨基酸的三维相互作用形成的构象表位。可以分离或合成不同长度(例如,至少4-6个氨基酸长)的肽,并用于与抗体的结合分析。在另一个示例中,抗体结合的表位可通过使用衍生自目标抗原序列的重叠肽在系统筛选中确定,并通过抗体的结合活性确定。根据基因片段表达分析,编码目标抗原的开放阅读框随机地或通过特异性遗传构建进行片段化,并确定表达的抗原片段与待测抗体的反应性。基因片段可以,例如,通过pcr产生,然后在放射性氨基酸存在下在体外转录并转译为蛋白。然后通过免疫沉淀与凝胶电泳确定抗体与放射性标记的抗原片段的结合。还可通过使用噬菌体颗粒表面上展示的大量随机肽序列库(噬菌体文库)来鉴定某些表位。或者,可以在简单结合分析中测试明确的重叠肽片段文库与待测抗体的结合。在另外的示例中,可以进行抗原结合结构域的诱变、结构域交换实验以及丙氨酸扫描诱变,以鉴定表位结合所需的、足够的和/或必需的残基。例如,可以使用目标抗原的突变体进行结构域交换实验,其中trop2多肽的各个片段已被来自紧密相关但抗原性不同的蛋白的序列替换(交换)。通过评估抗体与突变体trop2的结合,可以评估特定抗原片段对抗体结合的重要性。
[0118]
或者,可以使用已知结合相同抗原的其它抗体来进行竞争分析,以确定抗体是否与其它抗体结合在相同的表位上。竞争分析是本领域技术人员众所周知的。
[0119]
在一些示例中,抗trop2抗体通过如下所示例的重组技术制备。
[0120]
编码如本文所述的抗trop2抗体的重链与轻链的核酸可以克隆至一个表达载体
中,每个核苷酸序列可操作地连接到合适的启动子。在一示例中,编码重链与轻链的每个核苷酸序列可操作地连接到不同的启动子。或者,编码重链与轻链的核苷酸序列可以与单个启动子可操作地连接,使得重链与轻链都可由相同的启动子表达。必要时可在重链与轻链编码序列之间插入内部核醣体进入位点(ires)。
[0121]
在一些示例中,编码抗体两条链的核苷酸序列被克隆到两个载体中,其可以被导入至相同或不同的细胞中。当两条链在不同的细胞中表达时,每一条都可以从表达其的宿主细胞中分离出来,并将分离的重链与轻链混合并在合适的条件下孵育以形成抗体。
[0122]
通常,使用本领域已知的方法,可以将编码抗体的一条或所有链的核酸序列与合适的启动子可操作地连接地克隆到合适的表达载体中。例如,核苷酸序列与载体可以在合适的条件下与限制酶接触,以在每个分子上产生互补末端,其可以彼此配对并用连接酶连接在一起。或者,合成的核酸连接子可以连接到基因的末端。这些合成的连接子含有对应于载体中特定限制酶位点的核酸序列。表达载体/启动子的选择取决于用于产生抗体的宿主细胞的类型。
[0123]
多种启动子可用于如本文所述的抗体的表达,包括,但不限于,巨细胞病毒(cmv)立即早期启动子、病毒ltr(例如劳斯肉瘤(rous sarcoma)病毒ltr、hiv-ltr、htlv-1 ltr)、猿猴病毒40(sv40)早期启动子、大肠杆菌lac uv5启动子以及单纯疱疹病毒启动子。
[0124]
还可使用可调节的启动子。这类可调节的启动子包括使用来自大肠杆菌的lac阻遏物作为转录调节剂(transcriptional modulator)以调节来自携带有lac操纵子的哺乳动物细胞启动子的转录的那些[brown,m.等人,cell,49:603-612(1987年)],使用四环霉素阻遏物(tetr)的那些[gossen,m.与bujard,h.,proc.natl.acad.sci.usa 89:5547-5551(1992年);yao,f.等人,human gene therapy,9:1939-1950(1998年);shockelt,p.等人,proc.natl.acad.sci.usa,92:6522-6526(1995年)]。其他系统包括fk506二聚体、vp16或p65,使用雌二醇(astradiol)、ru486、二酚米乐甾酮(diphenol murislerone)或雷帕霉素(rapamycin)。可诱导的系统可从invitrogen、clontech以及ariad获得。
[0125]
可以使用含有带有操纵子的阻遏物的可调节启动子。在一实施方案中,来自大肠杆菌的lac阻遏物可作为转录调节剂,以调节来自携带有lac操纵子的哺乳动物细胞启动子的转录[m.brown等人,cell,49:603-612(1987年)];gossen与bujard(1992年);[m.gossen等人,natl.acad.sci.usa,89:5547-5551(1992年)]将四环霉素阻遏物(tetr)与转录活化剂(vp16)组合以产生tetr-哺乳动物细胞转录活化剂融合蛋白,tta(tetr-vp16),与源自人巨细胞病毒(hcmv)的主要立即早期启动子的携带有teto的最小启动子组合,以产生用于控制哺乳动物细胞中的基因表达的tetr-tet操纵子系统。在一实施方案中,使用四环霉素诱导型开关。四环霉素阻遏物(tetr)单独,而非tetr-哺乳动物细胞转录因子融合衍生物,可以作为有效的反式调节剂,以调节哺乳动物细胞中的基因表达,当四环霉素操纵子适当地位于cmvie启动子的tata元件的下游时(yao等人,human gene therapy)。这种四环霉素诱导型开关的一个特别的优点是不需使用四环霉素阻遏物-哺乳动物细胞反式活化剂或阻遏物融合蛋白,其在一些情况下可能对细胞具有毒性(gossen等人,natl.acad.sci.usa,89:5547-5551(1992年);shockett等人,proc.natl.acad.sci.usa,92:6522-6526(1995年)),以实现其可调节的效用。
[0126]
此外,载体可以包含,例如,以下的一些或全部:选择性标记基因,例如用于在哺乳
动物细胞中选择稳定或瞬时转染子的新霉素基因;用于高水平转录的来自人cmv的立即早期基因的增强子/启动子序列;用于mrna稳定性的来自sv40的转录终止与rna加工信号;用于适合的游离型复制(episomal replication)的sv40多瘤复制起始点与cole1;内部核醣体结合位点(ireses)、多样化多克隆位点;以及用于体外转录正义与反义rna的t7及sp6 rna启动子。用于生产含有转基因的载体的合适载体及方法是本领域众所周知且可用的。
[0127]
可用于实施本文所述的方法的多聚腺苷酸化信号的实施例包括,但不限于,人胶原蛋白i多聚腺苷酸化信号、人胶原蛋白ⅱ多聚腺苷酸化信号,以及sv40多聚腺苷酸化信号。
[0128]
可将包含编码任何所述抗体的核酸的一种或多种载体(例如,表达载体)导入合适的宿主细胞中以产生抗体。宿主细胞可以在合适的条件下培养以表达抗体或其任何多肽链。这些抗体或其多肽链可通过常规方法(例如,亲和性纯化)从培养的细胞(例如,从细胞或培养物上清液)回收。如果需要,抗体的多肽链可以在合适的条件下孵育合适的一段时间,以允许抗体的生产。
[0129]
在一些实施方案中,如本文所述的用于制备抗体的方法涉及编码抗trop2抗体的重链与轻链两者的重组表达载体,又如本文所述。可通过常规方法,例如,磷酸钙介导的转染,将重组表达载体导入合适的宿主细胞(例如,dhfr-cho细胞)中。可在合适的条件下选择及培养阳性转化体宿主细胞,允许形成抗体的两条多肽链的表达,其可以从细胞或培养基中回收。必要时,从宿主细胞回收的两条链可以在允许形成抗体的合适条件下孵育。
[0130]
在一示例中,提供两种重组表达载体,一种编码抗trop2抗体的重链,另一种编码抗trop2抗体的轻链。可通过常规方法,例如,磷酸钙介导的转染,将两种重组表达载体导入合适的宿主细胞(例如,dhfr-cho细胞)中。或者,可将每种表达载体导入合适的宿主细胞中。可在允许表达抗体多肽链的合适条件下选择并培养阳性转化体。当两种表达载体被导入相同的宿主细胞时,其中产生的抗体可以从宿主细胞或培养基中回收。如果需要,可以从宿主细胞或培养基中回收多肽链,然后在合适条件下孵育以形成抗体。当两种表达载体被导入不同的宿主细胞时,它们之中的每一个可以从相应的宿主细胞或相应的培养基中收获。然后可以在合适的条件下孵育该两条多肽链以形成抗体。
[0131]
使用标准分子生物学技术来制备重组表达载体、转染宿主细胞、选择转化体、培养宿主细胞并从培养基中回收抗体。例如,可以通过蛋白a或蛋白g偶联基质的亲和色谱分析法分离某些抗体。
[0132]
编码如本文所述的抗trop2抗体的重链、轻链或二者的任何核酸,含有这样的核酸的载体(例如,表达载体);以及包含所述载体的宿主细胞皆在本公开的范围内。
[0133]
抗体-药物缀合物
[0134]
本公开还提供抗体药物缀合物,其包含本文所述的任何抗trop2抗体,其与治疗剂共价连接。
[0135]
本文所用的术语“抗体-药物缀合物”或“adc”是指缀合物,其中本文所述的抗trop2抗体与治疗剂共价连接。通常,这个抗体-药物缀合物可以包括所述抗trop2抗体、治疗剂,以及任选存在的位于抗体与治疗剂之间的连接子。通过将治疗剂递送至抗体所靶向的trop2
+
细胞,具体而言,trop2
+
癌细胞,adc可以提高治疗效果。抗体-药物缀合物可通过本领域已知的多种制备抗体-药物缀合物的方法来制备。
[0136]
本文所述的adc中的治疗剂可为毒素、化学治疗剂、抗生素、adp-核糖基转移酶、放射性同位素或溶核酶(nucleolytic enzyme)。在某些情况下,治疗剂为细胞毒性剂。示例包括,但不限于,蒽环类、奥利斯达汀(auristatin)(例如,奥利斯达汀e)、喜树碱(camptothecin)、康普瑞汀(combretastain)、多拉司他汀(dolastatin)、倍癌霉素(duocarcincin)、烯二炔、格尔德霉素(geldanamycin)、吲哚-苯二氮杂二聚体(indolino-benzodiazepine dimer)、美登素(maytansine)、嘌呤霉素、吡咯并苯二氮杂二聚体、紫杉烷、长春花生物碱(vinca alkaloid)、微管溶素(tubulysin)、hemiasterlin、剪接抑素(spliceostatin)、普拉地内酯(pladienolide),以及卡奇霉素(calicheamicin)。
[0137]
在一些实施方案中,所述抗trop2抗体与治疗剂通过连接子连接。这样的连接子可为可裂解的连接子,例如,在一定ph条件下可裂解(ph敏感的连接子)、可被蛋白酶裂解(蛋白酶敏感的连接子)或在谷胱甘肽存在下可裂解(谷胱甘肽敏感的连接子)。在一些示例中,连接子包含蛋白酶切割位点,其可包含2-5个氨基酸残基,其可被合适的蛋白酶识别和/或切割。这样的肽可包含天然存在的氨基酸残基、非天然存在的氨基酸残基或其组合。在一示例中,肽连接子可为二肽连接子。实例包括缬氨酸-瓜氨酸(val-cit)连接子、苯丙氨酸-赖氨酸(phe-lys)连接子或马来酰亚胺基己酸-缬氨酸-瓜氨酸-对氨基芐氧基羰基(vc)连接子。或者,连接子可为不可裂解的,例如,包含任选经取代的烷烃或硫醚的连接子。
[0138]
在一些示例中,连接子可包含可与抗体形成共价键的官能基团。示例性的官能基团包括,但不限于,马来酰亚胺基团、碘乙酰胺基团、乙烯基砜基团、丙烯酸酯基团、丙烯酰胺基团、丙烯腈基团或甲基丙烯酸酯基团。在一些情况下,连接子可包含一种或多种反应性胺,包括,但不限于,乙酰基赖氨酸-缬氨酸-瓜氨酸-对氨基芐氧基羰基(aclys-vc-pabc)或氨基peg6-丙酰基。参见,例如,wo2012/059882。其他示例性的连接子包括磺基琥珀酰亚胺基-4-[n马来酰亚胺甲基]环己烷-1-甲酸(sulfosuccinimidyl-4-[nmaleimidomethyl]cyclohexane-1-carboxylate,smcc)。磺基-smcc的缀合是通过马来酰亚胺基团进行的,其与巯基(硫醇,-sh)反应,而其磺基-nhs酯则对伯胺具有反应性(如在赖氨酸与蛋白或肽n端中发现的)。
[0139]
在一些示例中,连接子可包含分子间隔子,例如式i的部分:其中r1可为任选经取代的c
1-6
烷基(例如,c
1-3
烷基)、任选经取代的苯基、任选经取代的c
2-6
亚烷基、任选经取代的c
2-6
亚烯基、任选经取代的c
2-6
亚炔基或任选经取代的三唑;和/或x可为o、s或n。
[0140]
将细胞毒性剂或其他治疗剂与抗体缀合的方法是本领域已知的,并且已在各种出版物中描述。例如,为发生缀合反应,可通过赖氨酸侧链胺或还原链间二硫键而活化的半胱氨酸巯基对抗体进行化学修饰。参见,例如,tanaka等人,febs letters 579:2092-2096,(2005年),以及gentle等人,bioconjug.chem.15:658-663(2004年)。还描述了在抗体的特定位点工程化的反应性半胱氨酸残基,用于通过明确的化学计量比进行特异性药物缀合。参见,例如,junutula等人,nature biotechnology,26:925-932,(2008年)。在wo2012/059882、strop等人chem.biol.20(2):161-167(2013年),以及farias等人,bioconjug.chem.25(2):245-250(2014年)中也描述了在转谷氨酰胺酸酶和胺(例如,用反
应性胺修饰的细胞毒性剂)存在下,使用通过多肽工程化而具有反应性的含有酰基供体的谷氨酰胺标签和/或内源性谷氨酰胺的缀合。出于引用的目的及主题,将这些出版物的相关公开内容援引加入本文。
[0141]
嵌合抗原受体(car)与表达这样的受体的免疫细胞
[0142]
本公开特征还在于靶向trop2的嵌合抗原受体以及表达这种受体的免疫细胞。本文所公开的嵌合抗原受体(cars)为人造细胞表面受体,其将表达这种受体的免疫细胞(例如,t细胞)的结合特异性重定向至trop2
+
细胞,例如上皮来源的癌细胞,从而消除目标疾病细胞,通过例如,免疫细胞的效应子活性。car构建体通常包含与至少一个细胞内信号传导结构域融合的胞外抗原结合结构域。cartellieri等人,j biomed biotechnol 2010:956304,2010年。胞外抗原结合结构域可为单链抗体片段(scfv),对trop2抗原具有特异性,且细胞内信号传导结构域可以介导导致免疫细胞活化的细胞信号传导。如此,表达trop2特异性的car构建体的免疫细胞可与表达trop2的患病细胞(例如,肿瘤细胞)结合,导致免疫细胞的活化与患病细胞的消除。
[0143]
本文所述的任何抗trop2抗体均可用于产生本文所述的car构建体。例如,可使用常规重组技术将抗trop2抗体的vh及v
l
结构域融合至细胞内信号传导结构域以产生car构建体。在一些示例中,抗trop2的vh及v
l
结构域通过肽连接子连接以形成scfv片段。
[0144]
本文公开的car构建体可包含一个或多个细胞内信号传导结构域。在一些示例中,car包含细胞内信号传导结构域,其包括基于免疫受体酪氨酸的激活基序(immunoreceptor tyrosine-based activation motif,itam)。这样的细胞内信号传导结构域可来自cd3ζ。另外,car构建体可进一步包含一个或多个共刺激信号传导结构域,其可来自共刺激受体,例如,来自4-1bb(cd137)、cd7、cd27、cd28、cd40、ox40、icos、gitr、hvem、tim1或lfa-1。
[0145]
本文公开的car构建体可进一步包含跨膜铰链结构域,其可获自合适的细胞表面受体,例如cd28或cd8。
[0146]
本发明还提供编码本文公开的任何抗trop2 car的分离的核酸分子及载体,以及包含所述核酸分子或载体的宿主细胞,例如宿主免疫细胞(例如,t细胞以及天然杀伤细胞)。包含trop2特异性抗体结合片段的表达抗trop2 car的免疫细胞可用于治疗表达trop2的癌症。因此,本文还提供通过选择患有表达trop2的癌症的对象,并向所述对象给药治疗有效量的表达靶向trop2的car的免疫细胞来治疗所述患有trop2
+
癌症的对象的方法。
[0147]
药物组合物
[0148]
如本文所述的抗trop2抗体、编码核酸或核酸集、包含这样的核酸的载体或包含所述载体的宿主细胞,以及包含所述抗trop2抗体的adc和/或表达靶向trop2的car的免疫细胞,可与药学上可接受的载剂(carrier)(赋形剂)混合,以形成用于治疗目标疾病的药物组合物。“可接受”是指载剂必须与组合物的活性成分(并且优选地,能够稳定活性成分)兼容,且对要治疗的对象无害。药学上可接受的赋形剂(载剂)包括本领域众所周知的缓冲液。参见,例如,remington:the science and practice of pharmacy第20版(2000年)lippincott williams and wilkins出版社,k.e.hoover编辑。
[0149]
用于本发明方法的药物组合物可包含冻干制剂或水溶液形式的药学上可接受的载剂、赋形剂或稳定剂。(remington:the science and practice of pharmacy第20版(2000年)lippincott williams and wilkins出版社,k.e.hoover编辑)。可接受的载剂、赋
形剂或稳定剂所使用的剂量及浓度对受者无毒,并可包含缓冲液,例如,磷酸、柠檬酸以及其它有机酸;抗氧化剂,包括抗坏血酸与甲硫氨酸;防腐剂(例如,十八烷基二甲基芐基氯化铵;氯化六甲双铵;苯扎氯铵,芐索氯铵;苯酚,丁醇或苯甲醇;对羟基苯甲酸烷基酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)多肽;蛋白,如,血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单醣、二醣以及其他碳水化合物,包括葡萄糖、甘露糖或葡聚醣;螯合剂,如edta;糖类,如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐的抗衡离子,如钠;金属复合物(例如,zn-蛋白复合物);和/或非离子界面活性剂,如tween
tm
、pluronics
tm
或聚乙二醇(peg)。
[0150]
在一些示例中,如本文所述的药物组合物包括含有可通过本领域已知的方法制备的抗体(或编码核酸或adc)的脂质体,如epstein等人,proc.natl.acad.sci.usa 82:3688(1985年);hwang等人,proc.natl.acad.sci.usa 77:4030(1980年);以及美国专利第4,485,045号以及第4,544,545号。具有增强的循环时间的脂质体描述于美国专利第5,013,556号。特别有用的脂质体可通过含有磷脂酰胆碱、胆固醇以及peg-衍生的磷脂酰乙醇胺(peg-pe)的脂质组合物的反相蒸发法产生。脂质体通过规定的孔径的过滤器挤出,以产生具有期望的直径的脂质体。
[0151]
抗体、编码核酸或adc也可包埋在微胶囊中,微胶囊通过,例如,凝聚(coacervation)技术或界面聚合(interfacial polymerization)分别制备,例如,羟甲基纤维素或明胶微胶囊以及聚-(甲基丙烯酸甲酯)微胶囊,在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米颗粒以及纳米胶囊)或在宏乳状液(macroemulsion)中。这类技术是本领域已知的,参见,例如,remington,the science and practice of pharmacy第20版,mack出版社(2000年)。
[0152]
在其它示例中,如本文所述的药物组合物可以配制成持续释放形式。持续释放制备品的合适实例包括,含有抗体的固体疏水性聚合物的半透性基质,所述基质为成形制品的形式,例如,薄膜或微胶囊。持续释放基质的实例包括聚酯、水凝胶(例如,聚(2-羟乙基-甲基丙烯酸酯)或聚(乙烯醇))、聚交酯(美国专利第3,773,919号)、l-谷氨酸与7乙基-l-谷氨酸盐的共聚物、不可降解的乙烯-乙酸乙烯酯、可降解的乳酸-乙醇酸共聚物,例如,lupron depot
tm
(由乳酸-乙醇酸共聚物与醋酸亮丙瑞林组成的可注射微球体)、蔗糖乙酸异丁酸酯以及聚-d(-)-3-羟基丁酸。
[0153]
用于体内给药的药物组合物必须为无菌的。这通过,例如,通过无菌过滤膜过滤而容易实现。治疗性抗体组合物通常放置在具有无菌入口的容器中,例如,静脉内溶液袋或具有可被皮下注射针刺穿的瓶塞的小瓶。
[0154]
如本文所述的药物组合物可以为单位剂型,例如,片剂、丸剂、胶囊、粉末、颗粒、溶液或悬浮液或栓剂,用于口服、肠胃外或直肠给药,或通过吸入或吹入给药。
[0155]
为制备固体组合物,如片剂,可将主要活性成分与药物载剂混合,例如,常规压片成分,如玉米淀粉、乳糖、蔗糖、山梨糖醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或树胶,以及其它药物稀释剂,例如水,以形成含有本发明化合物或其无毒的药学上可接受的盐的均质混合物的固体预制组合物。当将这些预制组合物称为均质时,是指活性成分均匀地分散在整个组合物中,使得组合物可以容易地细分成同等有效的单位剂型,例如片剂、丸剂以及胶囊
剂。然后将固体预制组合物细分为上述类型的单位剂型,其含有0.1至约500mg的本发明的活性成分。新组合物的片剂或丸剂可以被包衣或以其它方式复合,以提供具有延长作用的优点的剂型。例如,片剂或丸剂可包含内部剂量与外部剂量组分,后者是在前者上的包封的形式。两种组分可以被肠溶层分开,其用于抵抗在胃中的崩解,并允许内部组分完整地进入十二指肠或延迟释放。有许多材料可用于这类肠溶层或包衣,这类材料包括多种聚合酸以及聚合酸与诸如虫胶、鲸蜡醇以及乙酸纤维素等材料的混合物。
[0156]
合适的表面活性剂包括,特别是,非离子试剂,例如,聚氧乙烯脱水山梨糖醇(polyoxyethylenesorbitan)(例如,tween
tm 20、40、60、80或85)以及其它脱水山梨糖醇(例如,span
tm 20、40、60、80或85)。具有表面活性剂的组合物会方便地包含0.05至5%的表面活性剂,并可为0.1至2.5%。应当理解,如果需要,可以加入其它成分,例如,甘露醇或其它药学上可接受的载剂。
[0157]
合适的乳液可使用市售的脂肪乳液制备,例如,intralipid
tm
、liposyn
tm
、infonutrol
tm
、lipofundin
tm
以及lipiphysan
tm
。活性成分可溶解在预混合乳液组合物中,或可溶解在油中(例如,大豆油、红花油、棉籽油、芝麻油、玉米油或杏仁油),以及磷脂(例如,卵磷脂、大豆磷脂或大豆卵磷脂)和水混合后形成的乳液。应当理解,可以加入其它成分,例如,甘油或葡萄糖,以调节乳液的张力。合适的乳液通常含有达20%的油,例如,5至20%。
[0158]
乳液组合物可为通过将抗体与intralipid
tm
或其组分(大豆油、卵磷脂、甘油及水)混合而制成的那些。
[0159]
用于吸入或吹入的药物组合物包括在药学上可接受的水性或有机溶剂或其混合物中的溶液和悬浮液,以及粉末。液体或固体组合物可含有如上所述合适的药学上可接受的赋形剂。在一些实施方案中,通过口服或鼻呼吸途径给药组合物以获得局部或全身效应。
[0160]
优选的无菌的药学上可接受的溶剂中的组合物可通过使用气体进行雾化。可以直接从雾化装置吸收雾化的溶液,或者雾化装置可附着至面罩、帐篷或间歇正压呼吸机上。溶液、悬浮液或粉末组合物可从以适当的方式递送制剂的装置给药,优选口服或鼻腔给药。
[0161]
治疗与诊断的方法
[0162]
如本文所述,任何抗trop2抗体、编码核酸或核酸集、包含这样的核酸的载体、包含抗trop2抗体的adc,以及表达靶向trop2的car的免疫细胞(例如,t细胞或nk细胞),可用于抑制和/或消除trop2
+
疾病细胞,例如trop2
+
癌细胞,进而有益于治疗与trop2
+
疾病细胞相关的疾病或病症。
[0163]
为实施本文公开的方法,可以通过合适途径将有效量的如本文所述的药物组合物给药于需要进行治疗的对象(例如,人),例如,静脉内给药,例如,通过一段时间的快速推注或连续输注,通过肌肉内、腹膜内、脑脊髓内、皮下、关节内、滑膜内、鞘内、口服、吸入或局部途径。用于液体制剂的市售喷雾器,包括喷射式喷雾器以及超声雾化器可用于给药。液体制剂可以直接雾化,而冻干粉末可以在复溶(reconstitution)后雾化。或者,如本文所述的抗体可使用氟碳制剂与计量吸入器雾化,或作为冻干及研磨的粉末吸入。
[0164]
通过本文描述的方法治疗的对象可为哺乳动物,更佳为人。哺乳动物包括,但不限于,农场动物、运动动物、宠物、灵长类动物、马、狗、猫、小鼠以及大鼠。需要治疗的人对象可为患有、有风险或疑似患有与trop2
+
疾病细胞相关的目标疾病/病症的人患者。在一些实施方案中,trop2
+
疾病细胞为癌细胞,例如上皮癌细胞(即,衍生自上皮细胞)。实例包括,但不
限于,卵巢癌细胞、乳腺癌细胞、肾癌细胞、肺癌细胞、结肠直肠癌细胞以及脑癌细胞。可通过常规医学检查,例如实验室检查、器官功能检查、ct扫描或超声来鉴定患有目标疾病或病症的对象。疑似患有任何此类目标疾病/病症的对象可能显示出疾病/病症的一种或多种症状。有疾病/病症风险的对象可为具有那个疾病/病症的一种或多种风险因素的对象。
[0165]
如本文所用,“有效量”是指对对象赋予治疗效果所需的每种活性剂的量,不论是单独或与一种或多种其它活性剂组合地给药。在一些实施方案中,治疗效果为降低trop2活性或trop2
+
细胞的活性。确定抗体或包含这样的抗体的其他治疗剂(例如,adc或car-t细胞)的量是否达到治疗效果对于本领域技术人员而言是显而易见的。如本领域技术人员所认识的,有效量取决于所治疗的特定病症、病症的严重程度,个体患者参数(包括年龄、身体状况、尺寸、性别以及体重)、治疗持续时间、合并治疗的性质(如果有)、特定的给药途径,以及卫生从业人员的知识及专长以内的类似因素。这些因素是本领域普通技术人员众所周知的,并且仅通过常规实验即可解决。通常优选使用单个组分或其组合的最大剂量,即根据合理医学判断的最高安全剂量。
[0166]
经验上的考虑,如半衰期,通常会有助于剂量的确定。例如,可使用与人免疫系统兼容的抗体(例如,人源化抗体或全人抗体)来延长抗体的半衰期,并防止抗体被宿主的免疫系统攻击。可在治疗过程中确定并调整给药频率,且通常,但不是必需,基于目标疾病/病症的治疗和/或抑制和/或改善和/或延迟。或者,抗体的持续连续释放制剂可能是合适的。用于实现持续释放的各种制剂及装置是本领域已知的。
[0167]
在一示例中,如本文所述的抗体的剂量可以在给药一种或多种抗体的个体中依照经验来确定。给予个体递增剂量的拮抗剂。为评估拮抗剂的功效,可以遵循疾病/病症的指标。
[0168]
通常,为给药如本文所述的任何抗trop2抗体或包含这样的抗体的adc,初始候选剂量可为约2mg/kg。为了本公开的目的,典型的日剂量可为约0.1μg/kg至3μg/kg至30μg/kg至300μg/kg至3mg/kg、至30mg/kg至100mg/kg或更多中的任何剂量,取决于上述因素。对于几天或更长时间的反复给药,取决于病症,治疗持续到发生所期望的症状缓解,或达到足够的治疗程度以减轻目标疾病或病症或其症状为止。示例性的剂量给药方案包含给药约2mg/kg的初始剂量,随后每周维持剂量为约1mg/kg的抗体,或每隔一周约1mg/kg的维持剂量。然而,其他剂量方案可能是有用的,这取决于从业者希望实现的药物动力学衰变的模式。例如,考虑每周一至四次的剂量给药。在一些实施方案中,可以使用约3μg/mg至约2mg/kg(例如,约3μg/mg、约10μg/mg、约30μg/mg、约100μg/mg、约300μg/mg、约1mg/kg以及约2mg/kg)的剂量。在一些实施方案中,剂量给药频率为每周、每2周、每4周、每5周、每6周、每7周、每8周、每9周或每10周一次;或每月、每2个月或每3个月或更长时间一次。通过常规技术与测定法容易监测这种疗法的进展。剂量给药方案(包括使用的抗体)可随时间变化。
[0169]
为了本公开的目的,如本文所述的抗体的合适剂量会取决于所使用的特异性抗体、抗体和/或非抗体肽(或其组合物),疾病/病症的类型以及严重程度、抗体的给药是出于预防或治疗目的、先前的治疗、患者的临床病史及对拮抗剂的应答,以及主治医师的判断。通常,临床医师会给药抗体,直到达到期望结果的剂量。在一些实施方案中,期望的结果为血栓形成的减少。确定剂量是否导致所期望结果的方法对于本领域技术人员会是显而易见的。一种或多种抗体的给药可为连续的或间歇的,这取决于,例如,受者的生理状况、给药目
的为治疗性或是预防性的,以及熟练之从业者已知的其它因素。抗体的给药可以为在预选的时间段内基本连续的,或者可为一系列间隔的剂量,例如,在目标疾病或病症发展之前、期间或之后。
[0170]
如本文所用,术语“治疗”是指将包括一种或多种活性剂的组合物应用或给药于对象,其患有目标疾病或病症、疾病/病症的症状,或具有对疾病/病症的倾向,目的为治愈、治疗、缓解、减轻、改变、补救、改善、改进,或影响病症、疾病症状或对疾病或病症的倾向。
[0171]
缓解目标疾病/病症包括推迟疾病的发展或进展,或降低疾病严重程度。缓解疾病并不一定需要治疗结果。如其中所使用的,“延迟”目标疾病或病症的发展意指推迟、阻止、减缓、妨碍、稳定和/或延缓疾病进展。这样的延迟可为不同的时间长度,取决于疾病的历史和/或被治疗的个体。一种“延迟”或减轻疾病发展,或推迟疾病发病的方法,为减少在给定时间框架内发展一种或多种疾病症状的可能性,和/或在给定的时间框架内减少症状程度的方法,与未使用这种方法进行比较。这种比较通常基于临床研究,使用足以给出统计学显著结果的多个对象。
[0172]
疾病的“发展”或“进展”意指疾病的初始表现和/或随后的进展。可使用本领域众所周知的标准临床技术检测并评估疾病的发展。然而,发展也指可能无法检测的进展。为了本公开的目的,发展或进展是指症状的生物学过程。“发展”包括发生、复发及发病。如本文所用,目标疾病或病症的“发作”或“发生”包括初始发作和/或复发。
[0173]
在一些实施方案中,如本文所述的抗体以足以将一种或两种目标抗原的体内活性抑制至少20%(例如,30%、40%、50%、60%、70%、80%、90%或更高)的量给药于需要治疗的对象。在其它实施方案中,所述抗体以有效将一种目标抗原的活性程度降低至少20%(例如30%、40%、50%、60%、70%、80%、90%或以上)的量给药。
[0174]
医学领域的普通技术人员已知的常规方法,可用于根据待治疗的疾病的类型或疾病的部位,而向对象给药药物组合物。这种组合物也可通过其它常规途径给药,例如,口服、肠胃外、通过吸入喷雾、局部性、直肠、鼻腔、口腔、阴道或经由植入的储库给药。本文所用的术语“肠胃外”包括皮下、皮内、静脉内、肌内、关节内、动脉内、滑膜内、胸骨内、鞘内、病灶内以及颅内注射或输注技术。此外,其可通过可注射的储库途径给药于对象,例如使用1-、3-或6个月储库注射或可生物降解的材料及方法。在一些示例中,在眼内或玻璃体内给药药物组合物。
[0175]
可注射的组合物可含有各种载剂,如植物油、二甲基乙酰胺、二甲基甲酰胺、乳酸乙酯、碳酸乙酯、肉荳蔻酸异丙酯、乙醇以及多元醇(甘油、丙二醇、液体聚乙二醇等)。对于静脉注射,可通过滴注法给药水溶性抗体,由此输注含有抗体及生理学上可接受的赋形剂的药物制剂。生理上可接受的赋形剂可包括,例如,5%右旋糖、0.9%盐水、林格氏溶液或其它合适的赋形剂。可将肌内制剂,例如,抗体的合适的可溶性盐形式的无菌制剂溶解并在药物赋形剂中给药,例如注射用水、0.9%盐水或5%葡萄糖溶液。
[0176]
在一实施方案中,抗体通过位点特异性或靶向局部递送技术给药。位点特异性或靶向局部递送技术的实例包括,抗体的各种可植入式储库来源或局部递送导管,例如输注导管、留置导管或针导管、合成移植物、外膜包裹物、分流器和支架或其它可植入装置、位点特异性载剂直接注射或直接应用。参见,例如,pct公开号wo 00/53211以及美国专利第5,981,568号。
[0177]
还可使用含有反义多核苷酸、表达载体或亚基因组多核苷酸的治疗组合物的靶向递送。受体介导的dna递送技术描述于,例如,findeis等人,trends biotechnol.(1993年)11:202;chiou等人,gene therapeutics:methods and applications of direct gene transfer(j.a.wolff编辑)(1994年);wu等人,j.biol.chem.(1988年)263:621;wu等人,j.biol.chem.(1994年)269:542;zenke等人,proc.natl.acad.sci.usa(1990年)87:3655;wu等人,j.biol.chem.(1991年)266:338。
[0178]
在基因治疗方案中,含有多核苷酸(例如,编码如本文所述的抗体的那些)的治疗组合物在约100ng至约200mg的dna范围内给药,以进行局部给药。在一些实施方案中,还可在基因治疗方案中使用约500ng至约50mg、约1μg至约2mg、约5μg至约500μg以及约20μg至约100μg的dna或更多的浓度范围。
[0179]
如本文所述的治疗性多核苷酸及多肽可使用基因递送媒介递送。基因递送媒介(vehicle)可为病毒或非病毒来源的(参见,总体地,jolly,cancer gene therapy(1994年)1:51;kimura,human gene therapy(1994年)5:845;connelly,human gene therapy(1995年)1:185;以及kaplitt,nature genetics(1994年)6:148)。可使用内源哺乳动物或异源启动子和/或增强子来诱导这类编码序列的表达。编码序列的表达可为组成型或调节型。
[0180]
用于递送所期望的多核苷酸与在所期望的细胞中的表达的基于病毒的载体是本领域众所周知的。示例性的基于病毒的媒介包括,但不限于,重组逆转录病毒(参见,例如,pct公开号wo 90/07936、wo 94/03622、wo 93/25698、wo 93/25234、wo 93/11230、wo 93/10218、wo 91/02805;美国专利第5,219,740号以及第4,777,127号;英国专利第2,200,651号;以及欧洲专利第0 345 242号),基于甲病毒的载体(例如,辛德毕斯(sindbis)病毒载体、塞姆利基(semliki)森林病毒(atcc vr-67;atcc vr-1247)、罗斯河(ross river)病毒(atcc vr-373;atcc vr-1246),以及委内瑞拉马脑炎(venezuelan equine encephalitis)病毒(atcc vr-923;atcc vr-1250;atcc vr1249;atcc vr-532)),以及腺相关病毒(aav)载体(参见,例如,pct公开号wo 94/12649、wo 93/03769、wo 93/1919、wo 94/28938、wo 95/11984以及wo 95/00655)。还可使用与杀灭的腺病毒连接的dna的给药,如curiel,hum.gene ther.(1992年)3:147所描述的。
[0181]
还可使用非病毒递送媒介及方法,包括,但不限于,与单独杀灭的腺病毒连接或未连接的聚阳离子缩合dna(参见,例如,curiel,hum.gene ther.(1992年)3:147);配体连接的(ligand-linked)dna(参见,例如,wu,j.biol.chem.(1989年)264:16985);真核细胞递送媒介细胞(参见,例如,美国专利第5,814,482号;pct公开号wo 95/07994、wo 96/17072、wo 95/30763以及wo 97/42338)以及核酸电荷中和(nucleic charge neutralization)或与细胞膜融合。也可使用裸dna。示例性的裸dna导入方法描述于pct公开号wo 90/11092以及美国专利第5,580,859号。可作为基因递送媒介的脂质体描述于美国专利第5,422,120号;pct公开号wo 95/13796、wo 94/23697、wo 91/14445;以及欧洲专利第0524968号中。其他方法描述于philip,mol.cell.biol.(1994年)14:2411,以及woffendin,proc.natl.acad.sci.(1994年)91:1581。
[0182]
本文所述方法中使用的特定剂量方案,即剂量、时间和重复,会取决于特定对象及对象的病史。
[0183]
当将表达靶向trop2的car的免疫细胞用于疾病治疗时,可通过输注治疗有效剂量
的这类免疫细胞,例如t淋巴细胞或nk细胞,以每公斤体重约105至10
10
(个细胞/kg)或更多细胞来治疗患者。输注重复的频率和次数可根据患者的耐受性进行,直到达到所期望的应答。适当的输注剂量及时间表因患者而异,但可由治疗医师针对特定患者确定。通常,会输注大约106个细胞/kg的初始剂量,升级到108个或更多细胞/kg。il-2可共同给药以扩增输注的细胞。il-2的量可以约为每平方米体表1-5x106国际单位。
[0184]
在一些实施方案中,可将一种以上的抗体或抗体与另一合适的治疗剂的组合给药于需要治疗的对象。所述抗体、包含这样的抗体的adc和/或car-t细胞也可与用于增强和/或补充试剂效力的其他试剂联合使用。
[0185]
可通过本领域公知的方法评估针对目标疾病/病症的治疗功效。
[0186]
本文所述的任何抗trop2抗体也可用于检测样品中trop2
+
细胞的存在或水平。这种诊断测定可在体外或体内进行。
[0187]
抗trop2抗体与可检测的标记(例如,成像剂,例如造影剂)缀合,以用于体内或体外的诊断目的。如本文所用,“缀合的(conjugated)”或“附接的(attached)”是指两个实体相关联,优选地具有足够的亲和力以实现两个实体之间的关联的治疗/诊断益处。两个实体之间的关联可为直接的,也可通过连接子,例如聚合物连接子。缀合的或附接的可包括共价或非共价键合以及其他形式的关联,例如包埋,例如,一实体在另一实体上或之内,或这两个实体其中之一或二者都在第三实体之上或之内,例如胶束(micelle)。
[0188]
在一示例中,如本文所述的抗trop2抗体可附接于可检测标记,所述可检测标记为能够直接或间接释放可检测信号的化合物,进而配适体(aptamer)可于体外或体内检测、测量和/或定性。这类“可检测标记”的实例意图包括,但不限于,荧光标记、化学发光标记、比色标记、酶标记、放射性同位素以及亲和标记,如生物素。可通过常规方法将这类标记直接或间接地缀合至配适体。
[0189]
在一些实施方案中,可检测标记为适合于体内对trop2
+
细胞成像的试剂,其可为放射性分子、放射性药物或氧化铁颗粒。适用于体内成像的放射性分子包括,但不限于,
122
i、
123
i、
124
i、
125
i、
131
i、
18
f、
75
br、
76
br、
76
br、
77
br、
211
at、
225
ac、
177
lu、
153
sm、
186
re、
188
re、
67
cu、
213
bi、
212
bi、
212
pb以及
67
ga。适用于体内成像的示例性放射性药物包括
111
in羟喹啉、
131
i碘化钠、
99m
tc美溴非林(mebrofenin)、
99m
tc红细胞、
123
i碘化钠、
99m
tc依沙美肟(exametazime)、
99m
tc聚合白蛋白(macroaggregate albumin)、
99m
tc美罗酸盐(medronate)、
99m
tc巯替肽(mertiatide)、
99m
tc奥昔膦酸盐(oxidronate)、
99m
tc喷替酸盐(pentetate)、
99m
tc高锝酸盐(pertechnetate)、
99m
tc sestamibi、
99m
tc硫胶体、
99m
tc替曲膦(tetrofosmin)、铊-201以及氙-133。报告剂还可为染料,例如荧光基团,其用于检测由组织样品中的trop2
+
细胞介导的疾病。
[0190]
为进行体外诊断测定,可使抗trop2抗体与疑似含有trop2
+
细胞的样品接触。抗体及样品可在合适的条件下作用一段合适的时间,以使抗体与trop2抗原结合。然后可通过常规方法例如elisa或facs检测这种相互作用。为在体内进行诊断测定,可将适量的与标记物偶联的抗trop2抗体给药需要检查的对象。可通过常规方法基于从标记释放的信号来检测标记的抗体的存在。
[0191]
用于治疗与诊断的试剂盒
[0192]
本公开还提供用于抑制和/或消除trop2
+
疾病细胞从而减轻与这类疾病细胞相关
的疾病/病症的试剂盒。这类试剂盒可包括一个或多个容器,其包含抗trop2抗体、包含这样的抗体的adc或表达靶向trop2的car多肽的免疫细胞,例如任何本文所述的的那些。
[0193]
在一些实施方案中,试剂盒可包含用于根据如本文所述的任何方法的说明。所包括的说明可包含对抗trop2抗体、adc或免疫细胞的给药的描述,以治疗、推迟发作或减轻如本文所述的那些目标疾病。试剂盒可进一步包含基于鉴定个体是否患有目标疾病来选择适合于治疗个体的描述。在其他实施方案中,该指示说明包含对有目标疾病风险的个体给药抗体、adc或免疫细胞的描述。
[0194]
关于使用抗trop2抗体、包含这样的抗体的adc或表达靶向trop2的car的免疫细胞的说明,通常包括关于意图治疗的剂量、剂量给药计划表以及给药途径的信息。容器可为单位剂量、批量包装(例如,多剂量包装)或亚单位剂量。在本发明的试剂盒中提供的说明通常是在标签或包装插页(例如,试剂盒中包括的纸张)上的书面说明,但是机器可读取的说明(例如,磁性或光学存储碟上携带的说明)也是可以接受的。
[0195]
标签或包装插页指示组合物用于治疗、推迟发作和/或减轻与trop2
+
细胞相关的疾病或病症,例如上皮癌。可以提供说明用于实施如本文所述的任何方法。
[0196]
本发明的试剂盒置于合适的包装中。合适的包装包括,但不限于,小瓶、瓶子、罐、软性包装(例如,密封的聚酯薄膜或塑料袋)等。还考虑用于与特定装置组合使用的包装,例如,吸入器、鼻部给药装置(例如,雾化器)或例如微型泵的输注装置。试剂盒可具有无菌入口(例如,容器可为静脉内溶液袋或具有可被皮下注射针刺穿的瓶塞的小瓶)。容器也可以具有无菌入口(例如,容器可为静脉内溶液袋或具有可被皮下注射针刺穿的瓶塞的小瓶)。组合物中的至少一种活性剂为抗trop2抗体、包含这样的抗体的adc或表达如本文所述的靶向trop2的car的免疫细胞。
[0197]
套组试剂盒可选择性地提供附加组件,例如,缓冲液以及解释信息。通常,试剂盒包含在容器上或与容器相关联的标签或包装插页。在一些实施方案中,本发明提供包含上述试剂盒的内容物的制品。
[0198]
本文还提供用于检测样品中的trop2
+
细胞的试剂盒。这样的试剂盒可包含本文所述的任何抗trop2抗体。在一些情况下,所述抗trop2抗体可与如本文所述的可检测标记缀合。如本文所用,“缀合的”或“附接的”是指两个实体相关联,优选地具有足够的亲和力以实现两个实体之间的关联的治疗/诊断益处。两个实体之间的关联可为直接的,也可通过连接子,例如聚合物连接子。缀合或附接可包括共价或非共价键合以及其他形式的关联,例如包埋,例如,一实体在另一实体上或之内,或这两个实体其中之一或二者皆在第三实体之上或之内,例如胶束。
[0199]
替代地或另外地,试剂盒可包含能够结合抗trop2抗体的第二抗体。试剂盒可进一步包含使用抗trop2抗体检测trop2
+
的说明。
[0200]
一般技术
[0201]
除非另有说明,本公开的实践将使用在本领域技术范围内的分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学以及免疫学的常规技术。在文献中完全解释了这类技术,例如molecular cloning:a laboratory manual,第二版(sambrook等人,1989年)冷泉港出版社;寡核苷酸合成(m.j.gait编辑,1984年);methods in molecular biology,humana出版社;cell biology:a laboratory notebook(j.e.cellis编辑,1989年)
academic出版社;动物细胞培养(r.i.freshney编辑,1987年);细胞与组织培养介绍(j.p.mather与p.e.roberts,1998年)plenum出版社;cell and tissue culture:laboratory procedures(a.doyle、j.b.griffiths,以及d.g.newell编辑,1993-8年)j.wiley and sons出版社;酵素学方法(academic出版社公司);handbook of experimental immunology(d.m.weir与c.c.blackwell编辑);哺乳动物细胞的基因转移载体(j.m.miller与m.p.calos编辑,1987年);current protocols in molecular biology(f.m.ausubel,等人编辑,1987年);pcr:聚合酶连锁反应(mullis等人编辑,1994年);current protocols in immunology(j.e.coligan等人编辑,1991年);molecular protocols in molecular biology(wiley and sons出版社,1999年);免疫生物学(c.a.janeway与p.travers,1997年);抗体(p.finch,1997年);抗体:一种实用的方法(d.catty编辑,irl出版社,1988-1989年);单克隆抗体:一种实用的方法(p.shepherd与c.dean编辑,oxford university出版社,2000年);使用抗体:实验室手册(e.harlow与d.lan(冷泉港实验室出版社,1999年);the antibodies(m.zanetti与j.d.capra编辑,harwood academic出版社,1995年);dna cloning:a practical approach,第i及ii卷(d.n.glover编辑,1985年);nucleic acid hybridization(b.d.hames与s.j.higgins编辑,1985年);transcription and translation(b.d.hames与s.j.higgins编辑,1984年);animal cell culture(r.i.freshney编辑,1986年);immobilized cells and enzymes(lrl出版社)(1986年);以及b.perbal,a practical guide to molecular cloning(1984年);f.m.ausubel等人(编辑)。
[0202]
无需进一步的阐述,相信本领域技术人员可基于上述描述最大限度地利用本发明。因此,以下特定具体实施例会解释为仅仅是说明性的,而非以任何方式限制本公开其余的部分。为了本文引用的目的或主题,本文所引用的所有出版物援引加入。
[0203]
实施例
[0204]
实施例1:抗trop2抗体的产生
[0205]
试剂与一般方法
[0206]
杂交瘤细胞培养基(pfhm
‑ⅱ
无蛋白杂交瘤培养基;#12040077)购自thermo fisher。
[0207]
使用标准方法以及thermo fisher(#15596018)的trizol试剂分离rna。使用来自takara的cdna合成试剂盒(primescriptⅱ第一链cdna合成试剂盒;#6210a)产生所得的cdna分子。使用takara的premix taq(#rr901a)进行抗体v区扩增。标准pcr引物集(ig-primer sets#tb326)获自novagen。使用标准技术将基因克隆到pet28a载体(novagen;#69864)中,包括使用ecori、hindⅲ、sali以及t4连接酶(均来自neb)。使用qiaexⅱgel extraction试剂盒(qiagen,#20021)以纯化部分而非全部寡核苷酸分子。
[0208]
mda-468与hepg2细胞培养物在37℃以及5%co2的环境中作为单层培养物体外培养。根据需要定期传代肿瘤细胞。
[0209]
筛选抗体库以发现抗trop2抗体
[0210]
如之前在us 2015/0153356中所述,使用蛋白质组以及肽抗原的混合物生成大的单克隆抗体库(总计》100,000)。抗体库被分为一系列高密度抗体阵列,然后再针对癌症肿瘤样品以及fda正常组织组进行筛选。
[0211]
发现抗体库内的许多抗体(trop2-ab7、trop2-ab8、trop2-ab22、trop2-ab40、trop2-ab46、trop2-ab50以及trop2-ab51)差异地靶向mda-468细胞系。用抗体进行免疫沉淀,然后进行质谱分析,可将目标蛋白鉴定为trop2。随后使用标准反义寡核苷酸技术敲除trop2,并过度表达trop2,确认trop2为这些抗体的靶标。
[0212]
抗体克隆的生产
[0213]
将单个杂交瘤克隆培养于含有10ml杂交瘤细胞培养基(不含pfhm
‑ⅱ
蛋白的杂交瘤培养基)的t25烧瓶中。细胞于37℃下生长直至80%满。然后除去培养基,并用1x pbs洗涤细胞两次。将trizol试剂(1ml体积)直接加入到烧瓶中,并通过移液混合而将细胞裂解。然后从t25烧瓶中回收细胞裂解物,并使用标准方法分离总rna。随后用nanodrop 2000(thermo fisher)测量rna浓度。然后根据takara primescriptⅱ第一链cdna合成试剂盒方法从分离的rna中产生链cdna。然后按照novagen的使用方法tb326对所得cdna的杂交瘤v区进行扩增。如下表3所示的引物对用于扩增:
[0214]
表3.用于扩增编码抗trop2抗体的核酸的引物
[0215][0216]
[0217]
用1%琼脂凝胶检查pcr产物。使用qiagen gel extraction试剂盒回收阳性pcr产物,然后使用对应于引物序列的限制酶(来自neb)将其克隆到pet28a载体中。将插入有pcr产物的pet28a载体转化到dh5α细菌细胞中,并在氨芐青霉素阳性琼脂板上进行培养。使用muiggvh3'-2、muigkvl3'-1或muiglvl3'-1引物为每个细菌克隆用sanger测序。比较获得的序列的一致性,以分别确认目标vh及v
l
序列。然后在igmt数据库(http://www.imgt.org/)上分析vh及v
l
序列,以提供vh及v
l
的v区域、框架区以及cdr元件。
[0218]
实施例2:抗trop2抗体的评估
[0219]
使用胰蛋白酶-edta部分消化,然后用1000rpm离心5分钟,收获过度表达trop2的mda-468细胞(trop2
+
mda-468)以及对trop2表达阴性的hepg2细胞(trop2-hepg2)。将细胞重新悬浮于冷的pbs中并等分。将抗trop2抗体在pbs中稀释,并添加至trop2
+
mda-468细胞或trop2-hepg2细胞。混合细胞溶液,在黑暗中于4℃孵育,并用pbs洗涤,然后添加二抗缀合物(用于检测)。孵育后,将细胞用pbs洗涤,用固定剂固定,然后进行facs分析。如图1a-1g所示,这些抗体表现出与trop2
+
mda-468的饱和结合。这些抗体未表现出与trop2-hepg2的饱和结合。
[0220]
使用elisa滴定实验在抗原结合测定中测试抗体。将抗体与不同浓度的重组trop2蛋白[rprotein]孵育。所有抗体以<0.1至0.19nm的亲和力结合,如下表4所示。
[0221]
向mda-468细胞剂量给药全部七个抗trop2抗体克隆。为了实验的目的,剂量给药单独igg作为对照实验。剂量给药后,确定细胞活力以评估所有抗体克隆的间接细胞毒性。在两种细胞系中,抗trop2抗体使细胞活力降低至总活力的26-45%,ic
50
值在27-99pm之间,如下表4以及图2a-2g所示。igg对照抗体不会导致细胞活力的显著丧失。
[0222]
表4.抗trop2抗体的特征
[0223][0224]
其他实施方案
[0225]
本说明书中公开的所有特征可以任何组合形式来进行组合。本说明书中公开的每个特征可以由用于相同、等同或相似目的的替代特征所代替。因此,除非另有明确说明,否则所公开的每个特征仅仅为等效或类似特征的通用系列的示例。
[0226]
从上面的描述中,本领域技术人员可以轻易地确定本发明的基本特征,并且在不脱离其内涵及范围的情况下,可以对本发明进行各种改变与修改,以使其适应各种用途及条件。因此,其它实施方案也在权利要求书内。
[0227]
等同物
[0228]
虽然本文已描述并阐明了几个本发明的实施方案,但是本领域普通技术人员会容
易想出各种其他手段和/或结构,用于执行功能和/或获得结果和/或本文所述的一个或多个优点,且这类变化和/或修改中的每一个被认为包含在本文所述的发明实施方案的范围内。更一般地,本领域技术人员将容易理解到,如本文所述的所有参数、尺寸、材料及配置目的为示例性的,且实际参数、尺寸、材料和/或配置会取决于本发明的教导用于的特定应用或应用。本领域技术人员会认识到或仅使用常规实验来确定如本文所述的具体发明实施方案的许多等同物。因此,应当理解,前述实施方案仅以示例的方式呈现,且在所附的权利要求书及其等同物的范围内,发明实施方案可以不同于具体描述及请求保护的方式实施。本公开的发明实施方案涉及如本文所述的每个单独特征、系统、物品、材料、试剂盒和/或方法。此外,如果这些特征、系统、物品、材料、试剂盒和/或方法不相互矛盾,则两个或更多个这样的特征、系统、物品、材料、试剂盒和/或方法的任何组合都包括在本公开的发明范围内。
[0229]
本文所定义的及使用的所有定义应理解为优于字典定义、援引加入的文献中的定义和/或所定义的术语的普通含义。
[0230]
本文中公开的所有参考文献、专利及专利申请,相对于主题引用的每个,均援引加入,在某些情况下其可包含整个文件。
[0231]
在本说明书及权利要求书中使用的定冠词“一种”以及“一个”,除非明确指出相反意思,否则应理解为“至少一个”。
[0232]
权利要求书中使用的短语“和/或”应理解为是指所结合的元件中的“一个或两个”,即,在某些情况下元件结合存在,而在另一情况下则分开存在。用“和/或”列出的多个元件应该以相同的方式来解释,即,“一个或多个”元件如此地结合。除了用“和/或”子句特别标识的元件外,其他元件可任选地存在,不论与这些特别标识的元件相关或不相关。因此,作为非限制性的实例,当结合诸如“包含”的开放式语言使用时,对“a和/或b”的引用可以在一示例中仅指a(任选地包括除了b之外的元件);在另一实施方案中,则仅指b(任选地包括除了a之外的元件);在另一实施方案中,则指a与b(任选地包括其它元件);等等。
[0233]
如本说明书及权利要求书中所使用的,“或”应理解为具有与上述定义的“和/或”相同的含义。例如,当在列表中分离项目时,“或”或“和/或”应解释为包括的,即,包括多个元件或元件列表中的至少一个,但也包括多于一个,以及任选地包括其他未列出的项目。只有明确指出相反意思的术语,例如“只有一个”或“确切为一个”,或,当用于权利要求书中,“由...组成”时,会指仅列出多个元件或元件列表中的一个元件。一般而言,当前面放有排他性术语,例如“任一”、“之一”、“只有一个”或“确切为一个”时,本文所用的术语“或”应仅解释为表示排他性的替代品(即,“一个或另一个,但不是二者”)。当“主要由...组成”用于权利要求书中时,应具有其在专利法领域所使用的普通含义。
[0234]
权利要求书中所使用的,短语“至少一个”对于一个或多个元件的列表,应当理解为是指从元件列表中的任何一个或多个元件选择出的至少一个元件,但不一定包括具体列在元件列表中的各个及每个元件中的至少一个,且并不排除元件列表中的元件的任何组合。这个定义还允许任选地存在除了在短语“至少一个”所指的元件列表中具体标识的元件之外的元件,无论是与这些特定标识的元件相关或不相关的元件。因此,作为非限制性的实例,“a和b中的至少一个”(或等同地,“a或b中的至少一个”或等同地“a和/或b中的至少一个”),在一实施方案中,可以指至少一个,任选地包括多于一个,a,而没有b的存在(且任选
地包括除了b之外的元件);在另一个实施方案中,指至少一个,任选地包括多于一个,b,而没有a的存在(且任选地包括除了a之外的元件);在另一实施方案中,指至少一个,任选地包括多于一个,a,以及至少一个,任选地包括多于一个,b(且任选地包括其它元件);等等。
[0235]
还应当理解,除非明确指出相反意思,否则在本文所要求的任何包括多于一个步骤或动作的方法中,方法的步骤或动作的顺序不必限于所列举的方法的步骤或动作的顺序。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1