能够特异性靶向肿瘤细胞的嵌合抗原受体、其表达基因、其修饰的NK细胞及应用
能够特异性靶向肿瘤细胞的嵌合抗原受体、其表达基因、其修饰的nk细胞及应用
技术领域
1.本发明涉及一种嵌合抗原受体,特别是涉及一种能够特异性靶向肿瘤细胞的嵌合抗原受体、其表达基因及其修饰的nk细胞,以及在肿瘤治疗中的应用,属于肿瘤免疫治疗技术领域。
背景技术:
2.嵌合抗原受体(chimeric antigen receptor,car)是一种受体蛋白,它赋予免疫细胞新的能力,在肿瘤的免疫治疗中具有极具潜力的应用前景。嵌合抗原受体包括抗原结合结构域、跨膜结构域和共刺激信号结构域。它的细胞外抗原结合域通常为单链抗体(scfv),可以识别肿瘤细胞表面的特异性抗原。细胞内激活的信号结构域,如cd28、4-1bb(cd137)和ox40,通常起到触发免疫细胞激活和杀伤的作用。近年来,嵌合抗原受体修饰t细胞(car-t)在血液肿瘤治疗中的应用取得了成功,并成为肿瘤免疫治疗的临床热点。截止目前,已经有5款car-t产品获得美国fda批准上市,用于治疗血液癌症。2021年6月,中国也迎来了首款获批的car-t产品。但是car-t的应用受到固有风险的限制,例如,car-t会引起移植物抗宿主病(gvhd)与细胞因子释放综合征,以及car-t的产生需要患者自体t细胞导致治疗实施周期长等问题。
3.基于自然杀伤细胞(nk)细胞的特性,car-nk相比于car-t更具优势。首先,car-nk具有更好的安全性,主要指以下几个方面:1.由于nk细胞寿命很短,避免了如t细胞持续存在而引起的靶向效应;2.同种异体nk细胞输注耐受性良好,不会引起gvhd,因此car在异体nk细胞,nk92细胞系的应用成为可能,表明nk是一种更好的car载体,有望生产“通用型”产品;3.由于nk细胞活化不产生促炎性因子,因此几乎不会引起细胞因子释放综合征和神经毒性等不良反应。其次,nk细胞具有更强大的杀伤功能,除了通过car结构识别激活nk细胞发挥杀伤作用,nk细胞可通过表面各种受体识别配体从而杀伤肿瘤细胞,此外nk细胞还可通过cd16分子发挥adcc作用清除肿瘤细胞,表明car-nk具有更强大的杀伤能力。
4.car-nk的应用中最关键的是靶点的选择,目前现有的car结构中的胞外识别域一般主要为单链抗体(scfv),单链抗体具有特异性高的优点,因此在car-nk中被广泛应用。但是获得有效靶向肿瘤的单链抗体时间长,且难以获得,存在单链抗体序列的获得工艺复杂,耗时长、现有单链抗体对应的肿瘤靶点较少等问题。此外,并且单链抗体具有分子量较大的缺点,因此较难将两个以上单链抗体构建成为多价的胞外识别域,无法有效提高亲和力并减少脱靶。近年来有关car-nk技术的研究多使用单链抗体作为胞外识别结构域,hsiang-chi tseng等人构建了靶向肝癌gpc3的car-nk,证实了胞外信号可以转导激活nk细胞活化,证实了nk92细胞系的能用性。但更广泛的靶点选择仍是car-nk技术应用的难点。
技术实现要素:
5.本发明的主要目的在于提供一种能够特异性靶向肿瘤细胞的嵌合抗原受体,以克
服现有技术的不足。
6.本发明的另一目前还在于提供一种表达基因及嵌合抗原受体修饰的nk细胞,以及在制备用于治疗肿瘤的药物中的应用。
7.为实现前述发明目的,本发明采用的技术方案包括:
8.本发明实施例提供了一种能够特异性靶向肿瘤细胞的嵌合抗原受体,其包括依次连接的胞外抗原结合结构域、跨膜结构域和共刺激信号结构域,其中,所述胞外抗原结合结构域包含能够特异性靶向结合肿瘤细胞或病原的多肽。
9.在一些实施例中,所述胞外抗原结合结构域的蛋白多肽序列选自a1蛋白多肽序列的片段。
10.在一些实施例中,所述共刺激信号结构域包括2b4胞内区结构和cd3ζ胞内区结构,所述2b4胞内区结构的蛋白多肽序列选自2b4蛋白多肽序列的片段,所述cd3ζ胞内区结构的蛋白多肽序列选自cd3ζ蛋白多肽序列的片段。
11.在一些实施例中,所述能够特异性靶向肿瘤细胞的嵌合抗原受体的序列如seq id no.5所示。
12.本发明实施例还提供了一种表达基因,用于表达所述的能够特异性靶向肿瘤细胞的嵌合抗原受体。
13.本发明实施例还提供了一种表达载体,其中含有前述的表达基因。
14.本发明实施例还提供了一种能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞,所述nk细胞中能够表达前述的能够特异性靶向肿瘤细胞的嵌合抗原受体,或者所述nk细胞中导入了前述的表达基因,或者所述nk细胞中转染了前述的表达载体。
15.本发明实施例还提供了一种药物组合物,其包含作为有效成分的前述的能够特异性靶向肿瘤细胞的嵌合抗原受体、表达基因、表达载体,或者能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞。
16.进一步地,本发明实施例还提供了前述的能够特异性靶向肿瘤细胞的嵌合抗原受体、表达基因、表达载体、能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞,或者药物组合物在制备用于治疗和/或预防肿瘤疾病的药物中的应用。
17.较之现有技术,本发明的有益效果至少在于:
18.本发明所构建的能够特异性靶向肿瘤细胞的嵌合抗原受体及其修饰的nk细胞能特异性识别肿瘤细胞,激活nk细胞并产生细胞毒作用。此外,该特异性靶向肿瘤细胞的嵌合抗原受体中的多肽筛选工艺简单,实验室条件下能够筛选出具有针对肿瘤细胞高亲和力和特异性靶向作用的多肽,且可以将多个多肽进行融合构建成为多价-car-nk,提高car-nk对肿瘤细胞的特异性和靶向性。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
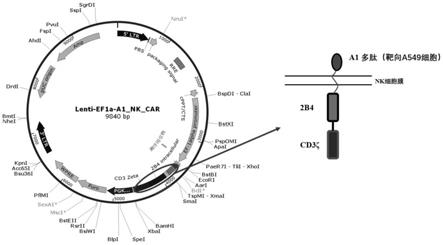
20.图1是本发明一典型实施例中car质粒的构建示意图;
21.图2a-图2e是本发明一典型实施例中慢病毒滴度检测结果示意图;
22.图3a-图3c是本发明一典型实施例中用流式细胞仪检测转染细胞apc荧光的阳性率结果示意图;
23.图4a-图4d是本发明一典型实施例中a1多肽-car-nk杀伤靶细胞测试结果示意图;
24.图5a和图5b是本发明一典型实施例中细胞培养上清中ifn-gamma的检测结果示意图。
具体实施方式
25.鉴于现有技术中的不足,本案发明人经长期研究和大量实践,尝试使用具有靶向性的多肽代替单链抗体,构建由具有靶向性的多肽作为胞外识别域、nkg2d作为跨膜结构域、2b4和cd3ζ链作为胞内激活信号结构域的能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞(下文可简称为多肽-car-nk)。筛选出能够特异性靶向某种肿瘤细胞的多肽时间较短,较易获得,且多肽分子量小,具有较强的靶向功能,同时既能保留car结构胞内激活域的功能有效激活细胞,也不影响nk细胞的杀伤活性。多肽-car-nk构建成功后,进一步通过体外细胞因子释放测定和肿瘤细胞杀伤实验鉴定其生物活性,证明多肽-car-nk介导的肿瘤细胞的杀伤作用,为多肽在car-nk技术中的应用提供理论依据,为下阶段多价多肽-car-nk针对更多靶点的应用提供基础。
26.本发明采用的术语解释如下:
27.嵌合抗原受体(chimeric antigen receptor,car)(chimeric antigen receptor,car)细胞疗法:是一种通过基因编辑技术来改造免疫细胞,从而有效的识别、攻击和消灭肿瘤细胞的特殊免疫疗法。嵌合抗原受体包括抗原结合结构域、跨膜结构域和共刺激信号传导区。
28.慢病毒滴度(titer):单位体积中有感染能力的病毒数目;单位:tu/ml(活性滴度单位)。
29.感染复数moi:一般将细胞有80%被感染时所用的病毒颗粒数和细胞数目的比值作为该株细胞的moi。moi值=病毒滴度(tu/ml)
×
病毒体积(ml)/细胞个数。
30.如下将对该技术方案、其实施过程及原理等作进一步的解释说明。
31.本发明实施例的一个方面提供的能够特异性靶向肿瘤细胞的嵌合抗原受体包括依次连接的胞外抗原结合结构域、跨膜结构域和共刺激信号结构域,其中,所述胞外抗原结合结构域包含能够特异性靶向结合肿瘤细胞或病原的多肽。
32.本发明采用的多肽具有替代单链抗体的潜质,相比于单链抗体,具有靶向性的多肽更易筛选得到,实验室条件下能够成功筛选出具有针对肿瘤细胞高亲和力和特异性靶向作用的多肽,且多肽的分子量也很小,可以将多个多肽进行融合构建成为多价多肽-car-nk,提高car蛋白对肿瘤细胞的特异性和靶向性,减少脱靶。
33.在一些实施例中,所述胞外抗原结合结构域的蛋白多肽序列选自a1蛋白多肽序列的片段。本发明中car结构中的胞外抗原结合结构域(亦可称为胞外识别域)除a1多肽外,还可使用其他具有靶向肿瘤或病原的多肽,或两种以上多肽联合使用构建多价多肽-car-nk。
34.进一步地,所述a1蛋白多肽序列具有如seq id no.1所示的核苷酸序列,具体为:ggccagagcggccagtggttctgcagctggtacggcggcgacacctgcgtgcagggcggccagagcggccag。
35.进一步地,所述a1蛋白多肽序列的片段为两种以上,可以多个多肽进行融合构建成为多价-car-nk,提高car对肿瘤细胞的特异性和靶向性。
36.在一些实施例中,所述跨膜结构域的蛋白多肽序列选自nkg2d蛋白多肽序列的片段。
37.进一步地,所述nkg2d蛋白多肽序列具有如seq id no.2所示的核苷酸序列,具体为:ccattttttttctgctgcttcatcgctgtagccatgggaatccgtttcattattatggtagca。
38.在一些实施例中,所述共刺激信号结构域包括2b4胞内区结构和cd3ζ胞内区结构,所述2b4胞内区结构的蛋白多肽序列选自2b4蛋白多肽序列的片段,所述cd3ζ胞内区结构的蛋白多肽序列选自cd3ζ蛋白多肽序列的片段。
39.进一步地,所述2b4蛋白多肽序列具有如seq id no.3所示的核苷酸序列,具体为:tggcgccgcaagcgcaaggagaagcagagcgagaccagccccaaggagttcctgaccatctacgaggacgtgaaggacctgaagacccgccgcaaccacgagcaggagcagaccttccccggcggcggcagcaccatctacagcatgatccagagccagagcagcgcccccaccagccaggagcccgcctacaccctgtacagcctgatccagcccagccgcaagagcggcagccgcaagcgcaaccacagccccagcttcaacagcaccatctacgaggtgatcggcaagagccagcccaaggcccagaaccccgcccgcctgagccgcaaggagctggagaacttcgacgtgtacagc。
40.进一步地,所述cd3ζ蛋白多肽序列具有如seq id no.4所示的核苷酸序列,具体为:cgcgtgaaattcagccgcagcgcagatgctccagcctaccagcaggggcagaaccagctctacaacgaactcaatcttggtcggagagaggagtacgacgtgctggacaagcggagaggacgggacccagaaatgggcgggaagccgcgcagaaagaatccccaagagggcctgtacaacgagctccaaaaggataagatggcagaagcctatagcgagattggtatgaaaggggaacgcagaagaggcaaaggccacgacggactgtaccagggactcagcaccgccaccaaggacacctatgacgctcttcacatgcaggccctgccgcctcggtga。
41.在一些更为具体的实施例中,所述能够特异性靶向肿瘤细胞的嵌合抗原受体包括依次串联的胞外抗原结合结构域、跨膜结构域、2b4胞内区结构和cd3ζ胞内区结构。
42.进一步地,所述嵌合抗原受体还包括标签序列,所述标签序列连接于胞外抗原结合结构域与跨膜结构域之间。
43.进一步地,所述标签序列包括myc-tag标签序列。
44.在一些更为具体的实施例中,所述能够特异性靶向肿瘤细胞的嵌合抗原受体的序列如seq id no.5所示,具体的,嵌合抗原受体基因序列为:atggccctccctgtcaccgccctgctgcttccgctggctcttctgctccacgccgctcggcccggccagagcggccagtggttctgcagctggtacggcggcgacacctgcgtgcagggcggccagagcggccaggagcagaagctgatcagcgaggaggacctgaccactaccccagcaccgaggccacccaccccggctcctaccatcgcctcccagcctctgtccctgcgtccggaggcatgtagacccgcagctggtggggccgtgcatacccggggtcttgacttcgcctgcgatccattttttttctgctgcttcatcgctgtagccatgggaatccgtttcattattatggtagcatggcgccgcaagcgcaaggagaagcagagcgagaccagccccaaggagttcctgaccatctacgaggacgtgaaggacctgaagacccgccgcaaccacgagcaggagcagaccttccccggcggcggcagcaccatctacagcatgatccagagccagagcagcgcccccaccagccaggagcccgcctacaccctgtacagcctgatccagcccagccgcaagagcggcagccgcaagcgcaaccacagccccagcttcaacagcaccatctacgaggtgatcggcaagagccagcccaaggcccagaaccccgcccgcctgagccgcaaggagctggagaacttcgacgtgtacagccgcgtgaaattcagccgcagcgcagatgctccagcctaccagcaggggcagaaccagctctacaacgaactcaatcttggtcggagagaggagtacgacgtgctggacaagcggagaggacgggacccagaaatgggcg
ggaagccgcgcagaaagaatccccaagagggcctgtacaacgagctccaaaaggataagatggcagaagcctatagcgagattggtatgaaaggggaacgcagaagaggcaaaggccacgacggactgtaccagggactcagcaccgccaccaaggacacctatgacgctcttcacatgcaggccctgccgcctcggtga。
45.进一步地,所述的能够特异性靶向肿瘤细胞的嵌合抗原受体蛋白的氨基酸序列如seq id no.6所示,具体为:malpvtalllplalllhaarpgqsgqwfcswyggdtcvqggqsgqeqkliseedltttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdpfffccfiavamgirfiimvawrrkrkekqsetspkefltiyedvkdlktrrnheqeqtfpgggstiysmiqsqssaptsqepaytlysliqpsrksgsrkrnhspsfnstiyevigksqpkaqnparlsrkelenfdvysrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr。
46.进一步地,所述肿瘤细胞包括非小细胞肺癌a549细胞,但不限于此。
47.本发明实施例的另一个方面还提供了一种表达基因,用于表达所述的能够特异性靶向肿瘤细胞的嵌合抗原受体。
48.本发明实施例的另一个方面还提供了一种表达载体,其中含有前述的表达基因。
49.在本说明书中,术语“表达载体”是能够在合适的宿主细胞中表达靶蛋白或靶rna的载体。本发明的基因序列可存在于载体中,其中该基因序列可操作地连接至能够提供用于通过适合的宿主细胞表达该基因序列的调节序列。在表达载体范畴中,术语“可操作地连接”意指感兴趣的基因序列以允许核酸表达的方式连接至(一个或多个)调节序列。术语“调节序列(或调控序列)”意在包括启动子、增强子以及其它表达控制元件。与表达载体的这种可操作连接能够通过本领域中已知的常规基因重组技术实现。
50.用于本发明的表达载体可包括质粒载体、粘粒载体、噬菌体载体、病毒载体等,但并不局限于此。
51.本发明实施例的另一个方面还提供了一种能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞,所述nk细胞中能够表达前述的能够特异性靶向肿瘤细胞的嵌合抗原受体,或者所述nk细胞中导入了前述的表达基因,或者所述nk细胞中转染了前述的表达载体。
52.在一些实施例中,所述nk细胞包括nk-92mi细胞、nk细胞或nk-92细胞等,但不限于此。也就是说,本发明中构建的car-nk除使用nk-92mi细胞系外,还可使用pbmcs中分离的nk细胞或nk92细胞系。
53.本发明实施例的另一个方面还提供了一种药物组合物,其包含作为有效成分的前述的能够特异性靶向肿瘤细胞的嵌合抗原受体、表达基因、表达载体,或者能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞。
54.进一步地,所述药物组合物还包括药学上可接受的药用载体和/或赋形剂。
55.本说明书中所述的“药用载体”具有本领域人员熟知的含义,其可包括任何及所有的溶剂、分散介质、涂层、表面活性剂、抗氧化剂、防腐剂(例如,抗细菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、凝胶、粘结剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料、类似物质及它们的组合。
56.本发明的药物组合物可以采用多种形式给药,例如可以通过注射给药,优选的,本发明的药物组合物可配制在水溶液,特别是生理兼容性缓冲液或生理盐水缓冲液中。这些注射制剂可以通过常规方法利用一种或多种分散剂、润湿剂和悬浮剂进行配制。
57.进一步地,本发明实施例的另一个方面还提供了前述的能够特异性靶向肿瘤细胞
的嵌合抗原受体、表达基因、表达载体、能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞,或者药物组合物在制备用于治疗和/或预防肿瘤疾病的药物中的应用。
58.进一步地,所述肿瘤疾病选自肺癌,但不限于此。
59.在一些更为具体的实施案例之中,本发明实施例的另一个方面还提供了能够特异性靶向肿瘤细胞的嵌合抗原受体修饰的nk细胞(多肽-car-nk)的构建方法,包括:
60.构建包含myc-tag标签、a1多肽、nkg2d跨膜域、2b4与cd3ζ链在内的慢病毒car目的质粒,并与慢病毒包装质粒pspax2、pmd2.9g一起包装成为car-慢病毒,car-慢病毒侵染nk92mi细胞后在nk细胞膜上成功表达car蛋白,表明成功构建car-nk。
61.本发明采用的检测方法为通过流式细胞仪检测nk细胞表明myc-tag标签的表达,验证car-nk构建成功,通过检测细胞因子验证car-nk细胞的活化,通过肿瘤细胞杀伤实验检测其细胞毒作用。如单链抗体(scfv)介导的靶向识别作用一样,本发明所构建的多肽-car-nk也能特异性识别肿瘤细胞,激活nk细胞并产生细胞毒作用。此外,单链抗体不易筛选,且分子量较大。而多肽-car-nk中的多肽易于筛选,且可以将多个多肽进行融合构建,提高多肽-car-nk对肿瘤细胞的特异性和靶向性。
62.进一步地,本发明中所用的检测杀伤技术,除使用本发明中d-荧光素钾检测活细胞中表达的荧光素酶,还可采用mtt法、cck8法检测效应细胞对肿瘤细胞的杀伤。
63.为更好的说明本发明的目的、技术方案和优点,下面将结合附图及典型实施案例对本发明的技术方案作更为详细的解释说明。以下所述的具体实施例仅用于进一步说明和解释本发明,并非是对本发明的限制;从本发明公开的内容联想到或导出的所有变形,均认为是本发明的保护范围。
64.1、car质粒的构建
65.利用基因合成方法将a1多肽序列(如seq id no.1所示)、跨膜序列nkg2d(如seq id no.2所示)、协同共刺激分子2b4(如seq id no.3所示)和胞内传递信号的cd3ζ(如seq id no.4所示)串联在一起,得到a1-nkg2d-2b4-ζ片段。然后通过亚克隆方法把a1-nkg2d-2b4-ζ片段克隆到慢病毒载体上,选用的慢病毒载体为lenti-ef1a_2
nd
_car。最终得到所需要的目的载体即lenti-ef1a-a1-nk_car(该质粒含有myc-tag标签,可用于后续检测),转化进入大肠杆菌top10菌株,用于后续慢病毒包装,质粒设计如附图1。
66.2、病毒的包装与滴度检测
67.慢病毒包装质粒的提取:
68.1)含有质粒的穿刺菌top10接种至lb液体培养基中活化,-80℃使用甘油保种。取冻存保种的甘油菌1:100接种于4ml含0.1%amp的lb培养基37℃摇床振荡活化4-6h,再转移至400ml含0.1%amp的lb培养基37℃摇床振荡培养12h。
69.2)按照倍沃医学质粒大量提取试剂盒说明书提取质粒,用紫外分光光度计检测质粒浓度和纯度,置于-20℃保存,用于后续的慢病毒包装。
70.慢病毒包装过程:
71.病毒包装细胞293t用dmem完全培养基(添加10%fbs,1%双抗)进行培养,隔天消化,消化用0.05%的胰酶。细胞密度70-80%时进行病毒包装操作。1号离心管中加入450μl无血清的dmem培养基中,以及载体lenti-ef1a-a1-nk_car质粒12μg,pspax2质粒9μg,pmd2.9g质粒4.5μg,充分混匀。2号离心管中转染试剂pei 75μl与400μl无血清dmem混匀,2
号离心管放置5min后加入到1号离心管中,充分混匀并室温静置20min。提前将细胞培养皿培养基换成无血清dmem培养基,将1号离心管中的混合液均匀滴入到培养皿中,轻轻晃动培养皿并置于37℃,5%co2中培养,3-4h后将无血清dmem培养基换成dmem完全培养基,20-24h再换一次新鲜培养基。48h开始可以回收293t细胞培养上清。4000rpm,4℃,离心10min,取上清,0.45μm滤膜过滤,293t中另补全dmem完全培养基,继续培养24h,可以再次收集病毒。将收集的病毒上清60000g离心2h,弃上清,用无血清α-mem培养基重悬沉淀,分装保存。长久保存置于-80℃。
72.慢病毒滴度检测:
73.前述设计的car质粒中包含myc-tag标签。将jurkat细胞(moi=20)接种至48孔板中,每孔1
×
105个。浓缩过的病毒液以0.1μl、1μl、10μl、100μl的梯度加入到48孔板中,选用的抗体为pe标记的anti-human myc-tag antibody,运用流式细胞术检测jurkat细胞上的目的标签myc-tag阳性表达率,根据阳性率等于病毒的感染效率,从而得出每微升病毒液中含有的病毒颗粒数。最终得到病毒滴度为3
×
107tu/ml,检测结果如图2a-图2e所示。
74.3、a1多肽-car-nk的构建
75.nk92mi细胞的培养:
76.nk92mi细胞用α-mem培养基(添加10%fbs,1%双抗,0.02mm叶酸,0.1mm巯基乙醇,0.2mm肌醇)进行培养,第0天接种,第一天半换液,第二天全换液。
77.慢病毒转染nk92mi细胞:
78.取1
×
106个nk-92mi细胞,离心去尽上清,加入浓缩过的lenti-ef1a-a1-nk_car病毒液(moi=20),混匀,置于37℃细胞培养箱中,6h后离心,将病毒液去除,细胞放入6孔板培养,72h后对转染过的nk-92mi细胞进行相关目的蛋白的检测及细胞毒性试验。
79.流式细胞术分析(flow cytometry,fc)目的蛋白的表达:
80.检测目的蛋白上的myc-tag标签,收集1
×
106个转染a1-car病毒的nk-92mi细胞(以后记为a1-car-nk92mi),并将未被基因修饰的nk-92mi细胞作为阴性对照,同时nk-92mi染抗体作为阳性对照。将收集到的细胞用myc-tag抗体(apc标记)4℃孵育30min,离心弃上清,pbs洗两次,然后用1mlpbs重悬细胞,最后用流式细胞仪检测转染细胞apc荧光的阳性率,结果如图3a-图3c所示,其中,图3a代表阴性对照,图3b代表阳性对照,图3c代表实验组,阳性率为48.32%。
81.4、a1多肽-car-nk杀伤靶细胞
82.靶细胞的培养:
83.靶细胞使用的是由本案发明人构建的可以稳定表达荧光素酶(luc)的a549-luc细胞和h460-luc细胞,其中h460-luc细胞作为对照。a549-luc细胞和h460-luc细胞用rpmi-1640完全培养基(添加10%fbs,1%双抗)进行培养,隔天消化,消化用0.05%的胰酶。细胞密度80%-90%时进行杀伤。
84.a1多肽-car-nk杀伤靶细胞:
85.设置效应细胞(car-nk/nk-92mi)与靶细胞(a549-luc/h46-luc)之比(效靶比,e:t)分别为0.5:1、1:1、2:1、5:1,每组设置三个复孔,并设置不加效应细胞的组为对照组。将效应细胞与靶细胞进行孵育,37℃、5%co2的细胞培养箱中孵育24h,加入d荧光素钾,37℃孵育5min,酶标仪检测各孔生物发光强度,生物发光强度与活细胞数量成正比,结果分别如
图4a-图4d所示。
86.5、细胞培养上清中ifn-gamma的检测
87.检测上述效靶比培养中nk92-mi或a1多肽-car-nk释放ifn-gamma的量,以验证效应细胞的活化水平,检测可以通过elisa的方法进行。elisa测试方法参考如下步骤进行:
88.在预包被ifn-gamma capture抗体的96孔板上加入300μl洗脱缓冲液,浸泡30s后倒去缓冲液,并在无纺布上面拍去残留液体。每孔依次加入50μl实验缓冲液,50μl样本上清以及实验缓冲液稀释的ifn-gamma detection抗体50μl,150rpm振荡,室温孵育120min。弃掉液体,每孔加入200μl洗液洗板,洗涤4次,每次1min,在无纺布上拍干。实验缓冲液稀释辣根过氧化物酶标记的链亲和素,每孔加入100μl,150rpm振荡,室温孵育45min,弃掉液体,每孔加入200μl洗液洗板,洗涤4次,每次1min,在无纺布上拍干。每孔加入100μl显色底物tmb,室温避光孵育约5min,每孔按次序加入100μl终止液,在30min之内用酶标仪测定450nm波长处的光吸收,并以测定570nm处的光吸收作为对照。光吸收值与ifn-gamma标准曲线对比即可得出细胞培养上清中的ifn-gamma的含量。标准曲线的绘制采用ifn-gamma标准样品进行。取500pg/ml ifn-gamma储存液,采用梯度稀释的方法稀释样本,设置因子梯度为:500pg/ml、250pg/ml、125pg/ml、62.5pg/ml、31.25pg/ml、15.63pg/ml、7.81pg/ml。以上实验的结果如图5a和图5b所示。
89.综上所述,本发明中的a1多肽-car-nk可以提高car-nk对a549细胞的杀伤能力。此外,由于单链抗体序列较难获得,使用单链抗体的选择有限。而相比于单链抗体,本发明所构建的a1多肽-car-nk中多肽筛选工艺简单,实验室条件下能够筛选出具有针对肿瘤细胞高亲和力和特异性靶向作用的多肽,且可以多个多肽进行融合构建成为多价-car-nk,提高car对肿瘤细胞的特异性和靶向性。
90.本发明的各方面、实施例、特征及实例应视为在所有方面为说明性的且不打算限制本发明,本发明的范围仅由权利要求书界定。在不背离所主张的本发明的精神及范围的情况下,所属领域的技术人员将明了其它实施例、修改及使用。
91.尽管已参考说明性实施例描述了本发明,但所属领域的技术人员将理解,在不背离本发明的精神及范围的情况下可做出各种其它改变、省略及/或添加且可用实质等效物替代所述实施例的元件。另外,可在不背离本发明的范围的情况下做出许多修改以使特定情形或材料适应本发明的教示。因此,本文并不打算将本发明限制于用于执行本发明的所揭示特定实施例,而是打算使本发明将包含归属于所附权利要求书的范围内的所有实施例。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1