一种葡聚寡糖的制备方法与流程
1.本发明涉及生物工程技术领域,涉及一种葡聚寡糖的制备方法,特别设计一种生物酶法降解可得然胶制备β-1,3-葡聚寡糖。
背景技术:
2.可得然胶是β-葡聚糖的一种,主要由微生物分泌而得。可得然胶由d-葡萄糖通过β-(1,3)-糖苷键连接而成,且无支链,分子量在4.4
×
104~1
×
105。可得然胶具有三股螺旋结构,不溶于水和乙醇等大多数的有机试剂,可在具有氢键破坏能力的溶液中溶解,比如ph>12的强碱性溶液、甲酸、二甲基亚砜(dmso)等。同时,它还具备加热后冷却凝胶的特性。此外,结合可得然胶粉末无色无味的特性,其常常作为食品添加剂被应用于食品工业中。相比之下,β-1,3-葡聚寡糖则存在较好的生物活性,比如诱导植物产生防御响应、免疫活性等。
3.目前,基于水解可得然胶制备β-1,3-葡聚寡糖的方法主要是酸水解。然而,酸水解效率较低,水解效率仅为25%左右,且产物聚合度跨度大;同时还造成环境污染等问题。生物法水解可得然胶制备β-1,3-葡聚寡糖是一种行之有效的、且绿色无污染的方法之一。研究表明,商业化的α-淀粉酶可水解可得然胶制备聚合度为1-9的β-1,3-葡聚寡糖,然而,水解产物宽泛的聚合度对于其后续的分离纯化,应用造成了较大的难度。因此,构建高效,窄聚合度的水解过程对于可得然胶来源的β-1,3-葡聚寡糖应用至关重要。
技术实现要素:
4.本发明的目的是提供一种高效酶解可得然胶制备窄聚合度的β-1,3-葡聚寡糖的方法。采用一种新的、可水解可得然胶的β-葡聚糖酶,经突变后,得到一种高效降解可得然胶的β-葡聚糖酶,其水解效率为80%-85%,β-1,3-葡聚寡糖聚合度为5-7。
5.为实现上述目的,本发明采用以下技术方案:
6.一种葡聚寡糖的制备方法,以可得然胶为原料,通过β-葡聚糖酶对其进行酶解制备葡聚寡糖。
7.所述的葡聚寡糖为β-1,3-葡聚寡糖,其聚合度为5-7。
8.所述的β-葡聚糖酶的反应条件为:1-8ml 1-30g/l可得然胶,1-4ml 1mpbs(ph 5.0-7.0),0.01-2ml 0.1-5g/lβ-葡聚糖酶,添加去离子水至反应体系为10ml。反应液置于30-70℃水浴锅,反应1-24h。反应结束后测定水解率,为45%-50%。
9.进一步优选地,反应温度为20-40℃,更优选的,反应温度为40℃。
10.pbs溶液优选为ph 6.0;
11.进一步优选地,反应时间为1-12h。
12.所述的β-葡聚糖酶来源于novosphingobium sp.p6w,氨基酸序列如seq id no.1所示,核苷酸序列如seq id no.3所示。
13.本发明以来源于novosphingobium sp.p6w的β-葡聚糖酶为模版,对其序列进行非定向进化,获得一种新型重组β-葡聚糖酶,其氨基酸序列如seq id no.2所示。突变后反应
更快,反应时间更短,水解效率更高。
14.所述β-葡聚糖酶的突变体(seq id no.2)是将seq id no.1所示的原始β-葡聚糖酶氨基酸序列第112位的脯氨酸置换为甘氨酸,第300位的亮氨酸置换为谷氨酸,第415位的异亮氨酸置换为酪氨酸。
15.一种β-葡聚糖酶的突变体,其氨基酸序列如seq id no.2所示。
16.编码seq id no.2所示β-葡聚糖酶的突变体的核苷酸序列。
17.一种表达载体,它包含所述β-葡聚糖酶基因或者β-葡聚糖酶突变体的基因。
18.一种重组菌,通过利用上述的表达载体转化宿主细胞获得的。
19.所述的β-葡聚糖酶突变体的反应条件为:1-8ml 1-30g/l可得然胶,1-4ml1m pbs(ph 6.0-8.0),0.01-2ml 0.5g/lβ-葡聚糖酶,添加去离子水至反应体系为10ml。反应液置于30-70℃水浴锅,反应1-24h。反应结束后测定水解率,为80%-85%。
20.优选地,可得然胶浓度为20g/l,β-葡聚糖酶溶液浓度为0.5g/l,pbs优选为ph 7.0。
21.进一步优选地,反应温度为30-60℃,更优选的,反应温度为40-50℃。
22.进一步优选地,反应时间为1-12h;更优选的,β-葡聚糖酶突变体的反应时间为1-4h。
23.本发明中,β-葡聚糖酶及其突变体能够高效酶解可得然胶制备窄聚合度(5-7)的β-1,3-葡聚寡糖,糖的分离在工业上是一个难点,通常需要上千万的模拟流动床设备,因此水解产物的组分越复杂,聚合度跨度越大,越不利于产品后续的分离纯化,本发明酶解所得β-1,3-葡聚寡糖聚合度窄,大大降低后续分离纯化的难度。
24.需要注意的是,“β-葡聚糖酶基因”还包括能编码具有与β-葡聚糖酶相同功能的蛋白的seq id no.3的突变形式,所述突变类型包括:确实、无义、插入、错义。本领域技术人员能够理解,作为遗传密码简并性的结果,许多不同的多核苷酸能够编码相同的多肽。另外,应当理解,本领域技术人员能够使用常规的技术进行核苷酸取代,所述取代不会影响本发明中所使用的多核苷酸编码的多肽序列。另外,还可以使用本领域中的已知的方法对多核苷酸进行修饰,以增强本发明多核苷酸在体内的活性或者存活期。
25.本领域技术人员可根据本发明提供的β-葡聚糖酶的氨基酸,根据密码子的简并性原则等自行调整其核苷酸序列以及功能等价体,这些经过调整的序列也在本发明请求保护的范围内。
26.有益效果:本发明提供了一种高效,绿色的降解可得然胶制备聚合度为5-7的β-1,3-葡聚寡糖的方法,水解率高。
附图说明
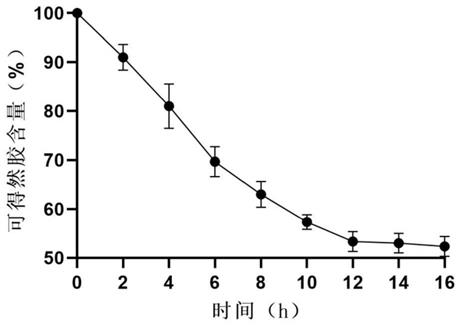
27.图1 β-葡聚糖酶野生型水解率测定;
28.图2 β-葡聚糖酶野生型水解可得然胶的水解产物分布;
29.图3 野生型与突变体的酶活测定;
30.图4 β-葡聚糖酶的最适ph测定;
31.图5 β-葡聚糖酶的最适温度测定;
32.图6 β-葡聚糖酶突变体水解率测定;
33.图7 β-葡聚糖酶突变体水解可得然胶的水解产物分布。
具体实施方式
34.为使本发明的目的、特征、优点能够更加的明显和易懂,下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,下面所描述的实施例仅仅是本发明一部分实施例,而非全部实施例。基于本发明中的实施例,本领域的技术人员所获得的所有其他实施例,都属于本发明保护的范围。
35.在以下实施例中,可得然胶的配置方法为:将20g可得然胶溶解于1l浓度为1m naoh溶液中,磁力过夜搅拌使其完全溶解。随后使用1m hcl将其ph调节至7,离心(6000g,20min)收集沉淀。沉淀经纯水洗涤三次后,向其加入纯水,使可得然胶终浓度为20g/l,随后匀浆,制备可得然胶悬浮液。
36.实施例1 β-葡聚糖酶的制备及其应用
37.β-葡聚糖酶的基因(序列如seq id no.3所示)由通用生物(安徽)股份有限公司合成所得,合成片段构建至pet-28a(+)载体中(酶切位点为:bamh i和ecor i)。随后将其转化至大肠杆菌bl21(de3),获得的重组菌株通过培养,培养基为lb培养基(nacl 1%,蛋白胨1%,酵母粉0.5%),培养条件为37℃,200rpm培养2-3小时,至od
600
在0.6-0.8之间,添加终浓度为1mm的iptg进行诱导表达,诱导表达的条件为:30℃,200rpm,进一步培养16小时,高压匀浆破碎,低温离心后收集上清,即为β-葡聚糖酶粗酶液。
38.β-葡聚糖酶粗酶液通过高亲和ni-nta纯化介质(购买自南京金斯瑞生物科技有限公司)纯化后,再经透析袋过滤并冷冻干燥后,即得β-葡聚糖酶粉末。
39.将上述的β-葡聚糖酶粉末用去离子水定容至0.5g/l,按如下体系进行酶解反应:2.5ml 20g/l可得然胶,2ml 1m柠檬酸盐缓冲溶液(ph 5.0),0.1ml0.5g/lβ-葡聚糖酶,额外添加5.4ml水。反应液置于40℃水浴锅,反应16h。每隔两小时取样一次(20ml),测定可得然胶的含量,以及反应终点的寡糖组成及转化率。
40.其中,可得然胶的含量测定方法如下:取10ml样品加热煮沸5min,随后高速离心(20000g,20min),收集沉淀,并烘干至很重,称量记录质量,为m1。此外,取10ml 0.5g/l的β-葡聚糖酶液,加热煮沸5min,随后高速离心(20000g,20min),收集沉淀,并烘干至恒重,称量记录质量,为m2。
41.可得然胶的含量(%)=(m
1-m2)/10
×
100
42.其中,寡糖组成的方法测定如下:以聚合度为2-10的壳寡糖为标准品,采用hplc对酶解寡糖组分的聚合度进行分析。色谱柱为shodex聚乙烯醇氨基柱(nh2p-50 4e),检测器为蒸发光检测器,流动相为乙腈/水(0-15min:70%-60%乙腈;15-25min:60%-50%;乙腈;25-30min:50%-70%乙腈),流速为1ml/min,柱温30℃。
43.结果如附图1和2所示,在酶解12h后趋于稳定,水解率为47.7%,此时,寡糖由葡聚5糖,葡聚6糖和葡聚7糖组成。
44.实施例2 β-葡聚糖酶突变体的筛选
45.使用genemorph ii random mutagenesis kit(安捷伦,美国)对目标片段进行随机突变。其中,使用的引物为gf(5
’‑
cagcaaatgggtcgcggatccgtgacgtcccccgatttcggc-3’)和gr(5
’‑
ttgtcgacggagctcgaattctcagttgccgtccggccacgcc-3’)。易错pcr体系为:重组质
粒2μl,引物gf和gr各1μl,mutazyme ii dna聚合酶1μl,dntps 1μl,10
×
mutazyme ii反应缓冲液5μl,用ddh2o补足至50μl。易错pcr反应条件为:95℃ 3min;95℃ 30s,55℃ 30s,72℃ 1.8min(30个循环);72℃ 5min。随后,通过柱回收后,通过in-fusion cloning连接至通过bamh i和ecor i双酶切的pet-28a(+)质粒,获得重组质粒。将重组质粒转化至大肠杆菌bl21(de3),用含卡那霉素的抗性平板进行筛选。
46.挑选所有的转化子至96深孔板(1ml lb)中,在37℃,200rpm培养2h后,用0.1m iptg进行诱导表达,随后在37℃,200rpm中继续培养8h。取100μl菌液至普通96孔板中,并额外加入50ml 10mm对-硝基苯-β-d-吡喃葡萄糖苷(pnpg),50ml 0.2m柠檬酸盐缓冲(ph 5.0)。反应10min后,立即加入2%磷酸三钠溶液(ph 12)终止反应,检测其在400nm处的吸收波长。以不同浓度的pnpg溶液做标曲,计算反应液中pnpg含量。其中,酶活的定义为:每分钟在ph 5和40℃下将1μmpnpg底物水解所需要的酶的数量。
47.相对酶活力(%)=β-葡聚糖酶突变体酶活
×
100/β-葡聚糖酶初始酶活
48.其中,最适ph的测试方法为,取100μl诱导表达的菌液至普通96孔板中,并额外加入50ml 10mm对-硝基苯-β-d-吡喃葡萄糖苷(pnpg),50ml 0.2m柠檬酸盐或磷酸盐缓冲调节ph至4、5、6、7、8、9、10;30℃下反应10min后测定并计算酶活。
49.其中,最适温度的测试方法为,取100μl诱导表达的菌液至普通96孔板中,并额外加入50ml 10mm对-硝基苯-β-d-吡喃葡萄糖苷(pnpg),50ml 0.2m柠檬酸盐缓冲(ph 6.0);在20、30、40、50、60、70、80℃下反应10min后测定并计算酶活。
50.实验结果如附图3所示,突变体1-63,突变体3-75,突变体6-22的酶活显著提升。其中,突变体3-75的酶活提升效果最显著,为β-葡聚糖酶初始酶活的272%。通过对突变体3-75的最适ph和最适温度的研究发现,与初始β-葡聚糖酶相比,均得到了显著的提升(图4、图5)。
51.实施例3 β-葡聚糖酶突变体的制备与应用
52.将突变体3-75过夜培养后,使用fastpure plasmid mini kit(南京诺维赞生物科技股份有限公司)提取突变体3-75的质粒,并送至通用生物(安徽)股份有限公司进行测序,其翻译后的氨基酸序列如seq id no.2所示。经对比发现,seq id no.2是将seq id no.1所示的原始β-葡聚糖酶氨基酸序列第112位的脯氨酸置换为甘氨酸,第300位的亮氨酸置换为谷氨酸,第415位的异亮氨酸置换为酪氨酸。
53.突变体3-75通过iptg诱导表达,高压匀浆破碎,低温离心后收集上清,即为β-葡聚糖酶突变体粗酶液。β-葡聚糖酶突变体粗酶液通过高亲和ni-nta纯化介质纯化后,再经透析袋过滤并冷冻干燥后,即得β-葡聚糖酶突变体的粉末。
54.将上述的β-葡聚糖酶突变体粉末用去离子水定容至0.5g/l,按如下体系进行酶解反应:2.5ml 20g/l可得然胶,2ml 1m磷酸盐缓冲溶液(ph 7.0),0.1ml 0.5g/lβ-葡聚糖酶,额外添加5.4ml水。反应液置于50℃水浴锅,反应8h。每隔两小时取样一次(20ml),测定可得然胶的含量,以及反应终点的寡糖组成及转化率。可得然胶含量和寡糖的测定如实施例1所述。
55.实验结果如图6和图7所示,在酶解4h后趋于稳定,水解率为82.3%,此时,寡糖由葡聚5糖,葡聚6糖和葡聚7糖组成。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1