从窃衣中分离的化合物及包含其作为有效成分的抗癌用药物组合物的制作方法
1.本发明涉及从窃衣中分离的化合物及包含其作为有效成分的抗癌用药物组合物。
背景技术:
2.尽管努力了几十年,但癌症至今仍在人类疾病致死原因中占据第一~第二位。这样的癌症是正常细胞在致癌物质或病毒等病因的作用下发生遗传变异而引起的,抗癌剂的开发和治疗是以不在正常细胞中表达而只在癌细胞中特异性表达的基因或蛋白质为靶标来开发的。抗癌剂为单独使用或与放射性疗法等其他治疗方法并用来治疗癌症的最普通且有效的治疗方法。通过上述抗癌剂来治疗癌症基于能够凋亡凋亡癌细胞的能力,但不仅凋亡癌细胞,还凋亡正常细胞,因此频繁诱发脱发、食欲不振、恶心、呕吐、呼吸困难、口腔炎、中性粒细胞减少性发热等副作用。根据患者的一般状态,这样的副作用会使抗癌剂治疗变为不可能,或者至少会给患者带来极度的不适和不便,会严重损害癌症患者的生活质量。
3.另一方面,已知窃衣(torilidis fructus)为伞形科(umbelliferae)的两年生草本小窃衣(torilis japonica(houtt.)dc.)的果实,辛且苦,性温无毒。在中文中也称为“蛇床子”。主要自生在沟渠或湿地中,由于蛇藏在窃衣草丛中并喜欢吃其种子而称为蛇床。高度为30cm~70cm,全身分布有细毛。叶为二次羽状复叶,长度为5cn~10cm,末端尖锐,叶柄末端包裹主干。果实长4mm~6mm,外形像稻种,表面密生刺毛。
4.在中医中,晾干其果实后制备的生药成为窃衣,药理效果有抗原虫作用、性激素相似作用等,在治疗女性的子宫凉症、抑制流感病毒和滴虫细菌的活动来在皮肤瘙痒症中也有效果,用作消炎剂或消除瘙痒的软膏。并且,窃衣对皮肤疾病也有治疗效果,因此也在皮肤湿疹、过敏性皮炎中使用。据报告,窃衣的主要成分含有窃衣素(torilin)、窃衣醇酮(torilolone)等倍半萜烯(sesquiterpene)类化合物。
5.另一方面,韩国授权专利第0159642号公开了含有窃衣素的抗癌及活性增强用组合物,韩国授权专利第1484709号公开了包含原野窃衣提取物作为有效成分的用于增强免疫及治疗或预防癌症的组合物,韩国授权专利第1485318号公开了包含窃衣提取物作为有效成分的用于预防或改善癌症的食品组合物及药物组合物,但尚无有关本发明的从窃衣中分离的化合物及包含其作为有效成分的抗癌用药物组合物的公开内容。
技术实现要素:
6.技术问题
7.本发明由上述要求导出,本发明提供从窃衣中分离的化合物及包含其作为有效成分的抗癌用组合物,本发明的化合物具有减少多种癌细胞的存活率且不给正常细胞的细胞存活率带来影响的效果,利用动物模型确认到具有减少肺癌及大肠癌的肿瘤的大小及重量的效果,从而完成了本发明。
8.技术方案
9.为了实现上述目的,本发明提供化学式1的化合物或其药学上可接受的盐。
10.并且,本发明提供包含化学式1或化学式2的窃衣素衍生物化合物或它们的药学上可接受的盐作为有效成分的抗癌用药物组合物。
11.并且,本发明提供包含化学式1或化学式2的窃衣素衍生物化合物或它们的食品学上可接受的盐作为有效成分的抗癌用保健功能食品组合物。
12.发明的效果
13.本发明涉及从窃衣中分离的化合物及包含其作为有效成分的抗癌用药物组合物,本发明的化合物具有减少多种癌细胞的存活率且不给正常细胞的细胞存活率带来影响的效果,利用动物模型确认到具有减少肺癌及大肠癌的肿瘤的大小及重量的效果。
附图说明
14.图1示出tr-9化合物的1h-核磁共振(nmr)((a)部分)、异核多量子相关谱(hmqc)((b)部分)及质谱图((c)部分)。
15.图2示出tr-10化合物的1h-核磁共振((a)部分)、异核多量子相关谱((b)部分)及质谱图((c)部分)。
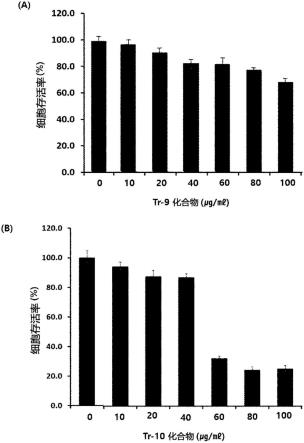
16.图3示出处理不同浓度的tr-9化合物((a)部分)、tr-10化合物((c)部分)以及处理不同时间的tr-9化合物((b)部分)时的肺癌细胞株(a549)的细胞存活率。
17.图4示出处理不同浓度的tr-9化合物((a)部分)及tr-10化合物((b)部分)时的胃癌细胞株(ags)的细胞存活率。
18.图5示出处理不同浓度的tr-9化合物((a)部分)及tr-10化合物((b)部分)时的乳腺癌细胞株(mda-mb-231)的细胞存活率。
19.图6示出示出处理不同浓度的tr-9化合物((a)部分)及tr-10化合物((b)部分)时的肝癌细胞株(hep3b)的细胞存活率。
20.图7示出处理不同浓度的tr-9化合物((a)部分)及tr-10化合物((b)部分)时的大肠癌细胞株(hct116)的细胞存活率。
21.图8示出处理不同浓度的tr-9化合物((a)部分)及tr-10化合物((b)部分)时的胰腺癌细胞株(bxpc3)的细胞存活率。
22.图9示出处理不同浓度的tr-9化合物时的人类成纤维细胞(human fibroblast)的细胞存活率。
23.图10为利用肺癌及大肠癌动物模型确认口服及腹腔给药tr-9化合物时的肿瘤大小变化的结果。(a)部分为向肺癌动物模型口服给药tr-9化合物后的肿瘤大小变化,(b)部分为向肺癌动物模型腹腔给药tr-9化合物后的肿瘤大小变化,(c)部分为向大肠癌动物模型腹腔给药tr-9化合物后的肿瘤大小变化。*、**、***表示窃衣素或本发明的tr-9化合物给药组的肿瘤大小增加量相对于对照组在统计学上显著减少,*表示p《0.05,**表示p《0.01,***表示p《0.001。
具体实施方式
24.本发明涉及化学式1的化合物或其药学上可接受的盐。
25.化学式1
[0026][0027]
并且,本发明涉及包含化学式1或化学式2的窃衣素衍生物化合物,或它们的药学上可接受的盐作为有效成分的抗癌用药物组合物。
[0028]
化学式1
[0029][0030]
化学式2
[0031][0032]
优选地,上述化学式1及化学式2的窃衣素衍生物化合物从窃衣中分离出来,但不限定于此,还可以从窃衣以外的天然物中分离出来,也可以通过有机合成方法合成。
[0033]
优选地,上述抗癌为对选自肺癌、胃癌、肝癌、乳腺癌、大肠癌及胰腺癌中的一种癌症的抗癌,但不限定于此。
[0034]
本发明的药物组合物可以为用于口服或胃肠外给药的多种剂型。在配制上述组合
物的情况下,可以使用通常使用的载体、赋形剂或稀释剂来制备,但不限定于此。
[0035]
用于口服给药的固体制剂包括片剂、丸剂、颗粒剂、胶囊剂等,这样的固体制剂在一种以上的化合物中混合一种以上的赋形剂,例如淀粉、碳酸钙、葡萄糖(sucrose)或乳糖(lactose)、明胶等来制备。并且,除单纯的赋形剂以外,还可以使用硬脂酸镁、滑石粉等润滑剂。用于口服给药的液体制剂由悬浮剂、内溶液剂、乳剂或糖浆剂等,除单纯用作稀释剂的水、液体石蜡以外,还可以包含多种赋形剂,例如湿润剂、甜味剂、芳香剂或保存剂等。
[0036]
用于胃肠外给药的制剂包括灭菌的水溶液、非水性溶剂、悬浮溶剂、油剂、冷冻干燥剂或栓剂等。非水性溶剂及悬浮溶剂可以使用丙二醇(propyleneglycol)、聚乙二醇、橄榄油之类的植物油、油酸乙酯之类的可注射的酯类等。栓剂的基剂(base)可以使用witepsol、聚乙二醇、吐温(tween)61、可可脂、月桂酸甘油酯(laurinum)、甘油、明胶等。
[0037]
本发明的药物组合物可以口服或胃肠外给药,在胃肠外给药时,优选地,可以选择皮肤外用或腹腔内、直肠、静脉、肌肉、皮下、子宫内膜或脑血管内注射的方式,但不限定于此。
[0038]
本发明的药物组合物以药学上有效的量来给药。在本发明中,药学上有效的量是指以医学治疗上可适用的合理的受益/风险比例来治疗疾病的充分的量,有效剂量的水平可以根据包括患者所患疾病的种类、疾病的严重程度、药物的活性、对药物的敏感度、给药时间、给药途径及代谢比例、治疗期间、同时使用的药物在内的因素及其他医学领域中熟知的因素来决定。本发明的组合物可以作为单独的治疗剂来给药或者与其他治疗剂并行给药,可以与现有的治疗剂依次或同时给药,可以单次给药或多次给药。重要的是,在考虑所有上述因素后以副作用最小的量获得最大的效果,该剂量可以通过本发明所属技术领域的普通技术人员轻松地决定。
[0039]
本发明的组合物的给药量的范围可以根据患者的体重、年龄、性别、健康状态、饮食、给药时间、代谢率及疾病的严重程度来多样地给药,可以根据给药途径、肥胖的严重程度、性别、体重、年龄等进行增减,但上述给药量不在任何方面限制本发明的范围。
[0040]
并且,本发明涉及包含化学式1或化学式2的窃衣素衍生物化合物或它们的食品学上可接受的盐作为有效成分的抗癌用保健功能食品组合物。
[0041]
本发明的保健功能食品组合物可以向食品中直接添加,或者可以与其他食品或食品成分一同来使用,可以根据通常的方法来适当地使用。有效成分的混合量可以根据其使用目的(预防或改善用)来适当地决定。通常,相对于保健功能食品的总重量,保健功能食品中所包含的上述化合物的量可以为0.1重量份~90重量份。但在以健康及卫生为目的而长期摄取的情况下,上述量可以为上述范围以下,也能够以上述范围以上的量来使用。
[0042]
在将本发明的保健功能食品组合物用作饮料的情况下,除包含作为上述有效成分的化合物以外的其他成分不受特别限制,可以与普通饮料一样,可以包含多种香味剂或天然碳水化合物等作为追加成分。上述天然碳水化合物的例有单糖,例如葡萄糖、果糖等;二糖,例如麦芽糖、蔗糖等;以及多糖,例如糊精、环糊精等通常的糖以及木糖醇、山梨糖醇、赤藓糖醇等糖醇。除上述成分以外,可以有利地使用天然香味剂(索马甜、甜叶菊提取物(例如莱鲍迪甙a、甘草甜素等))以及合成香味剂(糖精、阿巴斯甜等)作为香味剂。
[0043]
除上述有效成分以外,本发明的保健功能食品组合物还可以包含选自营养剂、维生素、电解质、风味剂、着色剂、增强剂、果胶酸及其盐、海藻酸及其盐、有机酸、保护性胶体
增稠剂、ph调节剂、稳定剂、防腐剂、甘油、酒精及碳酸饮料中使用的碳酸化剂中的一种以上。此外,本发明的保健功能食品组合物还可以包含用于制备天然果汁及蔬菜饮料的果肉。上述果肉可以单独或组合来使用。虽然上述多种添加剂的比例不很重要,但通常在每100重量份的本发明的化合物中包含0.1重量份~20重量份的范围中选择。
[0044]
以下,利用实施例更为详细地说明本发明。对于本发明所属技术领域的普通技术人员来说显而易见的是,这些实施例仅用于更为具体地说明本发明,本发明的范围不限定于这些实施例。
[0045]
实施例1.从窃衣中分离单一物质及纯化
[0046]
从窃衣提取物中实施利用有机溶剂的分馏来从正己烷(n-hexane)分馏物中分离单一物质并纯化后,通过质谱图及核磁共振分析确认分离的单一物质(化合物)的结构。
[0047]
利用硅胶快速柱层析(silica gel flash column chromatography)、硅胶开柱色谱法(silica gel open column chromatography)、葡聚糖凝胶lh-20柱色谱法(sephadex lh-20 column chromatography)、反相(ods)中压液相色谱法(mplc,medium pressure liquid chromatography)及高效液相色谱法(hplc)来从正己烷分馏物中分离并纯化纯化合物(tr-9)。
[0048]
然后,利用质谱法及400mhz ft-nmr spectrometer(varian公司,美国)对从窃衣提取物的正己烷分馏物中分离的纯化合物进行分析来确认化学式1的新型化合物(tr-9)及化学式2的二乙酰窃衣素(tr-10)的结构(图1及图2)。
[0049]
化学式1
[0050][0051]
实施例2.确认化合物tr-9及化合物tr-10的抗癌效果(水溶性四唑盐-1法(wst-1法))
[0052]
确认tr-9化合物对6种癌细胞株的细胞毒性。以5
×
103cells/well的量将肺癌(a549)、胃癌(ags)、肝癌(hep3b)、乳腺癌(mda-mb-231)、大肠癌(hct116)及胰腺癌(bxpc-3)细胞株与成纤维细胞接种于96孔培养板中,分别使用10μg/ml、20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml浓度的新型化合物tr-9处理24小时,对于肺癌细胞株,以100μg/ml的浓度进一步处理24小时、48小时及72小时。
[0053]
然后,利用高灵敏度水溶性四唑盐(wst,high sensitive water soluble tetrazolium salt)测定存活的细胞的量。水溶性四唑盐与存活的细胞的脱氢酶(dehydrogenase)反应来产生橘黄色的水溶性甲臜(formazan),与水溶性四唑盐反应的脱
氢酶为存在于代谢活动旺盛的细胞的线粒体电子传递系统的酶,只在活着的细胞中有效,产生的甲臜与存活的细胞数量具有成比例的相关关系。因此,在450nm的波长处测量吸光度来确认通过产生的甲臜的细胞存活率。
[0054]
结果如图3至图8所示,确认到本发明的化合物tr-9(化学式1的化合物)或tr-10(化学式2的化合物)减少肺癌、胃癌、肝癌、乳腺癌、大肠癌及胰腺癌细胞的细胞存活率,如图9所示,确认到tr-9化合物几乎没有改变人类成纤维细胞(human fibroblast)的细胞存活率,从而确认对正常细胞没有影响且具有特异性地凋亡作为癌细胞的肺癌、胃癌、肝癌、乳腺癌、大肠癌及胰腺癌细胞的抗癌活性。
[0055]
实施例3.利用动物模型确认口服给药化合物tr-9对肺癌的抗癌效果
[0056]
通过人体来源肺癌细胞(a549)的裸小鼠异种移植模型确认口服给药tr-9对肺癌的抗癌活性。动物模型使用balb/c系统的缺失特定病原体(spf)的裸小鼠。动物在保持温度为23
±
3℃、相对湿度为55
±
15%、换气次数10次-20次/小时(hr)、照明时间为12小时(尚无8点开灯~下午8点关灯)以及照度为150lux~300lux的韩南大学大德校区动物室中饲育。
[0057]
癌细胞移植是在培养的最后一天收集细胞并计数后使用磷酸盐缓冲溶液(pbs)来将人体来源肺癌细胞株a549的浓度调节为5
×
106cells/ml。以每只小鼠0.2ml(1
×
106cells/mouse)的量将如上述调节的细胞培养液注入右侧肩胛部与胸壁之间的腋窝部位皮下。
[0058]
以一日一次的频率向每只小鼠口服给药200μl的1mm的溶于灭菌的磷酸盐缓冲溶液中的tr-9,所有动物在开始给予药物(tr-9)之前、从移植癌细胞后的第2天至第23天共测量体重10次(表1)。
[0059]
结果如下述表1所示,体重几乎没有因给予药物(tr-9及窃衣素)而显出差异。
[0060]
表1
[0061]
小鼠的体重变化
[0062][0063]
在上述表1中,数据值为平均值
±
标准差。测量体重后,使用co2气体致死后分离肿瘤,利用游标卡尺(verniercaliper)测量各不同个体肿瘤的三个方向后,以(长
×
宽
×
高)/2的计算值表示肿瘤大小的变化(表2).
[0064]
如下述表2及图10所示,肿瘤大小在移植肿瘤细胞后逐渐增加,以不同日期来比较,与对照组相比,给药窃衣素及tr-9的组中的肿瘤大小更小,19天以后,与对照组相比,给药窃衣素及本发明的tr-9的肿瘤大小在统计学上显著小。即,通过口服给药窃衣素及本发明的tr-9抑制了癌细胞的生长。进而,可以确认与口服给药窃衣素的组相比,口服给药本发明的tr-9的组的肿瘤大小进一步减少约6%~7%。
[0065]
另一方面,如表3所示,确认到在第23天,与未做任何处理的对照组相比,口服给药
本发明的tr-9化合物的组中的肿瘤重量减少约36%。
[0066]
表2
[0067]
肿瘤的大小变化
[0068][0069]
表3
[0070]
第23天根据给药窃衣素及本发明的tr-9化合物的肿瘤重量
[0071]
组(n=4)第23天的肿瘤重量(mg)相对于对照组的肿瘤重量减少率(%)对照组1.057
±
0.145-窃衣素0.745
±
0.19629.5tr-90.676
±
0.185
*
36.0
[0072]
在上述表2及表3中,数据为平均值
±
标准差,*、**、***表示与对照组相比,窃衣素或tr-9给药组的肿瘤大小或重量的增加量在统计学上显著减少,*表示p《0.05,**表示p《0.01,***表示p《0.001。肿瘤大小增加量(
△
t)=vt-vo,其中,vt表示不同日期的肿瘤大小的测量值,vo表示初始肿瘤大小的测量值。
[0073]
实施例4.利用动物模型确认腹腔给药化合物tr-9对肺癌的抗癌效果
[0074]
通过人体来源肺癌细胞(a549)的裸小鼠异种移植模型确认腹腔给药tr-9对肺癌的抗癌活性。在本实施例4中,除腹腔给药以外,利用与上述口服给药相同的动物模型及方法来实施。
[0075]
动物模型使用balb/c系统的缺失特定病原体的裸小鼠。动物在保持温度为23
±
3℃、相对湿度为55
±
15%、换气次数10次-20次/小时(hr)、照明时间为12小时(尚无8点开灯~下午8点关灯)以及照度为150lux~300lux的韩南大学大德校区动物室中饲育。
[0076]
癌细胞移植是在培养的最后一天收集细胞并计数后使用磷酸盐缓冲溶液来将人体来源肺癌细胞株a549的浓度调节为5
×
106cells/ml。以每只小鼠0.2ml(1
×
106cells/
mouse)的量将如上述调节的细胞培养液注入右侧肩胛部与胸壁之间的腋窝部位皮下。
[0077]
以一日一次的频率向每只小鼠口服给药200μl的1mm的溶于灭菌的磷酸盐缓冲溶液中的tr-9,所有动物在开始给予药物(tr-9)之前、从移植癌细胞后的第2天至第23天共测量体重10次(表4)。
[0078]
结果如下述表4所示,体重几乎没有因给予药物(tr-9及窃衣素)而显出差异。
[0079]
表4
[0080]
小鼠的体重变化
[0081][0082]
在上述表4中,数据值为平均值
±
标准差。测量体重后,使用co2气体致死后分离肿瘤,利用游标卡尺测量各不同个体肿瘤的三个方向后,以(长
×
宽
×
高)/2的计算值表示肿瘤大小的变化(表4)。
[0083]
如下述表5及图10所示,肿瘤大小在移植肿瘤细胞后逐渐增加,以不同日期来比较,与对照组相比,给药窃衣素及tr-9的组中的肿瘤大小更小,19天以后,与对照组相比,本发明的tr-9的肿瘤大小在统计学上显著小。即,通过腹腔给药本发明的tr-9抑制了癌细胞的生长。可以确认与腹腔给药窃衣素的组相比,腹腔给药本发明的tr-9的组的肿瘤大小进一步减少约17%。
[0084]
另一方面,如表6所示,确认到在第23天,与未做任何处理的对照组相比,腹腔给药本发明的tr-9化合物的组中的肿瘤重量减少约53%。
[0085]
表5
[0086]
肿瘤的大小变化
[0087][0088]
表6
[0089]
第23天根据给药窃衣素及本发明的tr-9化合物的肿瘤重量
[0090]
组(n=4)第23天的肿瘤重量(mg)相对于对照组的肿瘤重量减少率(%)对照组1.358
±
0.145-窃衣素0.970
±
0.18328.6tr-90.641
±
0.100
*
52.8
[0091]
在上述表5及表6中,数据为平均值
±
标准差,*、**、***表示与对照组相比,窃衣素或tr-9给药组的肿瘤大小或重量的增加量在统计学上显著减少,*表示p《0.05,**表示p《0.01,***表示p《0.001。肿瘤大小增加量(
△
t)=vt-vo,其中,vt表示不同日期的肿瘤大小的测量值,vo表示初始肿瘤大小的测量值。
[0092]
实施例5.利用动物模型确认腹腔给药化合物tr-9对大肠癌的抗癌效果
[0093]
通过人体来源大肠癌细胞(hct116)的裸小鼠异种移植模型确认腹腔给药tr-9对肺癌的抗癌活性。在本实施例5中,除利用大肠癌细胞以外,以与上述实施例4相同的方式来实施。
[0094]
动物模型使用balb/c系统的缺失特定病原体(spf)的裸小鼠。动物在保持温度为23
±
3℃、相对湿度为55
±
15%、换气次数10次-20次/小时(hr)、照明时间为12小时(上午8点开灯~下午8点关灯)以及照度为150lux~300lux的韩南大学大德校区动物室中饲育。
[0095]
癌细胞移植是在培养的最后一天收集细胞并计数后使用磷酸盐缓冲溶液来将人
体来源大肠癌细胞株hct116的浓度调节为5
×
106cells/ml。以每只小鼠0.2ml(1
×
106cells/mouse)的量将如上述调节的细胞培养液注入右侧肩胛部与胸壁之间的腋窝部位皮下。
[0096]
以一日一次的频率向每只小鼠口服给药200μl的1mm的溶于灭菌的磷酸盐缓冲溶液中的tr-9,所有动物在开始给予药物(tr-9)之前、从移植癌细胞后的第2天至第21天共测量体重10次(表7)。
[0097]
结果如下述表7所示,体重几乎没有因给予药物(tr-9及窃衣素)而显出差异。
[0098]
表7
[0099]
小鼠的体重变化
[0100][0101]
在上述表7中,数据值为平均值
±
标准差。测量体重后,使用co2气体致死后分离肿瘤,利用游标卡尺测量各不同个体肿瘤的三个方向后,以(长
×
宽
×
高)/2的计算值表示肿瘤大小的变化(表8)。
[0102]
如下述表8及图10所示,肿瘤大小在移植肿瘤细胞后逐渐增加,以不同日期来比较,与对照组相比,给药窃衣素及tr-9的组中的肿瘤大小更小,14天以后,与对照组相比,本发明的tr-9的肿瘤大小在统计学上显著小。即,通过腹腔给药本发明的tr-9抑制了大肠癌细胞的生长。进而,可以确认与腹腔给药窃衣素的组相比,腹腔给药本发明的tr-9的组的肿瘤大小进一步减少约10%。
[0103]
另一方面,如表9所示,确认到在第21天,与未做任何处理的对照组相比,腹腔给药本发明的tr-9化合物的组中的肿瘤重量减少约36%。
[0104]
表5.肿瘤的大小变化
[0105]
表8
[0106]
肿瘤的大小变化
[0107][0108]
表9
[0109]
第21天根据腹腔给药窃衣素及本发明的tr-9化合物的肿瘤(大肠癌)重量
[0110][0111]
在上述表8及表9中,数据为平均值
±
标准差,*、**、***表示与对照组相比,窃衣素或tr-9给药组的肿瘤大小或重量的增加量在统计学上显著减少,*表示p《0.05,**表示p《0.01,***表示p《0.001。肿瘤大小增加量(
△
t)=vt-vo,其中,vt表示不同日期的肿瘤大小的测量值,vo表示初始肿瘤大小的测量值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1