由天然或合成DNA产生的基于痘病毒的载体及其用途的制作方法
由天然或合成dna产生的基于痘病毒的载体及其用途
1.优先权声明
2.本技术要求于2020年2月3日提交的美国临时专利申请号62/969,628,和于2020年11月13日提交的美国临时专利申请号63/113,803的优先权,其内容通过引用整体并入本文。
3.序列表
4.本技术包含以ascii格式电子提交并通过引用整体并入本文的序列表。所述ascii副本创建于2021年2月2日,名为8200wo00_sequencelisting.txt,大小为652千字节。
5.背景
6.痘病毒是大型双链包膜dna病毒,通过编码其自身的dna转录和复制酶,在受感染细胞的细胞质中完全复制
20,27
。医学史上最伟大的成就之一是通过大规模疫苗接种具有复制能力的减毒痘苗病毒疫苗株根除天花(天花病毒)的病原体。痘苗病毒被用作研究痘病毒复制的原型成员,并已被进一步开发以生成重组疫苗和溶瘤剂。
7.被修饰的痘苗安卡拉(mva)是一种高度减毒的正痘病毒,自其亲本株绒毛膜尿囊痘苗安卡拉(cva)在鸡胚成纤维细胞(cef)上通过570次传代衍生而来1。由于减毒过程,mva获得了六个主要的基因组缺失(del1-6)以及多个较短的缺失,插入,和点突变,导致基因片段化,截断,短内部缺失,和氨基酸替换2。虽然所有这些突变均可能导致mva的高度减毒表型,但与mva组装缺陷相关联的精确遗传决定因素仍然不清楚
2,3
。mva严重限制了宿主细胞的嗜性(tropism),仅允许在禽类细胞中进行生产性组装,例如,cef和幼仓鼠肾(bhk)细胞,而在人和大多数其他哺乳动物细胞中,mva组装由于病毒组装的后期阻滞而失败
4,5
。虽然为非病原和高度减毒,但mva仍保持出色的免疫原性,如多个动物模型和人所示
6,7
。在根除天花运动的后期阶段,mva被用作德国120,000多人的基于具有复制能力的痘苗的疫苗的启动载体,并且没有报告任何不良事件8。在过去的几十年中,mva已被开发为一种独立的(stand-alone)天花疫苗,目前美国(us)政府正在寻求将其作为更安全的替代物以代替已有的基于痘苗的疫苗库存,作为天花爆发的预防对策
9-11
。fda于2019年9月24日批准了商品名为jynneos(巴伐利亚北欧)的mva以预防天花和猴痘。此前,使用商品名imvamune的同一mva疫苗在欧洲被批准为天花疫苗。
8.所有目前使用的mva载体或其衍生物均由学术,商业,或政府实体许可或拥有,这大大限制了它们用于开发基于mva的疫苗载体。因此,需要开发用于多种研究,预防,和治疗用途的替代mva载体。此外,迫切需要新技术来加速开发用于病原体制备和疾病预防的重组痘病毒载体。
技术实现要素:
9.在一个方面,本公开涉及产生痘病毒载体或重组痘病毒载体的方法。该方法需要将一个或多个dna片段转染入宿主细胞的步骤,其中该一个或多个dna片段包含想要的痘病毒的整个基因组dna序列,使得痘病毒在该宿主细胞中重构。在某些实施例中,将两个或更多个dna片段共转染入宿主细胞,每个dna片段包含痘病毒基因组的部分序列,使得两个或
更多个dna片段在宿主细胞中重构时通过同源重组顺序组装并包含痘病毒基因组的全长序列。在某些实施例中,该方法还需要在转染一个或多个dna片段之前,期间,或之后用辅助病毒感染该宿主细胞以启动该一个或多个dna片段的转录。在某些实施例中,该辅助病毒是禽痘病毒(fpv),绵羊纤维瘤病毒,痘苗病毒,或牛痘病毒。在某些实施例中,该一个或多个dna片段在转染之前被环化或以环状形式转染入宿主细胞。在某些实施例中,将一个或多个dna片段克隆到质粒或细菌人工染色体(bac)载体中。在某些实施例中,该一个或多个dna片段在共转染之前线性化或以线性化形式转染入宿主细胞。在某些实施例中,该一个或多个dna片段是天然衍生的,化学合成的,或天然衍生的和化学合成的dna片段的组合。在某些实施例中,该痘病毒基因组序列包含被修饰的痘苗安卡拉(mva)登录号#u94848或#ay603355的序列。在某些实施例中,该痘病毒基因组序列包含痘苗病毒基因组的序列。在某些实施例中,两个相邻dna片段具有重叠序列以有助于同源重组。在某些实施例中,该重叠序列的长度在约100bp和约5000bp之间。在某些实施例中,该一个或多个dna片段还包含反向末端重复(itr)区。在某些实施例中,该一个或多个dna片段还包含痘病毒末端发夹环(hl)序列,痘病毒基因组解析(cr)序列,或两者,其中该hl或该cr序列作为单链或双链dna序列以正义或反义方向添加至该dna片段的一端或两端。在某些实施例中,该一个或多个dna片段还包含一个或多个hl序列和一个或多个cr序列。在某些实施例中,每个hl序列在该hl序列的两端的侧翼为两个cr序列。在某些实施例中,其中仅该一个或多个dna片段的子集包含该hl或cr序列。在某些实施例中,该一个或多个dna片段还包含编码一个或多个抗原,亚单位,或其片段的一个或多个dna序列或其他异源dna序列。在某些实施例中,两个或更多个dna片段包含相同抗原,亚单位或其片段dna序列或相同异源dna序列。在某些实施例中,两个或更多个dna片段包含不同抗原,亚单位,或其片段的dna序列或其他异源dna序列。在某些实施例中,抗原,亚单位,或其片段的dna序列或其他异源dna序列被密码子优化以在宿主细胞中表达。在某些实施例中,该一个或多个dna片段还包含抗原,亚单位,或其片段的dna序列或其他异源dna序列上游的病毒启动子,抗原,亚单位,或其片段的dna序列或其他异源dna序列下游的转录终止信号,或两者。在某些实施例中,编码抗原,亚单位,或其片段的dna序列或其他异源dna序列被插入一个或多个痘病毒插入位点中,如基因间区域,非必需基因和区域,和缺失位点。
10.在另一个方面,本文公开了表达系统,其包含:(i)包含想要的痘病毒的整个基因组的单个dna片段,或各自包含想要的痘病毒的基因组的部分序列的两个或更多个dna片段,使得当在共转染后转移入宿主细胞时,该两个或更多个dna片段顺序组装并包含痘病毒基因组的全长序列且能够重构痘病毒,和(ii)编码一个或多个抗原,亚单位,或其片段的一个或多个dna序列或其他异源dna序列被插入痘病毒的一个或多个插入位点中,其中抗原或其亚单位或其他异源dna序列在一个或多个痘病毒dna片段转染和痘病毒重构后在宿主细胞中表达。在某些实施例中,该一个或多个dna片段在转染之前被环化或以环状形式转染入宿主细胞。在某些实施例中,将一个或多个dna片段克隆到质粒或bac载体中。在某些实施例中,该一个或多个dna片段在转染之前线性化或以线性化形式转染入宿主细胞。在某些实施例中,该一个或多个dna片段是天然衍生的,化学合成的,或天然衍生的和化学合成的dna片段的组合。在某些实施例中,该痘病毒的基因组序列包含mva登录号#u94848或#ay603355的序列。在某些实施例中,两个相邻dna片段具有重叠序列以有助于同源重组。在某些实施例
中,该重叠序列的长度在约100bp和约5000bp之间。在某些实施例中,该一个或多个dna片段还包含反向末端重复(itr)区。在某些实施例中,该一个或多个dna片段还包含痘病毒末端发夹环(hl)序列,痘病毒基因组解析(cr)序列,或两者,其中该hl或该cr序列作为单链或双链dna序列以正义或反义方向添加至该dna片段的一端或两端。在某些实施例中,该一个或多个dna片段还包含一个或多个hl序列和一个或多个cr序列。在某些实施例中,每个hl序列在该hl序列的两端的侧翼为两个cr序列。在某些实施例中,仅该一个或多个dna片段的子集包含该hl或cr序列。在某些实施例中,该一个或多个dna片段还包含编码抗原,亚单位或其片段的dna序列或其他异源dna序列上游的病毒启动子,编码抗原,亚单位或其片段的dna序列或其他异源dna序列下游的转录终止信号,或两者。在某些实施例中,编码一个或多个抗原,亚单位或其片段的dna序列或其他异源dna序列被插入一个或多个痘病毒插入位点中。
11.在另一个方面,本文公开了用于预防或治疗癌症或感染性疾病的疫苗组合物,其包含:(i)包含想要的痘病毒的整个基因组的单个dna片段,或各自包含想要的痘病毒的基因组的部分序列的两个或更多个dna片段,使得当在共转染后转移入宿主细胞时,该两个或更多个dna片段顺序组装并包含痘病毒基因组的全长序列且能够重构痘病毒,和(ii)编码一个或多个抗原,亚单位,或其片段的一个或多个dna序列或其他异源dna序列被插入痘病毒的一个或多个插入位点中,其中抗原,亚单位或其片段,或其他异源dna序列在一个或多个dna片段转染和痘病毒重构后在宿主细胞中表达。在某些实施例中,抗原,亚单位或其片段,或其他异源dna序列被插入一个或多个痘病毒插入位点中。在某些实施例中,疫苗组合物还包含药学上可接受的载体,佐剂,添加剂,或其组合。
12.在又一个方面,本文公开了预防或治疗受试者的癌症或病毒感染的方法,包括向该受试者施用预防或治疗有效量的疫苗组合物,其中该疫苗包含:(i)包含想要的痘病毒的整个基因组的单个dna片段,或各自包含想要的痘病毒的基因组的部分序列的两个或更多个dna片段,使得当在共转染后转移入宿主细胞时,该两个或更多个dna片段顺序组装并包含痘病毒基因组的全长序列且能够重构痘病毒,和(ii)编码一个或多个抗原,亚单位或其片段的一个或多个dna序列或其他异源dna序列被插入痘病毒的一个或多个插入位点中,其中抗原,亚单位,或其片段,或其他异源dna序列在一个或多个dna片段转染和痘病毒重构后在宿主细胞中表达。在某些实施例中,抗原,亚单位,或其片段,或其他异源dna序列被插入一个或多个痘病毒插入位点中。
13.附图简要说明
14.本技术包含至少一张彩色绘制的附图。具有一张或多张彩色附图的本技术的副本将在请求并支付必要费用后由专利商标局(the office)提供。
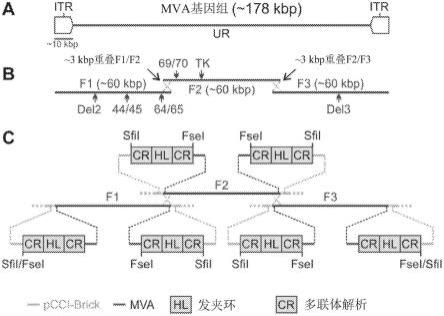
15.图1a-1c示出了smva构建的设计。图1a:mva基因组示意图。mva基因组的长度大约为178kbp,且包含侧翼为大的~9.6kbp长的反向末端重复(itr)的内部独特区(ur)。图1b:smva片段示意图。三个smva片段中的每一个的长度大约为60kbp。smva片段1(f1)包含mva基因组左部分的序列,包括左itr;smva片段2(f2)包含mva基因组中间部分的序列;smva片段3(f3)包含mva基因组右部分的序列,包括右itr。smvaf1和f2以及smva f2和f3共享用于同源重组的~3kbp重叠序列(点虚线交叉线)。标示了常用mva插入位点的近似位置,包括smva f1内的del2,igr44/45(44/45),和igr64/65(69/70),smva f2内的igr69/70(69/70)和tk插入位点,和smva f3内的del3。图1c:末端hl和cr序列的示意图。每个smva片段在两端包含序
列组合物,该序列组合物包含mva末端hl和侧翼cr序列的双链体拷贝,以促进基因组的解析和包装。如所示在每个smva片段的两端包括sfii和fsei限制性位点,以通过酶消化从具有或不具有末端cr/hl/cr序列的细菌载体骨架(pcci-brick)释放片段。
16.图2示出了smva的重构。描绘了使用如图1所示的三个smva片段(f1-f3)生成smva(smva)的示意图。将三个smva片段稳定地保持在大肠杆菌中,然后从细菌中分离出来,并通过转染将其作为环状或线性化dna分子转移入mva容许的bhk或cef细胞。随后用禽痘病毒(fpv)作为辅助病毒感染被转染的细胞,以启动mva基因组转录和复制,从而重构病毒形式的smva。
17.图3描绘了具有一个抗原的重组smva的构建。示意图示出了构建具有一个引入的抗原序列,异源基因序列,或其他基因组改变的重组smva(rsmva)的示例。使用线性pcr衍生的产物或其他形式的线性dna构建体,通过大肠杆菌中的细菌重组方法,将抗原或异源基因序列(黑色圆圈)插入f2(或其他smva片段之一(f1或f3))的mva基因组序列中。被修饰的smva片段f1和未被修饰的smva片段f2和f3从大肠杆菌中分离出来,并以环状或线性化形式共转染入fpv感染的bhk或cef细胞,以启动表达一个抗原或异源基因序列的rsmva的重构。nucl.=细胞核。
18.图4说明了具有三个抗原的重组smva的构建。示意图示出了生成具有3个引入的抗原序列,异源基因序列,或其他基因组改变的重组smva(rsmva)的示例。使用线性pcr衍生的产物或其他形式的线性dna构建体,通过大肠杆菌中的细菌重组技术,将抗原或异源基因序列(以正方形,圆形,或矩形示出)插入三个smva片段(f1-f3)的每一个中。被修饰的f1,f2,和f3 smva片段从大肠杆菌中分离出来,并以环状或线性化形式共转染入容许的bhk或cef细胞,其中表达三个抗原或异源基因序列的rsmva病毒在fpv作为辅助病毒的存在下重构。nucl.=细胞核。
19.图5说明了smva重构过程。示意图示出了使用三个smva片段(f1-f3)或其被修饰形式的smva或rsmva的组织培养重构过程的示例。以6孔组织培养形式接种的bhk细胞与三个smva片段(未被修饰,被修饰,或其组合)共转染,随后用fpv作为辅助病毒感染,以启动smva片段的转录和复制,从而启动smva病毒的重构。如所示每隔一天(在转染/感染后2,4,和6天(dpt/i))将被转染/感染的bhk细胞转移入更大的组织培养形式,以促进smva重构。在第2天和第4天细胞转移后可以检测到斑块形成和进展,从而在第6天转移后90-100%的bhk细胞在7或8dpt/i被感染。
20.图6a-6b示出了smva感染性分析。图6a是示出了在感染后(dpi)1天被smva或mva nih克隆1感染的bhk细胞单层中5个单个斑块的代表性明场显微镜图像的斑块分析。图6b示出了感染的进展。所示是在1,2,和3dpi被smva或mva nih克隆1感染的bhk细胞单层的代表性明场显微镜图像。将假感染(未被感染)的bhk细胞单层作为对照进行分析。通过痘苗病毒b5r蛋白的免疫染色观察斑块和被感染区域。
21.图7a-7l示出了重构的smva的pcr分析。bhk细胞以moi 5被从三个smva片段(f1-f3)重构的smva病毒或mva nih克隆1感染,并通过pcr评估了从被感染的bhk细胞提取的dna。将从假感染(未被感染)的bhk细胞(bhk)提取的dna以及仅h2o(ctrl)作为对照进行分析。pcr分析包括反向末端重复(itr)的序列检测(图7a);位于smva f1衍生的dna的从左itr过渡至内部独特区(litr/ur)(图7b)和mva缺失2位点(del2)(图7c);位于smva f2衍生的
dna的mva 69r和70l之间的基因间区域(igr)(igr69/70)(图7d);位于smvaf3衍生的dna的mva缺失3位点(del3)(图7e)和从内部ur过渡至右itr(ur/ritr)(图7f);smva f1和f2(f1/f2)(图7g)以及f2和f3(f2/f3)(图7h)的重组位点的重构;和包含对mva株antoine特异的五个核苷酸多态性(p0lym.1,2,3,4/5)(图7i-7l)的mva基因组位置。预期的pcr产物由每个小图右侧的箭头标示。pcr产物的预期大小在每个小图下方的括号中给出。
22.图8示出了用单荧光标志物重构smva。所示是bhk细胞单层使用未被修饰的smva片段f1和f3以及具有插入的红色荧光蛋白(rfp)标志物的被修饰的smva片段f2(f2-rfp)在转染/感染后(dpt/i)6天和7天的代表性免疫荧光和明场显微镜图像。这些片段的smva重构过程如图5所示,fpv被用作辅助病毒。假转染/感染的bhk细胞单层作为对照进行分析。
23.图9示出了用双荧光标志物重构smva。所示是bhk细胞单层使用未被修饰的smva片段f1,具有插入的红色荧光蛋白(rfp)标志物的被修饰的smva片段f2(f2-rfp),和具有插入的蓝色荧光蛋白(bfp)标志物的被修饰的smva片段f3(f3-bfp)在转染/感染后(dpt/i)6天和7天的代表性免疫荧光和明场显微镜图像。这些片段的smva重构过程如图5所示,fpv被用作辅助病毒。假转染/感染的bhk细胞单层作为对照进行分析。
24.图10a-10h说明了rsmva hcmv载体构建的多个示例。所示是使用smva片段f1-f3生成rsmva载体的示例,该rsmva载体具有基于五聚体复合物(pc;包括ul128,ul130,ul131a,gh,和gl)的五个亚单位,糖蛋白b(gb),磷蛋白65(pp65),和/或即早(immediately-early)蛋白1和2(ie1和ie2)的被插入的hcmv抗原序列。hcmv抗原序列如所示分开地或组合地作为2a连接的多顺反子表达构建体插入不同的mva插入位点中,包括mva缺失3(del3)位点或开放阅读框044/045(44/45),064/065(64/65),或069/070(69/70)之间的基因间区域。提供了表达全部pc亚单位(smva-pc1(图10a)和smva-pc2(图10b)),全部pc亚单位连同gb和pp65(smva-7ag1(图10c)和smva-7ag2(图10d)),或全部pc亚单位,gb,和pp65连同ie1/ie2抗原(smva-8ag1/2(图10e-10f))和smva-9ag2(图10g-10h))的rsmva载体的示例。mh5代表痘苗修饰的h5启动子,itr代表反向末端重复。
25.图11a-11b示出了smva特性。图11a:pcr分析。被smva感染的cef由fpv hp1.441(smva hp)或来自两个独立病毒重构体(smva tv1和smva tv2)的trovac衍生,通过pcr研究了几个mva基因组位置(itr序列,左或右itr过渡至内部独特区(左itr/ur;ur/右itr),del2,igr69/70,和del3插入位点,以及f1/f2和f2/f3重组位点)和缺失bac载体序列。用wtmva感染和未被感染的细胞,无样本(假),或用mvabac进行pcr反应作为对照。图11b:限制性片段长度分析。通过kpni和xhoi限制性酶消化比较了从超纯化的smva(smva tv1和smva tv2)或wtmva病毒分离的病毒dna。
26.图12a-12d示出了smva复制特性。将由fpv hp1.441(smva hp)或来自两个独立病毒重构体(smva tv1和smva tv2)的trovac衍生的smva的复制特性与wtmva进行了比较。图12a:病毒病灶。使用抗痘苗多克隆抗体(αvac)对被重构的smva病毒或wtmva以低感染复数(moi)感染的cef进行免疫染色。图12b:复制动力学。bhk或cef细胞以0.02moi被smva或wtmva感染,并测定了感染后24和48小时cef上接种物和被感染细胞的病毒滴度。应用了geisser-greenhouse校正的混合效应模型;在感染后24和48小时,组间差异不显著。图12c:病毒病灶大小分析。bhk或cef细胞单层以0.002moi被smva或wtmva感染,并在感染后24小时用αvac抗体免疫染色后测定了病毒病灶面积。图12d:宿主细胞范围分析。多个人细胞系
(hek293,a549,143b,和hela),cef,或bhk细胞以0.01moi被smva或wtmva感染,并测定了感染后48小时cef上病毒滴度。点虚线表示基于0.01moi计算的接种物的病毒滴度。图12c-12d中的组间差异使用单向anova计算,然后进行tukey(2c)或dunnett(2d)多重比较检验。ns=不显著。
27.图13a-13d显示了smva的体内免疫原性。通过体外分析将由fpv hp1.441(smva hp)或来自两个独立病毒重构体(smva tv1和smva tv2)的trovac衍生的smva与wtmva进行了比较。c57bl/6小鼠每隔三周用低(1x107pfu)或高(5x107pfu)剂量的smva或wtmva免疫两次。假免疫的小鼠用作对照。图13a:结合抗体。在第一次和第二次免疫后通过elisa测量了由smva或wtmva刺激的mva特异性结合抗体(igg滴度)。图13b:nab反应。在针对表达gfp标志物的重组wtmva的加强免疫后,测量了由smva或wtmva诱导的mva特异性nab滴度。图13c-13d:t细胞反应。在使用b8r免疫显性肽进行离体抗原刺激后,通过流式细胞术测量了两次免疫后由smva或wtmva诱导的mva特异性ifnγ,tnfα,il-4,和il-10分泌性cd8+(13c)和cd4+(13d)t细胞反应。使用tukey多重比较检验的单向anova评估了组间差异。ns=不显著。
28.图14a-14d显示了smva的体内免疫原性。通过体外分析将由fpv株hp1.441(smva hp)或来自两个独立病毒重构体(smva tvl和smva tv2)的fpv株trovac衍生的smva与wtmva进行了比较。c57bl/6小鼠(n=4)在三周间隔内用低(1x107pfu)或高(5x107pfu)剂量的smva或wtmva免疫两次。假免疫的小鼠用作对照。图14a:结合抗体。所示是在接受smva或wtmva的小鼠中第一次和第二次免疫后通过elisa测量的不同血清稀释的mva特异性结合抗体(igg滴度)在450nm处的吸光度。图14b:nab反应。在针对表达gfp标志物的wtmva的加强免疫后,测量了由smva或wtmva诱导的mva特异性nab滴度。所示是在不同血清稀释下以平方像素(pix2x103)表示的被感染细胞的所测量gfp面积。图14c-14d:t细胞反应。在使用痘苗a19l免疫显性肽进行离体抗原刺激后,通过流式细胞术测量了用smva或wtmva进行两次免疫后表达ifnγ,tnfα,il-4,和il-10的mva特异性cd8+(14c)和cd4+(14d)t细胞。使用tukev多重比较检验的单向anova评估了组间差异。ns=不显著。
29.发明详述
30.本文公开了从环化或线性化的天然衍生或化学合成的dna产生基于痘病毒的载体和重组痘病毒载体的方法。本文提供了从环化合成dna片段以及表达一个或多个异源基因序列(包括荧光标志物或感染性疾病和癌症抗原)的重组smva(rsmva)产生完全合成形式的mva(smva)的具体示例。
31.由于mva除了其通用的(versatile)表达系统和容纳外源dna序列(高达30kbp)的大容量外,还具有出色的安全性1,因此mva被广泛用于开发针对感染性疾病和癌症的重组疫苗载体
7,12,13
。mva一直致力于开发癌症治疗的不同疫苗策略
14,15
以及多种疫苗方法以预防人巨细胞病毒(hcmv)感染
16-18
,这是新生儿永久性出生缺陷和移植接受对象并发症的常见原因
19
。其中一些疫苗已完成临床i期或ii期评估
14,17
。作为痘病毒家族的一员,mva完全在被感染细胞的细胞质中复制,为转录和dna复制提供其自身酶
1,20
。尽管mva病毒的产生由于哺乳动物细胞中组装的后期阻滞而失败,但是mva可以有效感染大多数哺乳动物细胞,包括人细胞,并启动稳健的基因表达和dna复制,使mva成为体外和体内有效递送和表达外源抗原的理想载体
1,5
。最常用的生成mva重组体的方法是基于使用转移质粒的所谓转染/感染方法,其与mva一起共递送至容许细胞(cef或bhk),从而通过自发同源重组将想要的抗原与
上游启动子序列和下游转录终止信号一起插入mva基因组中
1,5,21
。
32.尽管这种方法被广泛使用,但它可能很费力,并且在抗原插入期间以及额外地在随后标志物去除期间为获得重组mva的同质群受到多轮选择的阻碍
21
。传统转染/感染方法中的这些缺点对于生成多抗原mva载体尤其成问题,其中抗原插入两个或更多个插入位点中,这会降低mva疫苗的稳定性
18,22
。作为传统转染/感染方法的替代并有助于生成多抗原mva载体,已经开发了使用细菌人工染色体(bac)技术生成mva重组体的方法
23-25
。这些方法允许重复操作,通过高效和通用的诱变技术将抗原插入mva基因组中,并以禽痘病毒(fpv)作为辅助病毒,在bhk细胞中重构重组mva的同质病毒群,这是“启动(jump-start)”非感染性mva基因组的转录所需的
23
。
33.合成痘病毒的构建
34.本文公开了从天然衍生或化学合成的dna产生基于痘病毒的载体或重组痘病毒载体的方法。在某些实施例中,单个dna片段衍生自病毒dna或为化学合成的并且包含痘病毒的整个基因组序列。该单个dna片段可用于转染宿主细胞,从而重构痘病毒。在其他实施例中,两个或更多个天然衍生或化学合成的dna片段或其组合用于共转染宿主细胞,其中每个dna片段包含痘病毒基因组dna的部分序列,在两个相邻dna片段的末端具有重叠序列,使得当两个或更多个dna片段共转染入宿主细胞时,它们通过同源重组彼此组装以形成包含想要的痘病毒基因组的全长序列的痘病毒。在某些实施例中,重叠序列的长度在约100bp和约5000bp之间。
35.在某些实施例中,缩短的基因组序列而不是整个基因组序列或在痘病毒基因组序列的非必需基因或区域中具有一个或多个缺失或一个或多个修饰的改变的基因组序列,或包含来自两种或多种不同痘病毒的基因组序列的杂合衍生物可用于产生本文公开的载体。
36.在某些实施例中,可进一步修饰包含痘病毒基因组或亚基因组dna的一个或多个天然衍生或化学合成的dna片段以形成由天然和合成痘病毒基因组dna序列构成的人工杂合片段。在其他实施例中,天然衍生或化学合成的一个或多个dna片段可由衍生自两种不同痘病毒的序列构成以形成痘病毒杂合序列。一个或多个dna片段可由衍生自以下的痘病毒序列构成或不同痘病毒序列构成的序列构成:mva(ncbi登录号#u94848,#ay603355),痘苗病毒(#nc_006998,#lt966077),骆驼痘病毒(#nc_003391),牛痘病毒(#nc_003663),鼠痘病毒(#nc_004105),猴痘病毒(#nc_003310),浣熊痘病毒(#nc_027213),臭鼬痘病毒(#nc_031038),沙鼠痘病毒(#nc_008291),天花病毒(#nc_001611,#l22579),维乐痘病毒(velopox virus)(#nc_031033),金丝雀痘病毒(#nc_005309),猪痘病毒(#nc_003389),fpv(#nc_002188,#mh734528),粘液瘤病毒(#gq409969),绵羊痘病毒(nc_004002),山羊痘病毒(#nc_004003),(orf病毒#nc_005336),兔纤维瘤病毒(#nc_001266),这些痘病毒的任何株变体,或任何其他痘病毒或其株变体。
37.在某些实施例中,宿主细胞在转染包含痘病毒基因组或亚基因组dna的序列的一个或多个dna片段之前,期间,或之后被辅助病毒如fpv感染。辅助病毒可以是感染宿主细胞并允许启动痘病毒转录和复制的任何合适的病毒。本文使用的示例是宿主细胞中的fpv,而不经历与痘病毒dna的同源重组。辅助病毒无法在宿主细胞中复制。此外,辅助病毒本身不是重构的痘病毒的组成部分,例如为本技术目的的fpv。在某些实施例中,牛痘病毒,shope纤维瘤病毒,或其他合适的痘病毒可用作辅助病毒。在某些实施例中,用于转染的一个或多
个dna片段可为线性化,环化,或线性化和环化dna片段的组合。在某些实施例中,用于转染的一个或多个dna片段被克隆至载体如质粒或bac和/或维持在宿主细胞如细菌细胞,例如,大肠杆菌中。
38.在某些实施例中,一个或多个dna片段进一步包含痘病毒的反向末端重复(itr)区之一或两者。在某些实施例中,itr的序列可包含一个或多个改变或变体,其不影响重构的痘病毒的设计方案。在一个实施例中,重构痘病毒的一个或多个dna片段可仅包含部分itr序列。例如,smva片段f1和f3以及重构的smva载体或重组smva载体(图1-4)可能仅包含部分mvaitr序列。在某些实施例中,进一步修饰一个或多个dna片段以将痘病毒末端发夹环(hl)序列添加在一端或两端作为双链体拷贝(双链dna)或在5’和/或3’端作为单链核苷酸序列。例如,可以将hl序列作为正义(5
’→3’
)或反义(3
’→5’
)方向的双链或单链dna序列添加至合成dna片段的任一端或两端。在某些实施例中,进一步修饰一个或多个dna片段以将痘病毒多联体(concatemeric)解析(cr)序列添加在一端或两端作为双链dna序列或在5’和/或3’端作为单链核苷酸序列。cr序列可以基于衍生自共有序列5
’‑
t
6-n
7-9-t/c-a
3-t/a-3’的任何序列,其中a是腺嘌呤,c是胞嘧啶,g是鸟嘌呤,t是胸腺嘧啶,n是任何核苷酸。在某些实施例中,可以将两个cr序列添加至hl序列的两端以形成cr-hl-cr序列。cr-hl-cr序列可以添加至一个或多个dna片段的一端或两端作为双链dna序列,或添加至5’端,3’端,或两端作为单链核苷酸序列。在其他实施例中,仅将hl或cr序列添加至一个或多个dna片段的一端或两端作为双链或单链dna序列。在某些实施例中,所有dna片段的一端或两端均包含hl或cr序列或其组合。在其他实施例中,并非所有dna片段均包含hl或cr序列。在某些实施例中,仅dna片段的子集或亚群包含hl或cr序列,或其组合。itr,hl,或cr序列可能衍生自mva(ncbi登录号#u94848,#ay603355),痘苗病毒(#nc_006998,#lt966077),骆驼痘病毒(#nc_003391),牛痘病毒(#nc_003663),鼠痘病毒(#nc_004105),猴痘病毒(#nc_003310),浣熊痘病毒(#nc_027213),臭鼬痘病毒(#nc_031038),沙鼠痘病毒(#nc_008291),天花病毒(#nc_001611,#l22579),维乐痘病毒(velopox virus)(#nc_031033),金丝雀痘病毒(#nc_005309),猪痘病毒(#nc_003389),fpv(#nc_002188,#mh734528),粘液瘤病毒(#gq409969),绵羊痘病毒(nc_004002),山羊痘病毒(#nc_004003),(orf病毒#nc_005336),兔纤维瘤病毒(#nc_001266),这些痘病毒的任何株变体,或任何其他痘病毒或其株变体。
39.在某些实施例中,本文使用的hl或cr序列公开如下:
40.含有侧翼为mva多联体解析序列的mva末端发夹环(hl)的双链体拷贝的末端cr-hl-cr序列的序列(长度为215bp,5
’→3’
)(seq id no:1),其中cr序列加下划线,hl序列加斜体和双下划线:
[0041][0042]
含有侧翼为多联体解析序列的mva末端发夹环(hl)的互补形式的双链体拷贝的末端cr-hl-cr序列的序列(长度为215bp,5
’‑
》3’)(seq id no:2),其中cr序列加下划线,hl序列加斜体和双下划线:
[0043][0044]
mva末端发夹环的序列(hl,长度为165nt,5
’→3’
)(seq id no:3):
[0045][0046]
mva末端发夹环的互补形式的序列(hl,长度为165nt,5
’‑
》3’)(seq id no:4):
[0047][0048]
含有侧翼为多联体解析序列的痘苗末端发夹环(hl;s型)的双链体拷贝的末端cr-hl-cr序列的序列(长度为154bp,5
’‑
》3’)(seq id no:5),其中cr序列加下划线,hl序列加斜体和双下划线:
[0049][0050]
含有侧翼为多联体解析序列的痘苗末端发夹环(hl;f型)的双链体拷贝的末端cr-hl-cr序列的序列(长度为154bp,5
’‑
》3’)(seq id no:6),其中cr序列加下划线,hl序列加斜体和双下划线:
[0051][0052]
痘苗病毒末端发夹环的序列1(hl,s型,长度为104nt,5
’→3’
)(seq id no:7):
[0053][0054]
痘苗病毒末端发夹环的序列2(hl,f型,长度为104nt,5
’→3’
)(seq id no:8):
[0055][0056]
mva多联体解析序列的序列1(cr,长度为20bp,5
’→3’
)(seq id no:9,正义方向),包括在工作示例中的发夹双链体拷贝的左端:
[0057][0058]
mva多联体解析序列的序列2(cr,长度为20bp,5
’→3’
)(seq id no:10,反义方向),包括在工作示例中的发夹双链体拷贝的右端:
[0059][0060]
如工作示例所示,本文公开的smva和rsmva重组体基于三个~60kbp长的dna片段的化学合成而生成,这些dna片段包含由antoine及同事公布的整个~178kbp的mva基因组(登录号#u94848)
26
。这包括内部独特区(ur)和侧翼~9.6kbp长的反向末端重复(itr)区,如图1所示。antoine等人公布的mva基因组序列(登录号#u94848)
26
,本文称为mva株antoine,
其与1974年获得许可并可商购的国立卫生研究院克隆1(mvanih克隆1)的mva基因组不同仅为内部ur中的五个碱基对,其在序列上与mva株acambis(登录号#ay603355)所公布的基因组相同。smva片段1(f1)包含mva基因组的左itr和~50kbp的内部ur的左端;smva片段2(f2)包含mva基因组~60kbp的内部ur的中间部分;和smva片段3(f3)包含mva基因组~50kbp的内部ur的右端和右itr(图1)。smvaf1和f2以及smva f2和f3被设计为共享~3kbp的重叠序列以允许通过同源重组重构完整的mva基因组(图1)。将侧翼为mva cr序列的165个核苷酸长的mva末端hl的双链体拷贝添加至三个片段中的每一个的两端,以促进mva基因组的解析和包装
26
(图1)。另外地,sfii和fsei限制性位点包括在三个片段中的每一个的两端,使得片段可以在有或没有hl和cr序列的情况下释放或线性化。唯一的例外是f1和f3的itr处的hl和cr序列,它们以相同的排列融合至端部,因为它们出现在mva多联体复制中间体的连接处
26
(图1)。如图1所示,侧翼为hl和cr序列以及重叠的同源重组序列的三个smva片段由genscript biotech使用基于酵母的重组系统合成和生成。所有三个smva片段均被克隆至称为pcci-brick的酵母穿梭载体,其包含细菌mini-f复制子元件,可用作bac载体以在细菌中以低拷贝数稳定繁殖三个片段(图1)。smva片段最终被克隆入重组缺陷的dh10b或epi300大肠杆菌细胞。
[0061]
在某些实施例中,包括在三个mva片段中的每一个的两端具有侧翼cr序列的hl的双链体拷贝-与仅在f1和f3的itr的端部相反,它们在多联体复制中间体中天然存在。这种设计基于这些序列元件在痘病毒dna复制期间所具有的内在功能。所包装的痘病毒基因组中的末端hl将基因组末端处的两条dna链连接至连续的多核苷酸链,其中它们以不完全碱基配对和at丰富的反向和互补形式存在于两端
26-29
。痘病毒hl序列对于将双链dna基因组复制成多聚体头对尾或头对头多联体复制中间体很重要,其中hl序列作为精确的双链体拷贝存在于多联体连接处
30-32
。cr元件包含高度保守的痘病毒解析序列,可以在与末端hl直接相邻的大的itr两端的包装后基因组中找到
26,27,33,34
。多联体复制中间体中的痘病毒cr元件存在于基因组连接处的hl双链体拷贝的任一位点,这些cr/hl/cr序列排列对于单位长度基因组的解析和随后的基因组包装至关重要
33-36
。当含有痘病毒多联体连接的环状质粒(由侧翼为cr元件的hl双链体拷贝构成)被转染入被痘病毒感染的细胞时,它们会自发分解成具有末端hl的线性微染色体
36,37
。在某些实施例中,当转染入宿主细胞时,环化的smva片段可以在宿主细胞中以独立于起源的方式立即复制。据报道,任何转染入被痘病毒感染的细胞的环状dna分子都以独立于起源的方式复制,并且这种非特异性序列复制不会通过插入任何病毒dna片段而增强
38
。在其他实施例中,当转染入宿主细胞时,环化的smva片段可以通过插入载体或mva序列的真核或病毒复制起源进行复制。
[0062]
所公开的合成痘病毒如smva的构建技术包括hl和cr序列,使得含有侧翼为多联体基因组连接(cr-hl-cr)和重叠基因组序列的三个合成mva片段的环状质粒或dna分子转染入fpv-感染的bhk或cef细胞将促进(1)三个smva片段的转录和复制,(2)从质粒载体序列解析三个smva片段,和(3)三个smva片段重组为全长基因组,最终导致将具有末端hl的无载体基因组包装成预先形成的病毒颗粒(图1和2)。这些事件可能由于fpv感染而立即启动,或者它们可能在三个smva片段的转录启动和复制后的逐步过程中发生。在另一个实施例中,从三个smva片段重构smva的过程可能在没有fpv或其他辅助病毒的情况下启动。作为使用环状质粒或dna分子从三个mva片段重构smva的替代策略,也可能通过基于三个smva片段的线
性化形式的方法促进smva的重构,例如,使用如图1和2所示的添加的fsei和sfii限制性位点。
[0063]
无论是使用三个mva片段的环状或线性化形式,还是环状和线性化形式的组合,片段的末端均可能包含或不包含hl和cr序列。在某些实施例中,仅片段的子集可能包含hl和cr序列,或者它们可能作为单链或双链dna序列以正义或反义方向添加至片段的仅一端或两端,例如,以它们仅存在于f1和f3的mva部分序列的方式,其中它们天然出现在假定的多联体复制中间体中。在另一个示例中,并非所有f1片段均包含hl和cr序列;相反,有或没有hl和cr序列的f1片段可能在构建过程中混合。同样地,并非所有f2或f3片段均需要包含hl和cr序列,但f2或f3片段的子集或亚群可能包含hl和cr序列。在某些实施例中,hl和/或cr序列也可能化学连接为三个片段的线性化形式的单链或双链dna序列。
[0064]
在另一个实施例中,可能通过引入插入,缺失,或点突变,或通过插入编码一个或多个抗原,亚单位,或其片段的一个或多个异源dna序列对由smva片段重构的smva病毒进行修饰。这些修饰或抗原序列可能使用具有介导同源重组的同源侧翼物的转移质粒通过常规转染/感染方法引入smva dna片段。在某些实施例中,编码一个或多个抗原,亚单位,或其片段的一个或多个核苷酸序列可能针对真核或痘苗表达进行密码子优化。例如,抗原,亚单位,或其片段可能针对在宿主细胞中转录或表达的稳定性进行优化。可能使用多种密码子优化技术,包括但不限于通过引入不导致所编码蛋白中氨基酸变化的沉默点突变而改变连续四个相同核苷酸(例如,gggg,cccc,tttt,aaaa),或使密码子使用适应于特定宿主物种。
[0065]
在另一个实施例中,由宿主细胞如bhk或cef细胞中的smva片段重构的smva病毒可用于生成包含全长smva基因组的smva细菌人工染色体(bac)。bac载体序列可通过包含具有介导同源重组的侧翼同源序列的bac序列的转移构建体插入smva基因组中。可能从宿主细胞如bhk或cef细胞分离具有插入的bac序列的环状复制中间体,并通过电穿孔或化学转化将其转移入大肠杆菌细胞,从而使大dna构建体如dh10b或epi300稳定繁殖。在另一个实施例中,可能将smvabac转移入gs1783大肠杆菌细胞并通过red-重组技术如en passant诱变进行操作。
[0066]
在另一个实施例中,smva片段可用于通过体外连接方法或通过其他体外dna组装方法如gibson或goldengate组装来重构完整或全长smva基因组。
[0067]
抗原或其他异源基因序列的表达
[0068]
本文公开的技术具有在转染前将多个抗原,亚单位或其片段,或其他异源dna序列插入一个或多个天然衍生或化学合成的dna片段中的灵活性,使得在重构后获得表达抗原,亚单位或其片段的合成痘病毒。这些抗原,亚单位或其片段可衍生自或基于病毒,如巨细胞病毒(cmv),爱泼斯坦-巴尔病毒(ebv),卡波氏肉瘤相关疱疹病毒(kshv),其他疱疹病毒,寨卡病毒,拉沙病毒,丙型肝炎病毒(hcv),肝炎(hbv),冠状病毒(如2019-ncov,sars,mers),流感,或任何其他病毒,细菌,或其他形式的感染性病原体。抗原序列还可衍生自或基于癌症相关联蛋白(例如,p53,视网膜母细胞瘤,新抗原)。同样地,可将其他异源基因序列插入一个或多个天然衍生或化学合成的痘病毒dna片段中。此类异源基因序列包括但不限于荧光标志物,rna如rnai,shrna,lncrna,mirna等的cdna拷贝,干扰素,细胞因子,抗体或其片段,或在原核或真核细胞中表达的其他蛋白质。在某些实施例中,抗原序列或异源基因序列可与上游天然或合成痘病毒启动子(psyn,p11,h5,mh5,p28,ati,phyb,p7.5)和下游转录终
止信号(tttttat)插入smva片段中,使得当痘病毒片段转染入宿主细胞时,抗原序列或异源基因序列被表达。
[0069]
抗原,亚单位,或其片段的dna序列,或其他异源基因序列,可以插入一个或多个dna片段内的一个或多个痘病毒插入位点中。以smva为示例,在转染宿主细胞之前,可以将一个抗原或其片段的dna序列插入位于一个smva dna片段(例如,smva f2)上的单个mva插入位点中(图3)。在另一个示例中,在转染宿主细胞之前,可以将两个或更多个抗原或其片段的dna序列插入位于一个dna片段(例如,smvaf2)上的单个mva插入位点中。这些抗原dna序列可在单个启动子或两个或更多个启动子的控制下。同样地,抗原dna序列可共享相同的转录终止信号或具有不同的转录终止信号。编码两个或更多个抗原的核苷酸序列也可通过介导核糖体跳跃的小核糖核酸病毒(p2a,t2a,f2a等)的2a序列或通过内部核糖体进入位点(ires)连接,使得抗原在翻译后被加工并自组装以形成多组分抗原复合物。
[0070]
在某些实施例中,编码一个或多个抗原,亚单位或其片段的一个或多个dna序列,或其他异源dna序列在5’端,3’端,或一个或多个必需或非必需痘病毒开放阅读框(orf)的任何内部位置处插入框,使得当将一个或多个天然衍生或化学合成的痘病毒dna片段转染入宿主细胞时,表达包含痘病毒蛋白与一个或多个抗原,亚单位或其片段,或添加至c-末端,n-末端,或痘病毒蛋白的任何内部位置的其他异源蛋白序列的一个或多个融合蛋白。在一些实施例中,编码一个或多个抗原,亚单位或其片段的一个或多个dna序列或其他异源dna序列通过小核糖核酸病毒(p2a,t2a,f2a等)的2a编码序列与一个或多个痘病毒orf连接,使得所表达的包含痘病毒蛋白与一个或多个抗原,亚单位或其片段,或添加至c-末端,n-末端,或痘病毒蛋白的任何内部位置的其他异源蛋白序列的一个或多个融合蛋白通过核糖体跳跃机制在2a接头序列处被加工(“切割”)成单个组分。在其他实施例中,编码一个或多个抗原,亚单位或其片段的一个或多个dna序列,或其他异源dna序列通过内部核糖体进入位点序列与一个或多个必需或非必需痘病毒orf连接,使得当将一个或多个天然衍生或化学合成的痘病毒dna片段转染入宿主细胞时,通过嵌合多顺反子表达构建体同时表达一种或多种痘病毒蛋白和一个或多个抗原,亚单位或其片段,或其他异源蛋白序列,表达构建体内每个orf的5’端处具有多个翻译起始位点。
[0071]
在某些实施例中,可将两个或更多个抗原,亚单位或其片段的dna序列或其他异源基因序列插入两个或更多个mva插入位点中,其可能位于相同的smva片段上或不同的smva片段上。例如,两个或多个抗原,亚单位或其片段的dna序列可以插入两个不同的mva插入位点中,均位于smva f1上。在另一个示例中,两个或多个抗原,亚单位或其片段的dna序列可插入两个不同的mva插入位点中,一个位于smva f1上,另一个位于smva f2上(图4)。应当理解,不同的dna片段可能插入有相同抗原,亚单位或其片段的dna序列。替代地,不同的smva片段可能插入有不同抗原,亚单位或其片段的dna序列,使得在转染后重构时,由合成的mva表达的不同抗原,亚单位或其片段自加工并自组装成病毒颗粒,病毒复合物,或包含亚单位或其片段的完整抗原。
[0072]
如工作示例所示,先前建立的使用bac技术
16,18,24,25
生成重组mva载体的方法适于使用三个smva片段生成rsmva重组体。由于三个smva片段已被克隆至具有mini-f复制子的bac载体,它们可以在细菌中稳定繁殖,因此可以通过高效重组方法(如enpassant诱变或其他基于大肠杆菌的操作过程)对其进行操作
39,40
。使用这些方法,可以将天然衍生或合成的
异源抗原序列连同上游痘苗病毒启动子和下游转录终止信号以平行,连续,或重复的方式插入smva片段中的仅一个,两个,或全部三个中的几乎每个mva基因组位置(图3和4)。这些插入位点可能包括常用插入位点,如mva缺失2(del2)位点,开放阅读框(orf)44l和45l之间的基因间区域(igr)(igr44/45),orf69r和70l之间的igr(igr69/70),64l和65l之间的igr(igr64/65),胸苷激酶(tk)基因插入位点,或mva缺失3(del3)位点(图1),或任何其他mva缺失位点,基因间区域,或基因插入位点(orf编号基于mva株antoine(登录号#u94848))。这些方法还可用于在一个或多个smva片段的一个或多个位置生成一个或多个点突变,插入,或缺失。然后可以从大肠杆菌中分离被修饰的smva片段,并通过多个转染方法将其作为环状或线性化dna分子共转移入被辅助病毒感染的bhk或cef细胞,以启动具有单抗原,双抗原,或多抗原插入或基因组改变的rsmva的重构(图3和4)。在某些实施例中,可以在不添加辅助病毒的情况下启动rsmva重构。在某些实施例中,三个smva片段还可用于通过体外连接方法生成具有单抗原或多抗原插入或基因组改变的smva。在某些实施例中,可以将一个或多个抗原,亚单位或其片段插入smva片段的一个或多个mva插入位点中。在某些实施例中,仅一个smva片段插入有一个或多个抗原或其片段(图3)。在某些实施例中,两个或更多个smva片段插入有一个或多个抗原或其片段(图4)。在某些实施例中,所有smva片段均插入有一个或多个抗原,亚单位或其片段(图4)。当两个或更多个smva片段插入有抗原,亚单位或其片段时,对于不同的smva片段,抗原,亚单位或其片段可能相同或不同。例如,smva f1可插入有一种类型的抗原或其片段,smvaf2可插入有不同类型的抗原或其片段。替代地,smva f1和f2可插入有相同类型的抗原或其片段,smvaf3可插入有相同类型的抗原或其片段或不同类型的抗原,亚单位或其片段。
[0073]
通过本文公开的技术产生的痘病毒载体可用于,例如,生成多抗原疫苗载体,以刺激针对多种病症如病毒感染和癌症的多功能体液和细胞免疫反应。例如,基于三个smva片段f1-f3的所公开的技术可用于生成多抗原rsmva疫苗载体,以刺激针对人巨细胞病毒(hcmv)的多功能体液和细胞免疫反应。这可包括基于hcmv五聚体复合物(pc)的五个亚单位,糖蛋白b(gb),磷蛋白65(pp65),和即早1和2蛋白(ie1和ie2)的免疫显性抗原序列。抗原序列可被分开地或组合地作为2a连接的多顺反子表达构建体插入不同的常用mva插入位点(del2,del3,igr44/45,igr69/70,igr64/65)处的smva片段中,以生成表达5,6,7,8,或9个hcmv抗原的rsmva疫苗载体,如图6和图10所示。也可生成仅表达单一hcmv抗原或上述九个hcmv抗原的任何其他数量或组合的rsmva载体。所有抗原序列或表达构建体都可连同上游mh5启动子和下游转录终止信号插入。这些载体可用于在动物模型或人中刺激针对hcmv的免疫反应。
[0074]
表达系统和疫苗
[0075]
根据本文描述的实施例,本文提供了mva表达系统。在某些实施例中,表达系统可表达一个或多个想要的抗原,亚单位或其片段或其他异源蛋白序列。
[0076]
如上所述,一个或多个smva片段可插入有编码一个或多个抗原,亚单位或其片段的dna序列,使得重构的smva同时表达所述抗原,亚单位及其片段。
[0077]
在某些实施例中,插入smva片段中的抗原dna序列可基于天然dna序列或来自化学合成。在其他实施例中,抗原dna序列可针对在表达系统内的表达和稳定性进行优化。
[0078]
基于smva所表达的抗原,本文描述的smva可为可用于治疗或预防病毒感染或治疗
癌症的方法的疫苗组合物的一部分。如本文所述的疫苗组合物可包含治疗有效量的如本文所述的smva,并且根据标准方法进一步包含药学上可接受的载体。可接受的载体的示例包括生理上可接受的溶液,如无菌盐水和无菌缓冲盐水。
[0079]
在一些实施例中,疫苗或药物组合物可与药学有效量的佐剂组合使用以增强预防或治疗效果。任何可刺激免疫系统并增加针对疫苗的反应但本身不具有任何特异性抗原作用的免疫佐剂均可用作佐剂。许多免疫佐剂模拟进化上保守的分子,称为病原体相关联分子模式(pamp),并被一组称为toll样受体(tlr)的免疫受体识别。可根据本文描述的实施例使用的佐剂的示例包括弗氏完全佐剂,弗氏不完全佐剂,双链rna(tlr3配体),lps,lps类似物,如单磷酰脂质a(mpl)(tlr4配体),鞭毛蛋白(tlr5配体),脂蛋白,脂肽,单链rna,单链dna,咪唑喹啉类似物(tlr7和tlr8配体),cpg dna(tlr9配体),ribi佐剂(单磷酰脂a/海藻糖二甲藻酸盐),糖脂(α-galcer类似物),未甲基化cpg岛,油乳剂,脂质体,病毒体,皂苷(皂苷的活性部分如qs21),胞壁酰二肽,明矾,氢氧化铝,角鲨烯,bcg,细胞因子如gm-csf和il-12,趋化因子如mip 1-α和rantes,激活的细胞表面配体如cd40l,n-乙酰胞壁胺-l-丙氨酰-d-异谷氨酰胺(mdp),和胸腺素
α
1。可以根据症状的程度合适地选择所使用的佐剂的量,所述症状如有皮肤软化,疼痛,红斑,发热,头痛,和肌肉疼痛,可作为施用这种类型的疫苗后的人或动物免疫反应的一部分被表达。
[0080]
在进一步的实施例中,如上文所讨论,与本发明的疫苗一起使用多种其他佐剂,药物或添加剂可增强通过施用疫苗或药物组合物实现的治疗效果。药学上可接受的载体可含有痕量的添加剂,如增强等渗性和化学稳定性的物质。此类添加剂在所使用的剂量和浓度下应对人或其他哺乳动物受试者无毒,其示例包括缓冲剂,如磷酸,柠檬酸,琥珀酸,乙酸,和其他有机酸,及其盐;抗氧化剂,如抗坏血酸;低分子量(例如,少于约10个残基)多肽(例如,聚精氨酸和三肽)蛋白质(例如,血清白蛋白,明胶,和免疫球蛋白);氨基酸(例如,甘氨酸,谷氨酸,天冬氨酸,和精氨酸);单糖,二糖,和其他碳水化合物(例如,纤维素及其衍生物,葡萄糖,甘露糖,和糊精),螯合剂(例如,edta);糖醇(例如,甘露醇和山梨糖醇);抗衡离子(例如,钠);非离子表面活性剂(例如,聚山梨醇酯和泊洛沙姆);抗生素;和peg。
[0081]
含有本文描述的smva的疫苗或药物组合物可作为水溶液或冻干产品储存于单位剂量或多剂量容器,如密封安瓿或小瓶。
[0082]
预防或治疗病毒感染或癌症
[0083]
由一个或多个天然衍生或化学合成的dna片段重构的痘病毒,具有或不具有插入的抗原,亚单位或其片段,或其他异源序列,可用作预防或治疗多种病毒感染或癌症的疫苗组合物。本领域普通技术人员将知道如何为待预防或治疗的病症或疾病选择特定的病毒或癌症抗原。这可包括但不限于能够引发免疫反应的任何感染性疾病或癌症抗原,如病毒包膜糖蛋白或糖蛋白复合物,免疫显性t细胞抗原,或突变的癌症新抗原。这些抗原序列或其部分可衍生自或基于病毒,如cmv,ebv,kshv,其他疱疹病毒,寨卡病毒,拉沙病毒,hcv,hbv,冠状病毒,流感,或任何其他病毒,细菌,或其他形式的感染性病原。
[0084]
以下示例旨在说明本发明的多个实施例。因此,所讨论的具体实施例不应被视为对本发明范围的限制。对本领域技术人员将显而易见的是,在不脱离本发明范围的情况下可以进行多种等效,改变,和修改,并且应当理解,这些等效实施例将被包括在本文。此外,在本公开中引用的所有参考文献均通过引用整体并入本文,如同在本文完全阐述。
[0085]
示例
[0086]
示例1:使用环状形式的合成mva片段的smva重构
[0087]
作为验证smva平台的初始测试,使用图2所示的过程评估从环状形式的三个smva片段的smva重构。三个smva片段(f1到f3)通过碱裂解
41
从epi300或dh10b大肠杆菌中分离出来,使得克隆为bac的大dna片段稳定繁殖,并作为环状质粒通过脂转染被共转染(~1-2μg/片段)入bhk细胞单层(6孔板格式)(图5)。在感染后4小时(hpi),以0.1感染复数(moi)的辅助fpv感染bhk细胞以启动mva转录和dna复制。仅用一个mva片段或仅两个mva片段的组合转染的fpv感染的bhk细胞,用所有三个mva片段转染的假感染(未被感染)的bhk细胞,和被fpv感染的假转染的bhk细胞用作对照。转染/感染的bhk细胞在合适的条件下生长,每2天使用图5所示的过程以~1∶2至1∶3的比例分散(传代)成更大的组织培养形式。在转染/感染后(dpt/i)3-6天,在用所有三个合成mva片段转染的fpv感染的bhk细胞单层中检测到细胞病变效应(cpe)和病毒斑块形成和进展的迹象,证明了smva的重构。在用所有三个mva片段转染的fpv感染的bhk细胞分散后7至8dpt/i,得到的bhk细胞单层显示90-100%的感染。相反,在任何对照中均未观察到cpe或特征性mva病毒斑块形成的迹象。用具有100%cpe的bhk细胞单层通过常规冷冻/解冻方法制备smva,在bhk细胞上滴定,并用于以低moi感染bhk细胞单层,以通过痘苗病毒糖蛋白b5r
16,42
免疫染色在16-72hpi评估mva感染和扩散。
[0088]
该分析表明了与mva nih克隆1相比,重组的smva具有相似的能力以形成特征性mva病毒病灶并在bhk细胞单层中扩散(图6),证明从三个smva片段形成smva。在感染后(dpi)1天,在smva和mva nih感染的bhk细胞单层中检测到特征性病毒病灶,而在2dpi,mva病毒感染在感染smva或mva nih的整个bhk细胞单层中可见,并且在3dpi,被smva或mvanih感染的bhk细胞单层的大多数细胞分离(detached)。相反,在假感染的对照中未检测到特征性mva病毒感染或cpe。其他研究组最终显示了用作辅助病毒的fpv在被引入bhk或cef细胞上的转染/感染温育时,不提供遗传物质或与mva基因组重组
43,44
。
[0089]
为了表征重构的smva的基因组,使用对三个合成mva片段内不同基因组位置特异的引物通过pcr对从smva感染的bhk细胞制备的病毒dna进行评估。从假感染(未被感染)的bhk细胞以及被nih mva克隆1感染的bhk细胞制备的dna用作对照。该pcr分析揭示了衍生自重构的smva的基因组dna内所有三个smva片段的dna的存在(图7)。衍生自smva感染的bhk细胞的所有pcr产物与衍生自mva nih感染的bhk细胞的pcr产物相似(分子量)。这包括(1)衍生自位于smva f1和f3内的itr序列的pcr产物(图7a);(2)对应于smva f1衍生的的dna的pcr产物,如左itr过渡至内部ur左端(图7b),和del2插入位点(图7c);(3)对应于smva f2衍生的dna的pcr产物,如g1l/i8r插入位点(igr69/70)(图7d);和对应于smva f3衍生的dna的pcr产物,如del3插入位点(图7e),内部ur右端过渡至右itr(图7f)。此外,使用具有位于smvaf1/f2或smva f2/f3重叠同源序列侧翼的结合位点的引物进行pcr分析(图1),显示了mva和mva nih感染的bhk细胞的产物大小相似(图7g-7h),表明三个smva片段的的成功重组和smva中载体序列的去除。
[0090]
对衍生自smva感染的bhk细胞的所有pcr产物的sanger测序分析揭示了这些基因组位置处的序列与mva株antoine
26
所公布的序列相同,包括f1/f2和f2/f3的重组位点。唯一的例外是衍生自smva的del2位点的pcr产物,其显示位于开放阅读框(orf)021l
26
下游三个碱基对处的igr的单个t到a的核苷酸改变。blast分析显示了smva dna内的这种序列改变不
存在于任何已公布的mva或痘苗病毒基因组序列中。从大肠杆菌纯化的smvaf1的sanger序列分析表明了在bhk细胞中的smva重构之前,del2位点处的这种特定核苷酸改变已经存在,这表明其来源于f1的化学合成或者是smvaf1在大肠杆菌中的克隆或繁殖。来自smva感染的bhk细胞的pcr产物的额外的测序分析(图7i-7l)表明smva基因组序列在内部ur中包含所有五个antoine特异性核苷酸多态性,这将其与mva nih克隆1的基因组序列区分开来。
[0091]
以下dna序列作为dna分子正义链的核苷酸序列(5’至3’)给出。smva片段1的序列(f1,长度为60021bp)(seq id no:11):
[0092]
[0093]
[0094]
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101]
[0102]
[0103]
[0104]
[0105]
[0106]
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120][0121]
smva片段f1,f2,和f3的任何序列均可包含一个或多个改变或变体。例如,smva片段f1的序列(以登录号mw023923存放于ncbi,www.ncbi.nlm.nih.gov/nuccore/mw023923.1/)在开放阅读框021下游的非编码决定区包含1个核苷酸改变(seq id no:12):
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
[0131]
[0132]
[0133]
[0134]
[0135]
[0136]
[0137]
[0138]
[0139]
[0140]
[0141]
[0142]
[0143]
[0144]
[0145]
[0146]
[0147]
[0148]
[0149]
[0150][0151]
smva片段2的序列(f2,长度为63035bp)(以登录号mw023924存放于ncbi,www.ncbi.nlm.nih.gov/nuccore/mw023924.1/)(seq id no:13):
[0152]
[0153]
[0154]
[0155]
[0156]
[0157]
[0158]
[0159]
[0160]
[0161]
[0162]
[0163]
[0164]
[0165]
[0166]
[0167]
[0168]
[0169]
[0170]
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179]
[0180]
[0181]
[0182][0183]
smva片段3的序列(f3,长度为62068bp)(seq id no:14):
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191]
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
[0198]
[0199]
[0200]
[0201]
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213][0214][0215]
替代地,smva f3的序列可在靠近itr序列末端的88bp处的非编码决定区中包含1个核苷酸改变(以登录号mw030459存放于ncbi,www.ncbi.nlm.nih.gov/nuccore/mw030459.1/)(seq id no:15):
[0216]
[0217]
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225]
[0226]
[0227]
[0228]
[0229]
[0230]
[0231]
[0232]
[0233]
[0234]
[0235]
[0236]
[0237]
[0238]
[0239]
[0240]
[0241]
[0242]
[0243]
[0244]
[0245][0246]
还公开了用于重构完整的痘苗病毒基因组的合成痘苗病毒(svac)片段的示例。svac片段1的示例序列(f1,长度为66679bp)(seq id no:16):
[0247]
[0248]
[0249]
[0250]
[0251]
[0252]
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
[0259]
[0260]
[0261]
[0262]
[0263]
[0264]
[0265]
[0266]
[0267]
[0268]
[0269]
[0270]
[0271]
[0272]
[0273]
[0274]
[0275]
[0276]
[0277]
[0278]
[0279][0280]
svac片段2的示例序列(f2,长度为66679bp)(seq id no:17):
[0281]
[0282]
[0283]
[0284]
[0285]
[0286]
[0287]
[0288]
[0289]
[0290]
[0291]
[0292]
[0293]
[0294]
[0295]
[0296]
[0297]
[0298]
[0299]
[0300]
[0301]
[0302]
[0303]
[0304]
[0305]
[0306]
[0307]
[0308]
[0309]
[0310]
[0311]
[0312]
[0313][0314]
svac片段3的示例序列(f3,长度为66679bp)(seq id no:18):
[0315]
[0316]
[0317]
[0318]
[0319]
[0320]
[0321]
[0322]
[0323]
[0324]
[0325]
[0326]
[0327]
[0328]
[0329]
[0330]
[0331]
[0332]
[0333]
[0334]
[0335]
[0336]
[0337]
[0338]
[0339]
[0340]
[0341]
[0342]
[0343]
[0344]
[0345]
[0346]
[0347][0348]
为了评估smva重构后细菌载体序列的去除,使用对细菌载体的sopa和cat氯霉素抗性基因特异的引物通过pcr评估了bhk细胞中smva连续病毒传代后smva感染的bhk细胞的dna。该pcr分析显示了在7或8dpt/i可以在smvadna中检测到残留载体序列,尽管在smva的两次额外的病毒传代后在smva dna中检测不到它们。总之,这些结果提供了证据,将三个合成mva片段作为环状质粒分子共转染入fpv感染的bhk细胞,导致形成具有全长,无载体基因组的smva,该基因组显示具有与所公布的mva株antoine的基因组序列相似的序列组成
26
。
[0349]
示例2:生成表达单一异源基因序列的重组smva
[0350]
为了评估使用三个smva片段生成rsmva,将三个片段转移入gs1783大肠杆菌细胞
40
,用于通过enpassant诱变操作大bac克隆的dna分子
39,40
。这种高效的方法允许通过基于red重组的两步诱变过程将点突变或大或小序列插入或缺失引入bac克隆的dna分子,而不会留下任何细菌标志物序列
39,40
。作为smva平台生成表达异源基因序列的rsmva的初始测试,评估了表达单一荧光标志物的rsmva的生成。如前所述将抗原序列插入mvabac-tk
18,24
,enpassant诱变用于将包含红色荧光蛋白(rfp)标志物的表达盒与上游mh5启动子和下游tttttat痘苗病毒转录终止信号插入smva片段f2内的igr69/70(也称为g1l/i8r)插入位点中(图3),产生f2-rfp。通过限制性片段长度多态性(rflp)分析以及基因插入位点的pcr和sanger测序分析确定了被操作的smva片段的序列完整性。从大肠杆菌中分离出具有插入的rfp标志物的被修饰的smva片段f2以及未被修饰的smva片段f1和f3并将其共转染入bhk细胞,以使用如图5所示的过程评估在fpv作为辅助病毒存在下rsmva的重构。如图8所示,免疫荧光成像揭示了在用f1/f2-rfp/f3质粒组合转染的bhk细胞单层中,在3-6dpt/i的红色荧光病毒斑块的形成和进展,而在7dpt/irfp表达在整个bhk细胞单层中可见。相反,在假转染/感染的bhk细胞单层中rfp表达不可见。总之,这些结果显示了smva平台可用于快速生成表达单一异源基因序列的rsmva。
[0351]
示例3:生成表达两个异源基因序列的重组smva
[0352]
为了评估用于生成具有插入不同基因组位置中的多个异源基因序列的rsmva的smva平台,评估了表达两个荧光标志物的rsmva的构建。使用gs1783细胞的en passant诱
变,将包含p11启动子,rfp标志物或蓝色荧光蛋白(bfp)标志物,和tttttat转录终止信号的基因表达盒分别插入smva f2的igr69/70和smva f3的del3位点中。从gs1783大肠杆菌细胞中分离出插入有rfp标志物(f2-rfp)的被修饰的smva f2和插入有bfp标志物(f3-bfp)的被修饰的smva f3并连同未被修饰的smva f1共转染入bhk细胞,以使用图5所示的过程评估在辅助病毒存在下具有rfp和bfp标志物的rsmva的重构。如图9所示,免疫荧光成像显示了在用f1/f2-rfp/f3-bfp质粒组合共转染的bhk细胞单层中,在3-6dpt/i的双荧光(红色和蓝色)病毒斑块的形成,在7dpt/i,大多数或所有bhk细胞显示了rfp和bfp双荧光蛋白表达。这些结果提供了smva平台可用于快速生成表达插入不同插入位点中的两个异源基因序列的rsmva的证据。
[0353]
示例4:生成表达三个异源基因序列的重组smva
[0354]
为了进一步评估用于生成具有多个插入的异源基因序列的rsmva的smva平台,研究了表达三个荧光标志物的rsmva的生成。在大肠杆菌中使用en passant诱变,将绿色荧光蛋白(gfp)标志物连同上游p11启动子和下游转录终止信号插入mva f1的igr44/45中。然后以不同的组合测试了插入有gfp标志物的所得被修饰的smva片段f1(f1-gfp)与荧光标记形式的f2和f3(f2-rfp和f3-bfp)以及f1,f2,和f3的未被修饰的smva片段,以使用图5所示的过程评估单荧光,双荧光,或三荧光smva表达载体。用于共转染的片段组合包括f1-gfp/f2-rfp/f3-bfp,f1-gfp/f2-rfp/f3,f1-gfp/f2/f3-bfp,f1/f2-rfp/f3-bfp,f1-gfp/f2/f3,f1/f2-rfp/f3,和f1/f2/f3-bfp。将三个未被修饰的smva片段(fl/f2/f3)共转染入fpv感染的bhk细胞作为阴性对照进行评估。除阴性对照外,在用任何不同片段组合转染的bhk细胞单层中通过免疫荧光成像在3-6dpt/i观察到荧光基因表达。在7到8dpt/i,在bhk单层的大多数细胞中观察到荧光标志物表达,表明荧光重组smva表达载体的重构。通过冷冻/解冻技术制备了重组smva表达载体,在bhk细胞上滴定,并用于以低moi感染bhk细胞单层。在16-24hpi,通过if成像评估了被感染的bhk细胞单层,以证明表达不同荧光标志物序列的smva的形成和重组。该分析揭示了病毒病灶的形成,在被f1-gfp/f2-rfp/f3-bfp衍生的smva感染的bhk细胞单层中显示了三荧光表达;在被f1-gfp/f2-rfp/f3,f1-gfp/f2/f3-bfp,或f1/f2-rfp/f3-bfp衍生的smva感染的bhk细胞单层中显示了双荧光表达;和在被f1-gfp/f2/f3,f1/f2-rfp/f3,或f1/f2/f3-bfp衍生的smva感染的bhk细胞单层中显示了单荧光表达。总之,这些结果表明可以在大肠杆菌中操作三个smva片段并将其用作环状dna分子以重构单,双,或三重组smva表达载体,突出了三个smva片段生成重组疫苗载体的潜力。
[0355]
示例5:感染性疾病抗原修饰的mva示例的构建和评估
[0356]
为了显示smva平台生成感染性疾病多抗原疫苗载体的效用,对表达由gh,gl,ul128,ul130,和ul131a构成的五元hcmv包膜五聚体复合物(pc)的rsmva的构建进行了评估。使用en passant诱变在大肠杆菌中将包含2a连接的gh/gl和ul128/ul130/ul131a亚单位的抗原表达盒分别插入位于smva f2的igr69/70和位于smva f3的del3位点中。将f2和f3的被修饰的smva片段连同f1的未被修饰的smva片段转染入fpv感染的bhk细胞,以重构表达所有五个pc亚单位的smva(rsmva-pc)。作为对照,生成仅表达gh/gl或ul128/130/131a亚单位的rsmva以及没有任何插入的抗原序列的smva。通过western blot证明抗原序列的表达,并且使用靶向由pc的两个或更多个亚单位形成的构象表位的中和抗体(nab)通过流式细胞术(fc)验证由rsmva-pc表达的pc亚单位形成的多蛋白复合物。为了研究rsmva-pc载体刺激
nab的免疫原性,balb/c小鼠以4周间隔通过腹膜内途径用rsmva-pc或对照载体免疫三次。在免疫后的多个时间点,在mrc-5成纤维细胞(fb)和arpe-19上皮细胞(ec)上测量hcmv特异性nab反应。该分析可以揭示在用rsmva-pc免疫的小鼠中对fb和ec特异性nab反应的有效刺激,而在用对照载体免疫的小鼠中没有或仅测量到最小反应。这些结果可显示smva疫苗平台可用于生成表达所有五个pc亚单位的多抗原mva疫苗载体,这些pc亚单位彼此组装形成nab表位并刺激小鼠中的有效nab反应。
[0357]
示例6:smva表达的2019-ncov的构建和评估
[0358]
举例说明了smva平台针对冠状病毒株2019-ncov(武汉)生成疫苗的效用,该株最近作为一种新的高度传染性和致病性冠状病毒出现。由于冠状病毒的s(刺突)蛋白参与受体识别以及病毒附着和进入,并且是保护性体液和细胞免疫的主要靶标,因此它代表了开发冠状病毒(cov)疫苗和治疗剂的潜在目标。编码全长s蛋白(~1273个氨基酸),2019-ncov株的s蛋白的免疫原性s1结构域,或s1结构域的受体结合结构域(rbd)的cdna分别插入smva片段f3的mvadel3位点中。然后将所得的被修饰的smvaf3片段与未被修饰版本的smva片段f1和f2共转染入bhk细胞,以使用如图5所示的过程启动表达新冠状病毒s蛋白(smva-2019-ncov-s),s1结构域(smva-2019-ncov-s1),或rbd结构域(smva-2019-ncov-rbd)的smva的重构。通过免疫印迹和流式细胞术分析证明来自smva重组体的s蛋白,s1结构域,或rbd结构域的表达。来自被感染的人,小鼠,或兔的恢复期血清用作免疫印迹的检测试剂。在某些情况下,标签如ha共价连接在羧基末端,针对它们的抗体用作免疫印迹或流式细胞术的检测试剂。类似地,将额外的免疫原性蛋白,例如,2019-ncov的n或m抗原插入smva的独特基因插入区域中,以开发多抗原疫苗。例如,将这些2019-ncov抗原中的一个或多个插入一个或多个插入位点中,如smva片段f3的del3位点和smva片段f2的igr69/70。
[0359]
为了测试smva构建体的免疫原性和保护性功效,可以使用两种动物模型:(1)鉴于在老年人中观察到的更严重的症状,12个月大的balb/c小鼠以4周间隔通过皮下和肌肉内途径用1x10
7-1x108的smva斑块形成单位(pfu)免疫两次;(2)考虑到人血管紧张素转换酶2(hace-2)在ncov进入肺细胞的潜在参与,使用表达人hace2受体的转基因小鼠以测试疫苗功效。
[0360]
为了测试smva构建体的免疫原性和保护性功效,血管紧张素转换酶2(ace-2)的转基因balb/c小鼠以4周间隔通过皮下和肌肉内途径用1x10
7-1x108的smva斑块形成单位(pfu)免疫两次。如前所述,在每次免疫后1周测量针对2019-ncov-s蛋白和衍生物特异的中和抗体反应和t细胞反应。在加强免疫后45天,小鼠被与疫苗抗原同源的7x10450%组织培养感染剂量(ticd50)的2019-ncov和异源株(sars-cov和mers-cov)感染,并在攻击后4天处死动物,收集其肺用于测量病毒载量和进行组织病理学分析。在假免疫和非重组mva免疫的对照组以及受到异源cov株攻击的动物中均发现平均>11,000至>20,000 2019-ncov基因组当量/ng总rna的大病毒载量。与此形成鲜明对比的是,蛋白质(smva-ncov-s)或s1结构域(smva-ncov-s1)受试者肺组织的2019-ncovrna(病毒载量)水平显著降低,表明疫苗诱导的免疫反应有效抑制了2019-ncov复制。所有安慰剂对照动物(mva-gfp)在感染后4至8天死亡,而mva-s,mva-n,和mva-n/s均未显示或显示最小的疾病迹象,包括最小的体重减轻。mva-n/s免疫的小鼠受到完全保护。
[0361]
组织病理学侧重于在2019-ncov亚单位抗原免疫的动物中显著减少的肺损伤。还
评估了抗体增强疾病的潜力,并发现在这些亚单位疫苗模型中不存在。nab对s蛋白抗原及其s1和rbd衍生物的反应使用ncov的拟型(pseudotyping)策略进行评估,该拟型策略对于抗原特异性nab的识别是稳健的,但避免使用cov的致病株。来自用s蛋白和衍生物免疫的动物的血清产生针对同源2019-ncov株而不是异源cov株(如mers和sars的病原体)的高滴度和中和抗体。计算每个小鼠血清样品的ic90中和滴度。基于转基因ace2 balb/c小鼠株疫苗研究的成功,研究了逐渐扩大的动物物种,即对2019-ncov攻击敏感且已知对基于mva的疫苗有反应的兔子,雪貂,和恒河猴。
[0362]
示例7:癌症抗原修饰的smva示例的构建和评估
[0363]
本示例显示了先前已用于从atcc或niaid获得的mva骨架的研究的小鼠p53基因的插入
46
。使用enpassant将小鼠p53 cdna插入缺失(del3)基因座中,使得在基因座的确切插入位点不进行额外的核苷酸添加或减少。通过序列分析验证插入是否准确,所有相关区域均为完整且100%序列可验证。修饰质粒f3后,将所有三个质粒组合成单个等分试样,并使用与示例2所述相同的方法,生成被修饰版本的smva,并在用fpv转染/感染后两天获得活病毒。活病毒在bhk细胞上浓缩和扩展,制备储备溶液(stocks),并使用sanger方法进行序列验证,以确定病毒在del3基因座中具有正确的p53基因插入序列。此外,制备病毒储备溶液并将其冷冻且长期储存,同时使用已公布的方法制备工作储备溶液,以将被修饰的smva储备溶液扩展到≥1x109pfu/ml的滴度。扩展后储备溶液的验证结合使用qpcr,sanger测序,感染滴度,和western印迹分析进行。执行所有这四个过程并获得合适的结果以确认核苷酸序列具有合适的大小,感染滴度在≥1x109pfu/ml的范围内,并且western印迹分析证实了大约53kd的蛋白带。本领域技术人员可以使用人版本的p53基因作为疫苗来应用这种方法以保护人免受癌症进展。
[0364]
鼠(mu)p53-smva
[0365]
雌性6-8周龄balb/c小鼠获自杰克逊实验室(巴尔港,me)并维持在特定的无病原体环境中。所有研究均经希望之城国家医学中心研究动物护理委员会批准,并根据美国实验动物护理认证协会指南进行。meth a肉瘤细胞(meth a)是纪念sloan-kettering癌症中心(纽约,ny)的lj old博士的礼物。metha作为腹水瘤传代。抗-ctla-4(9h10)是md安德森癌症中心(休斯顿,tx)的james allison博士的礼物。使用celline装置(bd生物科学,山景城,ca)产生抗体。通过蛋白g-琼脂糖(amersham生物科学,乌普萨拉,瑞典)吸附纯化igg抗体,然后用0.1m甘氨酸-hcl(ph2.7)洗脱。产物用磷酸盐缓冲生理盐水透析,并使用sentryplus离心过滤装置(密理博,贝德福德,ma)浓缩。对照叙利亚仓鼠igg获自杰克逊免疫研究(西格罗夫,pa)。rsmva滴度通过使用vectastain elite abc试剂盒(vector实验室,伯林盖姆,ca)对被感染的培养物进行免疫染色而确定。smva表达的小鼠p53蛋白的抗原特异性检测使用抗p53抗体,pab122,然后与试剂盒中提供的过氧化物酶标记的山羊抗小鼠二抗温育。还使用与构建鼠smvap53相同的技术构建表达cmv-pp65的对照smva。
[0366]
体内肿瘤攻击实验
[0367]
6周龄雌性balb/c小鼠通过皮下途径在左侧注射5x105meth a细胞。在第三天,通过腹膜内注射5x107pfu的smvap53治疗小鼠。阴性对照小鼠被注射5x107pfu的smvapp65或磷酸盐缓冲盐水。额外的阳性对照使用原始报告中描述的相同鼠mvap53。每周使用荧光素酶技术通过ivis成像方法评估皮下肿瘤,如果没有将荧光素酶基因插入metha肉瘤细胞,则使
用卡尺评估皮下肿瘤。额外的方法是在左侧注射与smva感染年龄相同的balb/c小鼠1x106metha细胞。尽管ctla-4(9h10)抗体治疗,但该肿瘤显示在大多数小鼠中产生快速致死肿瘤。在肿瘤接种后第七天,小鼠腹膜内注射5x107pfu的smvap53。对照与上述相同。在肿瘤注射后第六天,第九天,和第十二天,分别以100,50,和50微克的剂量腹膜内注射抗-ctla-4(9h10)抗体或对照仓鼠抗体。
[0368]
示例8:smva的构建与体外和体内表征
[0369]
如图1所示设计的三个smva片段,当作为环状dna质粒共转染入辅助病毒感染的细胞时,可以分解成线性微染色体,经由共享的同源序列彼此重组,最终包装成全长mva基因组。所有三个smva片段都被克隆至大肠杆菌作为细菌人工染色体(bac)克隆。
[0370]
使用先前采用的过程从bac拯救mva
16,24,25
,在将三个dna质粒共转染入bhk细胞后用禽痘(fpv)作为辅助病毒重构smva病毒(图2)-这对fpv是不容许的。两种不同的fpv株(hp1.441和trovac)用于促进smva病毒重构(图12a)。超纯化的smva病毒在病毒在cef中繁殖后产生,这常用于mva疫苗的产生。用重构的smva病毒获得的病毒滴度与用野生型mva(wtmva)获得的病毒滴度相似(下表1)。
[0371][0372][0373]
为了表征smva的病毒dna,通过pcr比较了来自smva和wtmva感染的cef的dna提取物的几个mva基因组位置。对于所有被评估的基因组位置(图11a),包括f1/f2和f2/f3重组位点,smva和wtmva获得了相似的pcr结果,表明三个smva片段的有效重组。额外的pcr分析表明了smva病毒dna中不存在任何bac载体序列(图11a),表明smva病毒重构后细菌载体元件自发且有效地去除。通过限制性酶消化对来自超纯化的smva和wtmva病毒的病毒dna进行比较,揭示了smva和wtmva之间相似的基因组模式(图11b)。smva病毒dna的测序分析证实了几个位置处的mva基因组序列,包括f1/f2和f2/f3重组位点。此外,用fpv trovac重构的一个smva病毒分离株的全基因组测序证实了参考mva基因组序列的组装,并且源自重构的smva病毒的病毒dna中不存在载体特异性序列。
[0374]
为了表征smva的复制特性,比较了smva和wtmva在bhk细胞和cef细胞上的生长动力学,这两种细胞类型已知支持生产性mva复制4。该分析揭示了smva和wtmva在bhk细胞和cef细胞上的生长动力学相似(图12b)。另外地,在感染smva或wtmva的bhk和cef细胞单层中确定了相似的病毒病灶区域(图12c),表明smva和wtmva在mva容许细胞中扩散的能力相似。与smva和wtmva在bhk和cef细胞中的生产性复制相比4,在感染多种人细胞系后,观察到smva或wtmva仅产生有限的病毒(图12d)。这些结果与mva严格限制的复制特性一致,并显示
smva病毒可以在bhk和cef细胞中有效繁殖,而不能在人细胞中有效繁殖。
[0375]
为了在体内表征smva,在高剂量或低剂量进行两次免疫后,在c57bl/6小鼠中比较了smva和wtmva的免疫原性。在第一次和第二次免疫后由smva和wtmva刺激的mva特异性结合抗体是相当的(图13a,14a)。虽然高剂量疫苗组的抗体水平在第一次免疫后超过了低剂量疫苗组,但在第二次免疫后观察到高剂量和低剂量疫苗组的抗体水平相似。另外地,在第二次免疫后,smva和wtmva诱导的mva特异性nab反应水平未检测到显著差异(图13b,14b)。通过使用免疫显性肽的离体抗原刺激在加强免疫后测定的mva特异性t细胞反应揭示了在接受smva或wtmva的小鼠中相似的mva特异性t细胞水平(图13c-13d和14c-14d)。这些结果表明,smva病毒在诱导小鼠mva特异性体液和细胞免疫方面具有与wtmva相似的能力。
[0376]
参考文献
[0377]
下面列出的参考文献,专利和公开的专利申请,以及上面说明书中引用的所有参考文献均通过引用整体并入本文,如同在本文完全阐述。
[0378]
1.volz,a.&sutter,g.modified vaccinia virus ankara:history,value in basic research,and current perspectives for vaccine development.adv.virus res.97,187-243,doi:10.1016/bs.aivir.2016.07.001(2017).
[0379]
2 meisinger-henschel,c.et al.genomic sequence of chorioallantois vaccinia virus ankara,the ancestor of modified vaccinia virus ankara.the joumal of general virology 88,3249-3259,doi:10.1099/vir.0.83156-0(2007).
[0380]
3 meyer,h.,sutter,g.&mayr,a.mapping of deletions in the genome of the highly attenuated vaccinia virus mva and their influence on virulence.the joumal of general virology 72(pt 5),1031-1038(1991).
[0381]
4 carroll,m.w.&moss,b.host range and cytopathogenicity ofthe highly attenuated mva strain of vaccinia virus:propagation and generation of recombinant viruses in a nonhuman mammalian cell line.virology 238,198-211,doi:10.1006/viro.1997.8845(1997).
[0382]
5 sutter,g.&moss,b.nonreplicating vaccinia vector efficiently expresses recombinant genes.proc.natl.acad.sci.u.s.a.89,10847-10851(1992).
[0383]
6 earl,p.l.et al.immunogenicity of a highly attenuated mva smallpox vaccine and protection against monkeypox.nature 428,182-185,doi:10.1038/nature02331(2004).
[0384]
7 gilbert,s.c.clinical development of modified vaccinia virus ankara vaccines.vaccine 31,4241-4246,doi:10.1016/j.vaccine.2013.03.020(2013).
[0385]
8 mayr,a.,stickl,h.,muller,h.k.,danner,k.&singer,h.[the smallpox vaccination strain mva:marker,genetic structure,experience gained with the parenteral vaccination and behavior in organisms with a debilitated defence mechanism(author
′
s transl)].zentralbl bakteriol b 167,375-390(1978).
[0386]
9 wilck,m.b.et al.safety and immunogenicity of modified vaccinia ankara(acam3000):efiect of dose and route of administration.j.infect.dis.201,1361-1370,doi:10.1086/651561(2010).
[0387]
10 vollmar,j.et al.safety and immunogenicity of imvamune,a promising candidate as a third generation smallpox vaccine.vaccine 24,2065-2070,doi:10.1016/j.vaccine.2005.11.022(2006).
[0388]
11 greenberg,r.n.et al.a multicenter,open-label,controlled phase ii study to evaluate safety and immunogenicity of mva smallpox vaccine(imvamune)in 18-40 year old subjects with diagnosed atopic dermatitis.plos one 10,e0138348,doi:10.1371/jourmal.pone.0138348(2015).
[0389]
12 draper,s.j.,cottingham,m.g.&gilbert,s.c.utilizing poxviral vectored vaccines for antibody induction-progress and prospects.vaccine 31,4223-4230,doi:10.1016/j.vaccine.2013.05.091(2013).
[0390]
13 cottingham,m.g.&carroll,m.w.recombinant mva vaccines:dispelling the myths.vaccine 31,4247-4251,doi:10.1016/j.vaccine.2013.03.021(2013).
[0391]
14 chung,v.et al.evaluation of safety and efficacy of p53mva vaccine combined with pembrolizumab in patients with advanced solid cancers.clinical&translational oncology:official publication of the federation of spanish oncology societies and of the national caneer institute of mexico21,363-372,doi:10.1007/s12094-018-1932-2(2019).
[0392]
15 ishizaki,h.et al.modified vaccinia ankara expressing survivin combined with gemcitabine generates specific antitumor effects in a murine pancreatic carcinoma model.cancer immunol.immunother.60,99-109,doi:10.1007/s00262-010-0923-0(2011).
[0393]
16 wussow,f.et al.human cytomegalovirus vaccine based on the envelope gh/gl pentamer complex.plos pathog 10,e1004524,doi:10.1371/journal.ppat.1004524(2014).
[0394]
17 la rosa,c.et al.mva vaccine encoding cmv antigens safely induces durable expansion of cmv-specific t cells in healthy adults.blood129,114-125,doi:10.1182/blood-2016-07-729756(2017).
[0395]
18 chiuppesi,f.et al.multiantigenic modified vaccinia virus ankara vaccine vectors to elicit potent humoral and cellular immune reponses against human cytomegalovirus in mice.journal ofvirology 92,doi:10.1128/jvi.01012-18(2018).
[0396]
19 diamond,d.j.et al.a fifty-year odyssey:prospects for a cytomegalovirus vaccine in transplant and congenital infection.expert review of vaccines 17,889-911,doi:10.1080/14760584.2018.1526085(2018).
[0397]
20 mcfadden,g.poxvirus tropism.nature reviews.microbiology 3,201-213,doi:10.1038/nrmicro1099(2005).
[0398]
21 wyatt,l.s.,earl,p.l.&moss,b.generation of recombinant vaccinia viruses.current protocols in protein sciennce 89,51311-151318,doi:10.1002/cpps.33(2017).
ellenhorn jd.ctla-4blockade enhances the therapeutic effect of an attenuated poxvirus vaccine targeting p53 in an established murine tumor model.j immunol170(6):3401-3407,2003,pmid:12626601.
[0424]
47.taylor,j.,weinberg,r.,kawaoka,y.,webster,r.g.&paoletti,e.protective immunity against avian influenza induced by a fowlpox virus recombinant.vaccine 6,504-508(1988).
[0425]
48.mayr,a.&malicki,k.[attenuation of virulent fowl pox virus in tissue culture and characteristics of the attenuated virus].zentralbl.veterinarmed.b 13,1-13(1966).
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1