寡核苷酸的制作方法
本发明涉及维持toll样受体7(tlr7)应答和/或增强toll样受体8(tlr8)感测的寡核苷酸。
背景技术:
1、随着8种基于寡核苷酸的治疗药物在美国和欧盟获得批准(yin和rogge,2019;alshaer等人,2020),以及当前iii期研究中更多药物的商业化的前景(coutinho等人,2019),信使rna(mrna)的治疗靶向将在疾病管理中发挥重要作用。虽然已经开发了不同的策略来影响mrna翻译,例如招募rnase-h1(用反义寡核苷酸[aso]如inotersen或volanesorsen)或ago2(用小干扰rna[sirna]如patisiran、inclisiran或givosiran)以主动降解靶mrna,或促进剪接调节(用aso如依特立生(eteplirsen)和诺西那生钠(nusinersen)),值得注意的是,迄今为止批准的所有治疗性寡核苷酸均依赖于广泛的化学修饰。这种修饰对于防止核酸酶降解至关重要,也可能影响与靶mrna的结合亲和力。如硫代磷酸酯(ps)主链修饰所示,这些修饰可用于稳定磷酸二酯(po)核苷酸间连接,或通过糖修饰(例如,用2’-o-甲基[2’ome]、2’-甲氧基乙基[2’moe]、2’-氟[2’f]或锁核酸[lna])稳定碱基(yin和rogge,2019)。
2、在哺乳动物中,外源性核酸的识别是对病原体的免疫应答的关键组分,并且通过多种先天免疫传感器实现,其中包括toll样受体(tlr),如tlr7、tlr8和tlr9、维甲酸诱导基因-i(rig-i)样受体、nod样受体和环-gmp-amp合成酶(cgas)途径。因此,并不令人惊讶是发现选择性寡核苷酸治疗药物通过直接接触此类传感器激发强效免疫应答(hornung等人,2005;kleinman等人,2008;krieg等人,1995;pichlmair等人,2006),指导行业在临床前和临床开发期间仔细考虑和监测此类免疫应答(frazier等人,2015)。然而,先天免疫传感器对自身和非自身核酸的区分可通过在病原体中很少遇到的核酸修饰的存在来调节,如在人核糖体rna中丰度是细菌rna的25倍的2’-o甲基化(2’ome)核苷所示的(kariko等人,2005)。tlr7和tlr8选择性检测rna分子和碱基类似物(如咪唑喹啉和核苷类似物),并被2’ome碱基抑制,促进自身和非自身rna之间的分子区分(kariko等人,2005)。因此,在治疗性寡核苷酸中掺入选择性碱基修饰(包括2’ome)是帮助减轻tlr7和tlr8的异常免疫应答的有用策略(kariko等人,2005;hamm等人,2010),并广泛应用于治疗性sirna(coutinho等人,2019)。
3、然而,这种方法也可能导致非预期的免疫抑制作用,如在含有特异性2’ome基序的寡核苷酸序列拮抗tlr7和tlr8的情况下观察到的(sarvestani等人,2015)。类似地,据报道,ps修饰的dna寡核苷酸以序列依赖性方式拮抗tlr9(gursel等人,2003)、tlr7(beignon等人,2005)、aim2(kaminkski等人,2013)和cgas(steinhagen等人,2018)的感测(bayik等人,2016)。关键地,考虑到目前批准或正在研究的大多数治疗性寡核苷酸联合ps和碱基修饰,目前尚不确定此类组合是否影响免疫抑制的频率。
4、因此,需要对toll样受体7(tlr7)和/或tlr8应答具有有限免疫抑制作用的寡核苷酸。
技术实现思路
1、在设计和测试寡核苷酸时,发明人观察到有助于维持toll样受体7(tlr7)反应的结构特征。
2、因此,在一个方面,本发明提供了一种寡核苷酸,其包含在寡核苷酸的5’端和/或3’端的7个碱基内的三个连续嘧啶碱基。
3、在另一方面,本发明涉及一种寡核苷酸,所述寡核苷酸包含位于或靠近寡核苷酸5’端的两个连续胞嘧啶碱基。适当地,两个连续胞嘧啶碱基中的一个或两个被修饰和/或具有修饰的主链。
4、在一个实施方案中,上述方面的寡核苷酸包含:
5、a)包含修饰的和/或具有修饰的主链的碱基的5’区域,
6、b)包含核糖核酸、脱氧核糖核酸或其组合、碱基的中间区域,和
7、c)包含修饰的和/或具有修饰的主链的碱基的3’区域。
8、在相关方面,本发明提供了一种寡核苷酸,所述寡核苷酸包含5’区域、3’区域和中间区域,所述中间区域包含核糖核酸、脱氧核糖核酸或其组合、碱基,其中5’区域和3’区域中的一个或两个包含修饰的和/或具有修饰的主链的碱基,并且适用以下至少一项;
9、a)5’区域包含修饰的和/或具有修饰的主链的三个连续嘧啶碱基,
10、b)5’区域包含修饰的和/或具有修饰的主链的碱基,并且5’区域和中间区域之间的连接处包含三个连续嘧啶碱基,
11、c)3’区域包含修饰的和/或具有修饰的主链的三个连续嘧啶碱基,
12、d)3’区域包含修饰的和/或具有修饰的主链的碱基,并且3’区域和中间区域之间的连接处包含三个连续嘧啶碱基,和
13、e)5’区域包含两个连续胞嘧啶碱基,它们被修饰和/或具有修饰的主链。
14、在一个实施方案中,中间区域的长度为约20、约15或约10个碱基。
15、在一个实施方案中,5’区域和/或3’区域的长度为约7、约5或约3个碱基。
16、在一个实施方案中,三个连续嘧啶碱基位于或靠近寡核苷酸的5’端和/或3’端。
17、本发明的5’三个连续嘧啶碱基的实例包括但不限于具有序列5’-cuu-3’、5’-cut-3’、5’-ccu-3’、5’-uuc-3’、5’-uuu-3’或5’-ctt-3’的那些。在一个实施方案中,5’三个连续嘧啶碱基包含序列5’-cuu-3’。
18、本发明的3’三个连续嘧啶碱基的实例包括但不限于具有序列5’-uuc-3’、5’-tuc-3’、5’-ucc-3’、5’-cuu-3’、5’-uuu-3’或5’-ttc-3’的那些。在一个实施方案中,3’三个连续嘧啶碱基具有序列5’-uuc-3’。在另一个实施方案中,3’嘧啶碱基具有序列5’-cuuc-3’。
19、在一个实施方案中,嘧啶碱基中的一个、两个或全部三个是修饰的碱基和/或具有修饰的主链。
20、在一个实施方案中,连接处的三个连续嘧啶碱基具有序列5’-mcmut-3’、5’-mctt-3’、5’-tmumc-3’或5’-ttmc-3’,其中m是修饰的碱基和/或具有修饰的主链。
21、可用于本发明的修饰的碱基的实例包括但不限于包含2’-o-甲基、2’-o-甲氧基乙氧基、2’-氟、2’-烯丙基、2’-o-[2-(甲氨基)-2-氧代乙基]、4’-硫代、4’-ch2-o-2’-桥、4’-(ch2)2-o-2’-桥、2’-lna、2’-氨基、氟代阿糖核苷酸(fluoroarabinonucleotide)、苏糖核酸或2’-o-(n-甲基氨基甲酸酯)的那些。在一些实施方案中,修饰的碱基包含2’-o-甲基、2’-氟、2’-烯丙基、2’-o-[2-(甲氨基)-2-氧代乙基]、4’-硫代、4’-ch2-o-2’-桥、4’-(ch2)2-o-2’-桥、2’-氨基、氟代阿糖核苷酸、苏糖核酸或2’-o-(n-甲基氨基甲酸酯)。
22、可用于本发明的修饰的主链的实例包括但不限于包含硫代磷酸酯、取代硫原子的非桥接氧原子、膦酸酯诸如甲基膦酸酯、磷酸二酯、磷酸吗啉酸酯、磷酸哌嗪酸酯、酰胺、亚甲基(甲氨基)、甲缩醛(fromacetal)、硫代甲缩醛、肽核酸或磷酰胺诸如吗啉代磷二酰胺(pmo)、n3’-p5’亚磷酰胺或硫代亚磷酰胺的那些。
23、在一个实施方案中,寡核苷酸的至少一部分具有/是核糖核酸、脱氧核糖核酸、dna硫代磷酸酯、rna硫代磷酸酯、2’-o-甲基-寡核苷酸、2’-o-甲基-寡脱氧核糖核苷酸、2’-o-烃基核糖核酸、2’-o-烃基dna、2’-o-烃基rna硫代磷酸酯、2’-o-烃基dna硫代磷酸酯、2’-f-硫代磷酸酯、2’-f-磷酸二酯、2’-甲氧基乙基硫代磷酸酯、2-甲氧基乙基磷酸二酯、脱氧亚甲基(甲基亚氨基)(脱氧mmi)、2’-o-烃基mmi、脱氧甲基膦酸酯、2’-o-烃基甲基膦酸酯、吗啉代、4’-硫代dna、4’-硫代rna、肽核酸、3’-酰胺、脱氧3’-酰胺、2’-o-烃基3’-酰胺、锁核酸、环己烷核酸、三环-dna、2’氟-阿拉伯核酸、n3’-p5’磷酰胺、氨基甲酸酯连接、磷酸三酯连接、尼龙主链修饰及其任何组合。
24、在一个实施方案中,修饰的碱基包含2’o-甲基,寡核苷酸包含硫代磷酸酯主链。
25、在上述方面的一些实施方案中,两个连续胞嘧啶碱基包含2’-lna和硫代磷酸酯主链。
26、在一个实施方案中,三个连续嘧啶碱基中的一个、两个或全部三个不与靶多核苷酸杂交。
27、在上述方面的实施方案中,两个连续胞嘧啶碱基中的一个或两个不与靶多核苷酸杂交。
28、在另一方面,本发明提供寡核苷酸,所述寡核苷酸包含:
29、i)5’端的5’-cuugu-3’、5’-ccuau-3’、5’-cauua-3’、5’-cgaau-3’、5’-cuuau-3’、5’-cuuua-3’或5’acugu-3’,和
30、ii)3’端的5’-cuucu-3’、5’-cauau-3’、5’-cuucu-3’、5’-aauuu-3’、5’-aaauu-3’、5’-ccuuc-3’、5’-aauca-3’或5’-cgucu-3’。
31、在上述方面的一个实施方案中,寡核苷酸包含末端5’u。在另一个实施方案中,寡核苷酸包含末端5’uc。
32、在一个实施方案中,将以下中的任一个修饰以包含如上所述的5’区域,优选末端,和/或3’区域,优选末端;
33、5’-auggaauacucuugguuactt-3’和/或5’-guaaccaagaguauuccautt-3’(用于治疗多神经病的sirna链,称为patisiran);
34、5’-gcgtttgctcttcttcttgcg-3’(用于治疗巨细胞病毒性视网膜炎的反义寡核苷酸,称为福米韦森(fomivirsen));
35、5'-mg-mc*-mc*-mu*-mc*-da-dg-dt-dc*-dt-dg-dc*-dt-dt-dc*-mg-mc*-ma-mc*-mc*-3',其中m为2’-o-(2-甲氧基乙基)核苷,d是2’-脱氧核苷,在c和u的5位具有甲基(*)(用于治疗纯合子家族性高胆固醇血症的反义寡核苷酸,称为米泊美生(mipomersen));
36、其中下划线字母为2’-o-(2-甲氧基乙基)核糖核苷酸;非下划线字母为2’脱氧核糖核苷酸;所有嘧啶均为5-甲基化;所有连接均为硫代磷酸酯(用于治疗具有遗传性转甲状腺素介导的淀粉样变性的成人神经损伤的反义寡核苷酸,称为inotersen);
37、5'-cuccaacaucaaggaagauggcauuucuag-3'(用于治疗杜氏肌营养不良症的反义寡核苷酸,称为依特立生);
38、5’-tcactttcataatgctgg-3’,它是在硫代磷酸酯主链上完全2'-o-甲氧基乙基(moe)修饰的(用于治疗脊髓性肌萎缩症的反义寡核苷酸,称为诺西那生钠);
39、5'-xgttgcctccggttctgaaggtgttc-3',其中碱基通过合成的中性磷二酰胺吗啉寡聚物(pmo)主链连接,x是亲水性三甘醇链(用于治疗杜氏肌营养不良症的反义寡核苷酸,称为golodirsen);或
40、5'-cagaaagagugucucaucuua-3'和/或5'-uaagaugagacacucuuucuggu-3'(用于治疗急性肝卟啉症的sirna链,称为givosiran)。此外,此类寡核苷酸可具有其他修饰,例如本领域中的那些标准修饰。
41、在一个实施方案中,任何上述方面的寡核苷酸在施用至动物时不抑制toll样受体7(tlr7)活性。在一个实施方案中,动物是人。
42、在另一方面,本发明提供了包含一个或多个修饰的碱基和至少四个胸苷的寡核苷酸,其中所述寡核苷酸在施用至动物时增强toll样受体8(tlr8)活性。
43、在一个实施方案中,寡核苷酸包含5'u。在另一个实施方案中,寡核苷酸包含5'uc。
44、在一个实施方案中,寡核苷酸包含:
45、a)长度为至少5个碱基的5’区域,所述碱基被修饰和/或具有修饰的主链,
46、b)包含10个碱基的区段的中间区域,其中至少四个碱基是胸苷,
47、c)长度为至少5个碱基的3’区域。
48、在进一步的实施方案中,至少四个胸苷碱基处于连续区段中。
49、在另一个实施方案中,至少四个胸苷碱基中的一个、两个、三个或四个不处于连续区段中。
50、在另一方面,本发明提供了一种寡核苷酸,其包含:
51、a)长度为至少5个碱基的5’区域,其中5'末端由末端5'-mumc-3'或末端5'-mcmu-3'组成,其中m是修饰的碱基和/或具有修饰的主链,
52、b)包含10个碱基的区段的中间区域,其中至少两个碱基是胸苷,和
53、c)长度为至少5个碱基和/或具有修饰的主链的3’区域,
54、其中所述寡核苷酸在施用至动物(例如人)时增强toll样受体8(tlr8)活性。
55、在一个实施方案中,上述两个方面的寡核苷酸也是其他方面所定义的寡核苷酸。
56、寡核苷酸可以是任何大小。合适大小的例子包括但不限于长度为至少约10、至少约18、至少约20、至少约21、至少约22、至少约23、至少约24、至少约25、至少约26、至少约27、至少约28、至少约29、至少约30、至少约40、约10至约50个核苷酸、约18至约50个核苷酸、约18至约30个核苷酸、约20至约30个核苷酸、约20至1,000个核苷酸、约20至5,000个核苷酸或约20个碱基。
57、本发明的寡核苷酸可用于多种目的。在一个实施方案中,寡核苷酸是反义寡核苷酸,例如用于与靶mrna杂交以减少其翻译。在另一个实施方案中,寡核苷酸是用于基因沉默(例如rna干扰)的链寡核苷酸或形成其一部分。在另一个实施方案中,寡核苷酸用于增强toll样受体8(tlr8)活性但不与靶rna杂交。
58、在一个实施方案中,寡核苷酸是gapmer反义寡核苷酸。在一个实施方案中,三个连续嘧啶碱基中的一个、两个或所有三个在体内被核酸内切酶去除。
59、在一个实施方案中,反义寡核苷酸下调基因的表达并增强toll样受体8(tlr8)活性。
60、在一个实施方案中,用于基因沉默的双链寡核苷酸是sirna或shrna。
61、在一个实施方案中,寡核苷酸的长度为10到16个碱基,并且当施用至动物(例如人)时增强toll样受体8(tlr8)活性。
62、在另一方面,本发明提供了一种选择用于降低靶基因的表达的寡核苷酸的方法,所述方法包括:
63、i)针对具有至少三个连续嘧啶碱基的区域扫描靶多核苷酸或其互补物;
64、ii)产生包含三个连续嘧啶碱基的一种或多种候选寡核苷酸,其中适用以下一项或两项;
65、a)候选寡核苷酸在寡核苷酸5'端的七个碱基内包含三个连续嘧啶碱基,和
66、b)候选寡核苷酸在寡核苷酸3'端的七个碱基内包含三个连续嘧啶碱基,
67、iii)测试一种或多种候选寡核苷酸降低靶基因的表达的能力,和
68、iv)选择降低靶基因的表达的寡核苷酸。
69、在一个实施方案中,候选寡核苷酸的三个连续嘧啶碱基具有修饰的碱基和/或修饰的主链。
70、在另一方面,本发明提供了一种选择用于降低靶基因的表达的寡核苷酸的方法,所述方法包括:
71、i)针对具有至少三个连续嘧啶碱基的区域扫描靶多核苷酸或其互补物;
72、ii)产生一种或多种候选寡核苷酸,其包含5’区域、3’区域和包含核糖核酸、脱氧核糖核酸或其组合、碱基的中间区域,其中5’区域和3’区域中的一个或两个包含修饰的和/或具有修饰的主链的碱基,并且适用以下至少一项;
73、a)5’区域包含三个连续嘧啶碱基,它们被修饰和/或具有修饰的主链,
74、b)5’区域包含修饰的和/或具有修饰的主链的碱基,并且5’区域和中间区域之间的连接处包含三个连续嘧啶碱基,
75、c)3’区域包含三个连续嘧啶碱基,它们被修饰和/或具有修饰的主链,和
76、d)3’区域包含修饰的和/或具有修饰的主链的碱基并且3’区域和中间区域之间的连接处包含三个连续嘧啶碱基,
77、iii)测试一种或多种候选寡核苷酸降低靶基因的表达的能力,和
78、iv)选择降低靶基因的表达的寡核苷酸。
79、在另一方面,本发明提供了一种选择用于降低靶基因的表达的寡核苷酸的方法,所述方法包括:
80、(i)针对具有以下序列之一的区域扫描靶多核苷酸或其互补序列:5’-cuugu-3’、5’-ccuau-3’、5’-cauua-3’、5’-cgaau-3’、5’-cuuau-3’、5’-cuuua-3’、5’acugu-3’、5’-cuucu-3’、5’-cauau-3’、5’-cuucu-3’、5’-aauuu-3’、5’-aaauu-3’、5’-ccuuc-3’、5’-aauca-3’或5’-cgucu-3’,其中u可以是t,
81、ii)产生一种或多种候选寡核苷酸,包括:
82、a)5’端的5’-cuugu-3’、5’-ccuau-3’、5’-cauua-3’、5’-cgaau-3’、5’-cuuau-3’、5’-cuuua-3’或5’acugu-3’和/或
83、b)3’端的5’-cuucu-3’、5’-cauau-3’、5’-cuucu-3’、5’-aauuu-3’、5’-aaauu-3’、5’-ccuuc-3’、5’-aauca-3’或5’-cgucu-3’,
84、iii)测试一种或多种候选寡核苷酸降低靶基因的表达的能力,和
85、iv)选择降低靶基因的表达的寡核苷酸。
86、在另一方面,本发明涉及一种选择用于降低靶基因的表达的寡核苷酸的方法,所述方法包括:
87、i)针对具有至少两个连续胞嘧啶碱基的区域扫描靶多核苷酸或其互补物;
88、ii)产生包含两个连续胞嘧啶碱基的一种或多种候选寡核苷酸,其中候选寡核苷酸包含位于或靠近寡核苷酸5’端的两个连续胞嘧啶碱基,
89、iii)测试一种或多种候选寡核苷酸降低靶基因的表达的能力,和
90、iv)选择降低靶基因的表达的寡核苷酸。
91、在一些实施方案中,寡核苷酸的两个连续胞嘧啶碱基具有修饰的碱基和/或修饰的主链。
92、在其他实施方案中,寡核苷酸包含:
93、a)包含修饰的和/或具有修饰的主链的碱基的5’区域,
94、b)包含核糖核酸、脱氧核糖核酸或其组合、碱基的中间区域,和
95、c)包含修饰的和/或具有修饰的主链的碱基的3’区域。
96、在一个实施方案中,5’区域和/或3’区域的长度为约3个碱基。
97、在另一个实施方案中,中间区域的长度为约10个碱基。
98、在相关方面,本发明涉及一种选择用于降低靶基因的表达的寡核苷酸的方法,所述方法包括:
99、i)针对具有至少两个连续胞嘧啶碱基的区域扫描靶多核苷酸或其互补物;
100、ii)产生一种或多种候选寡核苷酸,其包含5’区域、3’区域和包含核糖核酸、脱氧核糖核酸或其组合、碱基的中间区域,其中5’区域和3’区域中的一个或两个包含修饰的和/或具有修饰的主链的碱基,并且5’区域包含两个连续胞嘧啶碱基,其被修饰和/或具有修饰的主链,
101、iii)测试一种或多种候选寡核苷酸降低靶基因的表达的能力,和
102、iv)选择降低靶基因的表达的寡核苷酸。
103、在一个实施方案中,5’区域和/或3’区域的长度为约3个碱基。
104、在另一个实施方案中,中间区域的长度为约10个碱基。
105、在上述两个方面的某些实施方案中,两个连续胞嘧啶碱基中的一个或两个是修饰的碱基和/或具有修饰的主链。适当地,对于以上两个方面,两个连续胞嘧啶碱基包含2’-lna和硫代磷酸酯主链。
106、在上述三个方面的一个实施方案中,所述方法还包括测试一种或多种候选寡核苷酸抑制toll样受体7(tlr7)活性的能力,并选择不抑制tlr7活性的寡核苷酸。在这方面,上述方面的方法适用于降低寡核苷酸的tlr7抑制活性。
107、在设计和测试寡核苷酸时,发明人还观察到有助于增强toll样受体8(tlr8)活性的新结构特征。
108、因此,在另一方面,本发明提供了一种选择用于降低靶基因的表达的寡核苷酸的方法,所述方法包括:
109、i)针对包含至少四个碱基是胸苷的区域扫描靶多核苷酸或其互补物;
110、ii)产生包含一个或多个修饰的碱基和至少四个胸苷的一种或多种候选寡核苷酸,
111、iii)测试一种或多种候选寡核苷酸降低靶基因的表达和增强toll样受体8(tlr8)活性的能力,以及
112、iv)选择降低靶基因的表达并增强tlr8活性的寡核苷酸。
113、在另一方面,本发明提供了一种选择增强toll样受体8(tlr8)活性的寡核苷酸的方法,所述方法包括:
114、i)针对具有序列uc或cu和10个碱基的区段的区域扫描靶多核苷酸或其互补物,其中至少两个碱基是胸苷;
115、ii)产生一种或多种候选寡核苷酸,其包含;
116、a)长度为至少5个碱基的5’区域,其中5’末端由末端5’-mumc-3’或末端5’-mcmu-3’组成,其中m是修饰的碱基和/或具有修饰的主链,
117、b)中间区域包含10个碱基的区段,其中至少两个碱基是胸苷,和
118、c)长度为至少5个碱基和/或具有修饰的主链的3’区域,
119、iii)测试一种或多种候选寡核苷酸增强tlr8活性的能力,以及
120、iv)选择增强tlr8活性的寡核苷酸。
121、在一些情况下,可能无法设计出具有所需嘧啶碱基的合适寡核苷酸。或者,在其他情况下,可能需要改进缺乏所需嘧啶碱基的预先存在的寡核苷酸的功能。因此,在另一方面,本发明提供了一种降低寡核苷酸的toll样受体7(tlr7)抑制活性的方法,所述方法包括通过将核苷酸序列添加到寡核苷酸的5’和/或3’端使得修饰的寡核苷酸在寡核苷酸的5’和/或3’端的七个碱基内包含三个连续嘧啶碱基。
122、在一个实施方案中,嘧啶碱基中一个、两个或所有三个是修饰的碱基和/或具有修饰的主链。
123、在另一方面,本发明提供了一种降低寡核苷酸的toll样受体7(tlr7)抑制活性的方法,所述方法包括修饰寡核苷酸,使得修饰的寡核苷酸包含以下至少一种;
124、a)5’区域包含三个连续嘧啶碱基,它们被修饰和/或具有修饰的主链,
125、b)5’区域包含修饰的和/或具有修饰的主链的碱基,并且5’区域和中间区域之间的连接处包含三个连续嘧啶碱基,
126、c)3’区域包含三个连续嘧啶碱基,它们被修饰和/或具有修饰的主链,和
127、d)3’区域包含修饰的和/或具有修饰的主链的碱基并且3’区域和中间区域之间的连接处包含三个连续嘧啶碱基。
128、在以上两个方面的一个实施方案中,三个连续嘧啶碱基位于修饰的寡核苷酸的5’和/或3’端。
129、在另一方面,本发明提供了降低寡核苷酸的toll样受体7(tlr7)抑制活性的方法,所述方法包括通过将核苷酸序列添加到寡核苷酸的5’端来修饰寡核苷酸,使得修饰的寡核苷酸包含位于或靠近寡核苷酸的5’端的两个连续胞嘧啶碱基。
130、在某些实施方案中,两个连续胞嘧啶碱基中的一个或两个是修饰的碱基和/或具有修饰的主链。
131、在相关方面,本发明涉及一种降低寡核苷酸的toll样受体7(tlr7)抑制活性的方法,所述方法包括修饰寡核苷酸,使得修饰的寡核苷酸包含5’区域,其包含被修饰和/或具有修饰的主链的两个连续胞嘧啶碱基。
132、在上述两个方面的具体实施方案中,两个连续胞嘧啶碱基位于或靠近修饰的寡核苷酸的5’端。
133、在上述两个方面的其他实施方案中,两个连续胞嘧啶碱基包含2’-lna和硫代磷酸酯主链。
134、在上述四个方面的另一个实施方案中,所述方法还包括测试修饰的寡核苷酸抑制tlr7活性的能力,并选择比未修饰的寡核苷酸更小程度地抑制(tlr7)活性的寡核苷酸。
135、还提供了使用本发明的方法选择的或使用本发明的方法修饰的寡核苷酸。
136、在另一方面,本发明涉及一种寡核苷酸,其包含表1至6中所列的核酸序列或其变体、由其组成或基本上由其组成。
137、在另一方面,本发明提供包含本发明的寡核苷酸的组合物。
138、在一个实施方案中,该组合物还包含药学上可接受的载体。
139、在另一个实施方案中,该组合物还包含免疫应答调节剂。
140、在另一方面,本发明提供了一种降低细胞中靶基因的表达的方法,所述方法包括使细胞与本发明的寡核苷酸接触。
141、在另一方面,本发明提供治疗或预防受试者的疾病的方法,所述方法包括向受试者施用本发明的寡核苷酸,其中所述寡核苷酸降低与疾病有关的靶基因的表达。
142、在一个实施方案中,已经或将向动物施用免疫应答调节剂。
143、在一个实施方案中,免疫应答调节剂是toll样受体(tlr)激动剂。合适的toll样受体(tlr)激动剂的实例包括但不限于碱基类似物(包括:鸟苷类似物、脱氮-腺苷类似物、咪唑喹啉或衍生物、羟基腺嘌呤化合物或衍生物、噻唑喹诺酮化合物或衍生物,苯并氮(benzoazepine)化合物或衍生物),或rna分子。
144、在一个实施方案中,tlr激动剂为鸟苷、尿苷、瑞喹莫德(r848)、洛索立宾、艾沙托立宾(isatoribine)、咪喹莫德、cl075、cl097、cl264、cl307、852a或tl8-506。
145、还提供了本发明的寡核苷酸在制备用于治疗或预防受试者的疾病的药物中的用途,其中所述寡核苷酸降低与该疾病有关的靶基因的表达。
146、此外,提供了用于治疗或预防受试者的疾病的本发明的寡核苷酸,其中所述寡核苷酸降低与该疾病有关的靶基因的表达。
147、本文中的任何实施方案应被视为经必要的修改后适用于任何其他实施方案,除非另有说明。
148、本发明不限于本文描述的具体实施方案的范围,这些具体实施方案仅旨在用于示例的目的。如本文所述,功能等同的产品、组合物和方法显然在本发明的范围内。
149、贯穿本说明书,除非另有具体说明或上下文另有要求,提及单个步骤、物质组合物、步骤组或物质组合物组应被认为包括一个和多个(即一个或多个)那些步骤、物质组合物、步骤组或物质组合物组。
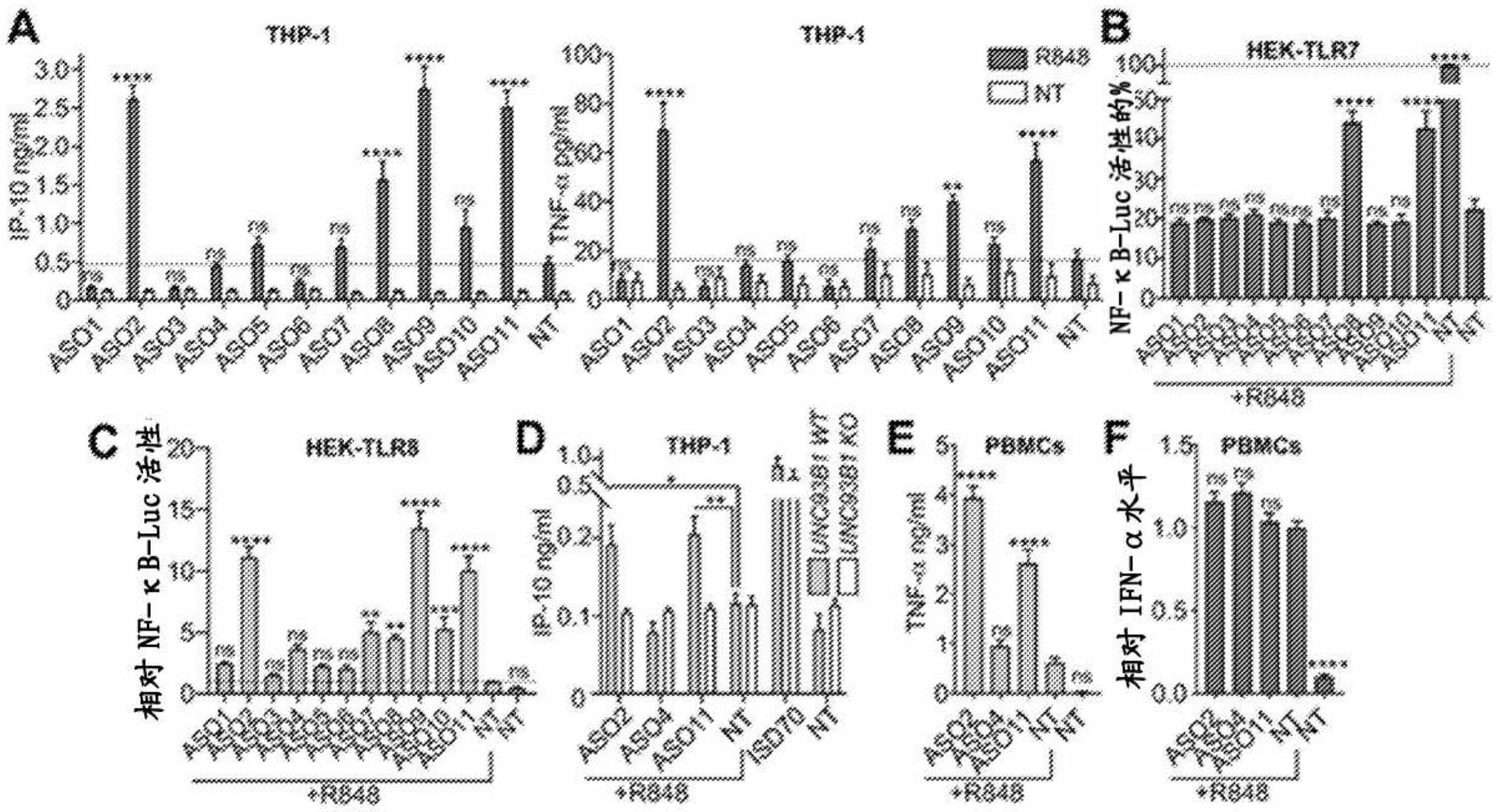
150、下文通过以下非限制性实施例并参考附图描述本发明。
- 还没有人留言评论。精彩留言会获得点赞!