蜻蜓凤梨AfFT2基因、克隆方法、表达载体及应用
蜻蜓凤梨afft2基因、克隆方法、表达载体及应用
技术领域
1.本发明属于生物技术领域,涉及凤梨ft基因、克隆、表达特性分析、表达载体构建、对乙烯的响应途径和对开花的调控作用。
背景技术:
2.凤梨科植物为多年生单子叶草本植物,包括重要的热带花卉(观赏凤梨)和重要的热带水果(菠萝)。为了满足市场需求,利用乙烯及其衍生物促进凤梨开花,调节上市时间,已经成为凤梨栽培中采用的重要技术。但实际生产中常有催花质量不佳造成经济损失的情况发生,解决这一问题的理论依据匮乏。已有的研究表明,外源乙烯通过提高内源乙烯的含量诱导凤梨植物开花,而内源乙烯如何启动开花仍是未解问题。
3.flowering locus t(ft)是植物开花调控途径的重要整合因子和调控开花的关键基因之一,可响应日照长短、温度等环境信号调控植物开花:不同光周期条件下,感受了constans(co)基因传递的光周期信号后,ft与fd基因互作,调控下游的apetala1(ap1)基因的表达,进一步调控leafy(lfy)基因,影响拟南芥开花;不同温度下,flowering locus c(flc)和short vegetative phase(svp)形成蛋白复合体,直接结合到了ft基因第一个内含子的carg box dna motif上,抑制了ft基因的表达,或者是由于受温度影响的mir156的靶标基因squamosa promoter binding protein(sbp)-like(spl3)直接结合到ft基因的启动子区的gtac元件上,调控ft基因的表达量,进一步影响到下游开花相关基因的表达而调控开花。但ft基因是否响应乙烯信号并进一步调控植物开花时间尚未可知。目前,也还没有关于凤梨科植物ft基因作用及其功能的报道。
4.通过蜻蜓凤梨(aechmea fasciata)比较转录组信息分析获得了ft基因的片段,blast对比显示均与其他植物中的ft基因具有较高的同源性,定名为afft 2。实时荧光定量pcr结果表明,乙烯处理凤梨成株后,afft 2基因的表达量明显提高,但在幼株中表达变化不明显。利用pcr克隆了基因的全长序列,在拟南芥中过表达后,回补了拟南芥ft突变体ft-10的晚花表型;在蜻蜓凤梨中过表达后,乙烯处理可以诱导转化体侧芽极早开花。利用酵母单杂和emsa技术,表明乙烯信号途径基因ein3蛋白可直接结合到afft2的启动子,诱导afft2的表达。说明,蜻蜓凤梨afft2基因具有响应外源乙烯并诱导开花的功能。
技术实现要素:
5.本发明的目的在于提供一种蜻蜓凤梨afft2基因,提取蜻蜓凤梨总rna,反转录合成cdna,以此为模板,设计特异引物,利用pcr方法获得afft2基因的全长cdna,与pmd-18t载体连接,转化大肠杆菌dh5α感受态细胞,挑取阳性克隆得到蜻蜓凤梨afft2基因,该基因的cdna全长818bp,包括起始密码子前的上游序列和多聚a尾巴。afft2基因的获得,为研究蜻蜓凤梨乙烯诱导开花机理奠定了基础,为凤梨植物栽培中乙烯催花技术的提高提供了理论参考,具有重要的理论及实践意义。
6.为了实现上述目的,本发明的技术方案为:提供一种蜻蜓凤梨afft2基因,该基因
序列具有序列表中seq id no.1所示的核苷酸序列。
7.本发明的另一目的在于提供一种蜻蜓凤梨afft2基因的克隆方法,包括以下步骤:
8.(1)以蜻蜓凤梨(aechemia fasciata)为材料,利用ctab法提取总rna:
9.(2)afft2基因的克隆:
10.(2-1)利用invitrogen公司的superscript iii kit将rna反转录为cdna,作为pcr模板备用;
11.(2-2)设计全长cdna扩增引物;
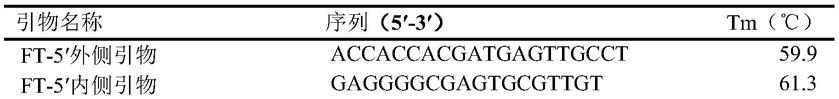
12.ft基因cdna全长克隆引物
[0013][0014][0015]
(2-3)根据引物的tm值进行pcr条件的优化后,进行pcr扩增,并将获得的产物连接到大肠杆菌,经pcr和酶切鉴定后进行序列测定。
[0016]
pcr体系及条件为:
[0017][0018][0019]
获得全长的cdna为818bp,包括部分起始密码子前的5’utr和终止密码子后的3’utr。开放阅读框部分为537bp,由此推得具179个氨基酸的一段序列,将此氨基酸序列在国际基因库中进行比较,表明与已发表的菠萝、玉米、水稻的ft蛋白的氨基酸同源性分别为91%、62%、51%。
[0020]
进一步地,步骤(1)总rna的提取具体如下:
[0021]
(1-1)取1ml ctab提取液分装到2ml离心管中,65℃预热;
[0022]
(1-2)称取0.2g材料,在液氮中研磨后立即转入含有ctab提取液的离心管中,涡旋混合,65℃温浴2~3min;
[0023]
(1-3)立即加入等体积的氯仿/异戊醇,涡旋混合,室温,10000rpm离心15min;
[0024]
(1-4)吸取上清到一新的离心管中,重复步骤(1-3);
[0025]
(1-5)取上清到一新的离心管中,加入1/3体积的8m licl,4℃沉淀过夜;
[0026]
(1-6)4℃,10000rpm离心30min;
[0027]
(1-7)弃上清,沉淀用70%乙醇洗涤,再用无水乙醇洗涤;
[0028]
(1-8)将沉淀溶解在100μl ste中,立即用氯仿/异戊醇抽提一次;
[0029]
(1-9)取上清,加入2倍体积的无水乙醇,-80℃沉淀30min,或-20℃沉淀2h;
[0030]
(1-10)4℃,10000rpm离心20min;
[0031]
(1-11)沉淀分别用70%乙醇和无水乙醇洗涤,干燥后用20μl rnase-free水溶解。
[0032]
进一步地,步骤(2-2)中的扩增引物包括ft-5
′
外侧引物、ft-5
′
内侧引物、ft-3
′
外侧引物、ft-3
′
内侧引物,所述ft-5
′
外侧引物、ft-5
′
内侧引物、ft-3
′
外侧引物、ft-3
′
内侧引物的序列依次如序列表中的seq id no.2、seq id no.3、seq id no.4、seq id no.5所示。
[0033]
本发明的另一目的在于提供一种蜻蜓凤梨afft2基因表达载体,利用蜻蜓凤梨afft2基因为目的基因的表达载体。
[0034]
进一步地,用蜻蜓凤梨afft2基因插入到植物表达载体cam35s-gfp上,构建成在camv35s启动子下游含有蜻蜓凤梨afft2基因的高效表达载体。
[0035]
蜻蜓凤梨afft2基因表达载体的构建,具体如下:
[0036]
根据已测序的afft2基因序列,设计在5’端加上kpni酶切位点的上游引物p1(5
’‑
cgagctcaga accaccacgatgagttgcct-3’)和在3’端加上xbali酶切位点的下游引物p2(5
’‑
gctctaga cactcgcccctcccactat-3’)。通过pcr反应扩增目的片段,回收pcr产物,经测序无误后再用kpni和xbali双酶切该产物和植物表达载体cam35s-gfp,并将酶切获得的含有两个酶切位点的基因和cam35s-gfp载体大片段连接获得含有afft2基因的表达载体。
[0037]
本发明的再一目的在于提供蜻蜓凤梨afft2基因在响应乙烯调控植物开花技术中的应用。
[0038]
afft2基因表达特性与乙烯诱导开花的关联分析:
[0039]
乙烯处理蜻蜓凤梨幼株不能诱导开花,处理成株可开花。利用实时荧光定量pcr测定了乙烯处理后的幼株和成株中afft2基因的表达水平,结果显示,在幼株中,乙烯处理后,afft2基因的表达水平在处理后6h,略有提高;而在成株中,乙烯处理后6h,afft2的表达量显著提高,是幼株中的20多倍。这说明,afft2基因在蜻蜓凤梨成株中明显受乙烯诱导,可能与开花有关。
[0040]
afft2基因的功能鉴定:
[0041]
(一)利用农杆菌介导法转化拟南芥。取拟南芥哥伦比亚(ecotype columbia)野生型(wt)和ft缺失突变体ft-10,开花后使用携带有afft2基因的植物表达载体的农杆菌进行侵染,并获得潜在的转基因种子,然后在50mg/l潮霉素的ms固体平板培养基上进行抗性筛选,获得t1代阳性转基因植株,待其成熟,再在50mg/l潮霉素的ms固体平板培养基上进行抗
性筛选,获得稳定遗传的t2代阳性转基因植株。通过观察发现转afft2基因的拟南芥野生型植株比未转基因的早花2d;转afft2基因的突变体ft-10比未转基因ft-10的早花3d。
[0042]
(二)利用农杆菌介导法转化蜻蜓凤梨。取蜻蜓凤梨无菌试管苗的叶片,使用携带有afft2基因的植物表达载体的农杆菌进行侵染,叶片分化不定芽后,在50mg/l潮霉素的ms固体平板培养基上进行抗性筛选,获得抗性芽,壮苗生根后,经gfp鉴定为阳性的植株,移栽到花盆中培养14个月,乙烯处理后,小侧芽开花。比未转基因蜻蜓凤梨的小侧芽开花早10个月以上。
[0043]
本发明利用实时荧光定量pcr测定了蜻蜓凤梨幼株(6-7个月)和成株(12-15个月)乙烯处理后afft2基因的表达水平,证实的乙烯处理后成株中的表达水平明显高于幼株。连接到植物表达载体cam35s-gfp上,构建一个新的植物表达载体,命名为cam35s-afft2。该基因会影响拟南芥开花和蜻蜓凤梨乙烯处理后开花。因此,afft2基因的获得,为研究蜻蜓凤梨乙烯诱导开花机理奠定了基础,为凤梨植物栽培中乙烯催花技术的提高提供了理论参考,具有重要的理论及实践意义。
具体实施方式
[0044]
通过以下详细说明可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0045]
实施例1:蜻蜓凤梨基因的克隆方法
[0046]
1、总rna的提取:改良的ctab法。
[0047]
(1)取1ml ctab提取液分装到2ml离心管中,65℃预热;
[0048]
(2)称取0.2g材料,在液氮中研磨后立即转入含有ctab提取液的离心管中,涡旋混合,65℃温浴2~3min;
[0049]
(3)立即加入等体积的氯仿/异戊醇(24:1),涡旋混合,室温,10000rpm离心15min;
[0050]
(4)吸取上清到一新的离心管中,重复步骤(3);
[0051]
(5)取上清到一新的离心管中,加入1/3体积的8m licl,4℃沉淀过夜;
[0052]
(6)4℃,10000rpm离心30min;
[0053]
(7)弃上清,沉淀用70%乙醇洗涤,再用无水乙醇洗涤;
[0054]
(8)将沉淀溶解在100μl ste(65℃预热)中,立即用氯仿/异戊醇抽提一次;
[0055]
(9)取上清,加入2倍体积的无水乙醇,-80℃沉淀30min,或-20℃沉淀2h;
[0056]
(10)4℃,10000rpm离心20min;
[0057]
(11)沉淀分别用70%乙醇和无水乙醇洗涤,干燥后用20μl rnase-free水溶解;2、afft2基因的克隆及序列分析
[0058]
(1)利用invitrogen公司的superscript iii kit将rna反转录为cdna,作为pcr模板备用。
[0059]
(2)设计全长cdna扩增引物:
[0060][0061]
(3)根据引物的tm值进行pcr条件的优化后,按照发明内容一所述的方法进行pcr扩增,并将获得的产物连接到大肠杆菌,经pcr和酶切鉴定后进行序列测定。
[0062]
(4)同源检索:利用blast软件将分离出的序列与基因银行中的序列进行比较。
[0063]
实施例2:蜻蜓凤梨afft2基因在幼株和成株中实时荧光定量rt-pcr表达检测:
[0064]
提取蜻蜓凤梨幼株与成株rna,并反转录合成cdna,根据qpcr引物设计原则设计特异引物,内参基因为蜻蜓凤梨afactin。引物序列如下:
[0065][0066]
以sybr green i作为荧光染料,利用qpcr测定afft2基因在不同株龄蜻蜓凤梨中的相对表达水平,用2-δδct
法计算afft2基因在各样品中的相对表达量。反应在quantstudio
tm 3荧光定量pcr仪(thermo fisher scientific)上进行。反应体系为20μl(模板2μl,正反向引物各0.4μl,50
×
rox reference dye2染料0.4μl,qpcr master mix混合液10μl,灭菌去离子水补齐至20μl)。反应程序为:95℃预变性30s;95℃10s,60℃30s,40个循环。融解曲线采集使用仪器默认程序。
[0067]
实施例3:蜻蜓凤梨afft2基因植物表达载体cam35s-gfp的构建
[0068]
1、根据分离出的蜻蜓凤梨afft2基因的核苷酸序列,设计引物:
[0069]
正向引物:5'-cgagctcagaagaagcgagggggagg-3'
[0070]
反向引物:5'-gctctaga caaataggactaggaaatgggag-3'
[0071]
以总rna反转录的5’race的cdna为模板,进行聚合酶链式反应。
[0072]
2、取1μl pcr产物与pmd18-t载体进行连接,操作步骤按takara公司产品pmd18-t vector system说明书进行。然后转化大肠杆菌dh5α菌株,在表面涂异丙基硫代-β-d-半乳糖苷(iptg)和5-溴-4氯-3-吲哚-β-d-半乳糖苷(x-gal)的含氨苄青霉素(100微克/毫升)的lb平板上生长过夜。挑取白色菌落,在lb液体培养基中培养过夜。碱法提取质粒dna,进行序列测定。
[0073]
3、用kpni和xbai两个限制性内切酶将该基因从pmd18-t vector载体上切下,与相同酶酶切的cam35s-gfp连接。连接产物转化dh5α细胞,然后在含卡那霉素的lb固体平板上培养,对菌落进行pcr鉴定和质粒dna的酶切分析。将构建好的重组子命名为cam35s-afft2。
[0074]
实施例4:afft2基因的乙烯响应机制
[0075]
1、dna的提取,改良的ctab法。
[0076]
(1)用2ml离心管在65℃水浴上预热1ml ctab缓冲液;
[0077]
(2)取0.2g材料在液氮中研磨后,迅速转入含有ctab缓冲液的离心管中,立即涡旋30s,然后65℃水浴中温浴30min,不断混匀;
[0078]
(3)加入等体积的氯仿/异戊醇(24:1),颠倒混匀,室温,11000g离心10min
(eppendorf,5810r);
[0079]
(4)取上清,加入等体积的氯仿/异戊醇,颠倒混匀,室温,11000g离心10min;
[0080]
(5)取上清,加入2倍体积的无水乙醇,颠倒混匀,-20℃沉淀30min,4℃,6000g离心10min;
[0081]
(6)沉淀用70%乙醇洗涤2次,风干,用200μl高盐te溶解;
[0082]
(7)4℃,6000g离心10min,上清转入新的离心管,加入3μl10mg/ml的rnasea,37℃温浴30min;
[0083]
(8)加入等体积的苯酚:氯仿:异戊醇(25:24:1),混匀,4℃,11000g离心10min;(9)取上清,加入等体积的氯仿/异戊醇,混匀,4℃,11000g离心10min;
[0084]
(10)取上清,加入2倍体积无水乙醇,混匀,-20℃沉淀30min,4℃,6000g离心10min;
[0085]
(11)沉淀用70%乙醇洗涤2次,风干,用30μlte溶解沉淀;
[0086]
(12)取2μl电泳检测,并利用核酸/蛋白分析仪(eppendorf biophotometer)检测其浓度和纯度,其余样品-20℃保存。
[0087]
2、afft2启动子的克隆与分析
[0088]
根据蜻蜓凤梨基因组序列,设计afft2启动子克隆引物,正向引物:5'-cgagctcagaagaagcgagggggagg-3',反向引物:5'-gctctagacaaataggactaggaaatgggag-3'。pcr克隆afft2启动子,pcr体系及条件为:
[0089][0090][0091]
获得全长的dna为3136bp,对其响应元件分析后,在该启动子序列的-395bp(相对于起始密码子atg而言)和-1847bp处分别找到了乙烯信号通路中关键因子afein3的核心结合元件atgta。
[0092]
3、酵母单杂交分析
[0093]
将afft2的3136bp的启动子序列分成了6段,分别构建入phis2载体中,同时将afein3的编码序列构入pgadt7 rec2载体中,通过酵母单杂交验证afein3与各分段启动子的相互作用。
[0094]
3.1、酵母单杂交诱饵载体的构建
[0095]
首先通过分析afft2启动子核苷酸序列与afein3基因的结合位点,即与afein3基因结合的核心序列“atgta”,发现完全匹配的“atgta”的位点有两个,其他还有多个差1个碱基的位点,将afft2的3136bp的启动子序列分成了6段,采用同源重组的方法设计带有phis2载体酶切位点同源臂序列的分段引物如下:
[0096][0097]
通过pcr反应扩增目的片段,回收pcr产物,经测序无误后,与通过ecori和saci双酶切的phis2载体进行同源重组(其中第四段因启动子本身含有ecori、smai位点,只能用saci和mlui),参考clonexpresstmii one step cloning kit试剂盒(vazyme)说明书构建重组载体,即酵母单杂交的诱饵载体。
[0098]
3.2、酵母单杂交猎物载体的构建
[0099]
根据分离出的蜻蜓凤梨afein3基因的核苷酸序列,采用同源重组的方法设计带有pgadt7载体酶切位点同源臂序列的引物,正向引物:
[0100]
5'-gaggccagtgaattccctccctctttctttctctctct-3',反向引物:
[0101]
5'-acccgggtggaattccgaatagaagttaaaaactatat-3'。通过pcr反应扩增目的片段,回收pcr产物,经测序无误后,与通过ecorⅰ酶切的pgadt7载体进行同源重组,参考clonexpresstmii one step cloning kit试剂盒(vazyme)说明书构建重组载体,即酵母单杂交的猎物载体。
[0102]
3.3、双转化酵母
[0103]
参考酵母y187感受态细胞说明书将诱饵载体和猎物载体双转化酵母感受态细胞中,涂布于二缺(sd/-trp/-leu)营养缺陷型培养基,30℃倒置培养2~4d,观察菌落生长情况。挑取饱满单克隆菌落,30℃,200rpm摇10h,按照梯度重悬(10倍,100倍,1000倍)后分别
用移液枪滴至加3-at(3-aminotriazole)(浓度分别110mmol
·
l-110mmol
·
l-170mmol
·
l-1、70mmol
·
l-1)的三缺营养缺陷型(sd/-trp/-leu/-his)固体培养基上,30℃培养2~4d,观察其生长情况及颜色变化。
[0104]
4、emsa分析
[0105]
4.1、afein3基因cds序列获取及原核表达载体构建
[0106]
根据ncbi网站预测的afein3基因cds序列,采用同源重组的方法设计带有pet28a载体酶切位点同源臂序列的引物,正向引物:
[0107]
5'-cgcggatccgaattcatgatgggtggcctcttaatgg-3',反向引物:
[0108]
5'-acggagctcgaattctcagtagaaccagtttggtccgt-3'。通过pcr反应扩增目的片段,回收pcr产物,经测序无误后,与通过ecorⅰ酶切的pet28a载体进行同源重组,方法参考clonexpresstmii one step cloning kit试剂盒
[0109]
(vazyme)说明书。
[0110]
4.2、afein3蛋白的诱导表达及纯化
[0111]
取原核表达载体的菌种50μl接种于5ml含卡那霉素的lb液体培养基中,置于摇床中37℃、220rpm培养12h。将5ml活化菌种转入500ml含卡那霉素的lb液体培养基中,置于摇床中37℃、220rpm培养至菌体od
600
约为0.6-0.8(约2.5h)。然后加入iptg至终浓度为0.4μm,置于摇床中37℃、160rpm培养约4h。
[0112]
将经过诱导的菌体分装到10个50ml的离心管中,离心机中5500rpm,离心30min。
[0113]
弃上清,沉淀用pbs缓冲液洗涤2次,随后按5ml每克的菌体加入预冷的bingding buffer(50mm tris-cl ph 8.0、500mm nacl、10%甘油,10mm咪唑)重悬。超声破碎前加入蛋白酶抑制剂至终浓度为1mm,加入溶菌酶至终浓度为1mg/ml,冰浴10min。用超声破碎仪,超声功率100w,超声破碎5s停5s,持续约30min,至样品变得清亮透明。加入rna酶至终浓度为10μg/ml冰浴10min后置于离心机中4℃、6000rpm离心40min。
[0114]
吸取2-3ml ni-nta基质到层析柱中,加入bingding buffer平衡层析柱,重复3-5次。将经破碎离心后的上清液加入层析柱中,摇床上冰浴结合1-2h。用wash buffer(50mm tris-cl ph8.0、500mm nacl、10%甘油,20mm咪唑)洗涤3-5次后,用elution buffer(50mm tris-cl ph8.0、500mm nacl、10%甘油,350mm咪唑)洗脱,将洗脱液收集于试管中,待测定浓度和纯度后于-80℃超低温冰箱中备用。
[0115]
4.3.emsa探针生物素标记
[0116]
通过酵母单杂交验证分析后,以afft2启动子的第一段核苷酸序列中与afein3基因结合的核心序列“atgta”为中心,合成大小约90bp的片段并进行emsa探针生物素标记。根据afft2启动子的第一段核苷酸序列结合位点设计探针引物,正向引物:5
’‑
actcaatttttctcgaacgtaaa-3’,反向引物为5
’‑
cagaagtaagatctcgttgaatc-3’;通过pcr反应扩增目的片段,回收pcr产物,经测序无误后,参考碧云天emsa探针生物素标记试剂盒说明书合成emsa探针。
[0117]
4.4、6.5%emsa变性胶的制备
[0118][0119]
4.5、探针与蛋白结合凝胶阻滞验证
[0120]
取出-80℃冰箱保存的afein3蛋白冰上冻融后,置于37℃水浴锅中水浴5分钟;
[0121]
参考碧云天化学发光法emsa试剂盒说明书进行探针与蛋白的结合试验。用0.5
×
tbe作为电泳缓冲液,按照10v/cm的电压预电泳10min,然后以80v电泳跑至聚丙烯酰胺凝胶下缘四分之一处。将跑完的胶经过转膜后放于image quant las4000仪器曝光显影,观察阻滞结果。
[0122]
实施例5:afft2基因的开花功能鉴定
[0123]
1、拟南芥种植
[0124]
称取适量的拟南芥(ecotype columbia)野生型种子,假如要种100株苗,一般需要500粒种子,以免种子不萌发,每粒种子约重0.02μg,总共需要10μg种子。将种子加去离子水,置于4度冰箱春化,24h后换一次水(4℃预冷),春化72h之后播种。播种前将种子置于光下放置6h。栽培介质为椰糠,播种前充分吸水,用移液器从水中吸5粒种子,播到培养钵中,尽量使种子分散。播种完覆盖保鲜膜,置于合适条件(湿度60%;温度23℃;光周期16h光/8h暗)下等待发芽,3d左右可以将保鲜膜去掉。种子出芽之后,间苗两次,尽量选取大小一致的苗留下,最终每个营养钵中只剩下一株苗。两天浇水一次,一周浇ms营养液一次。
[0125]
2、蜻蜓凤梨组培苗的培育
[0126]
取中国热带农业科学院热带作物品种资源研究所在国家热带作物中期库中保存的试管苗,利用ms基本培养基+ba0.2 mg/l+naa 0.1mg/l+蔗糖30g/l+卡拉胶7g/l,ph 5.8进行培养,湿度60%;温度25℃;光周期16h光/8h暗,光照强度50μmol
·
m-2
·
s-1
。
[0127]
3、侵染菌液的制备
[0128]
挑取含有目的基因的阳性菌落,在5ml含有相应抗生素的lb液体培养基中,28℃,200r/min培养约24h,期间对菌液进行pcr鉴定,确保目的基因的存在;吸取培养过的菌液2ml,加入到50ml新鲜的含有相应抗生素的lb液体培养基,继续振荡培养至od600约为1.0,离心收集菌体,用适量拟南芥转化液(ms+0.3mg/l 6-ba+150g/l蔗糖+15g/l ems+0.06%silwet l-77,ph=5.7)重悬菌体,终浓度od600约为0.8,用于拟南芥浸花转化;菌体用适量蜻蜓凤梨转化液(ms基本培养基+蔗糖30g/l)重悬,终浓度od600约为0.5,用于蜻蜓凤梨转化。
[0129]
4、转化
[0130]
(1)拟南芥,种植约一个月,植株开始陆续开花,挑选生长健壮的植株为待转化植株,转化前不断去除顶端花序,以使植株产生更多的花蕾。转化前一天需将待转化植株充分
浇水。将准备好的转化液装在喷壶中,轻轻喷洒在拟南芥花序上,喷至叶片滴水为止,将喷过菌液的植株用保鲜袋包裹,黑暗条件下培养24h,去除保鲜袋,正常培养。视植株生长及开花情况,约一周后可再喷一次,以后正常培养,直至收获t1代种子。
[0131]
(2)蜻蜓凤梨,不定芽高2cm左右时,从外向内取第2-6片莲座叶,切取从基部向上0.5-1.0cm长的段,农杆菌浸泡10min,无菌吸水纸吸干,接种到共培养基:ms基本培养基+ba 4.0mg/l+iba 2.0mg/l+蔗糖30g/l+卡拉胶7g/l,ph 5.8;黑暗条件(湿度60%;温度25℃)下共培养2d后,转接到恢复培养基:ms基本培养基+ba 4.0mg/l+iba 2.0mg/l+carb 0.3g/l+蔗糖30g/l+卡拉胶7g/l,ph 5.8,暗培养7d后,转入选择培养基。
[0132]
5、转基因植株的筛选
[0133]
(1)拟南芥:将收获的拟南芥种子至于离心管中,先用1ml 0.1%的升汞灭菌2min,然后用无菌水冲洗5-6遍,用枪头吸取种子,播于潮霉素浓度为25mg/l的ms固体培养基上。4℃黑暗条件下春化72h,转移至培养室,温度23℃;光周期16h光/8h暗条件下培养。约两周后,选取叶片绿色、根系发育正常的抗性植株移植到栽培基质中继续培养。移植前栽培基质充分吸水,移植后覆盖保鲜膜,约3d去除,以后管理同上,收获t2代种子,做好标记,继续筛选,至得到纯合转化植株。
[0134]
(2)蜻蜓凤梨:将在恢复培养基中培养7d的外植体转入选择培养基:ms基本培养基+ba 4.0mg/l+iba 2.0mg/l+carb 0.3g/l+g418 50mg/l+蔗糖30g/l+卡拉胶7g/l,ph 5.8,暗培养20d左右,分化不定芽后转至光下培养,培养条件:湿度60%;温度25℃;光周期16h光/8h暗,光照强度50μmol
·
m-2
·
s-1
。不定芽长度3-4cm时,单个切下,转接到壮苗、生根培养基:ms基本培养基+naa 2.0mg/l+carb 0.3g/l+kana 0.2g/l+蔗糖30g/l+卡拉胶7g/l,ph 5.8,光下培养。
[0135]
6、转基因植株的分子鉴定
[0136]
提取拟南芥苗期dna,利用基因特异引物进行pcr检测目的基因存在与否,所用引物为:上游引物5
’-gaggggcgagtgcgttgt-3’和下游引物5
’-cactcgcccctcccactat-3’;对检测为阳性的拟南芥和随机抽取蜻蜓凤梨抗性植株,提取其rna,反转录后pcr,检测目的基因的表达量变化:在拟南芥可正常转录;在蜻蜓凤梨植株中表达量显著提高,证明这些植株为转基因阳性植株。
[0137]
7、转基因表型观察
[0138]
(1)拟南芥:对转基因拟南芥在生长不同阶段进行观察,发现转afft2的野生型拟南芥比未转基因的早花2d;转afft2的ft缺少突变体ft-10比未转化的早花3d。进一步说明afft2的高表达促进了拟南芥开花,符合理论推测。
[0139]
(2)蜻蜓凤梨:转基因的蜻蜓凤梨,移栽到花盆中,在控温大棚中培养,温度27-32℃,湿度80%-90%,遮阴度30%左右。12个月,用600倍乙烯利溶液灌心处理,35d后,分生侧芽并很快开花,而未转基因植株,也分生侧芽,但不能开花。进一步说明,afft2的高表达促进了蜻蜓凤梨响应乙烯开花。
[0140]
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属于本发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1