形成类肾体的多能干细胞的分化
形成类肾体的多能干细胞的分化
1.本技术是申请日为2015年12月15日、申请号为201580076197.x、发明名称为“形成类肾体的多能干细胞的分化”的发明专利申请的分案申请。
技术领域
2.本发明涉及肾发育。更具体地说,本发明涉及产生类肾体的体外方法,其包括肾单位和/或输尿管芽和/或这些的祖细胞,其至少部分血管化并含有肾间质区室。
背景技术:
3.在终末期肾病的流行率全球每年上升8%的情况下,迫切需要肾再生策略。肾脏是通过输尿管芽(ureteric bud,ub)的形成以及该芽与相邻中段中胚层(intermediate mesoderm,im)来源的后肾间充质(metanephric mesenchyme,mm)之间的相互作用而从im分化的中胚层器官。肾单位来自源于mm的肾单位祖细胞群。im或mm中的其他祖细胞被认为有助于肾基质/间质和包括肾小球毛细血管在内的肾血管系统的组分。im本身源于后原条(posterior primitive streak)。尽管非常了解肾脏的发育起源,人肾中的肾单位形成在出生前已经完成5。因此,没有能够替代丢失的肾单位的出生后的干细胞。
4.人多能干细胞对于产生用于肾病的基于细胞的治疗具有巨大的潜力。然而,人多能干细胞作为临床使用的细胞来源以及作为诸如肾病等的治疗的实现已经因缺乏对如何制备产生肾单位和肾的其它结构所必需的细胞类型的理解而受到阻碍。
技术实现要素:
5.本发明人使用正常胚胎发生期间使用的生长因子,在完全化学限定的单层培养条件下成功地引导人多能干细胞通过后原条和中段中胚层(im)的分化。该分化方案导致输尿管芽(ub)和后肾间充质(mm)的同步诱导,所述同步诱导在体外形成自组织结构,包括肾单位形成和分段,以形成远端小管、近端小管和鲍曼氏囊。类器官还含有间充质源性肾基质。这种hesc来源的组分显示出广泛的离体肾潜能,说明了基于多能干细胞的肾再生的潜力。此外,本发明人已经引导类肾体内的血管系统分化,包括分化的输尿管芽(ub)、后肾间充质(mm)和mm来源的肾单位和基质。在特定形式中,本发明提供在缩短的培养期内形成类肾体的聚集的肾单位祖细胞和输尿管上皮祖细胞的生成。更具体地,本发明提供一种用于引导人多能干细胞形成复合多细胞类肾体的方法,所述复合多细胞类肾体包含由内皮和肾间质包围的完全分段的肾单位,并且与人胎肾转录相似。
6.因此,本发明的一个方面提供一种生产肾单位祖细胞和输尿管上皮祖细胞的方法,所述方法包括使中段中胚层(im)细胞与以下接触的步骤:成纤维细胞生长因子9(fgf9)和/或成纤维细胞生长因子20(fgf20)和/或成纤维细胞生长因子2(fgf2);和任选选自由:骨形态发生蛋白7(bmp7);肝素;wnt激动剂;视黄酸(ra),类似物或激动剂;和ra拮抗剂组成的组的一种或多种剂;从而在诱导或促进肾单位祖细胞和输尿管上皮祖细胞聚集成一个或多个类肾体的条件下由im细胞产生肾单位祖细胞和输尿管上皮祖细胞,由此类肾体至少部
分血管化和/或包含血管祖细胞。
7.在一些实施方案中,通过促进或引导来自间充质细胞或组织的血管内皮或血管祖细胞的发育的条件来促进至少部分血管化和/或血管祖细胞的存在。
8.在一个实施方案中,通过包含一种或多种人多能干细胞和/或由其分化的血管内皮祖细胞来促进类肾体的血管形成。
9.在另一个实施方案中,通过使用促进血管形成的合适的氧分压(oxygen tension)来促进类肾体细胞的血管化。
10.在一个实施方案中,im细胞衍生自或分化自后原条细胞。
11.在一个实施方案中,后原条细胞衍生自或分化自人多能干细胞(hpsc)。hpsc的非限制性实例包括人胚胎干细胞(hesc)和诱导的人多能干细胞(ipsc)。
12.本发明的相关方面提供一种产生中胚层细胞的方法,所述方法包括以下步骤:使hpsc与wnt激动剂接触,从而产生中胚层细胞。中胚层细胞可以是中胚层细胞例如定形中胚层(definitive mesoderm)和包括喙部im和/或尾部im的中段中胚层(im)的混合群体。
13.该方法可以进一步包括使定形中胚层细胞与成纤维细胞生长因子9(fgf9)和/或成纤维细胞生长因子20(fgf20)和/或成纤维细胞生长因子2(fgf2)接触的后续步骤。
14.适当地,使定形中胚层细胞与成纤维细胞生长因子9(fgf9)和/或成纤维细胞生长因子20(fgf20)和/或成纤维细胞生长因子2(fgf2)接触的后续步骤有助于形成中段中胚层(im),其随后产生来自im细胞的输尿管上皮细胞和肾单位祖细胞的分化。
15.在另一个实施方案中,该方法还包括将细胞解离并再聚集成细胞团用于在fgf2、fgf9和/或fgf20的存在下培养的后续步骤。适当地,该步骤有利于生产包含肾单位的类肾体。在fgf2、fgf9和/或fgf20的存在下的培养可以在空气/培养基界面处的浮动过滤器上进行。
16.在另一个实施方案中,所述方法还包括在除去fgf2、fgf9和/或fgf20之前添加wnt激动剂,并且随后在没有生长因子的情况下培养。该步骤进一步促进类肾体内肾单位的形成。适当地,在相对短的时间内(如30-60分钟)wnt激动剂处在相对较高的浓度下。
17.任选地,在任何上述步骤中在wnt激动剂、成纤维细胞生长因子9(fgf9)和/或成纤维细胞生长因子20(fgf20)和/或成纤维细胞生长因子2(fgf2)的存在下培养细胞还可以包括以下的一种或多种:视黄酸(ra)拮抗剂,ra或ra激动剂,骨形态发生蛋白7(bmp7);和/或视黄酸。
18.优选地,类肾体至少部分血管化。
19.优选地,类肾体包括由内皮、血管周围细胞和肾间质包围的分段的肾单位。
20.在一个实施方案中,通过包含一种或多种人多能干细胞和/或由其分化的血管内皮祖细胞来促进类肾体的血管化。
21.在另一个实施方案中,通过使用促进血管化的合适的氧分压来促进类肾体的血管化。
22.在一个实施方案中,该方法还包括鉴定活的肾单位祖细胞和/或输尿管上皮祖细胞的步骤。
23.在某些实施方案中,活的肾单位祖细胞和/或输尿管上皮祖细胞的鉴定包括作为活的肾单位和/或输尿管上皮祖细胞的标志物的多种核酸和/或蛋白质的共表达的测定或
检测。
24.另一方面,本发明提供根据前述方面的方法产生的分离的、富集的或纯化的肾单位和/或输尿管上皮祖细胞和/或类肾体。
25.优选地,类肾体包括由内皮和肾间质包围的分段的肾单位。
26.还在另一方面,本发明提供了一种产生肾或者肾细胞或组织的方法,所述方法包括由前述方面的肾单位祖细胞和/或输尿管上皮祖细胞和/或类肾体分化肾或者肾细胞或组织的步骤,由此产生肾或者肾细胞或组织。
27.在一些实施方案中,肾单位祖细胞和/或输尿管上皮祖细胞和/或类肾体可用于全器官脱细胞肾的再细胞化,从而产生重构或替代的肾。
28.在其他实施方案中,肾单位祖细胞和/或输尿管上皮祖细胞和/或类肾体可用作肾脏疾病和病况的细胞疗法的来源。
29.在某些方面,肾单位祖细胞和/或输尿管上皮祖细胞和/或类肾体可用作用于生物打印或生物工程全肾的细胞或组织的来源、用于肾移植或治疗慢性肾损害或疾病的肾细胞和/或组织的来源。
30.一个特定方面提供一种生物打印肾结构的方法,所述方法包括沉积本文公开的多个hpsc或其它祖细胞以形成肾结构,所述肾结构具有肾或其组分的一种或多种功能特征,或者其能够显现肾或其组分的一种或多种功能特征。
31.适当地,所述肾结构至少部分血管化和/或包含血管祖细胞。
32.适当地,hpsc或其它祖细胞经受本文公开的方法用于产生三维结构中的肾单位祖细胞和输尿管上皮祖细胞。
33.该特定方面还提供生物打印的肾结构,其具有肾或其组分的一种或多种功能特征,或能够显现肾或其组分的一种或多种功能特征,通过前述方法产生。
34.另一个具体方面提供一种生物打印肾结构的方法,所述方法包括沉积本文公开的多个肾单位祖细胞和输尿管上皮祖细胞以形成肾结构,所述肾结构具有肾或其组分的一种或多种功能特征,或能够显现肾或其组分的一种或多种功能特征。
35.适当地,生物打印的肾结构至少部分血管化和/或包含血管祖细胞。
36.适当地,肾单位祖细胞和输尿管上皮祖细胞已经通过本文公开的方法由hpsc产生。
37.该特定方面还提供生物打印的肾结构,其具有肾或其组分的一种或多种功能特征,或能够显现肾或其成分的一种或多种功能特征,由上述方法产生。
38.本发明的另一方面提供具有平面几何形状的肾单位祖细胞和输尿管祖细胞的阵列。
39.所述阵列可以包括2-15个或更多个堆叠阵列。
40.所述阵列可以以棋盘格状图案堆叠。
41.本发明的相关方面提供通过使前述方面的阵列或其中的细胞成熟或分化而获得的类肾体。
42.适当地,类肾体至少部分血管化和/或包含血管祖细胞。
43.另一方面,本发明提供一种确定一种或多种化合物的肾毒性的方法,所述方法包括使所述一种或多种化合物与前述方面的分离或纯化的肾单位祖细胞和/或输尿管上皮祖
细胞、生物打印的肾结构、阵列和/或类肾体、或由其分化或以其他方式获得的肾细胞或组织接触的步骤,从而确定所述一种或多种化合物是否是肾毒性的。
44.在一个实施方案中,该方面提供肾单位祖细胞和/或输尿管上皮祖细胞向用于肾毒性筛选的类肾体的生物打印。
附图说明
45.图1.用chir培养3、4或5天,然后单独使用fgf9(b)或使用fgf9(b)与ra(a)或ra拮抗剂(c)一起培养的分化效果。
46.图2.存在于形成肾单位之间的meis1
+
基质群体的存在。红色=meis1;蓝色=核。
47.图3.cd31
+
血管祖细胞的存在。红=nphs1(足细胞),蓝=核,绿=cd31。
48.图4.相互连接的正常发育中的肾单位的所有区段包括收集管(gata3
+
pax2
+
ecad
+
),远端小管(ecad
+
gata3-ltl-),近端小管(ltl
+
aqp1
+
)和肾小球(wt1
+
nphs1
+
synpo
+
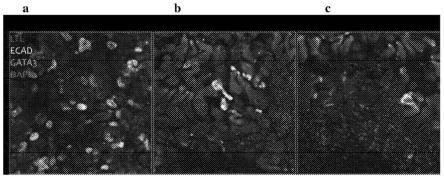
)的存在,提示正常的胚胎器官发生。粉色=gata3,绿色=ecad,蓝色=ltl,红色=wt1,收集管(粉色和绿色),远端小管(绿色),近端小管(蓝色),肾小球(红色在核中)。
49.图5.细胞成团后11天培养的类肾体。a=直径3至5cm的亮视野图像。b=免疫荧光染色的图像。绿色=ecad,红色=nphs1,蓝色=ltl,远端小管(绿色),近端小管(蓝色),肾小球(红色)。
50.图6.再聚集后立即加入高chir(5μm)的45分钟脉冲,然后在含有或不含agn(视黄酸抑制剂)、bmp7、低chir或ra的fgf9中培养5天,然后没有这些因子培养6天。a=没有chir的4天细胞团;b=45分钟chir脉冲的4天细胞团;c=没有chir的11天细胞团;d=45分钟chir脉冲的11天细胞团。
51.图7.收集管或肾间充质谱系的选择性诱导。a,示意性说明胚胎发生中im的a-p模式化(patterning)机制
13
。psm细胞迁移的时间设置决定了暴露于fgf9和ra的时间设置,导致ai和pi之间的命运选择。psm,前体节中胚层;ai,前中段中胚层;pi,后中段中胚层;ue,输尿管上皮;mm,后肾间充质。b,三个实验时间线的示意图。c,上述时间设置的分化的初始7天的时程qpcr。使用单层培养条件进行实验。(平均
±
s.d.,n=3个独立实验)d,用ai标志物gata3和pi标志物hoxd11分化的第7天的免疫荧光。比例尺=100μm。实验重复=3e,示意性说明后原条阶段的ra信号传导。ra代谢酶cyp26在psm区域表达以屏蔽psm细胞免受ra信号转导的影响。f,三个实验时间线的示意图。ra或agn193109(agn)在chir99021后加入fgf9,随后将生长因子撤出(无gf)。用单层培养条件进行实验。g,在3天chir99021后接着
±
ra/agn的分化第18天的免疫荧光。agn抑制早期迁移细胞的ai规格,导致后部化。在第18天,gata3和hoxd11分别标志ue和mm(左图)。gata3
+
pax2
+
ecad
+
细胞代表ue,而gata3-pax2
+
细胞表示mm(ecad-)及其衍生物(ecad
+
)(右图)。实验重复=3。比例尺=100μm。
52.图8.体外产生相当于人胎儿肾的类肾体。a,hpsc分化方案的示意图。b,跨时间序列的自组织类肾体的全局亮视野观察。类器官分化成功率为94.2%(138个类器官,5次实验)。比例尺=1mm。c,平扫扫描全类肾体的免疫荧光显示结构复杂性。比例尺=1mm d,大功率免疫荧光显微镜显示肾单位分为4个区室,包括收集管(cd,gata3
+
ecad
+
),远端小管(dt,gata3-ecad
+
ltl-),近端小管(pt,ecad-ltl
+
)和肾小球(g,wt1
+
)。比例尺=100μm。e,共聚焦显微镜从第11天类肾体的底部到顶部产生串联z-堆叠图像(扩展数据视频1和2)。示意图说
明了类器官内不同结构的位置。e'、e”和e”'是在e中指示的位置通过类器官拍摄的代表性图像。如下所述,肾单位的每个区段都被标志(或在示意图中着色):收集管,gata3
+
ecad
+
(在黄色中的绿点);远端小管,ecad
+
(黄色);近端小管,ltl
+
(红色);肾小球nphs1(绿色圆圈)。比例尺=100μm。f,类肾体与13个人胎儿组织的相对转录同一性的可视化热图(得分从0到1,使用keygene算法
15
确定)。对来自4个时间点(聚集后第0、3、11、18天)的全类肾体x来自1个实验/时间点的3个个体类器官进行rna-seq(参见补充表2)。g,基于先前定义的85个关键基因(补充表3),显示了来自第一妊娠期和第二妊娠期的人胎儿器官与第0、3、11和18天类肾体的分层聚类的树形图
15
。这清楚地显示了从第11天和第18天培养的第1妊娠期胎儿肾脏的紧密匹配。
53.图9.类肾体含有分化的肾单位、基质和血管系统,随着时间的推移逐渐成熟。a,示意图说明了从im到肾的每种细胞组分的发育途径。cd,收集管;dt,远端小管;loh,henle环;pt,近端小管;pod,足细胞;vasc,血管系统;strom,肾间质。b-j,第11天或第18天类肾体的免疫荧光。b,由pax2、gata3和ecad标志的收集管。比例尺=50μm。c,d,第11天ltl
+
ecad-的早期近端小管(空白箭头)。ltl
+
ecad
+
成熟的近端小管出现在第18天(白色箭头)。比例尺=100μm。e,近端小管表达cubilin(cubn)。比例尺=50μm。f,由umod和ecad标志的henle环。比例尺=50μm。g,具有由wt1和nphs1标志的足细胞的发育中的肾小球。比例尺=50μm。h,肾间质内的cd31
+
内皮细胞。比例尺=200μm。i,培养第18天内皮侵入肾小球的证据。比例尺=50μm。j,meis1标志的肾间质。比例尺=100μm。k-m,类肾体的透射电子显微镜。k,具有相对稀疏的短微绒毛(m)和紧密连接(tj)的推定的远端小管。l,推定的近端小管,内腔填充有广泛密集的、刷状缘(bb)特有的微绒毛。m,具有特征性大核和初级足突(pf)和次级足突(sf)的足细胞(p)。数据代表了至少3次独立实验。
54.图10.近端小管的功能成熟。a,显示ltl
+
小管的内吞能力的葡聚糖摄取测定。比例尺=50μm。b,用20μm顺铂处理类肾体,导致ltl
+
ecad
+
近端肾小管细胞凋亡。通过切割的半胱天冬酶3抗体染色(casp3)检测凋亡细胞。比例尺=100μm。c,通过肾毒性剂顺铂定量显示成熟的近端小管特异性细胞凋亡的凋亡小管数。响应于5um和20um顺铂,ltl
+
ecad
+
成熟近端小管(pt)剂量依赖地进行凋亡。相比之下,ltl
+
ecad-未成熟pt对顺铂没有反应。通过独立t检验(平均值
±
s.e.,n=5个独立实验)计算p值。
55.图11.类肾体中肾发生的调节。a,在聚集后立即用5μm的chir99021刺激类器官1h促进肾发生(chir脉冲),而没有chir99021(无脉冲)下只有有限数量的肾发生事件发生。比例尺=1mm。b,在该chir99021脉冲之后,不加入fgf9的情况下,类器官未引发肾发生(-fgf9)。比例尺=200μm。
56.图12.类肾体发育过程中基因表达的变化。a-c,显示了类肾体培养物的4个时间点(第0、3、11和18天)所选标志基因的表达变化的图。x轴表示rna测序分析中每个基因的检测计数。肾单位祖细胞(cap间充质)和收集管祖细胞(输尿管尖端)的标志物在第3天达到顶峰,然后下降(a)。早期肾单位的标志物在第3天增加,而成熟的肾单位组分(近端和远端小管和足细胞)的标志物在第3天后开始。图解显示发育中的肾中每个选定基因的表达区域(蓝色)(b)。
57.图13.显示d0、d3、d11、d18分化实验和来自第一和第二妊娠期的21个人胎儿器官
(gse66302)的分层聚类的树形图
15
。样品名称由个体id后接器官名称和孕周组成。例如,“dj1肾_9”代表来自个体id:dj1的第9周妊娠的肾脏。d0和d3类肾体带有性腺,与中段中胚层的性腺和肾脏的共同起源一致。d11和d18类肾体显示出与妊娠1期人肾最强的相似性。用于该分析的分类基因详见表3。
58.图14.类肾体中非上皮结构的表征。所有图像均取自第18天类肾体a,附着于kdr
+
血管的pdgfra
+
周细胞。比例尺=50μm。b,一些肾小球含有可能代表早期肾小球系膜细胞的pdgfra
+
细胞
19
。比例尺=50μm。
具体实施方式
59.本发明至少部分地基于鉴定特定的体外培养条件,所述条件定制为促进肾单位祖细胞和输尿管上皮祖细胞从中段中胚层(im)的同步、同时分化以产生至少部分血管化的类肾体或其它肾细胞或组织聚集体。更具体地,fgf9加肝素单独地、或者与包括骨形态发生蛋白7(bmp7)、视黄酸(ra)、ra拮抗剂;wnt激动剂和/或fgf20加肝素;和/或fgf2加肝素的一种或多种试剂组合,能够促进中段中胚层分化为肾单位祖细胞和输尿管上皮祖细胞。此外,体外培养方法提供一种体系,其用于通过后原条、im和后肾间充质阶段分化人胚胎干细胞以产生肾单位祖细胞和输尿管上皮祖细胞。有利地,可以操纵某些分子如ra、ra拮抗剂和/或wnt激动剂的存在或不存在以优先促进肾单位祖细胞与输尿管上皮祖细胞的产生,反之亦然。更具体地,本发明还基于以下发现:人多能干细胞可以引导形成复合多细胞类肾体,所述复合多细胞类肾体包含由内皮和肾间质包围的完全分段的肾单位并且与人胎肾转录相似。可以通过促进或引导血管内皮从间充质细胞或组织发育的条件来促进血管形成。
60.肾单位祖细胞和输尿管上皮祖细胞同时诱导,引导彼此在体内分化,并且能够发育成包括输尿管树和肾单位祖细胞间充质在内的不同管状上皮结构,期间上皮结构代替输尿管尖端以维持肾单位祖细胞。因此提出了根据本发明产生的hesc来源的输尿管上皮和/或肾单位祖细胞可以引导从输尿管和间充质区室二者分化成肾细胞。此外,可以进而利用这些细胞“自组织”成为聚集的类器官结构的能力来促进肾脏修复,例如借助于肾脏生物工程。如上所述肾单位祖细胞、由其衍生的肾单位或“自组织”的类肾体也可适用于受到以前无法生产适合于试验的细胞阻碍的肾毒性试验。
61.除非另有定义,本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。尽管与本文所述类似或等同的任何方法和材料可以用于本发明的实施或试验中,但是描述了优选的方法和材料。
62.如本文所使用的,除上下文另有要求外,术语“包括(comprise)”和该术语的变体如“comprising”、“comprises”和“comprised”,不意图排除进一步的添加剂、组分、整数或步骤。
63.将理解的是,不定冠词“a”和“an”不能被视为单数的不定冠词,或者不包括不止一个或多于一个不定冠词所指的单个对象。例如,“一个”细胞包括一个细胞、一个或多个细胞和多个细胞。
64.为了本发明的目的,“分离的”意指已经从其天然状态除去或以其他方式进行人为操作的材料。分离的材料(例如,细胞)可以实质上或基本上不含在其天然状态下通常伴随的组分,或者可以操作成与在其天然状态下通常伴随的组分一起处于人造状态。
[0065]“富集的”或“纯化的”意指在特定状态(例如富集或纯化状态)下与富集或纯化之前的先前状态相比具有更高的发生率、表现或频率。
[0066]
术语“分化”(“differentiate”,“differentiating”和“differentiated”)涉及细胞从发育途径的较早或初始阶段到发育途径的较晚或更成熟阶段的进展。将理解的是,在这种情况下,“分化(differentiated)”并不意味着或暗示细胞是完全分化的,并且已经丧失沿着该发育途径或沿着其它发育途径进一步进展的多能性或能力。分化可伴随细胞分裂。
[0067]“祖细胞”是能够沿着一个或多个发育途径分化,具有或不具有自我更新的细胞。通常,祖细胞是单能或寡能的并且能够至少有限的自我更新。
[0068]
如在本领域中将会很好理解的,细胞分化的阶段或状态可通过表达和/或不表达一种或多种标志物表征。在此情况下,“标志物”是指由细胞、细胞群、谱系、区室或子集的基因组编码的核酸或蛋白质,其表达或表达模式在整个发育过程中变化。核酸标志物表达可以通过本领域已知的任何技术来检测或测定,包括核酸序列扩增(例如聚合酶链式反应)和核酸杂交(例如微阵列、northern杂交、原位杂交),但不限于此。蛋白质标志物表达可以通过本领域已知的任何技术检测或测定,包括流式细胞术,免疫组织化学,免疫印迹,蛋白质阵列,蛋白质分析(例如2d凝胶电泳),但不限于此。
[0069]
本发明的一个方面提供生产肾单位祖细胞和输尿管上皮祖细胞的方法,所述方法包括使中段中胚层(im)细胞与:bmp7;视黄酸(ra);ra拮抗剂;wnt激动剂;成纤维细胞生长因子9(fgf9)和/或fgf20;和肝素接触的步骤;从而由im细胞产生肾单位祖细胞和输尿管上皮祖细胞。
[0070]
本文涉及的“视黄酸”或“ra”包括与ra具有相似生物学活性的所有形式的视黄酸(例如包括所有反式ra和9-顺式ra)、类似物和/或视黄酸受体(rar)激动剂。各种不同的ra类似物和rar激动剂(包括对rarα、β或γ非选择性和选择性的激动剂)是可从例如r&d systems和tocris bioscience商购的。
[0071]
具体涉及的“ra拮抗剂”包括视黄酸受体(rar)拮抗剂和通过rar抑制、阻断或阻止ra信号转导的任何其它分子。rar拮抗剂的非限制性实例包括agn193109、le 135、er 50891、bms 493、bms 453和mm 11253,但不限于此。该定义不排除ra拮抗剂也或可选地模拟由另一种配体的结合经由rar的信号传导阻断的可能性。
[0072]
如本文所用,“wnt激动剂”是在典型wnt信号传导途径的背景下、但优选不在其他非典型wnt信号传导途径的背景下抑制gsk3(例如gsk3-β)的分子。wnt激动剂的非限制性实例包括可从诸如santa cruz biotechnology和r&dsystems等商购的chir99021、licl sb-216763、cas 853220-52-7和其它wnt激动剂。不应将此定义视为绝对排除wnt激动剂模拟一种或多种其他gsk3β活性抑制剂的可能性。
[0073]
还将理解的是,尽管fgf9是优选的,但成纤维细胞生长因子如fgf2、fgf9和fgf20可以是可互换的。通常包括肝素以促进或增强成纤维细胞生长因子如fgf2、fgf9和/或fgf20的生物学活性。
[0074]
下文将更详细地描述fgf9、bmp7、视黄酸(ra);ra拮抗剂;wnt激动剂;fgf20和肝素各自优选的浓度。还将提及控制或操纵某些分子如ra激动剂或类似物、ra拮抗剂和/或wnt激动剂的存在或不存在以优先促进肾单位祖细胞与输尿管上皮祖细胞的产生,反之亦然。
[0075]
如本文所用,“肾单位祖细胞”是衍生自后肾间充质的祖细胞,其可以通过初始间充质向上皮过渡来分化成所有肾单位节段(除收集管外),其包括肾单位上皮细胞如连接段、远端小管曲部(dct)细胞、远端小管直部(dst)细胞、近端小管直部(pst)段1和2、pst细胞、足细胞、肾小球内皮细胞、henle上升环和/或henle下降环,但不限于此。肾单位祖细胞也能够自我更新。
[0076]
后肾间充质特有的或代表后肾间充质的标志物的非限制性实例包括wt1,six1,six2,sall1,gdnf和/或hoxd11,但不限于此。肾单位祖细胞特有的或代表肾单位祖细胞的标志物的非限制性实例包括wt1,six1,six2,cited1,pax2,gdnf,sall1,osr1和hoxd11,但不限于此。
[0077]“输尿管上皮祖细胞”意指衍生自、可得自或源自可以发育成肾组织和/或结构如收集管的中肾管或其衍生物输尿管芽的上皮祖细胞。
[0078]
输尿管上皮祖细胞特有的或代表输尿管上皮祖细胞的标志物的非限制性实例包括hoxb7,cret,gata3,calb1,e-cadherin和pax2,但不限于此。
[0079]
如上所述,肾单位祖细胞和输尿管上皮祖细胞在fgf9单独或与包含bmp7、视黄酸(ra)、激动剂或类似物、ra拮抗剂如agn193109和/或fgf20的一种或多种试剂、优选肝素组合的存在下从中段中胚层(im)分化。
[0080]“中段中胚层(im)”细胞意指从定形中胚层产生的胚胎中胚层细胞,而定形中胚层来源于后原条并可最终发育成泌尿生殖系统,包括输尿管和肾脏以及其他组织如性腺。中段中胚层特有的或代表中段中胚层的标志物的非限制性实例包括pax2,osr1和/或lhx1。
[0081]
还将理解,im细胞的产生并不意味着im细胞是不存在其它细胞类型(例如定形中胚层)的纯的或同质的im细胞群。因此,提及“im细胞”或“im细胞群”是指包含im细胞的细胞或细胞群。
[0082]
适当地,根据本发明,如下文将更详细描述的,通过使后原条细胞与促进将后原条细胞分化为im细胞的一种或多种试剂接触来产生im细胞。
[0083]
优选地,im细胞通过使后原条细胞与促进将后原条细胞分化成im细胞的一种或多种试剂接触来产生。
[0084]
通常,所述一种或多种试剂包括成纤维细胞生长因子9(fgf9)和任选的ra拮抗剂如agn193109和/或一种或多种其它fgf如fgf2和/或fgf20。
[0085]“后原条(posterior primitive streak,pps)”细胞意指可从在哺乳动物胚胎发育的早期阶段在囊胚中形成的原条结构的后端的细胞获得的细胞、或者与所述细胞功能上和/或表型上对应的细胞。后原条建立双侧对称性,确定原肠胚形成的位置并启动胚层形成。通常,后原条是中胚层的祖细胞(即推定的中胚层),前原条是内胚层的祖细胞(即推定的内胚层)。后原条特有的或代表后原条的标志物的非限制性实例包括brachyury(t)。前原条特有的或代表前原条的标志物的非限制性实例是sox17。mixl1可以由后原条和前原条表达。
[0086]
还将理解,后原条细胞的产生并不意味着后原条细胞是没有其它细胞类型存在的纯的或同质的后原条细胞群。因此,提及“后原条细胞”或“后原条细胞群”意指包含后原条细胞的细胞或细胞群。
[0087]
适当地,根据本发明,如下文将更详细描述的,后原条细胞通过使hpsc细胞与促进
hpsc细胞分化成后原条细胞的一种或多种试剂接触来产生。
[0088]
通常,所述一种或多种试剂包括骨形态发生蛋白4(bmp4)、活化素a和/或wnt激动剂如chir99021。
[0089]
术语“人多能干细胞”和“hpsc”是指衍生自、可得自或源自显示多能性的人组织的细胞。hpsc可以是人胚胎干细胞或人诱导的多能干细胞。
[0090]
人多能干细胞可来自内细胞团,或使用来自许多胎儿或成体体细胞类型的山中因子(yamanaka factors)重新编程。使用体细胞核转移可能可产生hpsc。
[0091]
术语“人胚胎干细胞”,“hes细胞”和“hesc”是指衍生自、可得自或源自人胚胎或囊胚的细胞,其是自我更新和多能或全能的,具有产生成熟动物中存在的所有细胞类型的能力。人胚胎干细胞(hesc)可以分离自例如从人体内植入前胚胎,体外受精胚胎或扩大到囊胚阶段的单细胞人胚胎获得的人囊胚。
[0092]
术语“诱导多能干细胞”和“ipsc”是指衍生自、可得自或源自通过外源基因例如转录因子的表达重编程为多能状态的任何类型的人成体体细胞的细胞,所述转录因子包括oct4、sox2、klf4和c-myc的优选组合。hipsc显示相当于hesc的多能性水平,但是可以衍生自进行自体治疗(在分化和细胞递送之前有或没有同时进行基因校正)的患者。
[0093]
更一般来说,本文公开的方法可以应用于衍生自任何患者的任何多能干细胞,或随后使用基因编辑修饰成产生突变体模型的hpsc,或使用基因编辑校正的突变体hpsc。基因编辑可以通过crispr、talen或zf核酸酶技术进行。
[0094]
从前文可以理解,本发明的优选广泛形式提供了一种包括以下顺序步骤的方法:(i)将hpsc与一种或多种促进hpsc分化为后原条细胞的试剂接触;(ii)使后原条细胞与一种或多种促进后原条细胞分化成中段中胚层细胞的试剂接触;和(iii)使中段中胚层细胞与fgf9和任选的以下中的一种或多种:bmp7;视黄酸;ra拮抗剂如agn193109;wnt激动剂如chir99021;fgf20;和肝素接触;从而从中段中胚层细胞产生后肾间充质细胞和输尿管上皮祖细胞。
[0095]
下文中将描述这些顺序步骤如下。(i)将hpsc分化为后原条
[0096]
从上述可以理解,将hpsc在不含血清的合适的培养基例如apel分化培养基(ng等人,2008,nat.protoc.3:768)中与bmp4、活化素a和/或chir99021接触,但不限于此,从而产生适当地包含后原条细胞的后原条细胞。hpsc可以是hesc或ipsc。
[0097]
适当地,bmp4的浓度为约5-40ng/ml,活化素a的浓度为约3-40ng/ml。在一个实施方案中,bmp4的浓度为约20-35ng/ml,或更优选约30ng/ml。在一个实施方案中,活化素a的浓度为约5-30ng/ml,或更优选为10ng/ml。适当地,最佳相对活性比在3:1至1:6的bmp4对活化素a的范围内。优选地,最佳相对活性比在3:1至1:1bmp4对活化素a的范围内。
[0098]
在一些实施方案中,诸如chir99021的wnt激动剂的浓度可以在约0.5至50μm的范围内,优选约4-30μm,更优选约5-20μm或有利地约8μm。在某些实施方案中,在不存在bmp4和活化素a的情况下,chir99021单独存在。
[0099]
干细胞群可以在含有bmp4、活化素a和/或wnt激动剂如chir99021的培养基中培养36-120小时。
[0100]
在一些非限制性实施方案中,细胞可以与bmp4、活化素a和/或chir99021接触比hesc所需的时间更长的时间。举例来说,诸如ipsc等细胞可以与bmp4、活化素a和/或chir99021接触多达96-120小时。
[0101]
培养基可以每24-48小时更换一次。
[0102]
虽然不希望受理论束缚,但如本文所公开的,使hpsc与bmp4、活化素a和/或wnt激动剂如chir99021接触导致包括后原条在内的原条(ps)的形成。这是产生中胚层和内胚层组织的初始步骤。通常,hpsc的分化是朝向包含表达后原条(即推定中胚层)特征性标志物的细胞和表达前原条(即推定内胚层)特征性标志物的细胞的混合细胞群。
[0103]
后原条(推定中胚层)特征性标志物的非限制性实例包括brachyury(t)。
[0104]
前原条(推定内胚层)特征性标志物的非限制性实例是sox17。(ii)将后原条细胞分化为中段中胚层(im)
[0105]
适当地,将后原条细胞或包含后原条细胞的混合原条群与至少包含fgf9和任选的fgf2和/或fgf20和/或视黄酸(ra)拮抗剂的一种或多种纤维细胞生长因子(fgf)在不存在血清的合适培养基如apel分化培养基中接触。
[0106]
通常,视黄酸信号传导拮抗剂是视黄酸受体(rar)抑制剂或拮抗剂,例如agn193109。
[0107]
合适地,fgf2、fgf9和/或fgf20的浓度为约100至400ng/ml。在优选的实施方案中,fgf2、fgf9和/或fgf20的浓度为约150至300ng/ml或有利地约200ng/ml。在一个实施方案中,ra拮抗剂(例如agn193109)的浓度为约0.1-10μm,更优选为0.5-5μm。
[0108]
将细胞与fgf9,单独或与fgf9同fgf2和/或fgf20和/或ra拮抗剂(例如agn193109)一起,接触至少约96小时但不超过约190-200小时。优选地,细胞与fgf9单独或与fgf9与fgf2和/或fgf20和/或ra拮抗剂(例如agn193109)接触约96小时。
[0109]
培养基可以每40-48小时更换一次。
[0110]
在一个实施方案中,使后原条细胞(其通常表达后原条(推定中胚层)和前原条(推定内胚层)的特征性标志物)与fgf9单独或与fgf9连同fgf2和/或fgf20一起接触导致细胞向表达中段中胚层(im)的特征性标志物的细胞群分化。中段中胚层的特征性标志物的非限制性实例包括pax2、lhx1和osr1。(iii)将中段中胚层(im)分化为肾单位祖细胞和输尿管上皮祖细胞
[0111]
适当地,将后原条细胞与fgf2、fgf9和/或fgf20接触后,将所得的im细胞在不含血清的合适培养基如apel分化培养基中与fgf9单独或与fgf9同bmp7、ra、ra拮抗剂、fgf20、wnt激动剂和/或肝素中的一种或多种的组合接触。
[0112]
适当地,fgf9浓度为约20ng至1μg/ml。在优选的实施方案中,fgf9的浓度为约50-500ng/ml,更优选为约100-300ng/ml或有利地为约200ng/ml。通常,以约0.1-10μg/ml,优选约0.3-5μg/ml,0.5-2μg/ml或有利地约1μg/ml的浓度包含肝素。
[0113]
在一个实施方案中,fgf20浓度为约20ng至1μg/ml。在优选的实施方案中,fgf 20的浓度为约50-500ng/ml,更优选为约100-300ng/ml或有利地为约200ng/ml。
[0114]
在一个实施方案中,fgf2浓度为约20ng至1μg/ml。在优选的实施方案中,fgf2的浓度为约50-500ng/ml,更优选为约100-300ng/ml或有利地为约200ng/ml。
[0115]
应当理解,fgf20和fgf2可以替代或补充fgf9,因为这些试剂具有相似的生物学活
性。
[0116]
在一个实施方案中,bmp7的浓度为约25至75ng/ml。在优选的实施方案中,bmp7的浓度为约35-60ng/ml、45-55ng/ml或有利地约50ng/ml。
[0117]
在一个实施方案中,ra为约10pm至1μm的浓度。在优选实施方案中,ra的浓度为约30pm至0.5μm,更优选约50pm至0.2μm或有利地约0.1μm。尽管对本发明没有约束力,但是初步数据表明,较高浓度的ra促进了输尿管上皮祖细胞比例的相对增加,而较低浓度的ra促进了输尿管上皮祖细胞比例的相对降低。
[0118]
在一个实施方案中,ra拮抗剂如agn193109的浓度为约50pm至10μm。在优选实施方案中,agn193109的浓度为约0.01μm至5μm,更优选约0.1μm至5μm或有利地约1μm。尽管对本发明没有约束力,但初步数据表明,较高浓度的agn193109促进了后肾间充质细胞比例的相对增加。
[0119]
在一个实施方案中,wnt激动剂如chir99021以约0.1μm至10μm,优选约0.2μm至5μm或更优选约1-2μm的浓度存在。
[0120]
虽然对本发明不具有约束力,但wnt激动剂促进了来自im细胞的肾单位祖细胞的产生的相对增加。优选地,细胞与fgf9单独或与fgf9同bmp7、ra、wnt激动剂、ra拮抗剂和/或fgf20和/或fgf2加肝素中的一种或多种一起接触至少72小时但不超过360小时。优选地,细胞接触约160-220小时,或更优选约190-200小时。
[0121]
培养基可以每48-72小时更换一次。
[0122]
通常,如本文所公开的,使中段中胚层细胞与fgf9单独或与fgf9同bmp7、ra、ra拮抗剂、wnt激动剂和/或fgf20和/或fgf2中的一种或多种并优选肝素一起接触,将中段中胚层细胞分化为后肾间充质和输尿管上皮细胞谱系的细胞。后肾间充质谱系包括在fgf9和肝素中培养约72小时后最佳产生的肾单位祖细胞。还提出可以选择ra类似物或激动剂和/或ra拮抗剂的存在、不存在和/或浓度来操纵由该方法产生的输尿管上皮与由该方法产生的后肾间充质相比的相对量。如前所述,ra以后肾间充质为代价促进输尿管上皮的形成,而ra拮抗剂如agn193109则以输尿管上皮为代价促进后肾间充质的形成。wnt激动剂如chir99021也可以以输尿管上皮为代价促进后肾间充质的生存和/或形成。
[0123]
后肾间充质谱系或其细胞的细胞特有的或代表其的标志物的非限制性实例包括wt1,six1,six2,sall1,gdnf和/或hoxd11,但不限于此。
[0124]
肾单位祖细胞特有的或代表其的标志物的非限制性实例包括wt1,six2,cited1,pax2,gdnf,sall1和hoxd11,但不限于此。
[0125]
输尿管上皮谱系的细胞特有的或代表其的标志物的非限制性实例包括hoxb7,gata3,calb1,e-cadherin,pax2和/或cret,但不限于此。
[0126]
基于wt1,six2,cited1,pax2,gdnf,sall1和hoxd11的共表达,在从hpsc细胞培养开始的该方法开始之后11-15天或有利地14天(第11至15天的范围),肾单位祖细胞可最大程度地产生。
[0127]
基于hoxb7,cret,e-cadherin和pax2的共表达,在从hpsc培养开始的该方法之后的至少10天后或有利地14天后,可以最大限度地产生输尿管上皮祖细胞。
[0128]
在该方法的优选形式中,fgf9存在于本文所述的两个步骤(ii)和(iii)的至少一部分或完全整个过程中。更优选地,wnt激动剂如chir99021存在于本文所述的步骤(i)的至
少一部分。
[0129]
其特别优选的方法包括以下顺序步骤:(a)将人多能干(hpcs)细胞与chir99021接触以促进hpsc细胞分化成后原条细胞;(b)将后原条细胞与fgf9(单独或与ra拮抗剂如agn193109一起)接触,以促进将后原条细胞分化成im细胞;和(c)使im细胞与fgf9和肝素(单独或与ra拮抗剂如agn193109一起)接触,从而从im细胞产生肾单位祖细胞和输尿管上皮祖细胞。
[0130]
根据该优选形式,可以在约18-20天的总培养期内促进从hes细胞的初始群体的肾分化。从hpsc快速生成类肾体
[0131]
本发明的相关方面提供产生定形中胚层细胞的方法,所述方法包括以下步骤:将hpsc与wnt激动剂接触更长时间(最佳3-5天)。适当地,该方面的方法产生包含定形中胚层细胞和im细胞的一种或多种的中胚层细胞群,所述im细胞可以包括喙部和尾部im。通常,用wnt激动剂培养的持续时间越长,尾部im出现越多,喙部im存留得越少。
[0132]
在一个实施方案中,该方法还包括使中胚层细胞与成纤维细胞生长因子9(fgf9)和/或成纤维细胞生长因子20(fgf20)和/或成纤维细胞生长因子2(fgf2)接触的后续步骤。适当地,该步骤有助于尾部和喙部im的分化。适当地,尾部和喙部im将依次分别分化为肾单位祖细胞和输尿管上皮细胞。如前所述,ra或类似物或激动剂的包含可增加输尿管上皮祖细胞的相对产生。
[0133]
在另一个实施方案中,在使中段中胚层(im)细胞与成纤维细胞生长因子9(fgf9)和/或成纤维细胞生长因子20(fgf20)和/或成纤维细胞生长因子2(fgf2)接触后,该方法还包括解离和再聚集细胞的后续步骤。这可以在空气-培养基界面处的浮动过滤器上进行培养。合适地,该步骤有助于形成含有肾单位、基质和血管系统的类肾体。
[0134]
在另一个实施方案中,在形成用于培养的聚集体(例如在浮动过滤器上)之后,该方法还包括随后加入wnt激动剂30-60分钟。适当地,该步骤有助于产生具有最大肾单位的聚集的类肾体。
[0135]
应当理解,该方法的优选目的是产生聚集的、分化的肾单位祖细胞和输尿管上皮祖细胞,它们形成类器官或其它至少部分有组织的肾结构。优选地,正常发育中的肾单位的所有区段的存在可以存在于包括收集管(表型为gata3
+
ecad
+
),早期远端小管(表型为gata3-ltl-ecad
+
),早期近端小管(表型为ltl
+
ecad-)和肾小球(表型wt1
+
)的类器官中,提示正常的胚胎器官发生。
[0136]
在一个实施方案中,可以如上所述在大约7天培养中形成用于培养为类器官的分化细胞的聚集体。
[0137]
wnt激动剂(例如chir99021)的优选浓度为约1-50mm,优选约1-20μm、5-15μm或有利地约8μm。优选地,与wnt激动剂接触的持续时间为约4天。
[0138]
适当地,fgf9浓度为约20ng至1μg/ml。在优选的实施方案中,fgf9浓度为约50-500ng/ml,更优选约100-300ng/ml或有利地约200ng/ml。优选地,随后与fgf9/fgf20/fgf2接触的持续时间包括肝素在内约3天。
[0139]
优选地,在fgf9/fgf20/fgf2加肝素中培养后再聚集后立即随后加入短脉冲的wnt激动剂如chir99021。wnt激动剂(例如chir99021)的优选浓度为约1-15μm,优选约2-10μm或有利地约5μm。短脉冲通常为0.5至2小时,例如约45分钟或1小时。
[0140]
可以通过维持或促进培养细胞之间的物理接触来辅助聚集的、至少部分有组织的结构如类肾体的形成。在这方面,在添加“短脉冲”的wnt激动剂(例如chir99021)之前,细胞的成团可有助于类器官形成。
[0141]
任选地,培养物可以进一步包括:视黄酸(ra)拮抗剂、ra或ra激动剂、骨形态发生蛋白7(bmp7)和/或肝素中的一种或多种。视黄酸(ra)拮抗剂、ra激动剂、骨形态发生蛋白7(bmp7);和/或肝素的各自的浓度和作用可如上所述。诱导血管形成
[0142]
适当地,类肾体或聚集体中至少部分血管化和/或血管祖细胞的存在通过促进或引导血管内皮或血管祖细胞从间充质细胞或组织发育的条件而促进。
[0143]
适当地,根据前述方面产生的分化细胞和/或类器官的聚集体可以在促进至少部分血管化、特别是肾小球结构的血管形成、或至少产生血管内皮或其它血管细胞或组织的祖细胞的条件下培养。在一些实施方案中,通过促进或引导血管内皮从间充质细胞或组织发育的条件来促进血管形成。
[0144]
在一个实施方案中,该方法可以包括与如上所述的im细胞一起共培养血管内皮祖细胞(例如从人多能干细胞分化的),或加入到至少部分分化的肾单位祖细胞和输尿管上皮祖细胞的培养物中,从而产生血管细胞或组织如血管内皮。
[0145]
在另一个实施方案中,该方法可以包括在培养期间降低的氧分压。通常,21%的o2是存在于标准组织培养培养箱中的常见氧分压。本发明考虑5至12%的o2,其可以更相当于发育中的胚胎中经受的氧分压。这可以提高后肾间充质产生vegfa的能力,从而诱导flk1
+
血管内皮祖细胞的形成和迁移。
[0146]
鉴于上述内容,所提及的蛋白质试剂如bmp4、bmp7、活化素a、fgf2、fgf9和fgf20应理解为包括任何哺乳动物(包括人、小鼠和大鼠)来源的天然或重组或化学合成蛋白质,但不限于此。此外,这些蛋白质可包括本领域公知的化学修饰,糖基化,脂化,诸如生物素的标记和附加的氨基酸序列如表位标签或融合伴侣。通常,上述蛋白质可以商业获得和/或通过常规实验室或制造方法制备为重组或化学合成蛋白质。
[0147]
另一方面,本发明提供根据本文公开的方法产生的分离或纯化的肾单位祖细胞、输尿管上皮祖细胞和/或类肾体。
[0148]
类肾体优选包括由内皮和肾间质包围的分段的肾单位。
[0149]
在特定的实施方案中,肾单位被分成四(4)个或更多个组成部分,包括收集管(表型为gata3
+
ecad
+
),早期远端小管(表型为gata3-ltl-ecad
+
),早期近端小管(表型为ltl
+
ecad-)和肾小球(表型为wt1
+
)。适当地,在类器官底部形成收集管树,连接到中部的远端和近端小管,在类器官顶部具有肾小球。
[0150]
应当理解,肾单位祖细胞和/或输尿管上皮祖细胞可以在如上所述的适当的培养时期之后获得,并且在一些任选的实施方案中可以根据表面标志物的共表达来进一步富集或纯化。细胞富集或纯化可以通过本领域已知的任何技术或方法,包括流式细胞术细胞分选(例如facs),通过磁性免疫珠(例如dynabeads
tm
)进行阳性或阴性细胞选择、淘选
(panning)、密度分离或补体介导的裂解等,但不限于此。肾再生和移植
[0151]
慢性肾病是一种严重的医学病症,每年影响3100万美国人和170万澳大利亚人。患者在出现症状前可能会损失其肾功能的90%,导致肾衰竭、透析或肾移植。2010年美国终末期肾病的医疗费用估计为280亿美元。
[0152]
因此,本发明的一个方面提供生产肾或者肾细胞或组织的方法,所述方法包括将肾或者肾细胞或组织从分离或纯化的肾单位和/或输尿管上皮祖细胞分化的步骤从而产生肾或者肾细胞或组织。此外,本发明的该方面在促进或引导血管内皮或血管祖细胞从间充质细胞或组织发育的条件下提供至少部分血管形成和/或产生血管祖细胞。
[0153]
本发明提供一种用于产生输尿管上皮和后肾间充质谱系或区室的细胞的方法。优选地,这些细胞被同时诱导并且在体内引导彼此的分化。这些细胞能够发育成不同的管状上皮结构,包括输尿管树和肾单位祖细胞间充质。因此,提出根据本发明制备的hpsc细胞衍生的输尿管上皮和/或肾单位祖细胞可以被引导从输尿管和后肾间充质区室分化成肾细胞。在适当的条件下,肾单位祖细胞可以能够分化成包括肾单位上皮细胞的任何肾单位节段(除收集管以外),如连接段、远端小管曲部(dct)细胞、远端小管直部(dst)细胞、近端小管直部(pst)段1和2、pst细胞、足细胞、肾小球内皮细胞、henle的上升环和/或henle的下降环,但不限于此。
[0154]
此外,这些细胞“自组织”的能力可以因此用来促进肾脏修复,例如通过肾组织或器官生物工程。
[0155]
应当理解,该方面的方法的一个实施方案可以包括将分离或纯化的肾单位和/或输尿管上皮祖细胞过继转移或移植到人中,从而产生肾或者肾细胞或组织。
[0156]
根据该实施方案,分离或纯化的肾单位和/或输尿管上皮祖细胞向肾或者肾细胞或组织的分化在体内发生。
[0157]
该方面的方法的另一个实施方案可以包括至少部分地将分离或纯化的肾单位和/或输尿管上皮祖细胞体外分化为肾、或者肾细胞或组织、或者这些的祖细胞。适当地,将至少部分体外分化的细胞肾、或者肾细胞或组织、或者这些的祖细胞过继转移或移植到人中。
[0158]
根据任一个或两个实施方案,肾、肾细胞或组织可以促进或有助于肾、其细胞或组织的再生或修复。
[0159]
一个实施方案提供类器官、由其获得的分离的肾单位祖细胞和/或输尿管上皮祖细胞产生工程化或人造肾的用途。例如,分离的肾单位祖细胞和/或输尿管上皮祖细胞可以并入支架内,例如脱细胞的人肾或其细胞外基质(ecm)组分,聚酯绒毛或可生物降解的聚合物支架,从而产生再生的肾小管结构。举例来说,这样的方法可以包括以下一个或多个:(a)从类器官中分离一种或多种分化的细胞类型和/或中间祖细胞类型;和(b)将一种或多种分化的细胞类型和/或中间祖细胞类型递送到脱细胞的肾支架中。在一些实施方案中,来自肾支架的ecm可以用作基质(例如从单独的ecm或与水凝胶结合的ecm产生),其中将一种或多种分化的细胞类型和/或中间祖细胞类型接种或生物打印从而使肾支架或基质再细胞化。
[0160]
另一实施方案可涉及修复受损或患病的肾脏。举例来说,该方法可以包括以下中的一种或多种:(i)从类器官中分离一种或多种分化的细胞类型和/或中间祖细胞类型;(ii)将一种或多种分化的细胞类型和/或中间祖细胞类型递送到受损或患病的肾脏中,从
而促进患病或受损肾的修复和/或再生。通过实质注射或通过血管途径直接递送至受损或患病的肾脏中。
[0161]
本发明的另一个实施方案提供在用于辅助或促进肾透析的装置中从分离的肾单位祖细胞和/或输尿管上皮祖细胞分化的肾细胞或组织的用途。例如,生物人造肾可以通过将肾细胞或其祖细胞接种到反应器中以产生与透析并行使用的“肾脏辅助装置”来制备。
[0162]
还考虑使用由本文所述的分离的肾单位祖细胞和/或输尿管上皮祖细胞分化或以其他方式获得的肾细胞或组织的“生物打印”肾或其他含有肾单位的器官、类器官或器官样结构。
[0163]
因此,本发明的一个特定方面提供一种生物打印肾结构的方法,所述方法包括沉积本文公开的多个hpsc或其它祖细胞以形成肾结构,其具有肾或其组分的一种或多种功能特征,或者其能够显现肾或其组分的一种或多种功能特征。
[0164]
适当地,使hpsc或其它祖细胞经受本文公开的用于在三维结构中产生肾单位祖细胞和输尿管上皮祖细胞的方法。
[0165]
该特定方面还提供一种生物打印的肾结构,其具有肾或其组分的一种或多种功能特征,或能够显现肾或其组分的一种或多种功能特征,由上述方法制备。
[0166]
本发明的另一个特定方面提供一种生物打印肾结构的方法,所述方法包括沉积本文公开的多个肾单位祖细胞和输尿管上皮祖细胞以形成肾结构,所述肾结构具有肾或其组分的一种或多种功能特征,或者其能够显现肾或其组分的一种或多种功能特征。
[0167]
适当地,肾单位祖细胞和输尿管上皮祖细胞已通过本文公开的方法由hpsc产生。在一些实施方案中,该方法产生具有或能够显现至少部分血管形成和/或血管祖细胞的生物打印的肾结构。
[0168]
该特定方面还提供一种生物打印的肾结构,其具有肾或其组分的一种或多种功能特征,或能够显现肾或其成分的一种或多种功能特征,由上述方法制备。在一些实施方案中,具有或能够显现至少部分血管形成和/或血管祖细胞的生物打印的肾结构。
[0169]
适当地,生物打印的肾结构是三维肾结构。
[0170]
还将理解,如下文将更详细地描述的,三维结构可以由多个生物打印“层”或“阵列”构造或形成。
[0171]
生物打印的肾结构组分可以是或包含肾的任何结构和/或功能组分,例如肾小球、近肾小球器、间质组织、收集管、鲍曼氏囊、近端和/或远端小管曲部、血管系统如小动脉、动脉、静脉和/或毛细血管,但不限于此。
[0172]
适当地,生物打印的肾结构至少部分血管化和/或包含血管祖细胞。
[0173]
在一些实施方案中,生物打印的肾或肾组分可以是可植入的或以其他方式过继转移到宿主中。
[0174]
如本文所使用的,“生物打印”包括并涵盖利用通过与自动化或半自动化的计算机辅助三维原型设备(例如生物打印机)兼容的方法三维、精确的细胞沉积(例如,细胞溶液、含细胞的凝胶、细胞悬浮液、细胞浓缩物、多细胞聚集体、类器官,多细胞体等)。在这方面,参考美国专利申请us20120116568,us20130164339和us20140012407,其通过引用并入本文,并提供潜在合适的生物打印技术的非限制性实例。
[0175]
举例来说,在一些实施方案中,工程化的、可植入的类肾体组织和/或器官的至少
一种组分可以生物打印。在另外的实施方案中,工程化的、可植入的组织和/或器官完全生物打印。还在另外的实施方案中,使用利用基于三维、自动化、计算机辅助的沉积如本文所公开的肾细胞(包括细胞溶液、细胞悬浮液、含细胞的凝胶或糊状物、细胞浓缩物,多细胞体(例如,圆柱体,球体,带状物等))以及将材料通过三维递送装置(如生物打印机)限制在生物相容性表面(例如,由水凝胶和/或多孔膜组成)上的快速原型技术的方法制备生物打印构建体。如本文所用,在一些实施方案中,术语“工程化”是指肾组织和/或器官,意味着细胞、细胞溶液、细胞悬浮液、含细胞的凝胶或糊状物、细胞浓缩物、多细胞聚集体和其层根据计算机脚本通过计算机辅助装置(例如,生物打印机)定位形成三维结构。在另外的实施方案中,计算机脚本例如是一个或多个计算机程序、计算机应用或计算机模块。还在另外的实施方案中,三维组织结构通过类似于早期形态发生中的自组装现象的细胞或多细胞体的打印后融合来形成。
[0176]
尽管许多方法可用于在生物相容性表面上排列细胞、多细胞聚集体和/或其层以产生三维结构,然而包括手动放置、通过自动化的计算机辅助机器(例如生物打浆机)定位是有利的。使用该技术递送细胞或多细胞体的优点包括细胞或多细胞体的快速、准确和可再现的放置,以产生展现具有各种组成的细胞、多细胞聚集体和/或其层的计划的或预定的取向或模式的构建体。优点还包括确保高细胞密度,同时最大限度地减少细胞损伤。在一些实施方案中,生物打印的方法是连续的和/或基本连续的。连续生物打印方法的非限制性实例是经由连接到生物墨储存器的分配尖端(例如,注射器、毛细管等)从生物打印机分配生物墨。在进一步的非限制性实施方案中,连续生物打印方法是以功能单元的重复模式分配生物墨。在各种实施方案中,重复功能单元具有任何合适的几何形状,包括例如圆形,正方形,矩形,三角形,多边形和不规则几何形状。在另外的实施方案中,生物打印功能单元的重复模式包括层或阵列,并且多个层或阵列相邻地生物打印(例如,堆叠)以形成工程化组织或器官。在各种实施方案中,2、3、4、5、6、7、8、9、10、11、12、13、14、15或更多层或阵列相邻生物打印(例如,堆叠)以形成工程化的肾组织或器官。
[0177]
在一些实施方案中,生物打印的功能单元以棋盘格模式重复。“棋盘格模式”是图表平面,该平面无重叠也无间隙。连续和/或棋盘格生物打印的优点包括(通过非限制性实例)提高生物打印组织的生产率。另一个非限制性的示例性优点是消除了将生物打印机与先前沉积的生物墨元件对准的需要。连续的生物打印还可以方便地从大的生物墨储存器中打印更大的组织,任选地使用注射器机构。
[0178]
在各种实施方案中,用于连续生物打印的方法包括独立地或相对于彼此优化和/或平衡诸如打印高度、泵速度、机器人速度或其组合等参数。在一个实例中,用于沉积的生物打印机头速度为3mm/s,第一层的分配高度为0.5mm,并且每个后续层的分配高度增加0.4mm。在一些实施方案中,分配高度近似等于生物打印机分配尖端的直径。无限定的,适当的和/或最佳的分配距离不会导致材料压扁或粘附到分配针上。在各种实施方案中,生物打印机分配尖端具有大约20、50、100、150、200、250、300、350、400、450、500、650、600、650、700、750、800、850、900、950、1000μm或以上的内径,包括其中的增量。在各种实施方案中,生物打印机的生物墨储存器具有约0.5、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100cm3或以上的体积,包括其中的增量。在一些实施方案中,当系统中的残余压力积聚低时,泵速度是合适的和/或最佳的。在一些实施方案中,有利
的泵速度取决于储存器和分配针的截面积之间的比,其中比率越大需要的泵速度越低。在一些实施方案中,合适的和/或最佳的打印速度使得能够沉积均匀的线而不影响材料的机械完整性。
[0179]
仅举例而言,organovo与invetech合作开发了一种器官打印机,其使用水凝胶支架以所需的取向放置人类细胞来重建人体器官。从本文所述的分离的肾单位祖细胞和/或输尿管上皮祖细胞分化的或以其他方式获得的肾细胞或组织可以与诸如上述organovo机一起使用以开发“生物打印”的人类肾体或肾脏。
[0180]
本发明的另一方面提供具有平面几何形状的肾单位祖细胞和输尿管祖细胞阵列。
[0181]
阵列可以包括多个堆叠阵列,优选2、3、4、5、6、7、8、9、10、11、12、13、14或15个或更多个堆叠阵列。
[0182]
阵列可以以棋盘格模式堆叠。
[0183]
本发明的有关方面提供通过使前述方面的阵列成熟获得的类肾体。
[0184]
适当地,类肾体至少部分血管化和/或包含血管祖细胞。
[0185]
还将理解,本文所述的分离的肾单位祖细胞和/或输尿管上皮祖细胞、类器官和生物打印的肾结构的定向分化可以是用于细胞疗法的纯化的、分化的肾细胞亚型、类器官和/或生物打印的肾结构的潜在来源。
[0186]
例如,本文所述的分离的肾单位祖细胞和/或输尿管上皮祖细胞可用于在某些基因遗传的肾脏病症中在基因校正后产生肾细胞或组织。例如,可以通过在基因校正后从本文所述的分离的肾单位祖细胞和/或输尿管上皮祖细胞再生肾组织来辅助或促进包括alport综合征(col4a3突变)和多囊肾病(pkd1,pkd2等)等单基因肾病的修复。
[0187]
在特定的实施方案中,衍生自、得自或源自患有遗传性肾病的患者的ipsc系可用于体外修复基因突变。可以根据本发明的方法使用这样的细胞,然后将其给予患者用于自体细胞疗法。肾毒性筛查
[0188]
还将理解,本文所述的分离的肾单位祖细胞和/或输尿管上皮祖细胞的定向分化可以提供纯化的分化肾细胞、生物打印的肾结构、类肾体、阵列或肾组织亚型的潜在来源用于肾毒性筛查。
[0189]
由于缺乏用于体外药物试验的原代人肾细胞的可用性,制定旨在预防疾病(包括药物和基于细胞的疗法)的干预的开发变得困难。
[0190]
因此,本发明的另一方面提供确定一种或多种化合物的肾毒性的方法,所述方法包括使一种或多种化合物与本文所述的肾单位祖细胞和/或输尿管上皮祖细胞(作为类器官或在分离和纯化后、或由其分化的或以其它方式由其获得的肾细胞或组织)接触的步骤,从而确定一种或多种化合物是否为肾毒性。
[0191]
优选地,该方法使用类器官或由分离或纯化的肾单位祖细胞、或衍生自肾单位祖细胞的肾细胞或组织进行。
[0192]
许多有用的药物具有肾毒性副作用,例如通过直接肾小管效应(例如氨基糖苷类抗生素、顺铂、放射性对照培养基、nsaids、ace抑制剂),间质性肾炎(例如β内酰胺抗生素、锂、csa、抗癫痫药如苯妥英)或肾小球性肾炎。因此,使用由本文所述的分离或纯化的肾单位祖细胞分化或以其他方式获得的确定的、特定的肾细胞和组织类型来试验新的或现有的
药物是有利的。上述“生物打印”的肾或生物打印的类肾体也可应用于肾毒性筛查。
[0193]
肾毒性可以通过针对体外肾细胞功能的任何适合的试验来评估或测量,包括降低的肌酐清除率或生物标志物表达,例如通过来自qiagen的human nephrotoxicity rt
2 profiler
tm
pcr array或来自eurofins的high content analysis(hca)multiplexed nephrotoxicity assay,但不限于此。
[0194]
如实施例中更详细描述的,顺铂是诱导肾脏中近端肾小管细胞的半胱天冬酶介导的急性凋亡的肾毒性物质。类肾体的顺铂治疗诱导成熟近端肾小管细胞的特异性急性凋亡,而未成熟细胞不发生凋亡。
[0195]
为了使本发明可以容易地理解并付诸实践,参考以下非限制性实施例。实施例
[0196]
导致本发明的研究确定了特定的体外培养条件,将其定制为促进来自中段中胚层(im)的肾单位祖细胞和输尿管上皮祖细胞的同步、同时分化。更具体地,fgf9加肝素单独、或与包括骨形态发生蛋白7(bmp7)、视黄酸(ra)、ra拮抗剂;wnt激动剂和/或fgf20加肝素的一种或多种试剂组合,能够促进中段中胚层分化为肾单位祖细胞和输尿管上皮祖细胞。此外,体外培养方法提供了通过后原条、im和后肾间充质阶段分化hpsc以产生肾单位祖细胞和输尿管上皮祖细胞的系统。可以操纵某些分子如ra、ra拮抗剂和/或wnt激动剂的存在或不存在以优先促进肾单位祖细胞与输尿管上皮祖细胞的产生,反之亦然。后部ps是用于中胚层如im的祖细胞群,并且使用wnt激动剂(例如chir99021)从hpsc诱导。im分化为两个关键的肾脏祖细胞群:输尿管上皮(ue),收集管的祖先;后肾间充质(mm),肾单位的祖先。当前部im产生ue时,后部im发育成mm。在这里,我们提出了一种通过使用chir99021仔细确定的时间段同时诱导前部和后部im的方法。这种同时诱导导致成功生成含有所有预期的肾脏成分(包括肾单位、间质和内皮)的类肾体。我们还提出了添加ra信号传导抑制剂,例如合成有效的泛视黄酸受体(rar)拮抗剂agn 193109,将促进后肾间充质的形成。实施例1材料和方法
[0197]
这些方法中提到的试剂的来源的非限制性实例在表1中提供。
[0198]
培养基如下:
·
明胶溶液:pbs中的0.1%明胶。然后将溶液高压蒸汽处理。
·
fdmem:89%dmem高葡萄糖,10%胎牛血清,1%glutamax补充剂,0.5%青霉素/链霉素。
·
ksr培养基:77.8%dmem/f-12、20%knockout血清替代品,1%neaa,1%glutamax,0.5%青霉素/链霉素,0.2%2-巯基乙醇(55mm)。然后用stericup-gp过滤培养基。
·
mef条件ksr培养基:在t175烧瓶中将40ml ksr培养基加至1000万个小鼠胚胎成纤维细胞一天。第二天收集培养基,再加入40ml的ksr培养基。重复6次后,收集和合并的培养基通过stericup-gp过滤。
·
apel:用0.5ml抗生素-抗真菌剂补充一瓶stemdiff apel(100ml)。
[0199]
对于其他试剂、方法、pcr引物等,还参见国际公开wo2014/197934和takasato,m.等人,2014,.nat.cell biol.16,118
–
26,这些文献整体通过引用并入本文。
接种饲养层(倒数第8天)
[0200]
在25cm2的组织培养瓶中涂3ml 0.1%明胶溶液。
[0201]
将冷冻的有丝分裂失活的小鼠胚胎成纤维细胞(mef)的小瓶通过在37℃下加热小瓶来解冻,直至留下小冰丸。将温热的5ml fdmem培养基以逐滴方式加入到小瓶中并轻轻混合。收集到15ml管中,并以1500rpm离心3分钟。
[0202]
去除上清液并将mef重悬在fdmem中。在fdmem中以12,000个细胞/cm2接种在烧瓶中,并在37℃的co2培养箱中孵育过夜。解冻hesc/ipsc(倒数第7天)
[0203]
将冷冻的ipsc/hesc的小瓶通过在37℃下加热小瓶将其解冻至所准备的含有有丝分裂失活的mef的25cm2组织培养瓶中,直至留下小冰丸。将温热的5ml ksr培养基(见附录a)逐滴加入小瓶中并轻轻混合。收集到15ml管中,并以1,500rpm离心3分钟。
[0204]
每25cm2组织培养瓶中准备5ml ksr培养基。向ksr培养基中加入10ng/ml bfgf。
[0205]
除去上清液并将ipsc/hesc在含有10ng/ml bfgf的ksr培养基中重悬。接种入烧瓶中并在37℃的co2培养箱中孵育3天。
[0206]
每日吸出消耗的ksr培养基,并补充5ml含有10ng/ml bfgf的新鲜ksr培养基。hesc/ipsc的解离和matrigel适应(倒数第3天)matrigel涂层:
[0207]
将3ml冷dmem/f12基础培养基等分至15ml管中。
[0208]
将25ul的hesc合格matrigel加入dmem/f12。混合均匀并转移到25cm2的组织培养瓶中。(*加热时将matrigel以固化形式在冰上处理。)
[0209]
将烧瓶保持在室温至少30分钟,以使matrigel涂布在表面上。
[0210]
准备5ml mef条件ksr培养基(见附录b),并向培养基中加入10ng/ml bfgf。解离细胞:
[0211]
(*为获得最佳效果,细胞应约80-90%汇合。如果细胞不汇合,允许另外一天进行孵育或进行较低的分裂比率。)
[0212]
用3ml pbs洗涤汇合的25cm2烧瓶两次。
[0213]
加入2ml tryple select至细胞,并在37℃孵育3分钟。
[0214]
移取5ml dmem/f12基础培养基至细胞,混合并确保细胞已从塑料表面脱落。
[0215]
在15ml管中以1:3分裂比率收集细胞悬浮液,并以1,500rpm离心3分钟。接种细胞到matrigel涂布的烧瓶上:
[0216]
去除上清液,并将制备的5ml条件ksr培养基加入细胞。轻轻混合。
[0217]
从制备的组织培养瓶中吸出含有matrigel的dmem/f12并接种细胞。
[0218]
在37℃的co2培养箱中孵育过夜两天。
[0219]
每日吸出消耗的条件ksr培养基,并补充5ml含有10ng/ml bfgf的新鲜条件ksr培养基。接种细胞用于分化(倒数第1天)
[0220]
用3ml pbs洗涤25cm2烧瓶两次。
[0221]
加入2ml tryple select至细胞,并在37℃孵育3分钟。
[0222]
移取5ml dmem/f12基础培养基至细胞,混合并确保细胞已从塑料表面脱落。
[0223]
将细胞悬浮液收集到15ml管中。计数。
[0224]
计算所需细胞数以达到每孔4000个细胞(12,500个细胞/cm2)。
[0225]
将所需细胞数量等分至15ml管中。以1,500rpm离心3分钟。
[0226]
将细胞重悬在含有10ng/ml bfgf的条件ksr中,每孔50ul。将细胞接种到96孔玻璃底板中,并在37℃孵育过夜。分化阶段一(第0天)
[0227]
对于新开的apel瓶,以1/100加入抗生素-抗真菌剂(100x)。
[0228]
在apel中准备8μm的chir。
[0229]
从96孔板吸出条件ksr。
[0230]
将100微升含有8μmchir的apel加入细胞。
[0231]
在37℃孵育4天,每2天更新一次培养基。分化阶段二(第4天)
[0232]
在apel中准备200ng/ml fgf9+1μg/ml肝素。
[0233]
从96孔板中吸取消耗的含有chir的apel。
[0234]
将含有200ng/ml fgf9+1μg/ml肝素的100μl apel加入细胞。
[0235]
在37℃下孵育2天,并在第6天用含有200ng/ml fgf9+1μg/ml肝素的新鲜apel更新培养基。3d类器官培养(第7天)
[0236]
在96孔板中获得不同条件的培养的c32 ips细胞。
[0237]
吸取培养基并用无菌pbs快速洗涤。
[0238]
吸取pbs。
[0239]
向每个孔中加入50μl胰蛋白酶edta(0.25%)。
[0240]
放置在37℃的培养箱中长达3分钟,使细胞从表面剥离。
[0241]
在显微镜下观察,以确保所有细胞都从玻璃(96孔)表面脱落。如果细胞仍附着在表面,则用胰蛋白酶轻轻抽吸细胞并放回培养箱中另外2分钟。
[0242]
用100μl dmem+10%fbs+1%p/s中和胰蛋白酶。
[0243]
将整个培养物等分至15ml falcon管中。
[0244]
以1500rpm的速度离心细胞5分钟。
[0245]
吸出培养基,直到仅剩下细胞沉淀物。
[0246]
用3ml chir重悬细胞。
[0247]
取出10μl的细胞悬液,用血细胞计数器进行细胞计数。
[0248]
每个3d类器官小球(pellet organoid)将具有大约5
×
105个细胞,将所需量的细胞悬液等分至15ml falcon管中。
[0249]
以2000rpm离心所述管2分钟。
[0250]
将1.2ml apel+5ml chir等分至6孔transwell聚酯膜细胞培养板中。
[0251]
使用p1000移液管,缓慢地将沉淀物从含apel的溶液中移出。
[0252]
通过使用p1000宽孔移液器枪头来取沉淀物。
[0253]
小心地将沉淀物置于transwell过滤器上,同时带有最少的培养基。
[0254]
置于细胞培养箱中1小时。
[0255]
将1.2ml apel+200ng/ml fgf9+1μg/ml肝素等分至corning costar 6孔板。
[0256]
将在apel+5μmchir中培养1小时的过滤器移至apel+200ng/ml fgf9+1μg/ml肝素板并培养5天。(培养基每两天更换一次)
[0257]
5天后,取出过滤器,并放入新鲜制备的具有1.2ml新鲜的apel的corning costar 6孔板中。
[0258]
在仅含apel的培养基中将类器官再培养6天。(培养基每两天更换一次)3d类器官免疫荧光(第18天)
[0259]
在类器官培养6天后,用1%多聚甲醛在4℃下将沉淀物固定20分钟。
[0260]
取出多聚甲醛并用pbs洗涤三次。
[0261]
一旦固定和洗涤,类器官可以在免疫荧光染色前在4℃下储存长达一周。
[0262]
将约150ul的封闭缓冲液(10%驴血清/0.3%triton-x/pbs)等分到mattek玻璃底培养皿中。
[0263]
小心地将类器官切出过滤器,并将过滤器浸没在封闭缓冲液中。
[0264]
封闭类器官2-3小时。
[0265]
在封闭缓冲液中准备选择的一抗。
[0266]
列出的大多数抗体的稀释度为1:300。
[0267]
将封闭缓冲液从mattek培养皿中吸出,并将150μl的封闭缓冲液+一抗等分至mattek培养皿中。
[0268]
在4℃将类器官与一抗孵育过夜。
[0269]
将一抗从培养皿中吸出并用pbtx洗涤6次,每次10分钟。
[0270]
在pbtx(0.1%triton-x/pbs)中准备选择的二抗(1:400diln)。
[0271]
将类器官在二抗中孵育4小时。
[0272]
去除二抗,并用pbs中的dapi(1:1000稀释)孵育1小时。
[0273]
用pbs洗3次,每次10分钟。
[0274]
准备成像。结果
[0275]
如图1所示,为了选择收集管(ecad
+
,gata3
+
,pax2
+
),较少天(2-3)的初始wnt激动剂和/或随后用fgf9培养并激活视黄酸信号传导是最佳的。为选择形成肾单位的后肾间充质(wt1
+
hoxd11
+
ecad-)并产生表达早期肾单位标志物的上皮结构),更多天(3-5)的初始wnt激动剂和/或随后用fgf9培养并抑制视黄酸信号传导是最佳的。
[0276]
我们现在已有证据表明通过使用本文公开的方法经由人多能干细胞的聚集形成的类器官显示了指示正常肾器官发生的以下特征。如图2所示,meis1
+
基质群的存在显示存在于形成肾单位之间。已知这种群体是由后肾间充质产生的,存在于胚胎肾的发育中的肾单位之间,并且已被证明有助于最终器官的血管周围的形成。在图3中存在cd31
+
血管祖细胞。我们看到了内皮的证据,如通过cd31评估的,然而cd31是成熟内皮的标志物,我们还没有看到显示积极入侵肾小球以形成功能性过滤单位的早期内皮祖细胞。图4和图5显示正常发育中的肾单位的所有区段的存在,包括收集管(gata3
+
pax2
+
ecad
+
),远端小管(ecad
+
gata3-ltl-),近端小管(ltl
+
aqp1
+
)和肾小球(wt1
+
nphs1
+
synpo
+
),其相互连接,提示正常的胚胎器官发生。
[0277]
许多参数的变化提高了由人多能干细胞形成的类器官内存在的总体大小、复杂性、成熟度和肾单位数。
[0278]
这些包括在诱导7天后形成用于培养为类器官的分化细胞的聚集体。最初,这些被证明能够在14或18天的现有培养后形成。我们现在可以在7天后可靠地获得类器官形成,这7天包括在8μmchir中培养4天,然后在具有或不具有agn(视黄酸抑制剂)、bmp7、低chir或ra的fgf9中培养3天,其浓度范围如前所述。如图6所示,通过在再聚集后立即加入高chir(5μm)的45分钟脉冲,随后在具有或不具有agn(视黄酸抑制剂)、bmp7、低chir或ra的fgf9中培养,浓度范围如前所述,可增强聚集体的形成。
[0279]
血管化肾小球的形成对肾功能至关重要。这种肾小球血管系统甚至可以在体外形成的证据将显著提高类器官作为肾脏模型的可信度。
[0280]
一种方法将分化为肾的人多能干细胞与分化为血管内皮祖细胞的人多能干细胞结合使用,例如orlova
31
的方案。
[0281]
另一种方法是将分化过程中的氧分压从21%o2(标准组织培养箱中常见的氧分压)减少至5至12%的o2(更相当于发育中的胚胎中经受的氧分压)。我们预计这可以很好地改善后肾间充质产生vegfa并诱导flk1+内皮祖细胞的形成和迁移的能力。实施例2细胞培养和分化
[0282]
所有呈现的实验都使用了以前描述的野生型人ipsc系crl1502(克隆#c32),其使用附加型重编程
28
产生。用人es细胞(hes)培养基将未分化的人ipsc保持在作为饲养层的小鼠胚胎成纤维细胞(mef)(millipore)上,如前所述1。对细胞进行鉴定并检测支原体感染
28
。将人ipsc铺在matrigel涂布的(millipore)培养皿上并在mef条件hes培养基(mef-cm)中培养直到达到60-100%汇合。然后,将细胞再次以5000细胞/cm2铺在matreigel涂覆的培养皿上并在mef-cm中培养。第二天,细胞达到40-50%的汇合,细胞在补充有抗生素-抗真菌剂(life technologies)的apel基础培养基(stemcell technologies)中用8μmchir99021处理2-5天,然后用fgf9(200ng ml-1)和肝素(1μg ml-1
)再处理5-2天,每隔一天更换培养基。在第7天,使用胰蛋白酶或tryple select(life technologies)收集细胞并将其解离成单个细胞。将细胞(0.5
×
106)以
×
400g离心2分钟以形成沉淀物,然后转移到transwell 0.4μm孔聚酯膜(#cls3450 corning)上。用5μm chir99021在apel中处理沉淀物1小时,然后用fgf9(200ng ml-1
)和肝素(1μg ml-1
)培养5天,然后在apel基础培养基中再培养6-13天,每周更换3次培养基。培养基不应超过膜之上。对于单层培养物中的分化,chir99021诱导后的细胞用fgf9(200ng ml-1
)和肝素(1μg ml-1
)处理10天,然后用apel基础培养基再处理6天。在一些实验中,将ra(0.1μm)或agn193109(5μm)加入到fgf9培养基中。在实施例1中提供了描述类肾体生成的逐步方案。免疫组化
[0283]
对于单层细胞,如前所述进行抗体染色1。对于类肾体,将类器官用pbs中的2%多聚甲醛在4℃下固定20分钟,然后用pbs洗涤3次。然后用10%驴血清,0.3%triton x/pbs在室温下封闭类器官2-3小时,并在4℃下与一抗孵育过夜。用0.1%triton x/pbs洗涤5次后,将二抗在室温下孵育4小时。使用以下抗体和稀释度:兔抗pax2(1:300,#71-6,000,zymed laboratories),山羊抗-six1(1:300,#sc-9709,santa cruz biotechnology),兔抗six2
(1:300,#11562-1-ap,proteintech),小鼠抗ecad(1:300,#610181,bd biosciences),兔抗wt1(1:100,#sc-192,santa cruz biotechnology),小鼠抗hoxd11(1:300,#sab1403944,sigma-aldrich),山羊抗gata3(1:300,af2605,r&d systems),兔抗jag1(1:300,#ab7771,abcam),山羊抗cubilin(1:150,#sc-20607,santa cruz biotechnology),绵羊抗nphs1(1:300,af4269,r&d systems),ltl-生物素缀合物(1:300,b-1325,vector laboratories),dba-生物素缀合物(1:300,b-1035,vector laboratories),小鼠抗krt8(1:300,#troma,dshb),小鼠抗cd31(1:300,#555444,bd pharmingen),兔抗kdr(1:300,#2479,cell signaling technology),山羊抗sox17(1:300,#af1924,r&d systems),兔抗ng2(1:300,#ab5320,merck millipore),兔抗sma(1:300,#ab15267,abcam),小鼠抗-pdgfra(1:200,#556001,bd pharmingen),兔抗层粘蛋白(1:300,#l9393,sigma-aldrich),兔抗umod(1:300,#bt-590,biomedical technologies),小鼠抗meis1(1:300,#atm39795,activemotif),山羊抗foxd1(1:200,#sc-47585,santa cruz biotechnology)和兔抗切割的casp3(1:300,#9661,cell signaling technology)。使用nikon ti-u显微镜或zeiss lsm 780共焦显微镜拍摄图像。所有免疫荧光分析成功重复超过三次,并显示代表性的图像。电子显微镜
[0284]
使用以下方法对类器官进行处理以用于电子显微镜分析。将5%戊二醛在2
×
pbs中的溶液直接加入到与生长培养基相等体积的类器官培养皿中并置于真空下5分钟。通过切成小块(~2
×
2mm)将类器官尺寸减小,并在80w功率的pelco biowave(ted pella in,redding,ca)中再次在真空下在2.5%新鲜固定剂中照射6分钟。然后将样品在0.1m二甲胂酸盐缓冲液中洗涤4
×
2分钟。然后将样品在室温下浸入含有铁氰化钾(3%)和四氧化锇(2%)在0.1m二甲胂酸盐缓冲液中的溶液中30分钟。在蒸馏水中洗涤6
×
3分钟后,将组织块在含有硫代对称二氨基脲(1%)的过滤溶液中在室温下孵育30分钟。随后在蒸馏水中洗涤(6
×
2分钟)后,将样品在四氧化锇水溶液(2%)中孵育30分钟,然后在蒸馏水(6
×
2分钟)中,并在1%的乙酸铀酰水溶液中在4℃孵育30分钟。在进一步蒸馏水洗涤(2
×
2分钟)后,将新鲜制备的温热至60℃的天冬氨酸(ph 5.5)中的0.06%硝酸铅过滤溶液加入到培养皿中,并在60℃下进一步孵育20分钟,然后室温下在蒸馏水中冲洗(6
×
3分钟)。在pelco biowave中,将组织块在30%、50%、70%、90%和无水乙醇的各乙醇溶液中在250瓦特下脱水两次40秒。epon lx112树脂用于在pelco biowave中的25%、50%和75%树脂:无水乙醇浸渍下在250瓦特真空下埋入组织3分钟,并用100%树脂(2次)完成,然后在60℃下最终埋入/封闭和固化12小时。qrt-pcr分析
[0285]
使用purelink rna迷你试剂盒(life technologies)从细胞中提取总rna,并使用super script iii逆转录酶(life technologies)从》100ng总rna合成cdna。通过roche lightcycler 96实时pcr机用gotaq qpcr master mix(promega)进行qrt-pcr分析。所有绝对数据首先相对于gapdh归一化,然后相对于对照样品归一化(δ-δ-ct法)。用于qrt-pcr的引物序列如表2所示。使用keygenes的下一代rna测序和比较分析
[0286]
使用illumina nextseq500(nextseq控制软件v1.2/real time analysis v2.1)
平台进行测序。文库池(library pool)根据标准nextseq500方案进行稀释和变性,并使用75个循环的nextseq500高产量试剂盒(目录号fc-404-1005)进行测序以产生单末端76bp的读段(read)。使用star
29
将读段与参考人类基因组(hg19)进行比对,并使用htseq python包中的htseq-count生成ucsc注释中的每个基因的读段计数((http://www-huber.embl.de/users/anders/htseq/doc/index.html)。唯一映射读段的数量范围为每个样本18810634-36706805。使用deseq2包
30
计算归一化的读段数。
[0287]
keygenes已经用于将d0、d3、d11、d18类肾体的特性分值(identity score)生成不同的第一妊娠期人体器官,包括肾脏(gse66302)
15
。显示了来自第一和第二妊娠期(gse66302)的d0、d3、d11、d18类肾体细胞和21个人胎儿器官的分级聚类的树形图(图13)是基于由keygenes(www.keygenes.nl;表3)确定的85个分类基因的表达水平的pearson相关分析。通过keygenes使用人胎儿数据的前500个最差异表达的基因计算分类基因,而不包括来自该数据集的胚胎外组织。近端小管的功能分析
[0288]
对于葡聚糖摄取测定,将第17天的类器官用10μg ml-1
的10,000mw的葡聚糖alexa488缀合物(d-22910,life technologies)培养24小时。将类器官固定并用ltl染色,不透化。对于肾毒性测定,将第17天的类器官用0、5、20或100μm顺铂(sigma-aldrich)培养24小时。在每个实验2或3个代表性区域中,使用imagej手动计数凋亡近端小管与总近端小管的比例。总计n=5次独立实验。使用zeiss lsm 780共焦显微镜拍摄图像。结果与讨论
[0289]
我们以前在体外证实了im的形成需要fgf9或fgf21。因此,在体内,我们假设ue形成于在原条阶段之后不久暴露于fgf9和ra的早期迁移性psm细胞,而细胞晚迁移,因此暴露于更长的wnt信号传导,应该引起mm
13
(图7a)。为了证实这一点以及继实施例1中所示的数据,我们在加入fgf9之前改变了初始wnt信号传导(chir99201)的持续时间(图7b),并通过qpcr监测了ai和pi的标志物。chir99021的较短时期诱导了ai标志物lhx1和gata3,而chir99021的较长天数则在第7天增加了pi标志物hoxd11和eya1。如预期的那样,在chir99021中较长时间后,psm标记物tbx6和t的长期表达表明fgf9诱导的命运承诺的延迟(图7c)。免疫荧光分析显示chir99021的较长(或较短)持续时间分别诱导较少(较多)的ai但较多(较少)的pi,如在第7天分化分别由gata3和hoxd11所示(图7d)。这些观察在培养18天后持续存在,在chir99201中较少的天数之后,具有优势的ue诱导(gata3
+
pax2
+
ecad
+
),在chir66201中较长的天数下mm(pax2
+
ecad-)及其衍生物(pax2
+
ecad
+
)优先诱导。此外,我们研究了ra信号传导是否也使用ra或rar拮抗剂agn193109与fgf9一起控制im的a-p命运模式(图7e,f)。ra促进ue诱导,而agn193109抑制ue但增强mm谱系的诱导(图7g,h)。
[0290]
这些结果增加了我们对胚胎发生的理解,并且提供了一种通过其调节对肾形成必不可少的两种im衍生的祖细胞群的相对诱导的方法。因此,我们修改了现有的肾脏分化过程,以增加mm形成的比例,增加3d培养时间,积极触发肾单位形成。该优化方法应用于hesc或人ipsc,并且包含初始4天的chir99021,其导致在单层培养中ue和mm的诱导,随后是3天的fgf9,然后转移至类器官培养(图8a)。将所得聚集体培养长达20天,在此期间它们自发形成复合的类肾体(图8b)。在正常肾脏发育期间,响应于从ue分泌的wnt9b启动由mm的肾单位形成。在小鼠中,可以通过添加规范的wnt激动剂来触发异位肾单位形成
14
。事实上,每个类
器官的最大肾单位数在形成沉淀物后需要chir99021的脉冲1小时(图8a和图11a)。此外,在chir99021脉冲后继续存在fgf9对于肾发生是必需的,这表明在wnt介导的肾单位诱导后fgf信号传导的附加作用(图11b)。在每个类器官内,肾单位适当分为4个组分,包括收集管(gata3
+
ecad
+
),早期远端小管(gata3-ltl-ecad
+
),早期近端小管(ltl
+
ecad-)和肾小球(wt1
+
)(图8c,d)。此外,类肾体显示复杂的形态发生模式,收集管树形成在类器官的底部,连接到中部的远端和近端小管,每个类器官的顶部有肾小球(图8e',e”,e”')。这种模式模拟在体内观察到的组织的结构化,其中肾小球在皮质中出现,而收集管从中间辐射状穿过器官。在这里,单个类器官内的收集管与肾单位的相对水平可以随着初始chir99201-至-fgf9开关的时间安排而变化。接下来,我们在聚集和3d培养后的第(d)0、3、11和18天对整个类肾体进行rna测序。在这个时间段,我们观察到肾单位祖细胞基因表达的暂时性损失,但是包括足细胞、近端和远端小管的多个肾单位段的标志物增加(图12)。进行转录谱分析,并使用无偏倚方法与从怀孕第一和/或第二妊娠期的21个人胎儿器官/组织的人胎儿转录数据集进行比较。该分析在第一妊娠期人胎儿肾脏培养的d11和d18时聚集了类肾体(图8f,g;图13)。在稍早期的培养时间点(d0,d3),类器官与胎儿性腺(衍生自im的与胚胎密切相关的组织)更紧密地匹配。
[0291]
在肾脏中,上皮细胞类型(肾单位和收集管)由其中存在血管网络的肾间质(基质)包围。除了形成mm之外,im产生基质和血管祖细胞(图9a)
16,17
。我们检查了类肾体以证明其他细胞类型和功能成熟。可以基于pax2、gata3和ecad的共表达来区分收集管(图9b)。在d11,肾单位上皮显示近端(ltl
+
ecad-)和远端(ltl-ecad
+
)元件(图9c)。到d18,近端小管成熟以共表达ecad与ltl,cubilin在顶端表面明显(图9d,e)。透射电子显微镜(tem)显示不同的上皮亚型;收集管/远端小管特有的、有很少的短的微绒毛围绕开放管腔的细胞(图9k)和显示具有紧密连接的顶端刷状缘的典型的近端肾小管上皮细胞(图9l)。到d18,henle环(umod
+
)开始形成(图9f)。到d11,观察到包含具有中心足细胞形成的鲍曼氏囊的wt1
+
nphs1
+
早期肾小球
18
连接到近端小管(图9g)。类肾体还发育出有腔形成的cd31
+
kdr
+
sox17
+
内皮网络(图9h)。tem显示足细胞特有的初级足突和次级足突的存在(图9m)。在发育中的肾脏中,肾间质分化为周细胞和系膜细胞
19
。正如预期的那样,如在人胎儿肾脏
20
中观察到的,类肾体含有沿着kdr
+
内皮和pdgfra
+
早期肾小球系膜细胞侵袭肾小球的pdgfra
+
血管周围细胞(图14a,b)。早期无血管性肾小球包含基底膜,如层粘连蛋白染色和tem所示,并显示足突附着在基底膜上。在一些情况下,肾小球显示内皮侵袭的证据(图9i),这是在移植的胚胎小鼠肾脏中未见的特征
21
。最后,肾单位被meis1
+
肾间质细胞
22
包围,其中一些也是foxd1
+
(图9j),表明存在皮质(foxd1
+
meis1
+
)和髓质(foxd1-meis1
+
)基质。因此,所有预期的肾组分形成、构型并开始在这些hpsc衍生的类肾体中成熟。与这些观察结果一致的是培养中随时间的转录变化,伴随着肾原性间充质和输尿管尖端标志物的逐渐减少,随后是对足细胞、近端小管、远端小管和henle环的特异性基因的上调
23,24
(图11)。
[0292]
干细胞来源的类肾体用于疾病建模或药物筛选的效用将取决于这些类器官内的肾单位的功能成熟。为了试验这一点,我们专注于近端小管,一个在溶质、维生素、激素和氨基酸重吸收中起重要作用的肾单位段。通过在暴露24小时后ltl
+
小管从培养基中选择性摄取葡聚糖-alexa488,证明了cubilin介导的近端小管特异性内吞的能力(图10a)。近端小管由于多药耐药性(如abcb1,abcg2)和阴离子和阳离子转运蛋白(如slc22基因家族)
23,24
的表
达而代表肾毒性的特定靶标。顺铂是诱导肾脏近端肾小管细胞的半胱天冬酶介导的急性细胞凋亡的肾毒剂之一
25,26
。我们用0、5和20μm顺铂处理类肾体24小时,然后检查切割的casp3抗体染色。虽然对照类器官有时会出现细胞凋亡的间质细胞,但5μm和20μm顺铂均诱导成熟近端小管细胞(ltl
+
ecad
+
)的特异性急性细胞凋亡,而未成熟细胞(ltl
+
ecad-)未发生细胞凋亡(图10b,c)。
[0293]
总之,这项研究表明,通过仔细平衡im与小分子的a/p模式化,可以引导人多能干细胞形成复合多细胞类肾体,所述复合多细胞类肾体包含由内皮和肾间质包围的完全分段的肾单位,并且与人胎肾转录相似。因此,这将提高我们对人肾脏发育的认识。每个类肾体达到》500个肾单位/类器官的实质大小,该数字相当于14.5dpc下的小鼠肾脏
27
。尽管关于管状功能成熟度、肾小球血管形成和具有尿液单出口路径的连续收集管上皮还有进一步改善的空间,但是观察到的组织复杂性和类器官功能化程度支持其用于筛选药物的毒性、建模遗传性肾病或作为细胞疗法的特定肾细胞类型的来源。
[0294]
我们可以从单独的分化hes细胞培养物形成类器官的事实打开了产生基于组织的肾毒性筛选、体外疾病模型或开发可移植类器官以补充肾功能的可能性。它还表明产生特异性成熟肾细胞类型以供以后纯化的可行性。
[0295]
使用此方法生成的细胞的特定用途可能包括:
·
产生微型类肾体或纯化的肾细胞用于肾毒性筛选;
·
产生微型类肾体或纯化的肾细胞用于疾病建模,无论是一般性地还是为每一名患者的;和/或
·
产生微型类肾体或纯化的肾细胞类型用于治疗肾病的药物筛选。
[0296]
这些可以在微型生物反应器中进行,或者在生物打印成更大格式的屏幕之后进行。对于疾病建模或药物筛选,我们可能会以根据具体疾病提供有用信息的方式或格式来纯化个体细胞类型并进行培养。例如,我们可以分离ub并在matrigel培养物中生长以评估包囊形成(例如用于疾病例如肾单位肾痨(nephronopthisis))或分离mm以产生足细胞(例如用于芬兰肾病或alport综合征等疾病)。
[0297]
细胞疗法和器官替代或修复的具体实例可包括:
·
产生肾细胞类型用于细胞疗法(急性肾损伤或慢性肾损伤);
·
产生肾细胞类型用于全器官替代生物工程,这可能需要将多个较小的肾连接在一起,形成替代“器官”;和/或
·
产生肾细胞类型用于脱细胞支架的再细胞化。
·
其他应用包括:
·
1)由这样的人多能干细胞系产生类肾体,其被工程化以报告一种或多种荧光报告子作为分化为特定肾细胞类型的读出。这将允许由单个起始细胞系产生类器官,其将报告分化的复杂程度,而不需要特异性抗体可视化,并且将促进组合facs分选以从一种分化纯化多种特异性肾细胞类型。这种分选的细胞可能在细胞疗法中有用。
·
2)由这样的人多能干细胞系产生类肾体,其被工程化以报告一种或多种基于荧光或荧光素酶的报告子,作为细胞损伤的读出(对肾毒性、细胞毒性或诱导凋亡/坏死的预测反应)。这将允许产生用于药物或肾毒性筛选并具有可计量的反应读出的类器官。
·
3)产生单独的收集管或单独的后肾间充质以与其他生物打印结构组合。例如,
产生单独的肾单位形成间充质用于与分别分化但生物打印成输尿管树的收集管细胞组合。这里的优点将是创建特定模式化的收集管网络,围绕该网络肾单位可以分化,使得最终产物可以充当能够将尿引导到单个出口的可移植器官。
[0298]
在整个说明书中,目的是描述本发明的优选实施方案,而不将本发明限制于任何一个实施方案或特定的特征集合。因此,本领域技术人员将理解,根据本公开,可以在所示的具体实施方案中进行各种修改和改变,而不脱离本发明的范围。
[0299]
本文引用的所有计算机程序、算法、专利和科学文献都通过引用并入本文。
[0300]
表1.试剂来源表1.试剂来源
[0301]
表2:用于qrtpcr的引物序列
[0302]
表3
参考文献1.takasato,m.et al.directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney.nat.cell biol.16,118
–
26(2014).2.james,r.g.&schultheiss,t.m.patterning of the avian intermediate mesoderm by lateral plate and axial tissues.dev.biol.253,109
–
124(2003).3.mae,s.et al.monitoring and robust induction of nephrogenic intermediate mesoderm from human pluripotent stem cells.nat.commun.4,1367(2013).4.xia,y.et al.directed differentiation of human pluripotent cells to ureteric bud kidney progenitor-like cells.nat.cell biol.15,1507
–
15(2013).5.taguchi,a.et al.redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells.cell stem cell 14,53
–
67(2014).6.lam,a.q.et al.rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers.j.am.soc.nephrol.25,1211
–
1225(2014).7.kang,m.&han,y.differentiation of human pluripotent stem cells into nephron progenitor cells in a serum and feeder free system.plos one 9,e94888(2014).8.xu,j.et al.eya1 interacts with six2 and myc to regulate expansion of the nephron progenitor pool during nephrogenesis.dev.cell 31,434
–
47(2014).9.duester,g.retinoic acid synthesis and signaling during early organogenesis.cell 134,921
–
31(2008).10.sakai,y.et al.the retinoic acid-inactivating enzyme cyp26 is essential for establishing an uneven distribution of retinoic acid along the anterio-posterior axis within the mouse embryo.genes dev.15,213
–
25(2001).
regulation of xenobiotic transporters in mouse kidneys.drug metab.dispos.37,2178-85(2009)25.mese,h.,sasaki,a.,nakayama,s.,alcalde,r.e.&matsumura,t.the role of caspase family protease,caspase-3 on cisplatin-induced apoptosis in cisplatin-resistant a431 cell line.cancer chemother.pharmacol.46,241
–
245(2000).26.cummings,b.s.&schnellmann,r.g.cisplatin-induced renal cell apoptosis:caspase 3-dependent and-independent pathways.j.pharmacol.exp.ther.302,8
–
17(2002).27.short,k.m.et al.global quantification of tissue dynamics in the developing mouse kidney.dev.cell 29,188
–
202(2014).28.briggs,j.a.et al.integration-free induced pluripotent stem cells model genetic and neural developmental features of down syndrome etiology.stem cells 31,467
–
78(2013).29.dobin,a.et al.star:ultrafast universal rna-seq aligner.bioinformatics 29,15
–
21(2013).30.love,m.i.,huber,w.&anders,s.moderated estimation of fold change and dispersion for rna-seq data with deseq2.genome biol.15,550(2014).31.orlova vv,van den hil fe,petrus-reurer s,drabsch y,ten dijke p,mummery cl.generation,expansion and functional analysis of endothelial cells and pericytes derived from human pluripotent stem cells.nat protoc.2014;9(6):1514-31。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1