油茶果壳多糖及其制备方法与流程
1.本发明涉及油茶果壳活性多糖的提取及应用领域,具体涉及一种油茶果壳多糖及其制备方法。
背景技术:
2.油茶(camellia oleifera abel.)为山茶科常绿灌木或小乔木,是优质的植物油来源。除油茶籽可用于榨油外,其果壳还可用于提取栲胶、糠醛、木糖醇等。近年来,国内外学者研究发现,采用油茶果壳为原料能够提取到多糖类物质,该多糖类物质具有抗氧化性、保湿性、吸湿性等性能。
3.目前,油茶果壳多糖的提取方法主要包括为以醇提法为基础,结合超声、水提、萃取等手段的方法。例如,朱志东等(2019)在《不同提取方法对油茶果壳多糖含量的影响》一文中检测了采用水提醇沉法、超声-乙醇提取法等方法对油茶果壳多糖进行提取时的多糖得率,并且对其中的具体条件进行了优化,发现当醇浓度、提取温度等条件提高时,多糖得率能够相应的有所上升。又例如,陈景斯等(2019)在《油茶果壳多糖乙醇提取的优化及其吸湿保湿性能》一文中介绍了采用油茶果壳粉与30倍量的60%乙醇混合浸泡1小时,而后100℃下加热回流提取的方法。沈建福等(2010)于《油茶果壳多糖的提取及抗氧化作用研究》一文中介绍了采用醇沉法,而后依次采用无水乙醇、丙酮、无水乙醚进行洗涤,真空干燥后获得油茶果壳多糖的方法。
4.然而,目前的提取方法中往往采用高温提取的方式,而高温会破坏油茶果壳多糖的生物活性,降低油茶果壳多糖的品质。因此,亟需开发一种低温提取油茶果壳多糖的方法,以解决上述问题。
技术实现要素:
5.本发明的目的是为了克服现有技术存在的提取方法中高温条件易破坏油茶果壳多糖生物活性的问题,提供一种油茶果壳多糖及其制备方法,该方法在低温条件下进行油茶果壳多糖提取,能够有效避免提取过程中油茶果壳多糖失活的问题,提高油茶果壳多糖的品质。
6.为了实现上述目的,本发明一方面提供一种油茶果壳多糖,所述油茶果壳多糖包括以下单糖提供的结构单元:甘露糖5-10重量%,岩藻糖15-20重量%,半乳糖15-20重量%,鼠李糖5-10重量%,阿拉伯糖1-5重量%和葡萄糖30-50重量%。
7.本发明第二方面提供一种制备油茶果壳多糖的方法,所述方法包括以下步骤:
8.(1)酶解:将油茶果壳、水和复合酶在酶解条件下混合进行酶解,并将获得的混合物进行第一固液分离;
9.(2)醇提:将第一固液分离得到的液相产物与醇接触进行醇沉,获得醇提产物。
10.本发明第三方面提供如上所述的方法制备获得的油茶果壳多糖。
11.通过上述技术方案,本发明能够取得如下有益效果:
12.(1)本发明提供的方法中采用低温条件进行油茶果壳多糖提取,能够减少因提取温度过高导致的油茶果壳多糖生物活性下降,提高油茶果壳多糖的品质。
13.(2)本发明提供的方法中,采用酶解法对油茶果壳原料进行处理,条件温和,处理效率高,并且减少了化学试剂的使用对油茶果壳多糖生物活性的破坏。
14.(3)采用本发明提供的油茶果壳多糖抗氧化性好,30μg/ml时对abts、dpph、oh等自由基的清除率即可达到65%以上。
附图说明
15.图1是测试例1中获得的酶解温度与油茶果壳多糖收率的关系曲线。
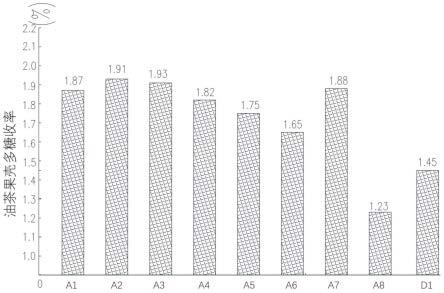
16.图2是本发明实施例和对比例中油茶果壳多糖的收率对比图。
17.图3-5分别是测试例3中油茶果壳多糖和茶多糖对abts自由基、dpph自由基和oh自由基的清除率对比图。
具体实施方式
18.在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
19.本发明第一方面提供一种油茶果壳多糖,所述油茶果壳多糖包括以下单糖提供的结构单元:甘露糖5-10重量%,岩藻糖15-20重量%,半乳糖15-20重量%,鼠李糖5-10重量%,阿拉伯糖1-5重量%和葡萄糖30-50重量%。以上重量百分比数值代表对应的单糖提供的结构单元在本发明提供的油茶果壳多糖中所占的含量。
20.优选地,所述油茶果壳多糖包括以下单糖提供的结构单元:甘露糖6.5-7.5重量%,岩藻糖18-20重量%,半乳糖15-17重量%,鼠李糖5-7重量%,阿拉伯糖1-3重量%,葡萄糖40-50重量%。
21.优选地,所述油茶果壳多糖包括以下单糖提供的结构单元:甘露糖6.8-7.5重量%,岩藻糖18.5-19.5重量%,半乳糖15-16.5重量%,鼠李糖6-7重量%,阿拉伯糖2-3重量%,葡萄糖45-50重量%。
22.根据本发明的优选实施方式,其中,所述油茶果壳多糖的重均分子量为50000-70000。此外,发明人在研究中还发现,该油茶果壳多糖为棕色粉末,分子量分布在3000-250000之间,且具有易溶于水或水溶液(如酸、碱、盐的水溶液),而不溶于有机溶剂(如醇、酮、醚等)的特点。
23.目前本领域用于油茶果壳多糖制备的方法主要是基于醇提法再辅以其他手段的方法,其中提取过程中往往采用较高的提取温度(例如100℃等)以提高油茶果壳多糖的得率。然而,高温虽然能够提高收率,同时也容易破坏油茶果壳多糖的生物活性。本发明的发明人在研究的过程中巧妙地发现,将酶解法与醇提法结合,配合本发明优选的复合酶和提取条件,能够在较低的提取温度下实现较高收率的油茶果壳多糖提取。同时,该方法还能保留较高的油茶果壳多糖生物活性,提高油茶果壳多糖的品质。
24.本发明第二方面提供一种制备油茶果壳多糖的方法,所述方法包括以下步骤:
25.(1)酶解:将油茶果壳、水和复合酶在酶解条件下混合进行酶解,并将获得的酶解产物进行第一固液分离;
26.(2)醇提:将第一固液分离得到的液相产物与醇接触进行醇沉,获得醇提产物。
27.油茶果壳即为茶油加工企业在压榨茶油过程中产生的副产品,出于设备磨损、油品质量及出油率等方面的考虑,茶油加工企业一般先对油茶果进行脱壳处理(即,将油茶果剥壳并进行壳仁分离)后,再取其中的茶籽仁榨油。任意本领域现有的用于制备油茶果壳多糖的油茶果壳均可采用本发明提供的方法进行多糖提取。根据本发明的优选实施方式,其中,步骤(1)中,所述油茶果壳为茶油压榨之前,对油茶果进行脱壳处理时产生的油茶果壳。
28.为了使得所述油茶果壳与复合酶能够充分接触,提高酶解效率和效果,优选地,所述油茶果壳以粉末形式存在。该油茶果壳粉末可以为商购获得的相关产品,也可以是采用上述油茶果壳自行制备成粉末。
29.本发明提供的方法中对于所述油茶果壳粉末的粒径没有特殊限制,只要能够达到在酶解体系中与复合酶充分接触的目的即可。更优选地,所述油茶果壳粉末的粒径为150-450μm。即,该油茶果壳粉末至少可以通过40目筛,至多能够通过100目筛。
30.任意本领域现有的能够用于酶解油茶果壳(例如其中的主要成分,纤维素、淀粉、蛋白质等)的酶均可用作本发明提供的复合酶中的成分。出于成本、酶解效率和效果等方面的考虑,根据本发明的优选实施方式,其中,所述复合酶包括:纤维素酶、淀粉酶和蛋白酶中的至少一种。
31.优选地,所述纤维素酶选自c1酶、cx酶和葡萄糖苷酶中的至少一种。
32.优选地,所述淀粉酶选自α-淀粉酶、β-淀粉酶和γ-淀粉酶中的至少一种。
33.优选地,所述蛋白酶选自木瓜蛋白酶、胰蛋白酶、组织蛋白酶和枯草杆菌蛋白酶中的至少一种。更优选木瓜蛋白酶。
34.本发明提供的方法中采用的酶可以是商购获得的含有上述类型的酶的相关产品,也可以是自行制备获得的上述酶。
35.本发明提供的方法中,步骤(1)中的油茶果壳、水和复合酶的用量没有特别限制,只要能够使得所述油茶果壳(粉末)充分酶解即可。本领域技术人员可以根据采用的复合酶中的成分和特点等实际情况对油茶果壳、水和复合酶的用量进行调整。根据本发明的优选实施方式,其中,步骤(1)中,所述油茶果壳和水的重量比为1:10-30。
36.根据本发明的优选实施方式,其中,相对于1g的所述油茶果壳,所述纤维素酶的用量为500-1500u。
37.优选地,相对于1g的所述油茶果壳,所述纤维素酶的用量为700-1500u。
38.根据本发明的优选实施方式,其中,相对于1g的所述油茶果壳,所述淀粉酶的用量为400-1200u。
39.优选地,相对于1g的所述油茶果壳,所述淀粉酶的用量为450-1000u。
40.根据本发明的优选实施方式,其中,相对于1g的所述油茶果壳,所述蛋白酶的用量为3000-8000u。
41.优选地,相对于1g的所述油茶果壳,所述蛋白酶的用量为3500-7500u。
42.根据本发明的优选实施方式,其中,所述纤维素酶、淀粉酶和蛋白酶的用量比为1:0.8-2.5:2-6,优选为1:0.9-2:3-5。
43.本发明提供的方法中,步骤(1)中的酶解条件可以根据实际情况进行调整。根据本发明的优选实施方式,其中,步骤(1)中,所述酶解的条件包括:温度30-60℃,搅拌转速500-2000rpm,酶解时间4-8h。
44.为了使得酶解体系受热均匀,同时便于观察酶解程度,优选地,采用水浴加热的方式控制酶解的温度。
45.本发明提供的方法中,步骤(1)中可以采用任意本领域现有的方式进行第一固液分离。根据本发明的优选实施方式,其中,所述第一固液分离的方式选自离心分离和/或自然沉降分离。
46.出于固液分离的效率和效果等方面的考虑,优选地,所述第一固液分离的方式为离心分离,条件包括:离心转速2000-5000rpm,离心时间10-30min,温度30-60℃,ph值5-6。所述温度和ph值是指第一固液分离体系中物料的(初始)温度和ph值。
47.任意本领域现有的能够用于油茶果壳多糖提取的醇均可适用于本发明提供的方法。根据本发明的优选实施方式,其中,步骤(2)中,所述醇选自c1-c5的醇。
48.出于成本、提取效率等方面的考虑,优选地,所述醇选自甲醇和/或乙醇及其水溶液中的至少一种。
49.考虑到产品的安全性,更优选采用(无水)乙醇或其水溶液(优选其中乙醇体积分数在90%以上)与第一固液分离得到的液相产物接触。
50.本发明提供的方法中,所述醇的用量没有特别限制,可以根据实际情况进行调整。出于节能降耗和减少醇沉时多糖的损失的考虑,优选地,相对于1g的以干基计的所述液相产物,所述醇的用量为3-25ml,优选为5-20ml。所述干基即为将第一固液分离得到的液相产物干燥后所获得的固体物质。
51.本发明提供的方法中,所述醇沉的条件没有特别限制,任意本领域现有用于醇沉提取油茶果壳多糖的条件均可适用于本发明提供的方法。为了能够进一步提高所述油茶果壳多糖的收率,降低醇沉时多糖的损失,根据本发明的优选实施方式,其中,所述醇沉的条件包括:温度3-5℃,时间12-24h,醇沉体系中醇的体积浓度为70-85%。
52.为了提高醇沉的效率,同时减少醇的用量,根据本发明的优选实施方式,其中,所述方法还包括在步骤(2)之前,对第一固液分离得到的液相产物进行浓缩的步骤。
53.任意本领域现有的浓缩方式均可适用于本发明提供的方法。为了在保证浓缩效率和效果的情况下,能够更好地控制浓缩的温度,优选地,所述浓缩的方式选自旋蒸浓缩和/或水浴挥发浓缩。
54.本发明提供的方法中,所述浓缩的步骤只要能够达到减少步骤(1)中第一固液分离获得的液相的体积的目的即可。出于节约试剂、减少后续工作量、减少多糖损失等目的,根据本发明的优选实施方式,其中,浓缩后的体积为浓缩前的1/5-1/3。
55.本发明提供的方法中,所述浓缩的条件没有特别限制,只要能够实现上述目的,并且达到前述效果即可。为了提高浓缩效率,同时尽可能保留油茶果壳多糖的活性,优选地,所述浓缩的方式选自旋蒸浓缩,其条件包括:温度≤50℃。更优选温度40-50℃,时间120-180min。
56.根据本发明的优选实施方式,其中,所述方法还包括在步骤(2)之后对醇提产物进行第二固液分离的步骤。
57.任意本领域现有的固液分离方法均可适用于本发明。优选地,所述第二固液分离的方式选自离心分离和/或自然沉降中的至少一种。
58.出于处理效率和效果的考虑,更优选地,所述第二固液分离的方式为离心分离,其条件包括:离心转速5000-20000rpm,离心时间10-20min,离心温度1-5℃。
59.根据本发明的优选实施方式,其中,所述方法还包括在第二固液分离后对获得的固相进行干燥的步骤。
60.任意本领域现有干燥方式均可适用于本发明提供的方法。为了在保证干燥效果较好的同时能够尽可能保留油茶果壳多糖的生物活性,优选地,所述干燥的方式选自冷冻干燥和/或真空干燥。
61.更优选地,所述干燥的方式为冷冻干燥,其条件包括:温度-30℃至-20℃,时间480-600min。
62.本发明第三方面提供由如上所述的方法制备获得的油茶果壳多糖。
63.以下将通过实施例对本发明进行详细描述。应当能够理解的是,以下实施例仅用于示例性地进一步解释和说明本发明的内容,而不用于限制本发明。
64.以下实施例中,采用的油茶果壳为安徽东旭大别山农业科技有限公司压榨车间在茶油压榨生产过程中,对油茶果进行脱壳处理,获取用于榨油的油茶籽时产生的油茶果壳。纤维素酶(主要含有c1酶、cx酶和葡萄糖苷酶等酶成分)和木瓜蛋白酶均购自湖州礼来生物科技有限公司,其中纤维素酶活力1.5万u/g,木瓜蛋白酶活力40万u/g。淀粉酶(主要含有α-淀粉酶、β-淀粉酶和γ-淀粉酶等酶成分)购自义乌市忆隆生物科技有限公司,酶活力10万u/g。其他在以下实施例中涉及的试剂在未进行特殊说明的情况下,均为通过正规化学/生物试剂供应商购买获得,纯度为分析纯。
65.以下实施例中,采用的油茶果壳粉末的制备方法如下:将除杂、清洗后的油茶果壳研磨至粒径约为300μm。
66.以下实施例中,采用上海玉成冷冻设备有限公司生产的型号为yrd-30.2a的真空冷冻干燥机对醇提沉淀进行冻干处理。
67.实施例1
68.酶解:准确称取10g油茶果壳粉末,将其与100g水以及复合酶混合。
69.复合酶配方:7000u纤维素酶,4500u淀粉酶,35000u木瓜蛋白酶。
70.将获得的混合物在60℃水浴加热4h,过程中不断搅拌,搅拌转速为500rpm。保持物料温度为60℃,调节其ph至6后,进行第一固液分离:2000rpm离心30min,取上清液为第一固液分离产物。
71.浓缩:将所述上清液50℃旋蒸浓缩至原体积的1/3,获得浓缩的第一固液分离产物。
72.醇提:将浓缩的第一固液分离产物与无水乙醇按照1:4的体积比混合,静置于4℃冰箱中过夜(约为12h),获得醇提产物。
73.第二固液分离:将所述醇提产物5000rpm离心20min,获得醇提沉淀。
74.干燥:将所述醇提沉淀冻干(温度-30℃,时间480min)。获得油茶果壳多糖a1。
75.实施例2
76.酶解:准确称取10g油茶果壳粉末,将其与200g水以及复合酶混合。
77.复合酶配方:11000u纤维素酶,7250u淀粉酶,55000u木瓜蛋白酶。
78.将获得的混合物在45℃水浴加热5h,过程中不断搅拌,搅拌转速为1000rpm。保持物料温度为45℃,调节其ph至5.5后,进行第一固液分离:3000rpm离心20min,取上清液为第一固液分离产物。
79.浓缩:将所述上清液40℃旋蒸浓缩至原体积的1/4,获得浓缩的第一固液分离产物。
80.醇提:将浓缩的第一固液分离产物与无水乙醇按照1:5的体积比混合,静置于4℃冰箱中过夜(约为18h),获得醇提产物。
81.第二固液分离:将所述醇提产物12000rpm离心15min,获得醇提沉淀。
82.干燥:将所述醇提沉淀冻干(温度-25℃,时间540min)。获得油茶果壳多糖a2。
83.实施例3
84.酶解:准确称取10g油茶果壳粉末,将其与300g水以及复合酶混合。
85.复合酶配方:15000u纤维素酶,10000u淀粉酶,75000u木瓜蛋白酶。
86.将获得的混合物在30℃水浴加热8h,过程中不断搅拌,搅拌转速为2000rpm。保持物料温度为30℃,调节其ph至5后,进行第一固液分离:5000rpm离心10min,取上清液为第一固液分离产物。
87.浓缩:将所述上清液50℃旋蒸浓缩至原体积的1/5,获得浓缩的第一固液分离产物。
88.醇提:将浓缩的第一固液分离产物与无水乙醇按照1:4.5的体积比混合,静置于4℃冰箱中约24h,获得醇提产物。
89.第二固液分离:将所述醇提产物12000rpm离心10min,获得醇提沉淀。
90.干燥:将所述醇提沉淀冻干(温度-20℃,时间600min)。获得油茶果壳多糖a3。
91.实施例4
92.按照实施例1中的方法,不同的是,将其中的木瓜蛋白酶替换为35000u蛋白酶(购自湖州礼来生物科技有限公司,主要含有胰蛋白酶,酶活力10万u/g)。获得油茶果壳多糖a4。
93.实施例5
94.按照实施例1中的方法,不同的是,酶解步骤中的水浴温度提升至62℃。获得油茶果壳多糖a5。
95.实施例6
96.按照实施例1中的方法,不同的是复合酶配方如下:5000u纤维素酶,4000u淀粉酶,30000u木瓜蛋白酶。获得油茶果壳多糖a6。
97.实施例7
98.按照实施例1中的方法,不同的是复合酶配方如下:15000u纤维素酶,12000u淀粉酶,80000u木瓜蛋白酶。获得油茶果壳多糖a7。
99.实施例8
100.按照实施例1中的方法,不同的是采用未经研磨的油茶果壳进行油茶果壳多糖制备。获得油茶果壳多糖a8。
101.对比例1
102.采用如下水提-醇沉的方法进行油茶果壳多糖提取:
103.准确称取10g的油茶果壳粉末,将其与100g水混合。
104.水提:将获得的混合物在60℃水浴加热4h,过程中不断搅拌,搅拌转速为500rpm。之后进行第一固液分离,条件为2000rpm离心30min,取上清液为第一固液分离产物。
105.浓缩:将所述上清液50℃旋蒸浓缩至原体积的1/3,获得浓缩的第一固液分离产物。
106.醇提:将浓缩的第一固液分离产物与乙醇按照1:4的体积比混合,静置于4℃冰箱中过夜(约为12h),获得醇提取物。
107.第二固液分离:将所述醇提取物5000rpm离心20min,获得醇提沉淀。
108.干燥:将所述醇提沉淀冻干(温度-30℃,时间480min)。获得油茶果壳多糖d1。
109.测试例1
110.(一)油茶果多糖收率以及性质
111.对以上实施例和对比例中获得的油茶果壳多糖进行称重,按照以下公式计算其油茶果壳多糖收率。结果详见表1和图2。
112.油茶果壳多糖收率=油茶果壳多糖质量(g)/油茶果壳原料质量(g)
×
100%观察以上实施例和对比例获得的油茶果壳多糖色泽,利用由日本岛津公司生产,型号为prominencelc-20a的高效液相色谱仪,通过凝胶色谱法测定油茶果壳多糖的重均分子量和分子量分布情况,结果详见表1。
113.表1油茶果壳多糖收率和重均分子量
[0114][0115]
经观察对比,油茶果壳多糖a1、a4、a5、a6和a7的色泽相比a2和a3更深,其中a1的色泽最接近a2和a3,仅比其稍深,a4、a6和a7较a1色泽稍深,a5则是其中色泽最深的,较为接近a8和d1。油茶果壳多糖a5、a8和d1的色泽都较深,其中d1的色泽最深,a8次之,a5最浅。
[0116]
利用不同的溶剂对以上实施例和对比例获得的油茶果壳多糖的溶解性进行检测。结果表明,以上油茶果多糖均具有如下类似的溶解性:在水中,以及酸(如盐酸、硫酸等)、碱
(如氢氧化钠等)、盐(如氯化钠等)的水溶液中易溶解,但是不溶解于醇(如无水乙醇、无水甲醇等)、酮(例如丙酮等)、醚(例如乙醚等)等有机溶剂中。
[0117]
(二)酶解温度对油茶果多糖收率的影响
[0118]
设置不同的酶解温度梯度(5℃、25℃、27℃、30℃、45℃、60℃、62℃、70℃),按照实施例1中的方法(除酶解温度外的其他条件和步骤均与实施例1相同),对油茶果多糖进行提取。分别计算不同温度下的油茶果多糖收率,绘制出酶解温度与油茶果壳多糖收率的关系曲线(详见图1)。
[0119]
从图1中可以看出,当酶解温度低于45℃时,油茶果多糖的收率随着温度的上升而有所提升,其中在25-30℃之间,收率随着温度的提升幅度最大;达到45℃时,油茶果多糖的收率最高,然后随着温度上升略有下降;当达到60℃以后,随着温度上升,油茶果多糖的收率急剧下降。
[0120]
测试例2
[0121]
采用岛津公司生产的气相色谱仪gc-2010pro,通过气相色谱法对以上实施例和对比例获得的油茶果壳多糖中的主要单糖结构单元和含量进行检测。结果详见表2。
[0122]
表2油茶果壳多糖中的主要单糖结构单元和含量(重量%)
[0123]
编号甘露糖岩藻糖半乳糖鼠李糖阿拉伯糖葡萄糖a17.0319.0115.736.632.6548.93a27.319.1515.756.552.5548.55a37.519.0415.546.732.848.19a47.119.216.026.652.448.43a57.4519.116.056.82.647.8a67.219.315.926.52.348.58a77.3518.916.16.782.248.47a86.919.2315.836.22.948.74d16.819.415.676.62.4348.9
[0124]
测试例3
[0125]
本测试例中采用自由基清除实验对实施例3中获得的油茶果壳多糖a3的抗氧化性进行检测。
[0126]
以下实验中采用的样品溶液、工作液以及测试液的制备方法如下:
[0127]
样品溶液:将1mg/ml油茶果壳多糖水溶液用50体积%的乙醇水溶液按样品浓度(35μg/ml、30μg/ml、25μg/ml、20μg/ml、15μg/ml、10μg/ml、5μg/ml)稀释成不同浓度梯度,即为样品溶液。样品浓度即在自由基清除实验体系中,油茶果壳多糖a3的终浓度。
[0128]
工作液:将tptz(二硫代苏糖醇)水溶液(10mmol/l)、fecl3水溶液(20mmol/l)和醋酸缓冲液(0.3mol/l)以1∶1∶10的体积比混合,即为工作液。使用前需先预热至37℃。
[0129]
测试液:1ml样品溶液与3ml工作液混合均匀,即得测试液。测试液在混合后需先于37℃水浴中静置10min再进行检测。
[0130]
为了更好地确定油茶果壳多糖a3的抗氧化能力水平,以下实验中均以茶多糖(购自长沙三福生物公司公司)为阳性对照,采用与油茶果壳多糖同样的浓度和方法进行自由基清除实验,通过对比二者的自由基清除率确定油茶果多糖a3的自由基清除效果水平。
[0131]
(一)abts自由基清除实验
[0132]
测试原理:abts是一种较稳定的自由基,加入于磷酸缓冲液(pbs)中时,溶液呈蓝绿色,在734nm附近有强吸收峰。当有自由基清除剂存在时,abts的单电子被配对而使颜色变浅,在最大吸收波长处的吸光度变小,且吸光度变小的程度与自由基被清除的程度呈定量关系。
[0133]
测试方法:
[0134]
abts溶液:采用磷酸缓冲液(pbs)将abts(购自合肥博美生物科技有限责任公司,纯度为分析纯)配制成7mmol/l的溶液,呈蓝绿色。
[0135]
将采用不同浓度梯度样品溶液配制的测试液(各取1ml)与abts溶液按照4:3的体积比混合,在室温下反应6min,于734nm处测定吸光度,每个测试液做3个重复。
[0136]
观察对比测试液处理后的溶液与abts溶液的颜色差别发现,处理后溶液的颜色均比abts溶液颜色浅。
[0137]
采用上海科美仪器有限公司7225型号的分光光度仪,分别检测abts溶液与不同浓度梯度样品溶液配制的测试液处理后的溶液在734nm处的吸光度,按照以下公式计算abts清除率。具体结果详见图2及表3。
[0138]
abts清除率=(测试液734nm吸光值/abts溶液734nm吸光值)
×
100%
[0139]
表3油茶果壳多糖和茶多糖对abts自由基的清除能力对比
[0140][0141][0142]
从表3和图2中可看出油茶果壳多糖a3对abts自由基有清除效果,其浓度与清除率呈正相关,清除效果水平与茶多糖接近。
[0143]
(二)dpph自由基清除实验
[0144]
测试原理:dpph是一种很稳定的以氮为中心的自由基,若样品能清除它,则说明样品具有降低自由基、烷自由基或过氧自由基的有效浓度和打断脂质过氧化链反应的作用。dpph有个单电子,在517nm有强吸收峰,其甲醇溶液呈深紫色,当有自由基清除剂存在时,会与其单电子配对而使其吸收峰逐渐消失。
[0145]
测试方法:
[0146]
dpph溶液:采用无水甲醇将dpph(购自合肥博美生物科技有限责任公司,纯度为分析纯)配制成60μmol/l的溶液,呈深紫色。
[0147]
将采用不同浓度梯度样品溶液配制的测试液(各取1ml)与dpph溶液按照8:3的体积比混合,摇匀后于避光处室温下静置30min,而后加入比色皿中在517nm测定吸光度,每个测试液做3个重复。
[0148]
观察对比测试液处理后的溶液与dpph溶液的颜色差别发现,处理后溶液的颜色均比dpph溶液颜色浅。
[0149]
采用上海科美仪器有限公司7225型号的分光光度仪,分别检测dpph溶液与不同浓度梯度样品溶液配制的测试液处理后的溶液在517nm处的吸光度,按照以下公式计算dpph清除率。具体结果详见图3及表4。
[0150]
dpph清除率=(测试液517nm吸光值/dpph溶液517nm吸光值)
×
100%
[0151]
表4油茶果壳多糖和茶多糖对dhhp自由基的清除能力对比
[0152]
样品浓度(μg/ml)油茶果壳多糖清除率(%)茶多糖清除率(%)511.8412.531022.6317.471533.4525.642043.3533.182556.4240.573071.2749.633572.4360.32
[0153]
从表4和图3中可看出油茶果壳多糖a3对dhhp自由基具有清除效果,其浓度与清除率呈正相关,且清除效果优于茶多糖。
[0154]
(三)oh自由基清除实验
[0155]
测试原理:邻二氮菲-fe
2+
的水溶液呈桔红色,在536nm处具有最大吸收峰。当oh自由基存在时,邻二氮菲-fe
2+
被氧化为邻二氮菲-fe
3+
,其位于536nm处的吸收峰消失。
[0156]
测试方法:邻二氮菲-fe
2+
氧化法。
[0157]
邻二氮菲-fe
2+
溶液:采用去离子水将邻二氮菲-fe
2+
(购自国药集团化学试剂有限公司,纯度为分析纯)配制成0.75mmol/l的溶液,呈桔红色。
[0158]
将采用不同浓度梯度样品溶液配制的测试液(各取1ml)与邻二氮菲-fe
2+
溶液按照4:1的体积比混合,而后加入1ml硫酸亚铁溶液(0.75mmol/l)和1ml 0.01%h2o2,通过芬顿反应产生oh自由基,反应体系置于37℃水浴中1小时,而后在536nm处测定其吸光度值。每个测试液做三个重复。
[0159]
观察对比经测试液处理及经等体积去离子水处理后的溶液在芬顿氧化后的颜色差别发现,经过测试液处理的溶液的颜色更深。
[0160]
采用上海科美仪器有限公司7225型号的分光光度仪,分别检测邻二氮菲-fe
2+
溶液以及芬顿氧化后,不同浓度梯度样品溶液配制的测试液处理后的溶液与去离子水处理后的溶液在536nm处的吸光度,按照以下公式计算oh清除率。具体结果详见图4及表5。
[0161]
oh清除率=(邻二氮菲-fe
2+
溶液536nm吸光值-测试液处理溶液536nm吸光值)/(邻二氮菲-fe
2+
溶液536nm吸光值-去离子水处理溶液536nm吸光值)
×
100%
[0162]
表5油茶果壳多糖和茶多糖对oh自由基的清除能力对比
[0163]
样品浓度(μg/ml)油茶果壳多糖清除率(%)茶多糖清除率(%)
521.5319.571031.7227.321548.2431.922056.3546.212570.4260.233075.0669.253573.8371.15
[0164]
从表5和图4中可看出油茶果壳多糖a3对oh自由基有清除效果,其浓度与清除率呈正相关,且清除效果优于茶多糖。
[0165]
通过以上自由基清除实验结果可知,本发明提取的油茶果壳多糖具有较好的抗氧化性,且其抗氧化水平(自由基清除能力水平)等同或优于茶多糖。而且,本发明提供的油茶果壳多糖在30μg/ml时对abts、dpph、oh等自由基的清除率即可达到65%以上,其中对abts自由基和dpph自由基的清除率均超过70%。
[0166]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1