二氟烷基取代芳基或杂芳基化合物、其制备方法及应用
本发明涉及一种二氟烷基取代芳基或杂芳基化合物、其制备方法及应用。
背景技术:
1、二氟烷基取代的芳烃/杂芳烃化合物在医药、农药和材料科学领域都有着重要的应用。传统的引入二氟亚甲基主要是通过脱氧氟化试剂例如dast(即二乙胺基三氟化硫),对羰基、醛基进行脱氧氟化,或者在氧化剂存在下,利用亲核氟化试剂hf-py、tbaf等对缩硫酮或腙进行氟化。但是由于氟化试剂往往活性太高,反应复杂,很多重要官能团不兼容,使得该方法在合成复杂含二氟亚甲基化合物时不适用,从而限制了该方法的应用。虽然最近几年向芳环引入二氟烷基的方法取得了很大的进展,但是发展一些过渡金属催化的廉价、广谱通用的方法还是非常重要的。
2、在氟烷基取代芳烃化合物中,我们关注的是一类含二氟烷基取代的芳烃/杂芳烃化合物。由于二氟亚甲基可以作为羰基的生物电子等排体,再加上氟原子独特的理、化、生物性质,这类化合物在生命科学领域具有非常重要的应用((a)j.o.link,j.g.taylor,l.xu,m.mitchell,h.guo,h.liu,d.kato,t.kirschberg,j.sun,n.squires,j.parrish,t.keller,z.-y.yang,c.yang,m.matles,y.wang,k.wang,g.cheng,y.tian,e.mogalian,e.mondou,m.cornpropst,j.perry,m.c.desai,j.med.chem.2014,57,2033;(b)jr.t.r.burke,k.lee,acc.chem.res.2003,36,426;(c)z.-y.zhang,acc.chem.res.2003,36,385.)。目前过渡金属催化的合成该类化合物的方法取得了一定的进展,然而也只有少量的几例((a)k.fujikawa,y.fujioka,a.kobayashi,h.amii,org.lett.2011,13,5560;(b)z.feng,f.chen,x.zhang,org.lett.2012,14,1938;(c)z.feng,y.-l.xiao,x.zhang,org.chem.front.2014,1,113;(d)z.feng,q.-q.min,y.-l.xiao,b.zhang,x.zhang,angew.chem.2014,126,1695;angew.chem.,int.ed.2014,53,1669;(e)q.-q.min,z.yin,z.feng,w.-h.guo,x.zhang,j.am.chem.soc.2014,136,1230;(f)s.ge,w.chaladj,j.f.hartwig,j.am.chem.soc.2014,136,4149;(g)c.guo,r.-w.wang,f.-l.qing,j.fluorine chem.2012,143,135.(h)y.-l.xiao,w.-h.guo,g.-z.he,q.pan,x.zhang,angew.chem.2014,126,10067;angew.chem.int.ed.2014,53,9909.),且这些方法仍然存在一些不足,例如:反应条件苛刻,催化剂昂贵,官能团兼容性不好,广谱性不好,尤其是对大范围的含n、o、s等杂环并不兼容。因此,探索一种高效简便、兼容多种类型含n、o、s等杂原子的芳环和杂芳环结构、催化剂廉价且用量低、反应条件温和的合成含二氟烷基取代的芳基/杂芳基化合物的方法具有非常重要的意义。
技术实现思路
1、本发明所要解决的技术问题是为了克服现有的含二氟烷基取代的芳基或杂芳基化合物的制备方法较为单一,而提供了一种含二氟烷基取代的芳基或杂芳基化合物、制备方法和应用。本发明的制备方法具有以下一个或多个优点:原料简单易得;反应步骤少;转化率和反应收率高;操作简单;催化剂廉价易得;成本低;官能团兼容性好;底物适用范围广;广谱性强;可避免使用剧毒性试剂;安全性高;具有良好的工业化应用前景。
2、本发明主要是通过以下技术方案解决上述技术问题。
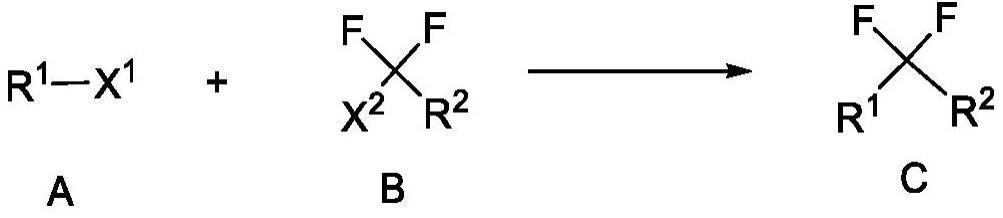
3、本发明提供了一种将与芳香碳原子连接的br或i原子转化为-cf2r2基团的方法,其包括如下步骤:将含有与芳香碳原子连接的br或i原子结构的底物与如式b所示的化合物在zn、含氮配体、ni催化剂和添加剂的存在下于有机溶剂中进行还原偶联反应;
4、
5、其中,r2为-c(o)nr2-1r2-2(例如-c(o)net2、)、-c(o)or2-3(例如-c(o)oet)或c1-6烷基,所述c1-6烷基为未取代的或者取代的(例如取代的c1-6烷基为-ch2otbs);
6、r2-3为c1-6烷基,所述c1-6烷基为未取代的或者取代的;
7、r2-1和r2-2各自独立地为c1-6烷基,所述c1-6烷基为未取代的或者取代的;
8、或者,r2-1和r2-2连同它们连接的氮原子一起形成5-10元杂环烷基(例如5-6元杂环烷基,例如),所述5-10元杂环烷基除r2-1和r2-2共同连接的氮原子外还可包含1或2个独立选自n、o或s的杂原子;
9、x2为cl或br。
10、在r2、r2-3、r2-1和r2-2的定义中,所述的取代是指被可以理解的不影响上述反应的常规基团所取代。在一些实施方案中,在r2、r2-3、r2-1和r2-2的定义中,所述的取代是指被1个或多个ra取代,每个ra独立地为c1-6烷基、c1-6烷氧基、c6-c14芳基、c6-c14芳基-c1-6烷基-、5-10元杂芳基、5-10元杂芳基-c1-6烷基-、-c(o)orb或-o-si(c1-6烷基)3;rb为c1-6烷基、c6-c14芳基、c6-c14芳基-c1-6烷基-、5-10元杂芳基或5-10元杂芳基-c1-6烷基-;所述杂芳基中的杂原子个数为1、2、3或4个,每个杂原子独立地为n、o或s;所述5-10元杂芳基例如为5-6元杂芳基,例如吡啶基。
11、在一些实施方案中,所述与芳香碳原子连接的br或i原子指与杂环芳香碳原子连接的br或i原子。
12、在一些实施方案中,x2为cl。
13、在一些实施方案中,r2为-c(o)net2、(例如)、-c(o)oet、-ch2otbs(tbs指叔丁基二甲基硅基)或(例如)。
14、在一些实施方案中,所述如式b所示的化合物为
15、在一些实施方案中,所述含有与芳香碳原子连接的br或i原子结构的底物为如式a所示的化合物;
16、r1-x1
17、a
18、其中,x1为br或i;
19、r1为c6-14碳环基或5-14元杂环基,r1中包含至少一个芳香碳原子,该芳香碳原子与x1连接;所述c6-14碳环基和5-14元杂环基中的1个或多个氢原子独立地任选被r1-1取代;
20、每个r1-1独立地为f、cl、c1-6烷基、卤代c1-6烷基、-or1-2、-s(o)2r1-2、-c(o)r1-2、-c(o)or1-2、醛基、羰基、氰基、氨基、c6-14碳环基或5-14元杂环基;所述c6-14碳环基和5-14元杂环基中的1个或多个氢原子独立地任选被r1-3取代;
21、每个r1-2独立地为c1-6烷基、卤代c1-6烷基、c6-14碳环基或5-14元杂环基;所述c6-14碳环基和5-14元杂环基中的1个或多个氢原子独立地任选被r1-3取代;
22、每个r1-3独立地为f、cl、c1-6烷基、卤代c1-6烷基、-or1-4、-s(o)2r1-4、-c(o)r1-4、-c(o)or1-4、醛基、羰基、氰基或氨基;
23、每个r1-4独立地为c1-6烷基或卤代c1-6烷基;
24、所述杂环基中的杂原子个数为1、2、3或4个,每个杂原子独立地为n、o或s。
25、在一些实施方案中,在r1-1、r1-2、r1-3、r1-4的定义中,所述卤代c1-6烷基中的卤素可以独立地为氟、氯、溴或碘。
26、在一些实施方案中,在r1-1、r1-2、r1-3、r1-4的定义中,所述卤代c1-6烷基可以为氟代c1-6烷基,例如三氟甲基。
27、在一些实施方案中,在r1-1、r1-2、r1-3、r1-4、r2、r2-1和r2-2的定义中,所述c1-6烷基在任一处出现时(包括卤代c1-6烷基中的c1-6烷基、-c(o)oc1-6烷基、-ch2si(c1-6烷基)3中的c1-6烷基)可以独立地为c1-4烷基,例如甲基、乙基、正丙基、异丁基、正丁基、异丁基、仲丁基或叔丁基。
28、在一些实施方案中,在r1-1、r1-2、r1-3、r1-4的定义中,所述卤代c1-6烷基在任一处出现时可以独立地为c1-4卤代烷基,例如c1-4氟代烷基,例如三氟甲基。
29、在一些实施方案中,在r1、r1-1、r1-2的定义中,所述碳环基在任一处出现时可以独立地为苯基、萘基、蒽基、菲基或芴基,例如苯基。
30、在一些实施方案中,在r1、r1-1、r1-2的定义中,所述杂环基在任一处出现时可以独立地为1、2或3个5-6元单环形成的稠环,所述5-6元单环独立地为苯环、5-6元杂芳环、(双键位置为与芳环或杂芳环形成并环的位置);例如,所述杂环基在任一处出现时可以独立地为5-6元杂芳环、苯并5-6元杂芳环、二苯并5-6元杂芳环、5-6元杂芳环并5-6元杂芳环、(例如)(例如)。5-6元杂芳环的非限制性实例包括但不限于噻吩、呋喃、吡咯、吡唑、咪唑、噻唑、噁唑、吡啶或嘧啶。
31、在一些实施方案中,r2-1和r2-2各自独立地为c1-6烷基;或者,r2-1和r2-2连同它们连接的氮原子一起形成5-6元杂环烷基,所述5-6元杂环烷基除r2-1和r2-2共同连接的氮原子外还可包含1个o原子。
32、在一些实施方案中,r1为苯基、噻吩基、吡啶基、嘧啶基、吲哚基、喹啉基、异喹啉基、上述基团中的1个或多个氢原子独立地任选被r1-1取代,r1-1的定义如本发明任一实施方案中所述。
33、在一些实施方案中,r1为苯基、上述基团中的1个或多个氢原子独立地任选被r1-1取代,r1-1的定义如本发明任一实施方案中所述。
34、在一些实施方案中,r1为
35、在一些实施方案中,每个r1-1独立地为f、cl、c1-6烷基、卤代c1-6烷基、-or1-2、-s(o)2r1-2、-c(o)r1-2、-c(o)or1-2、醛基、羰基、氰基、氨基、苯基、所述苯基、中的1个或多个氢原子独立地任选被r1-3取代。
36、在一些实施方案中,每个r1-1独立地为f、cl、甲基、三氟甲基、-ome、-oph、-s(o)2me、-s(o)2ph、-c(o)me、-c(o)oet、boc、醛基、羰基、氰基、氨基、苯基、
37、在一些实施方案中,每个r1-2独立地为c1-6烷基、卤代c1-6烷基或苯基,所述苯基中的1个或多个氢原子独立地任选被r1-3取代。
38、在一些实施方案中,每个r1-3独立地为f、cl、甲基、三氟甲基、-ome、-s(o)2me、-c(o)me、-c(o)ome、醛基、氰基或氨基。
39、在一些实施方案中,每个r1-4独立地为甲基或三氟甲基。
40、在一些实施方案中,x1为br。
41、在一些实施方案中,x1为i。
42、所述的有机溶剂可为本领域该类型还原偶联反应常规的溶剂,例如酰胺类溶剂、砜类溶剂、醚类溶剂和/或腈类溶剂中的一种或多种。酰胺类溶剂的实例包括但不限于n,n-二甲基甲酰胺、n-甲基吡咯烷酮、n,n-二甲基乙酰胺和1,3-二甲基-3,4,5,6-四氢-2-嘧啶酮中的一种或多种。砜类溶剂的实例包括但不限于二甲基亚砜。醚类溶剂的实例包括但不限于二氧六环。腈类溶剂的实例包括但不限于乙腈。所述的有机溶剂优选为酰胺类溶剂。所述的有机溶剂进一步优选为n,n-二甲基甲酰胺和/或n-甲基吡咯烷酮。所述的有机溶剂的用量可为本领域常规用量。
43、所述的含有与芳香碳原子连接的br或i原子结构的底物与如式b所示的化合物的用量关系可为本领域常规用量。在一些实施方案中,所述的含有与芳香碳原子连接的br或i原子结构的底物与如式b所示的化合物的摩尔比值可以为(1-5):1(例如(1.5-2.5):1)。
44、所述的含氮配体可为本领域该类型还原偶联反应的常规含氮配体。含氮配体的非限制性实例包括但不限于所述中的一个或多个氢原子独立地任选被r3取代,每个r3独立地为氨基、c1-c10烷基(例如叔丁基或正壬基)、c1-c10烷氧基(例如甲氧基)或卤代c1-c10烷基(例如氟代c1-c10烷基,例如三氟甲基)。当被取代时,取代的优选为在一些实施方案中,是未取代的。在一些实施方案中,所述的含氮配体优选为其中r3为正壬基。
45、所述的含氮配体与所述的如式b所示的化合物的摩尔比值可以为本领域常规,例如0.01-0.2(例如0.1)。
46、所述的ni催化剂可为本领域该类型还原偶联反应的常规ni催化剂,例如ni(ii)催化剂。ni催化剂的实例包括但不限于nicl2·dme(氯化镍(ii)乙二醇二甲基醚络合物)、nicl2、nil2、nibr2、ni(acac)2(乙酰丙酮镍(ii))、ni(otf)2(三氟甲磺酸镍(ii))、ni(no3)2·6h2o、ni(pph3)cl2、溴化镍(ii)二乙二醇二甲醚复合物(nibr2·diglyme)中的一种或多种。所述的ni催化剂优选为nicl2·dme(氯化镍(ii)乙二醇二甲基醚络合物)、nicl2、nil2、nibr2、ni(no3)2·6h2o、ni(pph3)cl2和溴化镍(ii)二乙二醇二甲醚复合物(nibr2·diglyme)中的一种或多种。所述的ni催化剂进一步优选为nicl2·dme(氯化镍(ii)乙二醇二甲基醚络合物)、nibr2、ni(pph3)cl2和溴化镍(ii)二乙二醇二甲醚复合物(nibr2·diglyme)中的一种或多种。在一些实施方案中,所述的ni催化剂优选为nicl2·dme(氯化镍(ii)乙二醇二甲基醚络合物)。
47、所述的ni催化剂与所述的如式b所示的化合物的摩尔比值可以为本领域常规比例,例如(0.01-0.2):1(例如0.1:1)。
48、所述还原偶联反应可以在不存在膦配体的条件下进行,也可以在膦配体存在的条件下进行。所述膦配体可以为本领域该类型还原偶联反应的常规膦配体。膦配体的实例包括但不限于中的一种或多种,其中n为1、2、3、4或5;每个r4、r5、r6、r7和r8各自独立地为c1-6烷基(例如正丁基或叔丁基)、c3-10环烷基(例如环己基或金刚烷基)、c6-10芳基(例如苯基)或5-10元氧杂芳基(例如呋喃基,例如呋喃-2-基),所述c3-10环烷基、c6-10芳基和5-10元氧杂芳基中的一个或多个氢原子独立地任选被r4-1取代;每个r4-1独立地为c1-6烷基(例如甲基)或c1-6烷氧基(例如甲氧基)。在一些实施方案中,n为4。在一些实施方案中,可以为
49、p(t-bu)2ph和中的一种或多种。在一些实施方案中,可以为在一些实施方案中,可以为在一些实施方案中,所述膦配体优选为在一些实施方案中,所述膦配体优选为其中r4、r5和r6各自独立地为c3-10环烷基或c6-10芳基,所述c6-10芳基中的一个或多个氢原子独立地任选被r4-1取代;每个r4-1独立地为c1-6烷基或c1-6烷氧基。在一些实施方案中,所述膦配体优选为
50、当所述还原偶联反应在膦配体的存在下进行时,所述的膦配体与所述的如式b所示的化合物的摩尔比值可以为本领域常规比例,例如(0.01-0.5):1(例如0.2:1)。
51、所述添加剂可为本领域该类型还原偶联反应的常规盐添加剂。添加剂的实例包括但不限于lif、licl、libr、lii、naf、nacl、nabr、nai、kf、kcl、kbr、ki、mgf2、mgcl2、mgbr2、mgi2、alf3、alcl3、albr3、ali3、n(c1-6烷基)4f、n(c1-6烷基)4cl、n(c1-6烷基)4br和n(c1-6烷基)4i中的一种或多种。在一些实施方案中,n(c1-6烷基)4f、n(c1-6烷基)4cl、n(c1-6烷基)4br和n(c1-6烷基)4i中的c1-6烷基为正丁基。在一些实施方案中,所述添加剂可以为lif、licl、nai、ki、mgcl2、alcl3和n(c1-6烷基)4i中的一种或多种。在一些实施方案中,所述添加剂优选为lif、licl、nai、ki、mgcl2和n(c1-6烷基)4i中的一种或多种。在一些实施方案中,所述添加剂优选为lif、licl、nai、ki和n(c1-6烷基)4i中的一种或多种。在一些实施方案中,所述添加剂优选为licl。
52、所述的添加剂与所述的如式b所示的化合物的摩尔比值可以为本领域常规比例,例如(1-2):1(例如1.5:1)。
53、所述的制备方法中,所述的还原偶联反应的进程可以采用本领域中的常规检测方法(例如tlc、hplc或nmr)进行监控,一般以如式b所示的化合物不再反应作为反应的终点。在一些实施方案中,所述的还原偶联反应的时间可以为1-48小时,例如8-12小时。
54、本发明还提供了如式c所示的化合物:
55、
56、其中,r1和r2的定义均同上所述。
57、在一些实施方案中,所述的如式c所示的化合物为下列任一化合物:
58、
59、
60、本发明还提供了如式c所示的化合物的制备方法,其包括如下步骤:将如式a所示的化合物与如式b所示的化合物在zn、含氮配体、ni催化剂和添加剂的存在下于有机溶剂中进行还原偶联反应,得到所述如式c所示的化合物;
61、
62、其中,r1、x1、x2、r2的定义均同上所述。
63、所述如式c所示的化合物的制备方法中,还原偶联反应的条件均可以如上所述。
64、本发明还提供了所述的如式c所示的化合物作为羰基的生物电子等排体在制备医药、农药或医用材料中的应用。例如以下文献所报道的情况:(a)j.o.link,j.g.taylor,l.xu,m.mitchell,h.guo,h.liu,d.kato,t.kirschberg,j.sun,n.squires,j.parrish,t.keller,z.-y.yang,c.yang,m.matles,y.wang,k.wang,g.cheng,y.tian,e.mogalian,e.mondou,m.cornpropst,j.perry,m.c.desai,j.med.chem.2014,57,2033;(b)jr.t.r.burke,k.lee,acc.chem.res.2003,36,426;(c)z.-y.zhang,acc.chem.res.2003,36,385;(d)f.xue,h.li,s.l.delker,j.fang,p.martasek,l.j.roaman,t.l.poulos,r.b.silverman,j.am.chem.soc.2010,132,14229;(e)m.o.anderson,j.zhang,y.liu,c.yao,p.-w.phuan,a.s.verkman,j.med.chem.2012,55,5942;(h)h.eto,y.kaneko,t.sakamoto,chem.pharm.bull.2000,48,982。
65、本文中的术语卤素是指氟、氯、溴或碘。
66、本文中的术语烷基指直链或支链的饱和的烃基。c1-10烷基包括c1、c2、c3、c4、c5、c6、c7、c8、c9、c10烷基;同理,c1-6烷基包括c1、c2、c3、c4、c5、c6烷基,c1-4烷基包括c1、c2、c3、c4烷基。烷基的实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基。
67、本文中的术语烷氧基指-o-烷基,其中烷基的定义如前所述。c1-c10烷氧基包括c1、c2、c3、c4、c5、c6、c7、c8、c9、c10烷氧基;同理,c1-6烷氧基包括c1、c2、c3、c4、c5、c6烷氧基,c1-4烷氧基包括c1、c2、c3、c4烷氧基。烷氧基的实例包括但不限于甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基或叔丁氧基。
68、本文中的术语卤代烷基是指烷基中的一个或多个氢原子被卤素所取代所形成的基团,烷基和卤素的定义如前所述。卤代c1-10烷基包括卤代c1、c2、c3、c4、c5、c6、c7、c8、c9、c10烷基;同理,卤代c1-6烷基包括卤代c1、c2、c3、c4、c5、c6烷基,卤代c1-4烷基包括卤代c1、c2、c3、c4烷基。当烷基的一个氢原子被卤素所取代时,卤代可以是氟代、氯代、溴代或碘代。当烷基的多个氢原子被卤素所取代时,每个卤素独立地选自氟、氯、溴和碘,卤代也可以是氟氯代、氟溴代等。卤代烷基的实例包括但不限于三氟甲基。
69、本文中的术语碳环基是指由碳原子形成的环状基团。其可以是单环或多环(例如二环和三环),可以是并环、螺环和桥环结构。碳环基所含的每个单环可以是饱和的、部分不饱和的或芳香性的。碳环基的实例包括但不限于苯基、萘基、蒽基、菲基、芴基。
70、本文中的术语环烷基是指饱和的碳环基,即成环的碳原子均是饱和的。环烷基可以是单环或多环(例如二环和三环),可以是并环、螺环和桥环结构。c3-10环烷基包括c3、c4、c5、c6、c7、c8、c9、c10环烷基。环烷基的实例包括但不限于环丙基、环丁基、环戊基、环己基、金刚烷基。
71、本文中的术语芳基是指由碳原子形成的芳香性的环状基团。其可以是单环或多环(例如二环和三环)。芳基的实例包括但不限于苯基、萘基、蒽基、菲基、芴基。
72、本文中的术语杂环基是指由碳原子和选自n、o和s的杂原子形成的环状基团。杂环基可以是单环或多环(例如二环和三环),可以是并环、螺环和桥环结构。杂环基所含的每个单环可以是饱和的、部分不饱和的或芳香性的。5-14元杂环基包括5、6、7、8、9、10、11、12、13、14元杂环烷基。
73、本文中的术语杂环烷基是指由碳原子和选自n、o和s的杂原子形成的饱和的环状基团。杂环烷基可以是单环或多环(例如二环和三环),可以是并环、螺环和桥环结构。5-10元杂环烷基包括5、6、7、8、9、10元杂环烷基。
74、本文中的术语杂芳基是指由碳原子和选自n、o和s的杂原子形成的芳香性的环状基团。杂芳基可以是单环或多环(例如二环和三环)。氧杂芳基指包含o作为杂原子,而不包含n和s杂原子的杂芳基。杂芳基的实例包括但不限于噻吩基、呋喃基、吡咯基、吡唑基、咪唑基、噻唑基、噁唑基、吡啶基或嘧啶基。
75、本文中的术语杂芳环是指由碳原子和选自n、o和s的杂原子形成的芳香性的环状基团。杂芳环可以是单环或多环。5-6元杂芳环的实例包括但不限于噻吩、呋喃、吡咯、吡唑、咪唑、噻唑、噁唑、吡啶或嘧啶。
76、术语“取代”或“取代基”是指一个或多个氢原子被指定的基团所代替。当没有指明取代位置时,取代可以在任何位置,但是只有形成一个稳定的或者是化学意义上可行的化合物才是被允许的。
77、本文所述“1个或多个氢原子”在任一处出现时可以独立地为1、2、3、4或5个氢原子。
78、当任何变量(例如r)在化合物的组成或结构中出现一次以上时,其在每一种情况下的定义都是独立的。因此,例如,如果一个基团被0-2个r所取代,则所述基团可以任选地至多被两个r所取代,并且每种情况下的r都有独立的选项。此外,取代基和/或其变体的组合只有在这样的组合会产生稳定的化合物的情况下才是被允许的。
79、在不违背本领域常识的基础上,上述各优选条件可任意组合,即得本发明各较佳实例。
80、本发明中,所述的室温指环境温度为10℃-35℃。
81、本发明所用试剂和原料均市售可得。
82、本发明的优势:提供了一种含二氟烷基取代的芳基或杂芳基化合物、制备方法和应用。本发明的制备方法原料具有以下一个或多个优点:简单易得;反应步骤少;转化率和反应收率高;操作简单;催化剂廉价易得;成本低;官能团兼容性好;底物适用范围广;广谱性强;可避免使用剧毒性试剂;安全性高;具有良好的工业化应用前景。
- 还没有人留言评论。精彩留言会获得点赞!