暗纹东方鲀肠上皮细胞分离培养及应激模型建立的方法
1.本发明属于水产养殖领域,尤其涉及一种暗纹东方鲀肠上皮细胞分离培养及应激模型建立的方法。
背景技术:
2.暗纹东方鲀(takifugu fasciatus)是一种溯河洄游型鱼类,大部分时间在海洋中度过,其适宜生长温度范围为23-32℃,为我国长江三鲜之一,主要分布在中国近海区域及长江中下游。近年来暗纹东方鲀在中国的养殖规模也在逐渐扩大。根据《中国渔业统计年鉴》记录,2020年中国淡水养殖河鲀量超2.6万吨,其中,暗纹东方鲀的养殖量较大。鱼类的肠道是重要的渗透、酸碱调节器官,鱼体的消化能力和吸收功能依靠着肠道健康。而暗纹东方鲀养殖规模扩大的过程中,重金属、化学药品使用、外源性饲料的持续投喂等导致养殖水体污染问题日益加重,已经严重威胁到暗纹东方鲀的肠道健康,如出现炎症、肠壁变薄、肠道弹性、肠道寄生虫等问题,一旦肠道出现以上问题,肠道的消化吸收能力变弱,将严重限制饲料价值的发挥,无形中拉高了养殖成本降低了养殖效益。
3.原代肠上皮细胞体外培养为研究肠上皮细胞增殖、分化、凋亡,营养物质吸收利用及转化提供了准确的手段,能够探讨营养物质对肠上皮细胞营养作用机制、重金属及其它有毒有害物质对肠道损伤与肠道修复机制、筛选有益鱼类肠道健康的功能性饲料的理想模型。并且暗纹东方鲀具有最小脊椎动物基因组,却拥有与人相近的基因数目,已作为模式生物应用于基础医学研究领域。但目前河豚肠道上皮细胞培养未突破,已知的公开专利如一种维持鱼类肠细胞增殖分化的原代培养方法(cn201110348822.5)、一种鱼类肠道上皮细胞的分离方法(cn201510893962.9)等不能解决河豚肠道的上皮细胞培养。
4.随着我国养殖业的飞速发展,鱼类应激反应问题也愈发严重,大量研究表明,鱼类应激会引发多种疾病,影响养殖业的健康发展。在鱼类养殖过程中,环境变化可能导致鱼类产生氧化应激,而长时间的氧化应激状态下,鱼类体内产生大量活性氧,降低鱼类生长性能,损伤免疫系统,进而引起疾病和死亡。肠黏膜屏障通过肠上皮细胞感受,是机体应激状态下易受到氧化损伤的器官。当前水产动物中没有很好的肠道细胞层面的应激模型,通过肠上皮细胞应激模型的建立能够成为研究鱼类细胞氧化应激损伤机制的有效方法之一。
技术实现要素:
5.发明目的:本发明的目的在于提供一种暗纹东方鲀肠上皮细胞分离培养及应激模型建立的方法,为暗纹东方鲀肠道健康的研究提供基础材料,同时为暗纹东方鲀应用于发育生物学、免疫学、毒理与环境检测等方面的研究提供有力的研究材料。
6.技术方案:本发明的暗纹东方鲀肠上皮细胞分离培养及应激模型建立的方法,包括以下步骤:
7.步骤1、将暗纹东方鲀幼鱼在盐水中养殖7-10d,期间投喂含新霉素和氨苄青霉素饲料,幼鱼取样前禁食;
8.步骤2、幼鱼取样麻醉后无菌解剖摘取中段肠道,置于自配的清洗液中,去除肠系膜,纵向剪开肠道,刮去内容物,用自配的清洗液清洗2-3遍,放入无菌离心管中剪成体积为0.5~0.8mm3肠组织块;
9.步骤3、向肠组织块中加入0.5~1ml胶原酶ⅳ消化液,金属浴消化,每隔5~10min取出吹打一次,加入提前配好28℃预温过的完全培养基终止消化,100目筛网过滤后于1000rpm,低温离心后向沉淀中加适量完全培养基,用移液枪反复轻轻吹打混匀,补足完全培养基后进行培养;
10.步骤4、培养后吸除培养基,添加含皮质醇的完全培养基刺激肠上皮细胞24h建立氧化应激模型。
11.进一步地,步骤1中,所述暗纹东方鲀幼鱼,体长为5
±
0.5cm。
12.进一步地,步骤1中,期间投喂的饲料中含新霉素和氨苄青霉素浓度为10~20u/kg和15~20u/kg,两者比例关系为2~4:3~4。
13.进一步地,步骤1中,所述盐水浓度为8-10ppt,禁食时间为24-28h。
14.进一步地,步骤2中,采用弯头镊子刮去内容物,无菌离心管的容量为1.5ml,所述pbs含1~2%青霉素链霉素,所述自配清洗液的配方如下:
[0015][0016][0017]
上述清洗液经微孔滤膜过滤除菌,即得。
[0018]
进一步地,步骤3中,所述胶原酶ⅳ消化液质量浓度为0.25~0.3%;消化条件为28℃金属浴消化25~30min;完全培养基成分为dmem+胎牛血清+暗纹东方鲀血清,三者比例关系为15~16:2~4:1~2,每100ml培养液中加入400-500μl双抗溶液,双抗溶液包括青霉素100units/ml、链霉素100μg/ml。
[0019]
进一步地,步骤3中,所述低温离心为4℃离心5-6min。
[0020]
进一步地,步骤3中,所述培养为28-30℃、4-6%co2,进行培养72h。
[0021]
进一步地,步骤4中,所述皮质醇浓度为80~120nmol/l,能够引起肠上皮细胞氧化应激,且此时的肠上皮细胞密度为1*107以上、存活率为90%以上。
[0022]
有益效果:与现有技术相比,本发明具有如下显著优点:
[0023]
1、投喂暗纹东方鲀含有10~20u/kg新霉素和15~20u/kg氨苄青霉素,两者比例关系为2~4:3~4的饲料能有效抑制肠上皮细胞污染,且不会对细胞造成损伤。
[0024]
2、采用自配的清洗液对暗纹东方鲀中段肠道进行清洗,可有效去除肠道污染物、
抑制细菌污染,提高细胞存活率。
[0025]
3、配制含dmem+胎牛血清+暗纹东方鲀血清,三者比例关系为15~16:2~4:1~2比例的完全培养基可以为肠上皮细胞提供足够的营养成分,良好适应生长环境,且细胞可快速稳定贴壁。
[0026]
4、本发明建立了暗纹东方鲀肠上皮细胞应激模型,能够成为研究鱼类肠细胞氧化应激损伤机制的有效材料。
附图说明
[0027]
图1:消化处理后暗纹东方鲀原代肠上皮细胞(400
×
);
[0028]
图2:72h培养后暗纹东方鲀原代肠上皮细胞(100
×
);
[0029]
图3:皮质醇处理对暗纹东方鲀原代肠上皮细胞存活及氧化应激的影响(cck法);
[0030]
图4:原代肠上皮细胞在皮质醇处理下的应激状态(400
×
);
[0031]
图5:原代肠上皮细胞在皮质醇处理下的氧化应激相关基因相对表达量;
[0032]
图6:本发明实施例得到的原代肠上皮细胞活力数据。
具体实施方式
[0033]
下面结合附图对本发明的技术方案作进一步说明。
[0034]
实施例1
[0035]
1、暗纹东方鲀肠上皮细胞分离培养:
[0036]
(1)选取暗纹东方鲀幼鱼,体长为5
±
0.5cm,取肠组织前将暗纹东方鲀养殖在10ppt盐水中7d以上,期间投喂含10u/kg新霉素和20u/kg氨苄青霉素饲料,幼鱼取样前禁食24h。
[0037]
(2)麻醉后无菌解剖摘取中段肠道,置于自配的清洗液中,去除肠系膜,纵向剪开肠道,用弯头镊子刮去内容物,用自配的清洗液清洗两遍。放入1.5ml无菌离心管中剪成体积为0.5~0.8mm3组织块。所用自配的清洗液配方为:na2hpo4:1.42g;k2hpo4:0.24g;nacl:10g;kcl:0.3g;维生素c:1g;d-葡萄糖:1g;青霉素链霉素:1ml;超纯水定容至1l,微孔滤膜过滤除菌,即得;
[0038]
(3)肠组织加入1ml浓度为0.25%胶原酶ⅳ消化液,28℃金属浴消化25min(每隔5~10min取出吹打一次),加入提前配好28℃预温过的完全培养基终止消化,100目筛网过滤后于1000rpm、4℃、离心5min。向沉淀中加适量完全培养基,用移液枪反复轻轻吹打混匀,补足完全培养基,28℃、5%co2,进行培养。于倒置显微镜下观察细胞见图1。所用完全培养基的配方为:dmem+胎牛血清+暗纹东方鲀血清:15:4:1,每100ml培养液中加入500μl双抗溶液(青霉素100units/ml、链霉素100μg/ml)。
[0039]
(4)48h后,吸除原培养液,加入新配的完全培养液,继续扩大培养。
[0040]
(5)72h后,于倒置显微镜下观察细胞见图2。图中可见,72h培养后的暗纹东方鲀原代肠上皮细胞生长状态良好,细胞形态发生改变,稳定贴壁。肠上皮细胞活力达90%以上(图6),均已达到细胞培养要求,实验证明本发明方法切实可行。
[0041]
2、应激模型的建立:
[0042]
(1)在以上基础上,原代肠上皮细胞培养6组,分别添加含0nmol/l、100nmol/l、
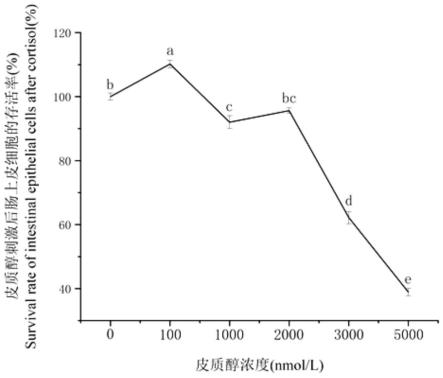
1000nmol/l、2000nmol/l、3000nmol/l、5000nmol/l皮质醇的完全培养基刺激肠上皮细胞24h,cck法测得皮质醇浓度为100nmol/l时细胞存活率与空白对照比提高10%(图3);
[0043]
(2)选取100nmol/l皮质醇刺激肠上皮细胞24h建立氧化应激模型,于倒置显微镜下观察细胞见图4,图中所见的暗纹东方鲀肠上皮细胞形态良好;荧光定量pcr技术检测暗纹东方鲀100nmol/l皮质醇刺激四个时间点(3h、6h、12h、24h)氧化应激相关基因sod、cat和gsh-px在原代肠上皮细胞中的相对表达量均呈现上调的趋势(图5),结果表明100nmol/l的皮质醇刺激肠上皮细胞24h能够引起氧化应激且细胞仍能够正常生长。
[0044]
荧光定量pcr反应程序如下:
[0045][0046]
荧光定量pcr引物如下,其中18s rna为内参基因:
[0047][0048]
作为案例1的补充说明,在基本实验操作相同的基础上,选择不同的实验参数进行了两组实验,分别为(a)选取80nmol/l皮质醇刺激肠上皮细胞24h建立氧化应激模型;(b)选取120nmol/l皮质醇刺激肠上皮细胞24h建立氧化应激模型;结果与实施例1基本相同,皮质醇刺激肠上皮细胞24h后均能引起细胞氧化应激,且细胞生长状态良好,cck法测得肠上皮细胞存活率达95%以上,证明选取范围可靠。
[0049]
实施例2
[0050]
实施例2与实施例1(暗纹东方鲀肠上皮细胞分离培养)基本相同,不同之处仅在于:
[0051]
投喂的饲料含20u/kg新霉素和15u/kg氨苄青霉素;
[0052]
所用自配的清洗液中,配方为:na2hpo4:1.42g;k2hpo4:0.24g;nacl:8g;kcl:0.2g;维生素c:1g;d-葡萄糖:1g;青霉素链霉素:0.5ml;超纯水定容至1l,微孔滤膜过滤除菌,即
得。
[0053]
所用完全培养基的配方为:dmem+胎牛血清+暗纹东方鲀血清:16:2:2,每100ml培养液中加入400μl双抗溶液(青霉素100units/ml、链霉素100μg/ml)。
[0054]
结果经过显微观察,并且进行cck法测细胞活力(如图6所示),结果与实施例1基本相同,证明选取范围可靠。
[0055]
实施例3
[0056]
实施例3与实施例1(暗纹东方鲀肠上皮细胞分离培养)基本相同,不同之处仅在于清洗液的不同,如下:
[0057]
麻醉后无菌解剖摘取中段暗纹东方鲀肠道,置于pbs中清洗,去除肠系膜,纵向剪开肠道,用弯头镊子刮去内容物,用pbs清洗两遍。放入1.5ml无菌离心管中剪成体积为0.5~0.8mm3组织块。
[0058]
结果显示细胞存活率明显降低(如图6所示),对比实施例1,说明自配的清洗液能有效提高细胞活力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1