靶向实体肿瘤细胞B7-H3蛋白的CAR载体、CAR-T细胞及其构建方法和应用与流程
靶向实体肿瘤细胞b7-h3蛋白的car载体、car-t细胞及其构建方法和应用
技术领域
1.本发明属于生物医药领域,涉及免疫细胞技术,具体涉及一种靶向实体肿瘤细胞b7-h3蛋白的car载体、car-t细胞及其构建方法和应用。
背景技术:
2.在目前的全球癌症发病率中,90%为实体肿瘤,如黑色素瘤、乳腺癌、前列腺癌、卵巢癌、胰腺癌、结直肠癌等癌症,现阶段实体肿瘤的治疗方法包括外科手术治疗、化学治疗、放射治疗、免疫治疗、及多种治疗方法联合治疗等,且随着近年来基础科学研究的不断发展,免疫治疗因其独特的疗效和多癌种适应性,逐渐成为重要的实体肿瘤辅助治疗方法。
3.鉴于免疫系统的复杂性,肿瘤免疫治疗涵盖了多种作用机制和药物形式,例如:lak细胞、dc、cik细胞都曾作为肿瘤的免疫治疗手段,但是上述细胞缺乏特异性识别肿瘤相关抗原(tumor associated antigen,taa)和杀伤特定肿瘤靶细胞的能力,且在肿瘤免疫编辑过程会使靶细胞表面的主要组织相容性复合物(main histocompatibility complex,mhc)在肿瘤细胞表面表达下降形成免疫逃逸(即肿瘤细胞成功躲避t细胞的攻击),使得lak细胞、dc、cik细胞等慢慢被淘汰。
4.再例如:嵌合抗原受体(car)-t细胞疗法是通过基因工程技术在t细胞表面人为过表达,其在血液系统恶性肿瘤治疗方面具有重大突破,其能够识别特定的肿瘤表面抗原的单链抗体可变区基因片段,从而使t细胞可以识别特定抗原,进而杀伤表达该抗原的靶细胞,同时由于car-t细胞是采用抗体识别抗原的模式而不受mhc的限制,许多学者尝试将car-t技术用于实体肿瘤的治疗,但是由于实体肿瘤的特殊性,car-t免疫疗法在治疗实体肿瘤的疗效与治疗血液恶性肿瘤疗效相差甚远,因此如何避免肿瘤免疫逃逸的发生,并且增强t淋巴细胞对肿瘤细胞的杀伤,从而提高car-t免疫疗法对实体肿瘤细胞的治疗效果,仍然是car-t治疗亟待解决的问题。
5.随着基础科学研究的不断发展,从人树突细胞(dc)来源的cdna文库克隆获得的b7-h3蛋白,经研究它由316个氨基酸组成,其在氨基端有一信号肽,包括细胞外的免疫球蛋白样可变区(igv)、恒定区(igc)、跨膜区和45个氨基酸的胞浆区,且其在氨基酸序列上与b7家族的其他成员在细胞外区域有一定的同源性。将研究发现,b7-h3蛋白在肝、肺、膀胱、睾丸、前列腺、乳房、胎盘、淋巴样组织等器官中均有表达,b7-h3蛋白与上述器官中的肿瘤的发生、发展密切相关,并在实体瘤中呈广谱且过度表达。其b7-h3蛋白可以作为实体瘤靶向治疗的位点,为实体肿瘤的治疗提供了全新的治疗思路,但是目前针对实体肿瘤细胞的b7-h3蛋白靶点的car-t的研究还较少,而如何构建特异性的car结构是此治疗方法成功的关键。
技术实现要素:
6.为了使靶向b7-h3蛋白的car-t细胞既能识别b7-h3阳性表达的实体肿瘤细胞,又
可以增强t淋巴细胞的杀伤能力,从而提高car-t免疫疗法抗肿瘤细胞的效果,本发明公开了一种靶向实体肿瘤细胞b7-h3蛋白的car载体、car-t细胞及其构建方法和应用。
7.实现发明目的的技术方案如下:第一方面,本发明提供了一种car载体,包括嵌合抗原受体及连接嵌合抗原受体的载体,嵌合抗原受体包括引导肽sp、b7-h3单链抗体、跨膜区tm、共刺激结构域cd28-4-1bb、信号转导域cd3ζ。
8.其中,b7-h3单链抗体包括重链可变区vh、轻链可变区vl、柔性linker,柔性linker用于连接重链可变区vh和轻链可变区vl。
9.在car载体的一个实施例中,上述重链可变区vh的核苷酸序列参见seq id no.2、seq id no.3、seq id no.4中任意一种所示,轻链可变区vl的核苷酸序列参见seq id no.5、seq id no.6、seq id no.7中任意一种所示。
10.本发明通过设计car载体,首先,对car载体的b7-h3单链抗体进行设计,其是根据b7-h3蛋白在实体肿瘤组织中高表达,从而将其作为靶点设计的特异性结构,其既可靶向性结合实体肿瘤细胞,又可赋予t细胞新的抗原特异性,能够有效避免肿瘤细胞mhc表达下调的免疫逃逸机制;其次,对共刺激结构域进行设计,将cd28和4-1bb共同应用作为car载体的共刺激结构域cd28-4-1bb,其能够使得下述形成的car-t细胞具有很高的转导效率,可以实现在使用低效靶比即可在短时间内快速杀伤肿瘤细胞的目的。
11.在car载体的一个实施例中,上述引导肽sp的核苷酸序列参见seq id no.1中所示;跨膜区tm的核苷酸序列参见seq id no.8中所示;共刺激结构域cd28-4-1bb中,cd28的核苷酸序列参见seq id no.9中所示,4-1bb核苷酸序列参见seq id no.10中所示;信号转导域cd3ζ的核苷酸序列参见seq id no.11中所示。
12.进一步的,上述柔性linker的氨基酸序列为ggggsggggsggggs。
13.在car载体的另一个实施例中,上述载体为慢病毒载体。
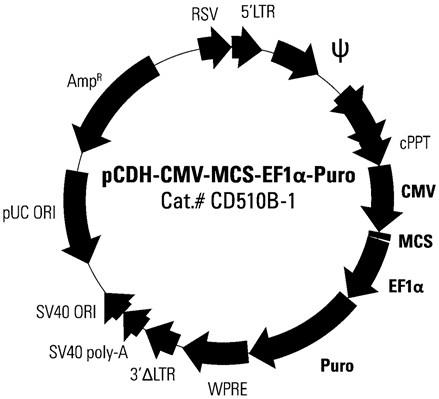
14.进一步的,上述慢病毒载体为pcdh-cmv-mcs-ef1-puro。
15.在car载体的一个改进实施例中,上述靶向实体肿瘤细胞的b7-h3表达蛋白的car载体的制备方法,包括以下步骤:将编码有嵌合抗原受体的基因保存在puc19质粒上;对保存有嵌合抗原受体的puc19质粒进行酶切,分离后获得含嵌合抗原受体的目标片段;对载体进行酶切,分离后获得酶切载体;将含嵌合抗原受体的目标片段与酶切载体连接、转化、提取后获得重组质粒,即car载体。
16.进一步的,上述酶切可以采用单酶切方法进行酶切,也可以采用双酶切进行酶切,为了提高酶切效率,本发明择优选择采用双酶切对保存有嵌合抗原受体的puc19质粒和载体进行酶切,且酶切的位点为ecori和noti。
17.进一步的,上述将含嵌合抗原受体的目标片段与酶切载体连接时,目标片段与酶切载体的摩尔比择优选择为5:1。
18.第二方面,本发明提供了一种car-t细胞,用于靶向实体肿瘤细胞的b7-h3表达蛋白,包括t淋巴细胞,且t淋巴细胞上结合有第一方面中所述的car载体。
19.本发明设计的car-t细胞,是将t淋巴细胞与第一方面设计的car载体结合形成的,其能够靶向性识别并杀伤实体肿瘤细胞,避免因肿瘤细胞mhc表达下调而造成的免疫逃逸的问题。
20.第三方面,本发明提供了一种car-t细胞的构建方法,对第二方面的靶向实体肿瘤细胞的b7-h3表达蛋白的car-t细进行构建,包括以下步骤:将car载体包装成慢病毒;对慢病毒进行离心、浓缩处理,获得慢病毒悬液;用慢病毒悬液感染t淋巴细胞,得到car-t细胞。
21.在car-t细胞的构建方法的一个实施例中,上述慢病毒包装方法为:以pspax2质粒、pmd2g质粒、car载体为三质粒包装系统,以293t细胞为包装细胞,将car载体包装成慢病毒。
22.进一步的,上述三质粒包装系统中,pspax2质粒、pmd2g质粒、car载体三者的摩尔比择优选择为27:3:20。
23.在car-t细胞的构建方法的一个实施例中,上述t淋巴细胞为从pbmc(peripheral blood mononuclear cell,又称外周血单个核细胞)中分离获得。
24.在car-t细胞的构建方法的一个实施例中,当获得car-t细胞后,还需要对car-t细胞进行抗体结合抗原的检测,即采用流式细胞术的方法,使用b7-h3蛋白对car-t细胞进行感染阳性筛选。
25.第四方面,本发明提供了一种car-t细胞的应用,car-t细胞用于靶向实体肿瘤细胞的b7-h3表达蛋白,实体肿瘤细胞包括黑色素瘤、乳腺癌、前列腺癌、卵巢癌、胰腺癌、结直肠癌、胃癌、食管癌、肝癌、骨肉瘤、子宫内膜癌、口腔鳞状细胞癌、宫颈癌、肺癌、膀胱癌、透明细胞肾细胞癌、胶质瘤中任意一种。
26.与现有技术相比,本发明的有益效果是:1.本发明通过根据b7-h3蛋白在实体肿瘤组织中高表达,从而将其作为靶点设计的特异性结构的b7-h3单链抗体,其既可靶向性结合实体肿瘤细胞,当car载体与t细胞结合时,可以赋予t细胞新的抗原特异性,能够有效避免肿瘤细胞mhc表达下调的免疫逃逸机制。
27.2.对car载体的共刺激结构域进行设计,将cd28和4-1bb共同应用作为car载体的共刺激结构域cd28-4-1bb,其能够使得下述形成的car-t细胞具有很高的转导效率,可以实现在使用低效靶比即可在短时间内快速杀伤肿瘤细胞的目的。
28.3.本发明设计的car-t细胞可以靶向各种实体肿瘤细胞(如黑色素瘤、乳腺癌、前列腺癌、卵巢癌、胰腺癌、结直肠癌、胃癌、食管癌、肝癌、骨肉瘤、子宫内膜癌、口腔鳞状细胞癌、宫颈癌、肺癌、膀胱癌、透明细胞肾细胞癌、胶质瘤等)的b7-h3蛋白,避免因肿瘤细胞mhc表达下调而造成的免疫逃逸的问题。
附图说明
29.为了更清楚地说明本发明实施例技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是本发明为了更清楚地说明本发明实施例或现有技术中的技术方案,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
30.图1为实施例1中car载体的嵌合抗原受体的结构的示意图;图2为实施例1中car载体的pcdh-cmv-mcs-ef1-puro结构的慢病毒载体的示意图;图3为实施例2中car载体的制备流程图;图4为实施例4中靶向实体肿瘤细胞的b7-h3表达蛋白的car-t细胞的构建方法流程图;图5为具体实施方式中b7-h3在实体肿瘤细胞系胃癌hgc27、骨肉瘤hos、卵巢癌skov3和结直肠癌hct116上的高表达示意图;图6为具体实施方式中car-t细胞的阳性率检测结果图;图7为具体实施方式中car-t细胞在rtca监测平台上对实体肿瘤细胞系卵巢癌skov3和骨肉瘤hos的杀伤作用效果图;图8为car-t细胞对实体肿瘤细胞系卵巢癌skov3和骨肉瘤hos的杀伤作用效果图;图9为具体实施方式中b7-h3 car-t细胞对骨肉瘤pdx动物模型的药效作用效果图。
具体实施方式
31.下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
32.在本实施例的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“上”、“下”、
ꢀ“
前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明创造和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明创造的限制。
33.此外,术语“第一”、“第二”、“第三”等仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”等的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明创造的描述中,除非另有说明,“多个”的含义是两个或两个以上。
34.实施例1:本实施例提供了一种car载体,包括嵌合抗原受体及连接嵌合抗原受体的载体,嵌合抗原受体包括引导肽sp、b7-h3单链抗体、跨膜区tm、共刺激结构域cd28-4-1bb、信号转导域cd3ζ。其中,b7-h3单链抗体包括重链可变区vh、轻链可变区vl、柔性linker,柔性linker用于连接重链可变区vh和轻链可变区vl,即如图1所示,嵌合抗原受体的结构组成为sp-b7-h3scfv-tm-cd28-4-1bb-cd3ζ。
35.在car载体的b7-h3单链抗体的一个实施例中,上述重链可变区vh的核苷酸序列参见seq id no.2、seq id no.3、seq id no.4中任意一种所示,轻链可变区vl的核苷酸序列参见seq id no.5、seq id no.6、seq id no.7中任意一种所示;柔性linker可以选择现有通用的氨基酸序列,也可以选择为ggggsggggsggggs组成的氨基酸序列。例如,b7-h3单链抗体可以由如seq id no.2 、seq id no.5所示的核苷酸序列、以及柔性linker构成;也可以
由如seq id no.3 、seq id no.7所示的核苷酸序列、以及柔性linker构成,也可以采用其他组合方式形成。b7-h3单链抗体用于表达针对实体肿瘤细胞表面的肿瘤相关抗原b7-h3蛋白的抗体anti-b7-h3,anti-b7-h3负责识别实体肿瘤细胞中高表达的b7-h3蛋白,能够大大增加car-t细胞的靶向性,降低肿瘤免疫逃逸在car载体的嵌合抗原受体的一个实施例中,上述引导肽sp可表达引导新合成的蛋白质进行跨膜转移,其核苷酸序列参见seq id no.1中所示;跨膜区tm是用来连接胞外抗原结合域和胞内信号域,将car结构锚定于t细胞膜上,其核苷酸序列参见seq id no.8中所示;共刺激结构域cd28-4-1bb是用来转导增殖信号并诱导细胞因子产生、刺激t细胞活化的,其cd28的核苷酸序列参见seq id no.9中所示,4-1bb核苷酸序列参见seq id no.10中所示;信号转导域cd3ζ是当胞外区和目标抗原结合时,向胞内传导tcr样信号,激活t细胞的,其核苷酸序列参见seq id no.11中所示。嵌合抗原受体能够赋予t细胞更强的增殖性,持久的生命力,使其表现出更强的肿瘤细胞杀伤能力在car载体的载体的一个实施例中,上述载体为慢病毒载体,上述慢病毒载体择优选择为pcdh-cmv-mcs-ef1-puro,参见图2所示。通过snap gene软件分析该慢病毒载体及现有相关文献可知,pcdh-cmv-mcs-ef1-puro结构的慢病毒载体内可以用ecori与noti双酶切后插入含有嵌合抗原受体的目标基因片段,其中该表达载体包括:cmv启动子、多克隆位点(mcs)、wpre元件、sv40 polya序列、杂交型rsv / 5’ltr、遗传要素、sv40 origin,cmv启动子(即哺乳动物细胞特异性启动子),其具有较强的驱动能力;多克隆位点(mcs),包含多个限制性酶切位点(restriction site),是外源基因插入的位置;wpre元件,可以提高mrna的polya加尾效率,改进转移基因的表达效率;sv40 polya序列,能有效终止转录以及为转录的mrna添加polya尾;杂交型rsv / 5’ltr,其含有启动子和增强子等调控元件,使其在293t细胞中高水平的表达全长病毒转录物;遗传要素(cppt,gag,env,ltrs),其用于包装、转导和稳定地将病毒表达结构整合到宿主的基因组dna中;sv40 origin,其用于使质粒在包装细胞中稳定增殖。该慢病毒载体可作为使含有嵌合抗原受体的目标基因片段在几乎所有哺乳动物细胞包括非分裂细胞和分裂细胞中表达的最有效载体,其可容载外源基因片段大,转染效率较高,对t细胞也能达到满意的转染效果。
36.本实施例通过设计car载体,b7-h3单链抗体是根据b7-h3蛋白在实体肿瘤组织中高表达,从而将其作为靶点设计的特异性结构,其既可靶向性结合实体肿瘤细胞,又可赋予t细胞新的抗原特异性,能够有效避免肿瘤细胞mhc表达下调的免疫逃逸机制;共刺激结构域cd28-4-1bb是将cd28和4-1bb共同应用作为car载体的共刺激结构域cd28-4-1bb,其相对于现有方式中只使用cd28或4-1bb作为共刺激结构域,具有能够提高car-t细胞转导效率,可以实现在使用低效靶比即可在短时间内快速杀伤肿瘤细胞的目的。
37.实施例2:本实施例提供了对实施例1中car载体的制备方法,car载体用于靶向实体肿瘤细胞的b7-h3表达蛋白。
38.如图3所示,car载体的制备方法包括以下步骤:s1、将编码有嵌合抗原受体的基因保存在puc19质粒上。
39.在本步骤中,将结构为sp-b7-h3scfv-tm-cd28-4-1bb-cd3ζ的嵌合抗原受体,在puc19质粒上以质粒形式保存。
40.s2、对保存有嵌合抗原受体的puc19质粒进行酶切,分离后获得含嵌合抗原受体的目标片段。
41.在本步骤中,在制备car载体时,通过酶切方式将保存在puc19质粒上的嵌合抗原受体分离,形成目标片段。具体的,酶切可以采用单酶切方法进行酶切,也可以采用双酶切进行酶切,为了提高酶切效率,本发明择优选择采用双酶切对保存有嵌合抗原受体的puc19质粒和载体进行酶切,且酶切的位点为ecori和noti。
42.s3、对载体进行酶切,分离后获得酶切载体。
43.在本步骤中,载体选用结构为pcdh-cmv-mcs-ef1-puro的慢病毒载体,同时需要对慢病毒载体进行酶切,以便于形成能够连接步骤s2中含嵌合抗原受体的目标片段的酶切载体。具体的,为了步骤s4中确保酶切载体与含嵌合抗原受体的目标片段的连接,载体的酶切方法与步骤s2中保存有嵌合抗原受体的puc19质粒的酶切方式相同。
44.s4、将含嵌合抗原受体的目标片段与酶切载体连接、转化、提取后获得重组质粒,即car载体。
45.本步骤中,将含嵌合抗原受体的目标片段与酶切载体连接时,目标片段与酶切载体的摩尔比择优选择为5:1。
46.实施例3:本实施例提供了一种car-t细胞,用于靶向实体肿瘤细胞的b7-h3表达蛋白,包括t淋巴细胞,且t淋巴细胞上结合有实施例1和实施例2中所述的car载体。
47.本发明设计的car-t细胞,是将t淋巴细胞与第一方面设计的car载体结合形成的,其能够靶向性识别并杀伤实体肿瘤细胞,避免因肿瘤细胞mhc表达下调而造成的免疫逃逸的问题。
48.实施例4:本实施例提供了实施例3中car-t细胞的构建方法,即对靶向实体肿瘤细胞的b7-h3表达蛋白的car-t细胞进行构建。
49.如图4所示,靶向实体肿瘤细胞的b7-h3表达蛋白的car-t细胞的构建方法,包括以下步骤:s5、将car载体包装成慢病毒。
50.在本步骤中,慢病毒包装方法为:以pspax2质粒、pmd2g质粒、car载体为三质粒包装系统,以293t细胞为包装细胞,将car载体包装成慢病毒。进一步的,上述三质粒包装系统中,pspax2质粒、pmd2g质粒、car载体三者的摩尔比择优选择为27:3:20。
51.s6、对慢病毒进行离心、浓缩处理,获得慢病毒悬液;s7、用慢病毒悬液感染t淋巴细胞,得到car-t细胞。
52.在本步骤中,t淋巴细胞为从pbmc(peripheral blood mononuclear cell,又称外周血单个核细胞)中分离获得。
53.在car-t细胞的构建方法的一个实施例中,当获得car-t细胞后,还包括步骤s8、对car-t细胞进行抗体结合抗原的检测,即采用流式细胞术的方法,使用b7-h3蛋白对car-t细胞进行感染阳性筛选。
54.本实施例构建的car-t细胞用于靶向实体肿瘤细胞的b7-h3表达蛋白,其中,实体肿瘤细胞包括黑色素瘤、乳腺癌、前列腺癌、卵巢癌、胰腺癌、结直肠癌、胃癌、食管癌、肝癌、
骨肉瘤、子宫内膜癌、口腔鳞状细胞癌、宫颈癌、肺癌、膀胱癌、透明细胞肾细胞癌、胶质瘤中任意一种。
55.以下对靶向实体肿瘤细胞b7-h3蛋白的car载体的制备方法,car-t细胞的构建方法及应用进行详细的说明。
56.1.实验材料:1.1慢病毒载体pcdh-cmv-mcs-ef1-puro,慢病毒包装质粒pmd2g,载体质粒 pspax2购自sbi;慢病毒表达质粒pcdh-cmv-mcs-ef1-puro结构如图1所示。
57.1.2.嵌合抗原受体(sp-b7-h3scfv-tm-cd28-4-1bb-cd3ζ)以puc19质粒形式保存;1.3.对编码有嵌合抗原受体的基因保存在puc19质粒和结构为pcdh-cmv-mcs-ef1-puro的慢病毒载体进行双酶切的限制性核酸内切酶ecori、noti购自neb。
58.1.4.t4 dna ligase、free h2o购自宝生物;1.5.感受态细胞购自trans;1.6.胶回收试剂盒,质粒小提试剂盒购自天根生化科技有限公司;1.7.293t细胞、skov3细胞购自中科院细胞库;1.8.fbs、dmem、1640培养基、pbs、opti-mem、lipofectamine 2000购自gibco;1.9.cd3单抗、cd28单抗、ch38蛋白、il-2购自于上海近岸蛋白质科技有限公司;1.10.multiskan go酶标仪+udrop超微量板、流式细胞仪购自thermofisher;1.11.he120水平电泳槽、tanon凝胶成像仪购自tanon;1.12.隔水式恒温培养箱、恒温培养摇床购自上海一恒科技有限公司;1.13.bio-rad mini-protean tetra cell小型电泳系统购自bio-rad;1.14.奥林巴斯显微镜购自奥林巴斯;1.15.接种环、涂布棒购自洁特生物过滤股份有限公司;1.16.注射器,0.45μm滤膜、各规格的培养皿、培养瓶、多孔培养板、各种规格离心管购自corning。
59.2.靶向实体肿瘤细胞的特异性高表达蛋白b7-h3的car载体制备2.1,获取结构为pcdh-cmv-mcs-ef1-puro的慢病毒载体和保存有嵌合抗原受体的puc19质粒。
60.2.2分别对结构为pcdh-cmv-mcs-ef1-puro的慢病毒载体和保存有嵌合抗原受体的puc19质粒进行酶切、连接、转化:将pcdh-cmv-mcs-ef1-puro的慢病毒载体和保存有嵌合抗原受体的puc19质粒和保存有嵌合抗原受体的puc19质粒分别进行ecori、noti双酶切,将酶切产物分别进行琼脂糖凝胶电泳,用凝胶成像仪观察并记录结果。用琼脂糖凝胶回收试剂盒对目的条带回收,将含嵌合抗原受体的目标片段与酶切载体以5:1的摩尔比进行连接,并进行转化至感受态细胞,将转化后的感受态细胞滴于预热的固体培养基上,做好标记,37℃孵箱过夜。
61.2.3对car载体进行酶切验证、测序:挑取部分菌落于5ml的lb液体培养基(amp抗性)中,在恒温摇床进行增菌培养并进行质粒抽提,质粒抽提之前取出500μl在1.5ml的ep管中用作菌种保存,储存于-80℃;将抽提产物采用ecori、noti双酶切验证,取条带正确的质粒1μg进行测序,条带异常的质粒以及留存的菌液均丢弃;将测序结果正确的质粒进行抽提,测序结果错误的质粒及其菌液均丢弃。
62.3.靶向实体肿瘤细胞的特异性高表达蛋白b7-h3的car-t细胞的构建3.1将2中制备的car载体包装成慢病毒:采用三质粒包装系统进行慢病毒包装,其中三质粒分别为含有car载体、pmd2g质粒、pspax2质粒,用293t细胞作为包装细胞进行包装。
63.具体实施步骤如下:3.1.1染前24h内进行铺板,一般选择传代次数在3代以内的细胞,根据细胞生长密度和状态调整细胞密度,生长密度达到80%的293t细胞进行铺板;3.1.2待生长密度达60-90%,细胞状态良好,即可进行病毒包装;3.1.3按照pspax2质粒、pmd2g质粒、car载体(即重组质粒)的比例为27:3:20(即3μg的car载体、 0.5μg的pmd2g质粒、4μg的pspax2 质粒)进行病毒包装,以6cm皿为例。
64.3.1.4转染试剂选择lipofectamine 2000(4℃保存),加入量为2μl/μg质粒;3.1.5将3.1.3中的质粒混合物与3.1.4中转染试剂混合物混于一管中,室温静止20min后,加入换液细胞中,继续培养;3.1.6分别收集48h、72h后培养上清,通过0.45μm滤膜过滤;3.1.7将收集的病毒液采用peg8000浓缩法进行浓缩,并测定病毒滴度,储存于﹣80℃备用。
65.3.2 t淋巴细胞的慢病毒感染3.2.1获取t淋巴细胞:用含有肝素的真空采血管收集约6ml外周新鲜血液,获得pbmc:室温下向3.2.1中加入等体积的pbs,轻轻吹打混匀稀释;取50ml离心管,吸取6ml ficoll(淋巴细胞分离液)于离心管中(ficoll与稀释前血液的体积比为1:1),离心管倾斜45
°
,将稀释后的血液在ficoll液面上方约1cm处沿管壁缓慢加至ficoll上面;离心:18-20℃,2000rpm,30min,离心后从管底至液面分四层,依次为红细胞和粒细胞层、分层液层、单个核细胞层、血浆层;回收:将移液管直接插入云雾层(或者先吸去上层的血浆),轻轻吸出云雾层,放入新的离心管中;洗涤:加入至少于pbmc(外周血单个核细胞)体积3倍的pbs,18-20℃,2000rpm,10min,两次;细胞计数:弃上清,加1ml淋巴细胞培养基,吹打混匀,制备成pbmc细胞悬液。采用血细胞计数板计数:取一滴pbmc悬液与一滴2%台盼蓝染液混匀后加于血细胞计数板中,在显微镜下计数4大格内细胞总数。细胞数/ml=4个大方格细胞总数/4
×
104×
2(稀释倍数)。
66.3.2.2、t细胞的激活与慢病毒感染:3.2.2.1实验前准备:anti-cd3单抗液配制:cd3单抗50μg溶于5mlpbs溶液中,配制成浓度为10μg/ml的溶液,溶解后按照每ep管400μl进行分装,并置于-80℃冰箱保存;(此浓度下每24孔板内加入175μl抗体溶液);anti-cd28单抗液配制:cd28单抗50μg溶于5mlpbs溶液中,配制成浓度为10μg/ml的溶液,溶解后按照每ep管400μl进行分装,并置于-80℃冰箱保存;(此浓度下每24孔板内加入175μl抗体溶液);ch-38蛋白液配制:ch38蛋白500μg溶于10ml pbs溶液中,配制成50μg/ml溶液,溶解后按照每ep管400μl进行分装,并置于-80℃冰箱保存;(此浓度下每24孔板内加入175μl抗体溶液);il-2因子配制:il-2蛋白固体按1
×
107u/mg进行配制,每50μg il-2蛋白加入500μl的pbs溶液,配制成103u/μl的浓度,配制后按照每ep中加入32μl进行分装,并置于-80℃冰箱保存;淋巴细胞培养基配制:takara
‑ꢀ
551h3淋巴细胞培养基每50ml加入30μl已分装的il-2溶液,0.5ml双抗,250μl自体血清。
67.3.2.2.2实验流程:day0:24孔板包被:取corning 24孔板,以2孔为例,在2孔中各加入cd3单抗液175μl,cd28单抗液175μl,ch-38蛋白液175μl。加入后轻震荡混匀后,用封口膜将孔板封闭,放入4℃冰箱内过夜;细胞复苏:取液氮中的pbmc细胞,复苏;day1:清洗包被板:取出昨日包被的24孔板,弃去上清,pbs清洗2次后,加入pbs待用;pbmc铺板:收集pbmc细胞,计数并将浓度最终调整到0.7
×
106cells/ml,每孔中加入400μl细胞悬液,即每孔中加入2.8
×
105个cells;病毒感染:以moi=30进行感染,配制1ml病毒培养基悬液,加入24孔板中,1000g离心30min,将离心机温度调节至32℃;day1-day2:观察细胞状态;day3:将24孔板中的所有细胞转移至加入10ml培养基的25cm2培养瓶中,观察细胞状态;day4-day7:观察细胞状态以及细胞数量,若细胞开始明显扩增,并局部区域细胞密度较多,加入10ml培养基;day8:此时25cm2培养瓶中的细胞已经长满,转移到加入20ml培养基的75cm2培养瓶中继续培养;day9-day10:观察细胞状态,当细胞在75cm2培养瓶中处于充满状态时,停止继续生长,富集细胞并计算扩增比例,流式检测检测细胞分型,进行细胞杀伤检测或细胞冻存等后续实验。
68.4.car-t细胞的鉴定与检测4.1流式细胞术检测car结构阳性表达率4.1.1检测细胞cd3、cd4、cd8、ccr7、cd45ra阳性率:将取得的nc组细胞(未进行病毒感染)和样本组细胞(已进行病毒感染)使用pbs+2%bsa温和洗涤2次,离心条件为1500rpm、3min;nc管中加入1000μl pbs+2%bsa,分装成5管,分别为nc、nc-cd3、nc-cd4、nc-cd8、nc-cd3/4/8,样本管中加入200μl pbs,标记为样本-cd3/4/8,分别加入cd3/4/8抗体5μl/20μl/20μl,温和混匀;室温避光孵育30min后,1500rpm,3min,弃去废液;加入200μl pbs+2%bsa,温和混匀重悬,1500rpm/3min,弃去废液;加入100μl pbs+2%bsa,温和混匀重悬后即可上机检测;4.1.2检测car结构阳性表达率:将取得的nc组细胞(未进行病毒感染)和样本组细胞(已进行病毒感染),使用pbs+2%bsa温和洗涤2次,1500rpm/6min,弃去废液;nc管中加入200μl pbs,重悬;样本管中加入100μl pbs,重悬,再加入100μl一抗工作液(3μg/ml),混匀;室温孵育1h,1500rpm/3min,弃去废液;加入200μlpbs,温和混匀重悬,1500rpm/3min,弃去废液;nc管中加入200μl pbs,重悬;样本管中加入200μl pbs,重悬,再加入5μl二抗工作液,混匀;室温避光孵育1h后,1500rpm/3min,弃去废液,使用pbs+2%bsa温和洗涤3次,离心条件为1500rpm、3min,弃去废液;加入100μl pbs,温和混匀重悬后上机检测(图5、6)。
[0069] 4.2 car-t细胞对实体肿瘤细胞的杀伤检测:以实体肿瘤细胞卵巢癌skov3和骨肉瘤hos为例,消化后制备成细胞悬液,吹打混匀后进行细胞计数;将细胞悬液稀释成5
×
10
4 cells/ml浓度,放置在冰上备用;将rtca检测板取出,加入50μl培养基;在rtca检测仪程
序中编选本次试验的试验程序;将rtca检测板置入检测仪中,观测程序中messege项是否正常,待正常后启动实验程序;程序1运行完毕后取出检测板,在对应孔中加入肿瘤细胞悬液100μl,加入之前混匀每管细胞悬液;细胞悬液加入后,将检测板置入培养箱中静置30min,使细胞自然沉降;30min后,将检测板放入检测仪中,运行程序2;24h后观察细胞生长曲线,待细胞处于对数生长期时,准备加入效应t细胞;培养瓶中取出效应t细胞,离心,清洗,计数,按不同效靶比配制效应组细胞浓度;暂停程序,取出检测板,对应位置加入效应细胞50μl,放回检测仪中,继续程序,每天观察。
[0070]
4.3 elisa检测细胞因子分泌:用ddh2o稀释10
×
包被液buffer,按比例配制250
×
包被蛋白,例如2ml包被液buffer中加入8 μl 250
×
包被蛋白;向corning 9018 elisa高亲和96孔板中加入100μl/孔1)中配制完成的包被液,密封放入4℃冰箱中,过夜;使用pbst(0.05%tween 20)对已包被的96孔板进行清洗,3次;用ddh2o配制5
×
封闭液,200μl/孔加入,室温下封闭1h;按瓶装标准品要求加入1
×
封闭液进行配制,进行7次倍比稀释,同时对样品(取rtca检测实验中的car-t细胞对skov3和hos杀伤24h后的上清液)进行5倍稀释;pbst清洗封闭后的板子5次,加入标准品和稀释后的样品液,室温孵育2h或4℃过夜;pbst清洗4次;使用1
×
封闭液稀释250
×
检测抗体,100μl/孔中加入,室温孵育1h;pbst清洗4次,使用1
×
封闭液稀释250
×
hrp,100μl/孔中加入,室温孵育30min;pbst清洗5次,每孔中加入1
×
tmb试剂100μl,室温孵育15min;加入50 μl/孔 终止液终止显色;酶标仪450nm检测od值。
[0071]
通过以下示例对上述car-t细胞靶向实体肿瘤细胞的b7-h3表达蛋白的作用进行说明:示例1:使用人源化b7-h3抗体采用流式细胞术检测实体肿瘤细胞系上b7-h3阳性率,参见图5所示,b7-h3蛋白在实体肿瘤细胞中呈高表达。
[0072]
示例2:使用b7-h3蛋白采用流式细胞术检测car-t细胞的阳性率,参见图6所示,car-t细胞的阳性率可达到60%以上。
[0073]
示例3:在rtca监测平台上测试car-t细胞对实体肿瘤细胞的杀伤作用:使用car-t细胞对卵巢癌skov3细胞与骨肉瘤hos细胞进行杀伤,采用rtca监测平台进行实时监测,参见图7所示,car-t细胞在不同效靶比情况下对卵巢癌skov3细胞与骨肉瘤hos细胞均进行有效的杀伤。
[0074]
示例4:测试car-t细胞对实体肿瘤细胞杀伤作用:使用car-t细胞对卵巢癌skov3细胞与骨肉瘤hos细胞杀伤24h后,对tnf-α和ifn-γ因子的elisa进行检测,如图8所示,在对卵巢癌skov3细胞实验中,当效靶比5:1和2.5:1的情况下,car-t细胞组的细胞因子tnf-α和ifn-γ释放均比nc-t对照组的高;在对骨肉瘤hos细胞实验中,当效靶比1:1和2.5:1的情况下,car-t细胞组的细胞因子tnf-α和ifn-γ释放均比nc-t对照组的高。
[0075]
示例8:检测car-t细胞对骨肉瘤pdx动物模型的药效作用:参见图9所示,构建骨肉瘤pdx动物模型并设置对照组,将不同剂量的car-t细胞经尾静脉注射到骨肉瘤pdx动物模型体内,定时测定动物模型与动物模型内肿瘤体积,以评价car-t细胞对骨肉瘤pdx动物模型的药效作用。
[0076]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
[0077]
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包
含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1