抗狂犬病病毒单克隆抗体及分泌该抗体的杂交瘤细胞株与应用
1.本发明属于细胞工程与免疫学技术领域,具体涉及一种抗狂犬病病毒单克隆抗体及分泌该抗体的杂交瘤细胞株与应用。
背景技术:
2.狂犬病是一种由狂犬病病毒(rabies virus,rv)感染引起的人兽共患的急性高度致死性传染性疾病,人和几乎所有温血动物均对狂犬病病毒易感,一旦发病几乎100%死亡,至今仍无特效治疗药物。全球每年约5.9万人因狂犬病死亡,大多数病例发生在发展中国家。近年来狂犬病疫情逐年回升,严重危害全民健康,是世界共同关注的重要公共卫生问题。
3.狂犬病病毒属弹状病毒科(rhabdoviridae)狂犬病毒属(lyssa virus),为单股负链rna病毒。狂犬病病毒基因组含有5 个开放阅读架(orf),分别编码5种结构蛋白,依次为核蛋白、磷蛋白、膜基质蛋白、糖蛋白和转录酶大蛋白。目前认为糖蛋白是唯一能持续诱导病毒产生中和抗体的狂犬病病毒抗原,也是研究最为广泛且深入的的抗原成分。磷蛋白是一种多功能蛋白,其在病毒逃逸、病毒转录复制以及细胞内运动中均发挥着一定的作用。研究表明磷蛋白上存在丰富有效的抗原表位,越来越多的研究者也不断证实着磷蛋白作为病毒感染的临床血清检测抗原或者超抗原的可能性。近来有报道,狂犬病病毒的核蛋白和磷蛋白抗原也能诱导产生特异性的免疫应答反应。因此,狂犬病病毒的抗原成分在参与机体对狂犬病病毒的免疫应答中均发挥了不可缺少的作用。
4.抗狂犬病病毒单克隆抗体是研究狂犬病病毒诊断方法、治疗及预防狂犬病的有利工具。自1978年wiktor和koprowski 首次制备了狂犬病病毒的单克隆抗体以来,越来越多的实验室建立了狂犬病病毒的单抗杂交株,并探讨了单抗在狂犬病病毒的免疫保护机制、新型疫苗的研制、流行病学、蛋白功能以及狂犬病病毒感染诊断等方面的应用价值。针对不同抗原表位的狂犬病抗体的研究也是狂犬病抗体研究的主要方向之一。单克隆抗体因其具有高度的同质性和特异性等常规免疫血清无法比拟的优点,成为了检测病原和抗体的最佳生物探针,并在病毒血清学鉴定及诊断治疗方面得到了广泛应用。
5.目前,疫苗接种是预防、控制和消灭狂犬病的唯一方法。狂犬病疫苗的安全性、有效性和质量稳定性是该制品保护免疫效果的关键因素。抗原含量作为评价狂犬病疫苗质量的主要指标之一,所以在狂犬病疫苗的研制和生产过程中,建立一套简便、快速、特异和灵敏的狂犬病病毒抗原检测方法就显得尤为重要,不仅可以代替费时费力的动物实验,大大地提高工作效率,可以及时对疫苗制备过程中各步骤的抗原含量进行快速定量检测,适合于病毒收获、浓缩、灭活、纯化工艺等各阶段的监测和控制,从而建立内控标准,以指导生产和质控,确保批次间的一致性与稳定性。因此通过简便的监测方法对疫苗中抗原含量进行定量监测对于预防本病的流行和制定科学的免疫程序具有重要意义。
技术实现要素:
6.本发明的目的是为了解决现有技术的不足,针对目前狂犬病依然严重危害全民健康,且防治过程中依然存在各种困难的现状,而提供一种能与狂犬病病毒磷蛋白/糖蛋白特异性结合的单克隆抗体以及产生该抗体的杂交瘤细胞的制备方法。本发明的单克隆抗体与狂犬病病毒的其他蛋白以及其他抗原和病原体无交叉反应,具有高特异性、高敏感性的特点,可以建立一种新型、方便、实用的检测方法,定量检测狂犬病毒疫苗中的抗原成分的含量,用于疫苗研发与生产过程中病毒含量的及时监测,具有良好的应用前景。
7.为实现上述目的,本发明采用的技术方案如下:
8.本发明第一方面提供抗狂犬病毒磷蛋白/糖蛋白单克隆抗体杂交瘤细胞株的制备方法,包括如下步骤:
9.步骤(1),免疫原的制备:以纯化的狂犬病毒为免疫原;
10.步骤(2),动物免疫:取6~8周龄balb/c小鼠,以2周间隔进行四次免疫,程序为:首次免疫,弗氏完全佐剂与等量免疫原充分混合乳化后,背部皮下多点注射;第二次免疫和第三次免疫,佐剂换为弗氏不完全佐剂,方法和剂量同首次免疫;第四次采用腹腔注射未加佐剂的免疫原,注射量同首次免疫;3天后,取免疫小鼠脾脏细胞用于制备杂交瘤细胞;
11.步骤(3),杂交瘤细胞株的制备和筛选:将处于对数生长期的sp2/0细胞与步骤(2)免疫小鼠脾脏细胞通过peg4000 的作用下进行细胞融合,利用1
×
hat选择性培养基培养融合后的杂交瘤细胞,细胞融合后10-14天,通过酶联免疫吸附试验检测细胞上清以筛选能特异性分泌抗狂犬病毒磷蛋白/糖蛋白单克隆抗体的杂交瘤细胞株。
12.进一步,优选的是,步骤(2)中,首次免疫注射量为200ul 106ffu/ml;
13.步骤(3)中,将处于对数生长期的sp2/0细胞与步骤(2)免疫小鼠脾脏细胞通过peg4000的作用下进行细胞融合,利用1
×
hat选择性培养基培养融合后的杂交瘤细胞,具体方法为:
14.选择6~8周龄balb/c小鼠,取其腹腔巨噬细胞制备饲养层细胞;取处于对数生长期的sp2/0细胞与步骤(2)免疫小鼠脾脏细胞按照1∶10的细胞数量比例进行混和,采用聚乙二醇4000进行细胞融合,细胞融合后获得的杂交瘤细胞加入已含有饲养层细胞的培养板中,使用含有1
×
hat选择性培养基,在37℃、5%co2条件下培养;
15.还包括杂交瘤细胞的克隆化,具体是:通过有限稀释法对杂交瘤细胞株进行亚克隆培养,连续培养多次,直至克隆孔内抗体检测100%阳性为止,扩大培养并冻存。
16.本发明第二方面提供一种由上述杂交瘤细胞分泌的抗狂犬病毒磷蛋白/糖蛋白单克隆抗体。
17.本发明第三方面提供一种抗狂犬病毒磷蛋白/糖蛋白单克隆抗体,包括重链可变区和轻链可变区,所述抗磷蛋白单克隆抗体的轻链可变区的氨基酸序列如seq id no.1所示,重链可变区的氨基酸序列如seq id no.2所示;所述抗糖蛋白单克隆抗体的轻链可变区的氨基酸序列如seq id no.5所示,重链可变区的氨基酸序列如seq id no.6所示。
18.本发明第四方面提供一种抗狂犬病毒磷蛋白/糖蛋白单克隆抗体的编码dna,包括重链可变区和轻链可变区;所述抗磷蛋白单克隆抗体轻链可变区的编码dna序列如seq id no.3所示,重链可变区的编码dna序列如seq id no.4所示;所述抗糖蛋白单克隆抗体轻链可变区的编码dna序列如seq id no.7所示,重链可变区的编码dna序列如seq id no.8所
示。
19.本发明第五方面提供一种狂犬病毒的双抗体夹心抗原检测试剂盒,采用上述抗狂犬病毒磷蛋白/糖蛋白单克隆抗体,以抗狂犬病毒磷蛋白单克隆抗体作为包被抗体,以酶标记的抗狂犬病毒糖蛋白单克隆抗体作为检测抗体,或者,其是以抗狂犬病毒糖蛋白单克隆抗体作为包被抗体,以酶标记的单克隆抗体磷蛋白单克隆抗体作为检测抗体。
20.进一步,优选的是,所述的酶为辣根过氧化物酶或碱性磷酸酶。
21.本发明第六方面提供上述抗狂犬病毒磷蛋白/糖蛋白单克隆抗体在制备狂犬病毒疫苗抗原含量检测试剂或试剂盒、狂犬病毒检测试剂或试剂盒、狂犬病毒抗体检测试剂或试剂盒中的应用。
22.本发明第七方面提供上述抗狂犬病毒磷蛋白/糖蛋白单克隆抗体在制备狂犬病毒疫苗生产产品质量检测试剂或试剂盒中的应用。
23.本发明第八方面提供上述抗狂犬病毒磷蛋白/糖蛋白单克隆抗体在制备预防或治疗狂犬病药物中的应用。
24.本发明试剂盒中,单克隆抗体可以为经生物标记或化学标记得到的标记复合物。所述的生物标记为酶标记,所述的酶为辣根过氧化物酶或碱性磷酸酶。
25.本发明提供的能够识别狂犬病毒磷蛋白的单克隆抗体和识别狂犬病毒糖蛋白的单克隆抗体,具有良好的特异性。各克隆间识别蛋白和识别位点都没有交叉反应,间接elisa表明这两个抗体具有较高的灵敏度,因此可用于狂犬病病毒及疫苗中抗原的检测。此外,由于两种单克隆抗体分别识别狂犬病病毒不同蛋白上的不同抗原决定簇。因此,可以采用双抗夹心法分别利用特异识别的两个单克隆抗体对狂犬病病毒抗原进行及时定量检测。
26.基于此构建的双抗体夹心elisa法表现出良好的灵敏度和特异性,可以用于疫苗生产过程中各阶段狂犬病病毒抗原的及时监测,并作为内控标准指导狂犬病毒疫苗制备方法、工艺的筛选、确定及优化。
27.在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
28.本发明所用试剂和原料均市售可得。
29.本发明中,抗狂犬病毒磷蛋白/糖蛋白单克隆抗体杂交瘤细胞株为抗狂犬病毒磷蛋白单克隆抗体和抗狂犬病毒糖蛋白单克隆抗体的两株杂交瘤细胞株。
30.本发明与现有技术相比,其有益效果为:
31.基于本发明提供的抗狂犬病毒单克隆抗体分别识别狂犬病病毒不同蛋白上的不同抗原决定簇,包括狂犬病毒磷蛋白和狂犬病毒糖蛋白,从而拓展了针对不同抗原表位的狂犬病单克隆抗体在狂犬病的诊断、预防及治疗方面应用的可能性,从而为狂犬病毒的检测定量方法的建立及不同蛋白功能的研究奠定坚实的基础。
32.目前基于双抗体的狂犬病毒检测试剂盒仅限于狂犬病毒核蛋白和糖蛋白,而基于磷蛋白单克隆抗体的狂犬病毒抗体检测试剂盒鲜见报道。一种杂交瘤细胞株及其产生的狂犬病毒磷蛋白单克隆抗体(201611157550.x)公开了筛选到一种杂交瘤细胞株产生的狂犬病毒磷蛋白单克隆抗体并应用于制备狂犬病毒检测试剂,检测灵敏度可达0.1iu/ml。本发明提供的能够识别狂犬病毒磷蛋白的单克隆抗体和识别狂犬病毒糖蛋白的单克隆抗体都具有良好的特异性,与狂犬病毒其他蛋白以及其他抗原和病原体无交叉反应,用于检测具
有高特异性和灵敏性的优点,因此建立了一种快速定量检测狂犬病病毒抗原含量的双抗夹心法,并极大提高了狂犬病病毒双抗体夹心elisa抗原检测方法的灵敏度(0.02iu/ml),这对于狂犬病毒疫苗研发与生产过程中的质控和病毒含量的及时监测显得尤为重要,在疫苗和临床检测中将会得到广泛应用,对于狂犬病的检测及防控都具有重要的指导意义。
附图说明
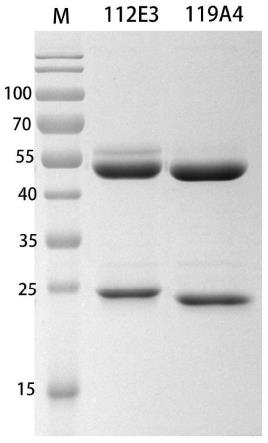
33.图1为抗狂犬病毒单克隆抗体的sds-page电泳图,其中,m是蛋白分子量标准(kda),泳道1为抗狂犬病毒磷蛋白单克隆抗体112e3,泳道2为抗狂犬病毒糖蛋白单克隆抗体119a4;
34.图2为抗狂犬病毒磷蛋白单克隆抗体112e3的western blot结果图,其中,m是蛋白分子量标准(kda),泳道1为rv g 蛋白,泳道2为狂犬病毒;
35.图3为抗狂犬病毒糖蛋白单克隆抗体119a4的western blot结果图,其中,m是蛋白分子量标准(kda);a为多抗pab 对照,b为抗狂犬病毒糖蛋白单克隆抗体119a4;
36.图4为抗狂犬病毒单克隆抗体的蛋白识别定位结果图;a为狂犬病毒糖蛋白多肽扫描,b为狂犬病毒磷蛋白多肽扫描;
37.图5为抗狂犬病毒磷蛋白单克隆抗体112e3的轻链-重链可变区pcr凝胶电泳图,其中,a为轻链可变区,b为重链可变区;m是蛋白分子量标准(kda),泳道1为112e3的轻链pcr产物1,泳道2为112e3的轻链pcr产物2;
38.图6为抗狂犬病毒糖蛋白单克隆抗体119a4的轻链-重链可变区pcr凝胶电泳图,其中,a为轻链可变区,b为重链可变区;m是蛋白分子量标准(kda),泳道1为119a4的轻链pcr产物1,泳道2为119a4的轻链pcr产物2;
39.图7为本发明建立的双抗体夹心elisa方法的抗原检测特异性;
40.图8为本发明建立的双抗体夹心elisa方法线性试验和灵敏度结果,a图为双抗体夹心elisa方法线性试验,横坐标为疫苗的效价(iu/ml),纵坐标为不同效价疫苗对应的od450值;b图为灵敏度结果,人血清白蛋白(hsa)作为检测基线,样品rv-1、rv-2和rv-3是不同批次的病毒收获液,通过梯度稀释最终稀释度达2-7
,对应的稀释参考疫苗作为定量标准来定量抗原含量;虚线为检测阈值(cutoff p/n》2.1)。
具体实施方式
41.下面结合实施例对本发明作进一步的详细描述。
42.本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用材料或设备未注明生产厂商者,均为可以通过购买获得的常规产品。
43.本发明除非另有说明,否则百分号代表体积百分数,比例代表体积比。
[0044]1×
hat选择性培养基:50
×
hat(购买自sigma)、20%(v/v)胎牛血清(购买自biological industries)、1640培养基(购买自 corning)、1%(v/v)双抗(青霉素-链霉素溶液);
[0045]1×
ht完全培养基:(50
×
ht(购买自sigma)、20%(v/v)胎牛血清(购买自
biological industries)、1640培养基(购买自corning)、 1%(v/v)双抗(青霉素-链霉素溶液);
[0046]
普通完全培养基:20%(v/v)胎牛血清(购买自biological industries)、1640培养基(购买自corning)、1%(v/v)双抗(青霉素
ꢀ‑
链霉素溶液)。
[0047]
实施例1抗狂犬病毒单克隆抗体杂交瘤细胞株的建立
[0048]
1、免疫原制备:以纯化的狂犬病毒(狂犬病毒ctn细胞毒株)为免疫原;
[0049]
2、动物免疫:取6~8周龄balb/c小鼠,以2周间隔进行四次免疫,程序为:首次免疫注射量为200ul 106ffu/ml,弗氏完全佐剂与等量免疫原充分混合乳化后,背部皮下多点注射;第二次免疫和第三次免疫,佐剂换为弗氏不完全佐剂,方法和剂量同首次免疫;第四次采用腹腔注射未加佐剂的免疫原,注射量同首次免疫;3天后,取免疫小鼠脾脏细胞用于制备杂交瘤细胞;
[0050]
3、杂交瘤细胞株的制备:具体是:细胞融合前2天,取免疫小鼠脾脏细胞用于制备杂交瘤细胞。选择6~8周龄balb/c 小鼠,取其腹腔巨噬细胞制备饲养层细胞,使细胞浓度为105个/ml,加入96孔板,每孔100μl,置于37℃、5%co2条件下培养备用。取处于对数生长期的sp2/0细胞(购自atcc)与步骤2免疫小鼠脾脏细胞按照1∶10的细胞数量比例进行混和,将45%聚乙二醇4000(peg)(购买自sigma)细胞融合后获得的杂交瘤细胞加入已含有饲养层细胞的96孔板中,使用含有1
×
hat选择性培养基在37℃、5%co2条件下培养。
[0051]
4、杂交瘤细胞株的筛选,具体是:将步骤3获得的杂交瘤细胞在含有1
×
hat选择性培养基的条件下培养10-14天,每隔4天更换一半量的1
×
hat选择性培养基。培养12天后取杂交瘤细胞上清进行间接elisa以初次筛选能特异性分泌抗狂犬病毒磷蛋白/糖蛋白单克隆抗体的杂交瘤细胞。具体步骤如下:用纯化狂犬病毒和rv g蛋白分别包被酶标板,设置空白对照,取培养上清为一抗,sp2/0细胞培养上清为阴性对照,二抗为hrp标记山羊抗小鼠igg(1:6000)(thermo scientific), tmb(solarbio)显色终止后,酶标仪检测450nm吸光度值(a450值),以高于阴性对照a450值2.1倍以上的孔为阳性细胞孔,并进行下一步的亚克隆。
[0052]
其中,rv g蛋白为现有蛋白,可以参见巩蔚,严丽蔚,朱文兵,张雪梅,徐婧雯,吴忠香,卢孔杰,孙明,董少忠.狂犬病病毒ctn-1 株g蛋白的原核表达及基本功能评价[j].中国生物制品学杂志,2016,29(10):1032-1036.doi:10.13200/j.cnki.cjb.001471。
[0053]
5、杂交瘤细胞的克隆化,具体是:选取步骤4中筛选得到的阳性细胞孔,采用有限稀释法对阳性孔的细胞进行克隆,将每孔200μl细胞吸取至加样槽,用1
×
ht完全培养基稀释至20ml后,均匀加至一个新的96孔板,每孔200μl,37℃、5%co2条件下培养5天后再次进行间接elisa检测,再次选取高于阴性对照a450值2.1倍以上且细胞生长状态良好的细胞孔,分克隆至另一个96孔板,并换1
×
hat选择性培养基培养,如此重复三至四轮,直至克隆孔内抗体检测100%阳性为止。选取生长状态好的细胞,用普通完全培养基逐步扩大培养,并液氮冻存。
[0054]
在亚克隆培养筛选的过程中,用纯化狂犬病毒和rv g蛋白分别包被酶标板,封闭后取杂交瘤细培养上清进行间接elisa,设置空白对照,sp2/0细胞培养上清为阴性对照,hrp标记山羊抗小鼠igg(1:6000)为二抗,根据酶标板a450值读数,筛选能够识别狂犬病毒磷蛋白和糖蛋白的单克隆细胞,这些杂交瘤细胞株进行进一步的亚克隆和扩增培养。
[0055]
结果连续4次亚克隆阳性杂交瘤细胞得到2株稳定分泌抗体的细胞株,编号为rv 112e3和rv 119a4,所得杂交瘤细胞系能够稳定传代,可以持续、稳定地分泌抗狂犬病病毒磷蛋白/糖蛋白的单克隆抗体。
[0056]
实施例2抗狂犬病病毒磷蛋白/糖蛋白的单克隆抗体的大量制备及鉴定
[0057]
一、抗狂犬病病毒磷蛋白/糖蛋白的单克隆抗体的大量制备
[0058]
取8~10周龄健康的balb/c小鼠腹腔注射500ul液体石蜡油,两周后,经小鼠腹腔注射上述步骤扩大培养得到的阳性克隆细胞,每只小鼠细胞注射量为10
6-107个,10-14天后收取腹水样品分装冻存或进行纯化。将上述小鼠腹水8000rpm/min离心30分钟,除去细胞成分和其他的沉淀物,收集的上清经protein a柱(购买自全式金)纯化,用12%的sds-page进行抗体纯度和完整性分析,图1显示了2株单克隆抗体的重链和轻链分别为55kd和28kd左右,最终得到的小鼠抗狂犬病病毒磷蛋白/糖蛋白的单克隆抗体用超滤离心管浓缩至1mg/ml,分别编号为112e3和119a4,分装冻存备用。
[0059]
二、单克隆抗体的生物特性分析与鉴定
[0060]
1、单克隆抗体型别鉴定
[0061]
采用mouse monoclonal antibody isotyping kit(roche)鉴定抗体的型别,方法见说明书。结果证明mab 112e3为igg2b亚型,mab 119a4为igg1亚型,轻链均为kappa型。
[0062]
2、单克隆抗体特异性鉴定
[0063]
分别取纯化rv g蛋白和狂犬病毒样本,按4:1比例加入5
×
sds-page蛋白上样缓冲液[250mm tris-hcl(ph6.8), 10%(w/v)sds,0.5%(w/v)bpb,50%(v/v)甘油,5%(w/v)β-巯基乙醇],加入样品后缓冲液终浓度为1
×
,95℃加热10分钟,以充分变性蛋白。冷却到室温后,分别将rv g蛋白和狂犬病毒处理后样品直接上样到sds-page胶加样孔内即可。80v 30 分钟,150v 50min电泳。使用半干转膜装置(bio-rad),设定转膜电流为100ma,转膜时间为45min,按照转膜仪的说明书,将电泳后的蛋白转印至pvdf膜(购买自millipore)上。转膜完毕后,立即把转膜完成的pvdf膜放置到预先准备好的5% (w/v)脱脂奶粉的tbs[20mm tris-hcl,500mm nacl(ph7.5)]中,在摇床上缓慢摇动(40rpm/min),室温封闭60分钟。纯化的单克隆抗体作为一抗,用tbst洗膜液[20mm tris-hcl,500mm nacl(ph7.5)0.01%tween-20(v/v)]将其稀释成1∶1000,加入至封闭完成后的pvdf膜中孵育过夜。弃一抗稀释液。加入tbst洗膜液5ml。在侧摆摇床上摇动(速度是80rpm/min),重复5次。随后以hrp标记的山羊抗小鼠igg为二抗(用tbst洗膜液稀释1:10000)进行室温孵育1h。弃二抗稀释液,tbst 洗膜重复5次,加入ecl(购买自millipore)试剂,在暗室压片,经显影液定影液进行洗片或者进行机器曝光,检测单克隆抗体的识别效果。结果如图2,elisa多次筛选到的112e3单克隆抗体能特异性识别狂犬病毒的磷蛋白。针对119a4单克隆抗体,采用非变性native-page进行wb鉴定,结果如图3,119a4和多克隆抗体一致能够特异性识别天然狂犬病毒糖蛋白。
[0064]
3、单克隆抗体蛋白识别定位
[0065]
rv p蛋白和g蛋白分段多肽(15-16aa/肽)由昆明赞纳生物科技有限公司合成,见表1。将所有多肽溶解后分别用pbs 缓冲液稀释至10μg/ml,每孔100μl的量包被于96孔酶标板,4℃孵育过夜;弃去孔内溶液,0.05%pbst洗板3次,5%脱脂奶粉的pbst以每孔200μl的量加入酶标孔中,于37℃孵育2h,对其进行封闭;弃去孔内溶液,用0.05%pbst洗板3次,将得到的纯化的腹水单克隆抗体用pbs缓冲液稀释至10μg/ml,分别取100μl加入已包被的反
应孔中,37℃孵育1h,同时做空白孔和阴性对照孔,空白孔为不包被的孔,阴性对照孔用pbs溶液替代腹水单克隆抗体作为一抗。弃去孔内溶液,用0.05%pbst 洗板3次,于各反应孔中,加入新鲜稀释hpr-羊抗鼠igg(1∶6000),每孔100μl,于37℃孵育1h;弃去孔内溶液,用0.05%pbst 洗板3次,每孔加入tmb底物显色溶液100μl,于37℃避光显色10min后加入100μl 2m硫酸终止反应,测定波长为450nm 的吸光值(a450值)。结果如图4,112e3能够特异性识别狂犬病毒磷蛋白的p3(niednqahlqgepie),而119a4能够特异性识别狂犬病毒糖蛋白g15(rglykslkgacklkl),112e3和119a4分别识别狂犬病病毒不同蛋白上的不同抗原决定簇,各克隆间识别蛋白和识别位点都没有交叉反应,用于检测具有高特异性和灵敏性的优点。
[0066]
表1 rv p蛋白和g蛋白分段多肽(15-16aa/肽)
[0067]
[0068][0069]
4、单克隆抗体112e3和119a4可变区序列测定
[0070]
1)rna提取:采用trnzol-a+(tiangen)提取所筛选的识别狂犬病病毒磷蛋白/糖蛋白的杂交瘤细胞的rna,细胞数为105。
[0071]
2)逆转录获取cdna:采用primescript ii 1st strand cdna synthesis kit将获取的rna逆转录为cdna,方法参见试剂盒 (takara,dalian)。
[0072]
3)巢式pcr扩增抗体重链可变区:巢式pcr扩增体系为共56ul:
[0073]
primestar max premixm(takara,dalian))28ul;
[0074]
步骤2)获取的cdna 5ul;
[0075]
vh forward(每个引物浓度为2pm):每个1ul,共4个,总共4ul;
[0076]
vh reverse(每个引物浓度为2pm):每个1ul,共19个,总共19ul。
[0077]
扩增程序为:98℃预变性1分钟;98℃变性,10秒,65℃复性10秒,72℃延伸10秒,循环35次;72℃延伸5分钟。
[0078]
4)巢式pcr扩增抗体轻链可变区:巢式pcr扩增体系52ul:
[0079]
primestar max premixm(takara,dalian)26ul;
[0080]
步骤2)获取的cdna 5ul;
[0081]
vl(κ)forward(每个引物浓度为2pm):每个1ul,共4个,总共4ul;
[0082]
vl(κ)reverse(每个引物浓度为2pm):每个1ul,共17个,总共17ul。
[0083]
扩增方法为:98℃预变性1分钟;98℃变性,10秒,60℃复性10秒,72℃延伸10秒,循环35次;72℃延伸5分钟;pcr 引物见表2。
[0084]
5)琼脂糖凝胶电泳鉴定巢式pcr产物:上样样品:marker(dl2000),vh,vl;采用1%琼脂糖凝胶,100ma,20min,结果见图5和图6。
[0085]
6)抗体可变区测序及序列分析:将步骤5)胶回收产物链接t载体内送tsingke公司测序,测序结果经igblast比对分析序列,并将获得的序列翻译成蛋白质的氨基酸序列。结果如下,112e3的氨基酸序列包括轻链可变区如seq id no.1所示,重链可变区如seq id no.2所示;轻链可变区的编码dna序列如seq id no.3所示;重链可变区的编码dna序列如seq idno.4所示;119a4的氨基酸序列包括轻链可变区如seq id no.5所示,重链可变区如seq id no.6所示;轻链可变区的编码 dna序列如seq id no.7所示;重链可变区的编码dna序列如seq id no.8所示;将该序列进行比对后未显示有相同序列,说明所获得的序列为2个克隆各自特异的序列。
[0086]
表2 pcr引物
[0087]
[0088][0089]
实施例3狂犬病病毒双抗体夹心elisa抗原检测方法的建立
[0090]
1、狂犬病病毒双抗体夹心elisa抗原检测方法的建立
[0091]
1)包被:用0.05m ph9.6的碳酸盐缓冲液稀释抗狂犬病毒蛋白的单克隆抗体100μl/孔,4℃包被过夜;
[0092]
2)洗涤:弃去孔内溶液,用0.05%pbst洗板3次;
[0093]
3)封闭:加入封闭液即样品稀释液,200μl/孔,37℃封闭2h;
[0094]
4)洗涤:弃去孔内溶液,用0.05%pbst洗板3次;
[0095]
5)加抗原:抗原用样品稀释液作适当的稀释,100μl/孔,37℃孵育1h;
[0096]
6)洗涤:弃去孔内溶液,用0.05%pbst洗板3次;
[0097]
7)加酶标单抗:于反应孔内加入辣根过氧化物酶标记的抗体,100μl/孔,37℃孵育50min;
[0098]
8)洗涤:弃去孔内溶液,用0.05%pbst洗板3次;
[0099]
9)加底物:每孔中tmb底物显色溶液(购自solarbio)100μl,于37℃避光显色10min;
[0100]
10)加终止液:100μl 2m硫酸终止反应,测定波长为450nm的吸光值(a450值。
[0101]
2、包被单抗与酶标单抗的选择
[0102]
分别以本发明制备的2株抗狂犬病病毒单克隆抗体112e3和119a4(10μg/ml)作为包被抗体包被96孔酶标板,加入阳性对照(狂犬病病毒样品)和阴性对照(细胞培养上清)作为待检,同时将这2株单抗分别用辣根过氧化物酶标记稀释至0.5μg/ml,按照上述elisa步骤进行操作,根据od450选择包被单抗和酶标单抗的配对组合,本发明选择其中一组检测体系进行评价,具体是以112e3株作为包被抗体,以酶标记单抗119a4株作为检测抗体。
[0103]
3、包被单抗与酶标单抗的工作浓度的选择
[0104]
以抗狂犬病病毒磷蛋白的包被单抗112e3和hrp标记的抗狂犬病病毒糖蛋白的酶标单抗119a4为组合,分别探讨单抗各自的使用浓度。112e3的包被浓度稀释至20、10、5、2.5、0.6、0.16μg/ml,并分别进行包被酶标板,加入阳性对照(狂犬病病毒样品)和阴性对照(pbs)作为样品待检,酶标抗体稀释至0.5μg/ml,按照上述elisa步骤进行检测;酶标单抗119a4 的检测工作浓度是通过比较不同浓度包括1、0.5、0.1、0.01μg/ml的抗体检测结果来确定的,通过综合评估选择包被单抗112e3 的包被浓度为2.5μg/ml,酶标单抗119a4的工作浓度为0.5μg/ml。
[0105]
4、特异性实验
[0106]
按照上述建立的双抗体夹心elisa抗原检测方法分别检测灭活脊髓灰质炎病毒i型(inactivated poliovirus type i,ipv-i)、 ipv-ii、ipv-iii、甲肝病毒(hepatitis a virus,hav)、肠道病毒(enterovirus 71,ev71)、狂犬病毒参考疫苗、狂犬病毒制备样品和pbs,狂犬病毒参考疫苗作为阳性对照,pbs作为阴性对照以评价本方法的特异性。结果显示,用本发明所建立的双抗夹心elisa方法检测的其他5种病毒抗原的od450值均低于阴阳临界值,即检测结果均为阴性,说明本方法对狂犬病毒抗原的检测特异性良好,结果见图7。
[0107]
5、灵敏度和线性范围测试
[0108]
分别将狂犬病毒疫苗参考品稀释至2.0、1.75、1.5、1.25、0.625、0.313、0.156iu/ml,按照实施例3中狂犬病病毒双抗体夹心elisa抗原检测方法进行实验,最终得到的线性结果如图8a所示。通过将不同批次的狂犬病毒收获液rv-1、rv-2、 rv-3以及狂犬病毒疫苗进行2倍梯度稀释至2-7
,疫苗的初始浓度为1.25iu/ml,本发明的方法灵敏度为0.02iu/ml,
线性范围为0.15-2.0iu/ml,如图8b所示,实验结果表明本发明的试剂盒具有良好的灵敏度和线性范围。
[0109]
以上结果表明,本发明的抗狂犬病毒糖蛋白/磷蛋白单克隆抗体特异性强、灵敏度好,经过进一步的开发,还可用于狂犬病的检测、预防、防治及流行病调查等方面,具有重要的实用意义。基于单克隆抗体构建的双抗体夹心elisa抗原检测方法对于其他流行病病毒抗原不存在交叉反应,具有良好的特异性和灵敏度,通过建立内控标准,及时对疫苗制备过程中各阶段的抗原含量进行快速定量检测,适合于指导病毒收获、浓缩、灭活、纯化工艺步骤的监测和控制,为狂犬病毒疫苗制备方法和工艺的筛选、确定及优化提供依据。
[0110]
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1