用于检测非洲猪瘟病毒的引物、试剂盒及方法
1.本发明涉及病毒检测技术领域,具体涉及一种用于检测非洲猪瘟病毒的引物、试剂盒及方法。
背景技术:
2.非洲猪瘟病毒(african swine fever virus,asfv)是双链dna病毒,包含外膜、衣壳、双层内膜、核心壳层和基因组5层结构,具有3万余个蛋白亚基(wang et al.,2019),主要在髓系细胞中复制,特别是抗原呈递细胞(apcs),如单核/巨噬细胞和树突状细胞,引起组织的严重坏死、出血,最终导致死亡(malmquist&hay,1960;wardley&wilkinson,1977;mebus,1988;tulman&rock,2001;s
á
nchez-cord
ó
n et al.,2018)。
3.由该病毒引起的非洲猪瘟(asf)最早在1921年于非洲肯尼亚国家发生,1957年传入欧洲,1971年传入美洲,随后自1982年起成为地中海撒丁岛地方流行性疾病,到2007年该疾病传入了东欧部分国家(s
á
nchez-cord
ó
n et al.,2018);2018年传入中国(zhao et al.,2019),席卷欧、美、亚、非四大洲,估计造成全球20亿美元的经济损失。该病发病急,传染速度快,发病率和死亡率均可达到100%,目前尚无有效疫苗。一旦确诊感染,动物立刻采取全扑杀措施以防范非洲猪瘟病毒的进一步扩散和蔓延。因此,非洲猪瘟病毒的快速和可靠的检测是至关重要的紧急控制措施。
4.在asfv早期诊断中,pcr方法占主导地位。2016年,luo等人通过对35个非洲猪瘟病毒毒株来源的vp72基因编码序列进行比对,成功设计了一对具有高度敏感性和通用性的pcr引物,建立了一种改良的传统pcr的检测方法(luo et al.,2016)。但该方法费时、易污染、后需电泳检测。荧光定量pcr将荧光检测和传统pcr结合起来,具有操作简单、敏感性高、特异性强、重复性好等优点。荧光定量pcr法有sybr green染料法和taqman探针法两种,相对而言,sybr green染料法因不用合成带荧光基团的探针,更为经济实惠,其特异性主要依靠优选的引物对;而taqman探针法,因需要合成特异性探针,其成本更高,但特异性较sybr green染料法好。世界动物卫生组织(oie)制定的asfv诊断标准中采用的是基于非洲猪瘟病毒vp72基因建立的qpcr方法,其利用了兼并引物,特异性较差(任名等,2020)。张泉等基于vp72基因建立了taqman探针法荧光定量pcr检测,其灵敏度达20copies/μl(张泉等,2007)。任名等以及李洪利等基于vp72基因建立的taqman探针法荧光定量pcr检测asfv方法,最低能检测到10copies/μl,与oie引物的扩增灵敏度相当(任名等,2020和李洪利等,2012)。因此,需要建立一种兼顾灵敏度、特异性和成本的非洲猪瘟病毒分子检测方法。
技术实现要素:
5.为建立一种经济快速、准确灵敏的非洲猪瘟病毒分子检测方法,我们对30个非洲猪瘟病毒毒株来源的vp72基因进行了多重序列比对,从其保守区域设计和筛选了特异性引物,通过优化反应体系和反应条件,成功建立了基于非洲猪瘟病毒vp72基因的荧光染料qpcr方法。该方法可检测到10copies/μl的非洲猪瘟病毒阳性质粒标准品,且特异性强,重
复性良好,相较taqman探针法更为经济实惠。
6.一方面,本发明提供用于检测非洲猪瘟病毒vp72基因的引物,其特征在于,所述引物的核苷酸序列如seq id no:6和seq id no:7所示。
7.另一方面,本发明提供用于检测非洲猪瘟病毒vp72基因的试剂盒,其特征在于,包括所述的用于检测非洲猪瘟病毒vp72基因的引物。
8.优选地,所述试剂盒还包括阳性对照品和/或阴性对照品。
9.优选地,所述阳性对照品为包含部分或全部vp72基因的标准质粒;所述阴性对照品为用于稀释所述阳性对照品的液体。
10.优选地,所述标准质粒包含seq id no:1所示的核苷酸序列。
11.优选地,所述阳性对照品为浓度为1
×
102copies/μl的标准质粒溶液。
12.优选地,所述试剂盒还包括pcr预混液;所述pcr预混液包含taq酶、dntp混合物、tb green染料以及缓冲液。
13.本发明还提供一种非洲猪瘟病毒vp72基因的荧光定量pcr检测方法,其特征在于,包括使用所述的引物或所述的试剂盒对待测样品的基因组dna进行染料法荧光定量pcr。
14.优选地,所述荧光定量pcr的反应体系为:tb green premix ex taq ii(tli rnaseh plus)(2
×
)5μl,上游引物(10μm)0.3μl,下游引物(10μm)0.3μl,dna模板1μl,无核酸酶的ddh2o 3.4μl。
15.优选地,所述荧光定量pcr的反应条件为:预变性95℃30s;变性95℃5s,退火延伸60℃30s,40个循环。
16.经试验证明,本发明建立的荧光定量pcr检测方法具有敏感性高、特异性强、重复性好等优点。在敏感性试验中,我们选取了文献报道的能特异扩增非洲猪瘟病毒vp72片段的引物对(seq id no:2和seq id no:3)(简称为“引物对p1”或“p1引物对”)作为对照,该引物对比oie推荐的pcr引物对更为保守,灵敏度和检测范围更广。结果显示,文献报道的p1引物对在普通pcr中显示出较好的灵敏度,但在荧光定量pcr检测中扩增效率较低,检测下限为104个拷贝/μl(图4-6),因此不适宜用于荧光定量pcr检测。本发明提供的引物对(seq id no:6和seq id no:7)(简称为“引物对p3”或“p3引物对”)在荧光定量pcr检测中灵敏度高,可检测到1copy/μl的质粒标准品,并且溶解曲线峰形较好,特异性强(图13-15)。重复性试验结果显示,采用本发明的方法检测非洲猪瘟病毒vp72基因,批内和批间变异系数均小于2%(表3),检测结果稳定可靠。
17.综上,本发明基于优选的vp72基因的扩增引物,成功建立了一种经济快速、准确灵敏的非洲猪瘟病毒(asfv)分子检测方法。该方法用sybr green染料法进行检测,特异性强,标准曲线的线性相关性r2可达到0.9972,灵敏度高于文献报道的taqman探针法,并且检测成本低于taqman探针法,为非洲猪瘟疫情的快速确诊提供了经济有效的分子诊断工具。
附图说明
18.图1为文献报道的引物对(p1)与30条asfv vp72基因完整编码序列的比对结果;其中点(.)表示相同的碱基;引物位置用虚线框指示。
19.图2为本发明设计的引物对(p2)与30条asfv vp72基因完整编码序列的比对结果;其中点(.)表示相同的碱基;引物位置用虚线框指示。
20.图3为本发明设计的引物对(p3)与30条asfv vp72基因完整编码序列的比对结果;其中点(.)表示相同的碱基;引物位置用虚线框指示。
21.图4为利用p1引物对进行荧光定量pcr检测的扩增曲线;其中104、105、106、107、108、109、10
10
表示质粒标准品的拷贝数。
22.图5为利用p1引物对进行荧光定量pcr检测的熔解曲线。
23.图6为利用p1引物对进行荧光定量pcr检测的标准曲线。
24.图7为利用p2引物对进行荧光定量pcr检测的扩增曲线;其中101、102、103、104、105、106、107表示质粒标准品的拷贝数。
25.图8为利用p2引物对进行荧光定量pcr检测的熔解曲线。
26.图9为利用p2引物对进行荧光定量pcr检测的标准曲线。
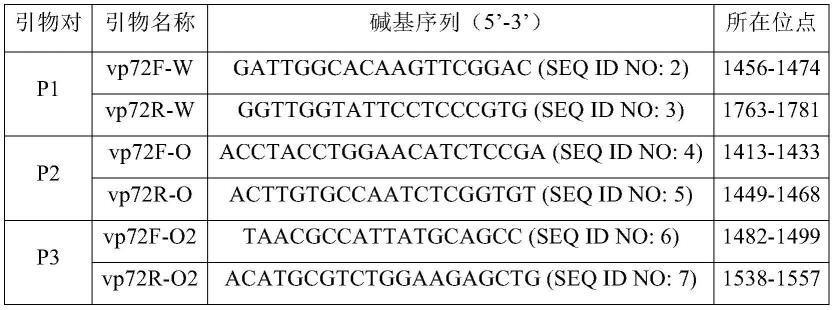
27.图10为利用p3引物对进行荧光定量pcr检测的扩增曲线;其中101、102、103、104、105、106、107表示质粒标准品的拷贝数。
28.图11为利用p3引物对进行荧光定量pcr检测的熔解曲线。
29.图12为利用p3引物对进行荧光定量pcr检测的标准曲线。
30.图13为针对p3引物对优化的荧光定量pcr的扩增曲线;其中100、101、102、103、104、105、106表示质粒标准品的拷贝数。
31.图14为针对p3引物对优化的荧光定量pcr的熔解曲线。
32.图15为针对p3引物对优化的荧光定量pcr的标准曲线。
具体实施方式
33.下面结合具体实施例和附图对本发明的技术方案进行详细描述。
34.以下实施例中用于提取巴拿马香猪基因组dna的血液,取自健康的未感染非洲猪瘟病毒的巴拿马香猪,巴拿马香猪由陆军军医大学实验动物中心提供。
35.大肠杆菌dh5α感受态细胞购买自北京擎科新业生物技术有限公司。
36.puc57质粒载体为克隆载体,购买自北京擎科新业生物技术有限公司。载体大小为2710bp,载体序列的ncbi登录号为y14837.1,载体抗性为氨苄青霉素。
37.主要试剂和耗材:
38.real time pcr荧光染料试剂tb greenpremix ex taq
tm
ii(tli rnaseh plus)购自takara公司,货号rr820q;质粒dna提取试剂盒购自天根生物有限公司,货号dp103。mini best viral rna/dna extraction kit ver.5.0试剂盒购自takara公司,货号9766。primescript
tm
rt reagent kit with gdna eraser试剂盒购自takara公司,货号rr047a。
39.所有引物委托华大基因有限公司合成。基因合成、载体构建与测序工作委托北京擎科新业生物技术有限公司完成。
40.若未特别说明,以下实施例中使用的试剂均为本领域常规试剂,可商购获得或按照本领域常规方法配制而得,规格为实验室纯级即可。若未特别说明,以下实施例所使用的实验方法和条件均为本领域常规实验方法和条件,可参考相关实验手册、公知文献或厂商说明书。除非另有定义,本文使用的所有技术和科学术语的含义与本发明所属领域普通技术人员通常理解的含义相同。
41.实施例1.非洲猪瘟病毒荧光定量pcr的引物设计与合成
42.我们在ncbi网站(https://www.ncbi.nlm.nih.gov/)上选择来源于30个非洲猪瘟毒株的vp72基因全长序列(表1),通过megalign软件进行多重序列比对,筛选到vp72基因的保守区域,所述保守区域的核苷酸序列如seq id no:1所示。在vp72基因保守区域利用ncbi primer designing tool设计并筛选特异性引物。
43.表1用于引物设计的30条非洲猪瘟病毒vp72基因序列
44.ncbi登录号基因大小ncbi登录号基因大小ncbi登录号基因大小mh713612.11,941bpay578701.12,082bpkt795356.11,941bpay578689.12,092bpay578702.12,082bpl76727.11,941bpay578690.12,083bpay578703.12,083bpmk554698.11,941bpay578691.12,082bpay578704.12,087bpmn207061.11,941bpay578692.12,092bpay578705.12,092bpmn793051.11,941bpay578694.12,106bpay578706.12,086bpmn886925.11,941bpay578696.12,084bpay578707.12,106bpmn886926.11,941bpay578697.12,093bpay578708.12,091bpmn886930.11,941bpay578699.12,085bpkj195685.11,941bpmn886932.11,941bpay578700.12,093bpkt795353.11,941bpmn886933.11,941bp
45.引物信息如表2所示,p1是文献(luo et al.,2016)报道的能特异扩增非洲猪瘟病毒vp72基因片段的引物对,p2和p3是本发明设计和筛选的引物对。我们采用p1引物对作为对照,该引物对比oie推荐的pcr引物对更为保守,灵敏度和检测范围更广。委托华大基因有限公司合成引物对p1、p2和p3。序列比对的结果显示,同引物对p1类似,本发明设计的两对引物(p2和p3)在不同非洲猪瘟毒株中高度保守(图1-3)。
46.表2非洲猪瘟病毒vp72基因的特异性引物
[0047][0048]
实施例2.质粒标准品的制备
[0049]
1.载体构建
[0050]
委托北京擎科新业生物技术有限公司合成核苷酸序列如seq id no:1所示的保守区域并将其插入puc57质粒载体中,得到总长度为3135bp的重组质粒载体,命名为puc57-vp72。
[0051]
2.转化
[0052]
取100μl冰浴融化的大肠杆菌dh5α感受态细胞,加入重组质粒载体puc57-vp72,轻轻混匀后冰浴放置30min;42℃水浴热激60s,将离心管迅速转移到冰浴中2min;向离心管中
加入200μl无抗性的无菌lb培养液,混匀后于37℃、180rpm摇床培养1h,使细胞复苏;取菌液100μl,均匀涂布于含有100mg/l氨苄青霉素的lb琼脂培养基,吹干培养基表面液体后,37℃倒置培养过夜。次日挑取单菌落,加入含有100mg/l氨苄青霉素的lb液体培养基中,37℃、180rpm摇床培养10-16h后,将菌液送北京擎科新业生物技术有限公司进行阳性克隆鉴定。
[0053]
3.质粒提取
[0054]
对测序正确的阳性克隆进行扩大培养,然后提取puc57-vp72质粒,得到质粒标准品原液。质粒标准品的拷贝数根据下述计算公式确定:(ng/μl)
×
10-9
×
6.02
×
10
23
/(bp
×
660)=copies/μl。
[0055]
实施例3.荧光定量pcr检测非洲猪瘟病毒的敏感性试验
[0056]
将实施例2制备的质粒标准品原液以10倍梯度稀释为1
×
10
10
~1
×
101copies/μl,作为dna模板。以ddh2o为对照,分别使用文献报道的引物对p1和本发明设计的引物对p2和p3(表2),按照如下反应体系和反应条件进行tb green染料法荧光定量pcr,绘制标准曲线和熔解曲线。
[0057]
荧光定量pcr的反应体系如下:
[0058][0059]
荧光定量pcr的反应条件为:预变性95℃30s;变性95℃5s,60℃30s,40个循环。溶解曲线反应条件:逐渐升温至95℃。
[0060]
结果显示,p1引物对的扩增产物无引物二聚体,但引物扩增效率较低,标准曲线相关系数为0.9932,检测下限为104个拷贝(图4-6)。p2引物对的扩增产物无引物二聚体,标准曲线相关系数为0.9953,检测下限为10个拷贝,灵敏度较高,但溶解曲线有偏峰,特异性差(图7-9)。p3引物对的扩增产物无引物二聚体,标准曲线相关系数为0.9972,检测下限为10个拷贝,灵敏度较高,并且溶解曲线峰形较好,特异性强(图10-12)。因此,p3引物对为染料法荧光定量pcr检测非洲猪瘟病毒vp72基因的最佳引物对。
[0061]
实施例4.荧光定量pcr检测非洲猪瘟病毒的重复性试验
[0062]
为进一步验证本发明建立的asfv荧光定量pcr检测方法的特异性和稳定性,分别以质粒标准品中的1
×
102copies/μl稀释度的质粒dna溶液、巴拿马香猪基因组dna和超纯水为模板,分别采用p2和p3引物对,按照实施例3中的荧光定量pcr的反应体系和反应条件进行tb green染料法荧光定量pcr。设置3次重复测定,进行批内重复性试验和批间重复性试验。ct值》33判定为阴性结果,以ct值变异系数来评估方法的重复性。
[0063]
巴拿马香猪基因组dna的获得:以巴拿马香猪血液为材料,采用血液基因组dna提取试剂盒(tiangen,货号dp318-02),按照试剂盒说明书记载的操作步骤提取基因组dna。
[0064]
结果显示,p2和p3引物对的扩增结果具有良好的重复性,批内和批间变异系数均
小于2%(表3)。以巴拿马香猪基因组dna或超纯水作为模板的扩增结果均为阴性。由此表明,本发明建立的基于vp72基因的染料法荧光定量pcr方法具有很好的重复性和特异性,检测结果稳定可靠。
[0065]
表3染料法荧光定量pcr检测方法的特异性和重复性
[0066][0067]
注:ct值》33判定为阴性结果,用-表示。“质粒”表示以质粒标准品中的1
×
102copies/μl稀释度的质粒dna为pcr模板;“猪dna”表示以巴拿马香猪基因组dna为pcr模板。
[0068]
实施例5.荧光定量pcr条件的优化
[0069]
将实施例2制备的质粒标准品原液以10倍梯度稀释为1
×
106~1
×
100copies/μl,作为dna模板。针对本发明设计优选的p3引物对进行荧光定量pcr反应体系及反应条件的进一步优化,绘制标准曲线和熔解曲线。优选后的最佳反应体系为:tb green premix ex taq ii(tli rnaseh plus)(2
×
)10μl,p3引物对的上游引物(10μm)和下游引物(10μm)各0.8μl,dna模板2μl,无核酸酶的ddh2o补至20μl。最佳反应条件为:第1步:预变性95℃30s;第2步:变性95℃5s,退火延伸60℃30s,40个循环;第3步:溶解曲线反应,逐渐升温至95℃。扩增曲线和溶解曲线如图13-15所示。利用p3引物对扩增的结果具有良好的灵敏性,最低可检测模板浓度为1copy/μl。
[0070]
实施例6.荧光定量pcr检测非洲猪瘟病毒的特异性试验
[0071]
试验材料:
[0072]
猪伪狂犬病病毒(prv)灭活疫苗(武汉科前生物股份有限公司,批准文号:兽药生字170041044,疫苗中含有猪伪狂犬病病毒鄂a株);
[0073]
猪圆环病毒2型(pcv2)灭活疫苗(武汉科前生物股份有限公司,批准文号:兽药生字170041087,疫苗中含有猪圆环病毒2型,灭活前每2ml的病毒含量≥10
7.0
tcid
50
);
[0074]
猪细小病毒(ppv)灭活疫苗(武汉科前生物股份有限公司,批准文号:兽药生字170041059,疫苗中含有猪细小病毒强毒wh-1株,灭活前每毫升的病毒含量≥10
5.5
tcid
50
或血凝效价不低于29);
[0075]
猪流感病毒h1n1亚型灭活疫苗(武汉科前生物股份有限公司,批准文号:兽药生字170041101,疫苗中含有猪流感病毒h1n1亚型tj株,灭活前每0.2ml病毒含量≥10
6.5
eid
50
)。
[0076]
用mini best viral rna/dna extraction kit ver.5.0试剂盒(takara,9766)按照试剂盒说明书分别提取prv、pcv2、ppv灭活疫苗的dna,以及猪流感病毒h1n1亚型灭活疫苗的rna,然后用primescript
tm
rt reagent kit with gdna eraser试剂盒(takara,rr047a)按照试剂盒说明书对提取的猪流感病毒h1n1亚型灭活疫苗的rna进行反转录,得到cdna。
[0077]
分别以prv、pcv2、ppv的dna和h1n1的cdna为模板,同时以1.0
×
105copies/μl的标准质粒(puc57-vp72)为阳性对照,以ddh2o为阴性对照,按照实施例5中荧光定量pcr的最佳反应体系和最佳反应条件检测特异性。结果如表4所示,阳性对照(puc57-vp72)有特异性扩增,而其他病毒未检测到阳性扩增,说明本发明的方法具有良好的特异性。
[0078]
表4 tb green荧光定量pcr检测方法的特异性
[0079]
样本ct平均值ct标准差puc57-vp7220.840.12h1n1
‑‑
pcv2
‑‑
ppv
‑‑
prv
‑‑
[0080]
注:ct值》35判定为阴性结果,用
“‑”
表示。
[0081]
实施例7.荧光定量pcr检测非洲猪瘟病毒的临床样本
[0082]
以军事医学科学院军事兽医研究所扈荣良研究员馈赠的4份感染asfv的大白猪dna为阳性样本,巴拿马香猪基因组dna为对照样本,按照实施例3中荧光定量pcr的反应体系和反应条件进行检测。
[0083]
结果如表5所示,4份对照样本均没有出现特异性扩增曲线,检测结果为阴性;4份阳性样本均出现特异性扩增,检测结果为阳性。因此,本发明建立的非洲猪瘟病毒vp72基因的荧光定量pcr检测方法的符合率为100%。
[0084]
表5临床样本检测结果
[0085]
样本ct平均值ct标准差阳性样本114.460.01阳性样本216.040.06阳性样本316.970.01阳性样本421.700.09对照样本1
‑‑
对照样本2
‑‑
对照样本3
‑‑
对照样本4
‑‑
[0086]
以上实施例只是本发明的部分实施例,而非全部实施例。上述实施例仅用于对本发明的技术方案进行解释和说明,而非用于限制本发明的保护范围。任何熟悉本领域技术的人员在本发明公开的技术范围内对上述实施例所做的修饰或改变,均应涵盖在本发明的
保护范围内。参考文献:
[0087]
luo y,atim sa,shao l,ayebazibwe c,sun y,liu y,ji s,meng xy,li s,li y,et al.2016.development of an updated pcr assay for detection of african swine fever virus.arch virol 162(1):191-199.
[0088]
malmquist wa,hay d.1960.hemadsorption and cytopathic effect produced by african swine fever virus in swine bone marrow and buffy coat cultures.am j vet res 21:104-108.
[0089]
mebus ca.1988.african swine fever.adv virus res 35:251-269.
[0090]sá
nchez-cord
ó
n pj,montoya m,reis al,dixon lk.2018.african swine fever:a re-emerging viral disease threatening the global pig industry.vet j 233:41-48.
[0091]
tulman er,rock dl.2001.novel virulence and host range genes of african swine fever virus.curr opin microbiol 4(4):456-461.
[0092]
wang n,zhao d,wang j,zhang y,wang m,gao y,li f,wang j,bu z,rao z,et al.2019.architecture of african swine fever virus and implications for viral assembly.science 366(6465):640.
[0093]
wardley rc,wilkinson pj.1977.the association of african swine fever virus with blood components of infected pigs.arch virol 55(4):327-334.
[0094]
zhao d,liu r,zhang x,li f,wang j,zhang j,liu x,wang l,zhang j,wu x,et al.2019.replication and virulence in pigs of the first african swine fever virus isolated in china.emerg microbes infect 8(1):438-447.
[0095]
李洪利,曹金山,王君玮,等.非洲猪瘟病毒实时荧光定量pcr检测方法的建立及应用[j].中国畜牧兽医,2012,39(006):37-40.
[0096]
任名,牛婷婷,于婉琪,等.非洲猪瘟病毒taqman探针法荧光定量pcr检测方法建立[j].中国动物传染病学报,2020,028(003):42-48.
[0097]
张泉,朱鸿飞,孙怀昌.非洲猪瘟病毒常规pcr及real-time pcr检测方法的建立[j].中国预防兽医学报,2007,029(006):458-461.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1