一类苯并杂环-吡啶酮衍生物及其制备方法和用途
1.本发明属于制药领域,具体涉及一类苯并杂环-吡啶酮衍生物及其制备方法和用途。
背景技术:
2.恶性肿瘤是世界上致死率最高的疾病之一,其发展机制一直是生物医学研究的热点之一。果蝇zeste基因增强子同源物2(enhancer of zeste homolog 2,ezh2)是一种组蛋白甲基转移酶,通过催化组蛋白h3赖氨酸27(h3k27)的甲基化以控制各种基因表达,从而调节细胞的正常生理功能。多种人类疾病(如癌症、炎症等)与ezh2失调有关,ezh2过表达会导致癌症的发生和恶化。在多种癌症中,如滤泡性淋巴瘤和弥漫性大b细胞淋巴瘤中均存在ezh2的失调,并与临床的不良预后和疗效相关。此外,ezh2失调还常见于乳腺癌、肺癌、结直肠癌、前列腺癌及胃癌等实体瘤中。
3.gsk126是一种代表性的ezh2抑制剂,对ezh2基因的过表达有明显的调控作用。已有研究报道gsk126对非实体瘤有较好的防治效果。但是,gsk126对于实体瘤的疗效不够理想,极大限制了其临床研究与应用。研究发现,ezh2抑制剂诱导激活的h3k27乙酰化(h3k27ac),是造成实体瘤对ezh2抑制剂耐药的重要原因。
[0004][0005]
溴结构域蛋白4(bromodomain-containing protein 4,brd4),是表观遗传家族中的另一重要高成药性靶点,该蛋白作为一种转录辅因子可以识别并结合组蛋白上乙酰化的赖氨酸残基(acetylated lysine residues,kac),募集蛋白质到启动子和增强子附近,并通过与rna聚合酶ii(rnap ii)偶联来调节转录过程,促进c-myc、nf-κb、aurora b、pax5和bcl-xl等致癌基因的异常表达,调节下游效应蛋白的表达参与疾病的发生、发展。多种人类疾病,如癌症,炎症,心血管疾病,中枢神经系统(cns)疾病和人类免疫缺陷病毒(hiv)感染,等与brd4失调有关,并且,研究发现,brd4抑制剂对包括胰腺癌在内的多种实体瘤具有较好的防治效果。
[0006]
为了提高药物的治疗效果,扩大药物适用的适应症范围,开发出一种ezh2/brd4双靶点抑制剂具有重要意义。
技术实现要素:
[0007]
本发明的目的在于提供一类苯并杂环-吡啶酮衍生物及其制备方法和用途。
[0008]
本发明具体提供了式i所述化合物,或其药学上可接受的盐、立体异构体、溶剂合物、氘代化合物:
[0009][0010]
x选自c
1-6
烷基、3~6元饱和环烷基、3~6元饱和杂环基、lz;l选自1~3个亚甲基,z选自3~6元饱和环烷基、3~6元饱和杂环基;
[0011]
y选自氢、c
1-6
烷基;
[0012]
w选自ch或n;
[0013]
r1选自氢、c
1-6
烷基,r2选自氢、c
1-6
烷基;或者r1与r2连接成环;
[0014]
r3选自氢、c
1-6
烷基;
[0015]
r4选自氢、c
1-6
烷基。
[0016]
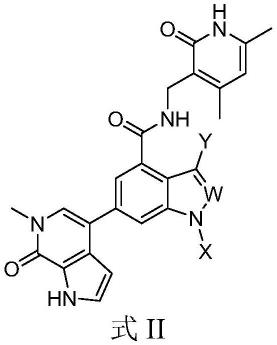
进一步地,所述化合物的结构如式ii所示:
[0017][0018]
其中,x选自c
1-5
烷基、3~6元饱和环烷基、3~6元饱和杂环基、lz;l选自1~2个亚甲基,z选自3~6元饱和环烷基、3~6元饱和杂环基;
[0019]
y选自氢、c
1-3
烷基;
[0020]
w选自ch或n。
[0021]
进一步地,所述化合物的结构如式iii所示:
[0022][0023]
其中,x选自c
1-5
烷基、5~6元饱和环烷基、5~6元饱和杂环基、lz;l选自1~2个亚甲基,z选自5~6元饱和环烷基、5~6元饱和杂环基。
[0024]
进一步地,所述化合物的结构如式iv所示:
[0025][0026]
其中,x选自c
1-5
烷基、3~6元饱和环烷基、3~6元饱和杂环基、lz;l选自1~2个亚甲基,z选自3~6元饱和环烷基、3~6元饱和杂环基;
[0027]
y选自氢、c
1-3
烷基;
[0028]
w选自ch或n。
[0029]
进一步地,所述化合物的结构如式v所示:
[0030][0031]
其中,x选自c
1-5
烷基、5~6元饱和环烷基、5~6元饱和杂环基、lz;l选自1~2个亚甲基,z选自5~6元饱和环烷基、5~6元饱和杂环基。
[0032]
进一步地,所述化合物选自:
[0033][0034]
本发明还提供了一种制备上述化合物的方法,所述方法包括以下步骤:
[0035][0036]
(1)化合物i-1进行水解反应,得到化合物i-2;
[0037]
(2)化合物i-2与化合物i-3反应,得到i-4;
[0038]
(3)化合物i-4与化合物i-5反应,然后脱保护,得到式i所示化合物;
[0039]
其中,x、y、w、r
1-r4如上所述;t为卤素,优选为溴;r5为氨基保护基团,优选为对甲苯磺酰基。
[0040]
本发明还提供了一种预防和/或治疗与ezh2和/或brd4活性有关疾病的药物,它是以上述化合物,或其药学上可接受的盐、立体异构体、溶剂合物、氘代化合物为活性成分,加上药学上可接受的辅料制备而成的制剂。
[0041]
本发明还提供了上述化合物,或其药学上可接受的盐、立体异构体、溶剂合物、氘代化合物在制备ezh2和/或brd4抑制剂中的用途。
[0042]
进一步地,所述ezh2和/或brd4抑制剂为预防和/或治疗与ezh2和/或brd4活性有关疾病的药物;优选地,所述与ezh2和/或brd4活性有关疾病为滤泡性淋巴瘤、弥漫性大b细胞淋巴瘤、乳腺癌、肺癌、结直肠癌、前列腺癌、胃癌、炎症、胰腺癌、心血管疾病、中枢神经系统疾病、免疫缺陷病毒感染;
[0043]
更优选地,所述胰腺癌为转移性胰腺癌或原位胰腺癌。
[0044]
关于本发明的使用术语的定义:除非另有说明,本文中术语提供的初始定义适用于整篇说明书的该术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
[0045]
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀c
a~b
烷基表示任何含“a”至“b”个碳原子的烷基。例如,c
1-6
烷基是指包含1-6个碳原子的直链或支链的烷基。
[0046]
卤素为氟、氯、溴或碘。
[0047]“氘代化合物”指化合物中的一个或两个以上的氢原子被氘替换后得到的化合物。
[0048]“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
[0049]“盐”是将化合物或其立体异构体,与无机和/或有机酸和/或碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。
[0050]
本发明中所述药学上可接受的盐可以是化合物的盐酸盐、硫酸盐、枸橼酸盐、苯磺酸盐、氢溴酸盐、氢氟酸盐、磷酸盐、乙酸盐、丙酸盐、丁二酸盐、草酸盐、苹果酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐或三氟乙酸盐。
[0051]
实验结果表明,本发明化合物能够有效抑制ezh2或brd4的活性,特别是化合物1-3、5能够同时有效抑制ezh2和brd4的活性。因此,本发明化合物可以用于制备ezh2和/或brd4抑制剂,以及预防和/或治疗与ezh2和/或brd4活性有关疾病(包括但不限于滤泡性淋巴瘤、弥漫性大b细胞淋巴瘤、乳腺癌、肺癌、结直肠癌、前列腺癌、胃癌、炎症、胰腺癌、心血管疾病、中枢神经系统疾病、免疫缺陷病毒感染)的药物。
[0052]
对肿瘤细胞株的增殖抑制活性实验进一步证实了,本发明化合物能够有效抑制aspc-1(人转移胰腺癌细胞)和bxpc-3(人原位胰腺癌细胞)的活性。因此,本发明化合物可以用于制备预防和/或治疗胰腺癌(包括转移性胰腺癌或原位胰腺癌)的药物。
[0053]
本发明化合物的制备方法简单,原料易得,适合工业化生产,应用前景广阔。
[0054]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0055]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0056]
本发明所用原料与设备均为已知产品,通过购买市售产品所得。
[0057]
以下结合实施例对本发明作进一步的阐述。实施例仅用于说明本发明,而不是以任何方式来限制本发明。
[0058]
实施例1:1-(仲丁基)-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物1)的制备
[0059][0060]
步骤1.中间体甲基-6-溴-1-仲丁基-1h-吲哚-4-甲酸甲酯的制备
[0061][0062]
将氢化钠(5.66g,141.7mmol)置于6-溴-4-吲哚甲酸甲酯(30g,118.1mmol)的dmf(100ml)中,冰浴搅拌20分钟,维持冰浴下加入2-溴戊烷(29.1g,22.5mmol),撤去冰浴,自然升温至室温过夜,tlc检测反应完成。反应液加水稀释,用乙酸乙酯萃取,合并有机相,再分别用水,饱和食盐水洗涤,有机相再用无水硫酸钠干燥后,真空浓缩,得到产物,产率40%。
[0063]
步骤2.中间体6-溴-1h-吲哚-4-甲酸的制备
[0064][0065]
将中间体甲基-6-溴-1-仲丁基-1h-吲哚4-甲酸甲酯(2.54g,10mmol)溶于乙醇(25ml)中,加入氢氧化钠(0.6g,15mmol)的水溶液(25ml),60℃搅拌1小时。tlc检测反应完毕,浓缩反应液后,加入水,用1n盐酸缓慢酸化至ph=3-4,待固体析出完成时,抽滤,干燥,得到产物,产率88%。步骤3.中间体6-溴-1-仲丁基-n-((4,6-二甲基-2-氧-1,2-二氢吡啶-3基)甲基)-1h-吲哚4-甲酰胺的制备
[0066][0067]
氮气保护下,将中间体6-溴-1h-吲哚-4-甲酸(1.42g,5.92mmol)加入到25ml dmso中,搅拌下慢慢加入n-甲基吗啉(3.14g,31.0mmol),加毕,再分别加入edci(2.14g,11.2mmol)、hoat(1.52g,11.2mmol),搅拌10分钟后加入3-(氨甲基)-4,6-二甲基吡啶-2
(1h)-酮(1.43g,7.44mmol),加毕,将体系搅拌过夜反应完成。将反应液倾倒入冰水中,析出大量固体,抽滤,干燥滤饼,得白色固体,收率69%。
[0068]
步骤4.1-(仲丁基)-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺的制备
[0069][0070]
将6-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1-对甲苯磺酰基-1,6-二氢-7h-吡咯并[2,3-c]吡啶-7-酮(513.6mg,1.2mmol)、6-溴-1-仲丁基-n-((4,6-二甲基-2-氧-1,2-二氢吡啶-3基)甲基)-1h-吲哚4-甲酰胺(430mg,1mmol)、碳酸钠(381mg,3.6mmol)和[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(40mg,0.05mmol)加入到圆底烧瓶中,随后加入二氧六环(5ml)和水(2ml),氮气置换三次并在氮气中,110℃加热4小时。tlc监测反应完成,减压下旋去有机溶剂,然后加水稀释并用乙酸乙酯萃取。乙酸乙酯相分别用水、饱和食盐水洗涤,无水硫酸钠干燥。将有机溶剂在减压下除去,固体混合物用硅胶拌干后,在200-300硅胶柱上提纯得到中间产物。将中间产物置于二氧六环(5ml)和氢氧化钠的水溶液(2m,5ml)中,90℃加热2小时,tlc监测反应完成,减压下旋去有机溶剂后加水稀释并用乙酸乙酯萃取。乙酸乙酯相分别用水、饱和食盐水洗涤,无水硫酸钠干燥,真空浓缩,得到产物,产率23%。
[0071]1h nmr(400mhz,dmso)δ12.13(s,1h),11.57(s,1h),8.22(t,j=5.1hz,1h),7.80(s,1h),7.62(s,1h),7.59(d,j=3.1hz,1h),7.43(s,1h),7.37(t,j=2.4hz,1h),6.86(d,j=3.1hz,1h),6.48(s,1h),5.89(s,1h),4.65-4.60(m,1h),4.39(d,j=5.0hz,2h),3.61(s,3h),2.25(s,3h),2.12(s,3h),1.89-1.83(m,2h),1.47(d,j=6.6hz,3h),0.74(t,j=7.3hz,3h).
[0072]
实施例2:n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1-(戊烷-2-基)-1h-吲哚-4-甲酰胺(化合物2)的制备
[0073][0074]
以2-溴戊烷为原料,参照实施例1的制备方法,得到目标化合物,产率38%。
[0075]1h nmr(400mhz,dmso)δ12.15(s,1h),11.58(s,1h),8.22(s,1h),7.80(s,1h),7.70
–
7.52(m,2h),7.40(d,j=18.0hz,2h),6.87(d,j=2.7hz,1h),6.49(s,1h),5.88(s,1h),4.65(t,j=28.7hz,1h),4.40(d,j=4.6hz,2h),3.62(s,3h),2.25(s,3h),2.12(s,3h),1.98
–
1.69(m,2h),1.47(d,j=6.5hz,3h),1.36
–
0.96(m,2h),0.82(t,j=7.2hz,3h).
[0076]
实施例3:n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1-(戊烷-3-基)-1h-吲哚-4-甲酰胺(化合物3)的制备
[0077][0078]
以3-溴戊烷为原料,参照实施例1的制备方法,得到目标化合物,产率21%。
[0079]1h nmr(400mhz,dmso)δ12.12(s,1h),11.54(s,1h),8.20(t,j=5.3hz,1h),7.80(s,1h),7.71
–
7.50(m,1h),7.38(dd,j=9.6,6.9hz,1h),6.88(d,j=3.1hz,1h),6.45(s,1h),5.88(s,1h),4.39(d,j=5.0hz,2h),3.61(s,2h),2.25(s,2h),2.11(s,2h),1.87(dd,j=10.6,5.6hz,3h),1.23(s,2h),0.69(t,j=7.3hz,3h).
[0080]
实施例4:1-环戊基-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物4)的制备
[0081][0082]
以溴代环戊烷为原料,参照实施例1的制备方法,得到目标化合物,产率25%。
[0083]1h nmr(400mhz,dmso)δ12.12(s,1h),11.54(s,1h),8.20(t,j=5.0hz,1h),7.80(s,1h),7.62(s,1h),7.57(d,j=3.2hz,1h),7.42(s,1h),7.36(t,j=2.6hz,1h),6.83(d,j=3.2hz,1h),6.50(s,1h),5.88(s,1h),5.15
–
4.81(m,1h),4.38(d,j=5.0hz,2h),3.61(s,3h),2.24(s,3h),2.18(d,j=7.6hz,2h),2.11(s,3h),1.95
–
1.61(m,6h).
[0084]
实施例5:1-(环己基甲基)-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物5)的制备
[0085][0086]
以溴甲基环己烷为原料,参照实施例1的制备方法,得到目标化合物,产率29%。
[0087]1h nmr(400mhz,dmso)δ12.12(s,1h),11.54(s,1h),8.20(t,j=5.2hz,1h),7.74(s,1h),7.60(s,1h),7.45(d,j=3.1hz,1h),7.39(s,1h),7.37(t,j=2.7hz,1h),6.81(d,j=3.0hz,1h),6.50(d,j=22.5hz,1h),5.88(s,1h),4.38(d,j=5.1hz,2h),4.09(d,j=7.1hz,2h),3.61(s,3h),2.24(s,3h),2.11(s,3h),1.78(d,j=22.5hz,1h),1.62(d,j=19.0hz,2h),1.50(d,j=12.5hz,2h),1.23(m,4h),1.17
–
0.91(m,6h).
[0088]
实施例6:1-(仲丁基)-n-((1-甲基-3-氧代-2,3,5,6,6,5,6,6,7,5-六羟基喹啉-4-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物6)的制备
[0089][0090]
参照实施例1的制备方法,其中步骤3以4-(氨甲基)-1-甲基-5,6,7,8-四氢异喹啉-3(2h)-酮为原料,得到目标化合物,产率27%。
[0091]1h nmr(400mhz,dmso)δ12.11(s,1h),11.56(s,1h),8.22(t,j=4.0hz,1h),7.79(s,1h),7.60-7.54(m,2h),7.40(s,1h),7.36(t,j=2.7hz,1h),6.86(d,j=3.2hz,1h),6.47(t,j=4.0hz,1h),4.76
–
4.65(m,1h),4.41(d,j=5.0hz,2h),3.61(s,3h),2.80(s,2h),2.11(s,3h),1.92-1.80(m,4h),1.64(s,4h),1.47(d,j=6.7hz,3h),0.81(t,j=7.3hz,3h).
[0092]
实施例7:n-((1-甲基-3-氧代-2,3,5,6,7,8-六羟基喹啉-4-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1-(戊烷-2-基)-1h-吲哚-4-甲酰胺(化合物7)的制备
[0093][0094]
参照实施例1的制备方法,其中步骤1以2-溴戊烷为原料,步骤3以4-(氨甲基)-1-甲基-5,6,7,8-四氢异喹啉-3(2h)-酮为原料,得到目标化合物,产率21%。
[0095]1h nmr(400mhz,dmso)δ12.12(s,1h),11.56(s,1h),8.22(t,j=4.0hz,1h),7.79(s,1h),7.60-7.54(m,2h),7.40(s,1h),7.36(t,j=2.7hz,1h),6.86(d,j=3.2hz,1h),6.47(t,j=4.0hz,1h),4.76
–
4.65(m,1h),4.41(d,j=5.0hz,2h),3.61(s,3h),2.80(s,2h),2.38(s,2h),2.11(s,3h),1.88-1.78(m,4h),1.64(s,4h),1.47(d,j=6.7hz,3h),0.82(t,j=7.3hz,3h).
[0096]
实施例8:1-(环己基甲基)-n-((1-甲基-3-氧代-2,3,5,6,7,8-六羟基喹啉-4-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物8)的制备
[0097][0098]
参照实施例1的制备方法,其中步骤1以溴甲基环己烷为原料,步骤3以4-(氨甲基)-1-甲基-5,6,7,8-四氢异喹啉-3(2h)-酮为原料,得到目标化合物,产率34%。
[0099]1h nmr(400mhz,dmso)δ12.15(s,1h),11.64(s,1h),8.25(t,j=5.0hz,1h),7.75(s,1h),7.63(s,1h),7.44(d,j=3.1hz,1h),7.40(s,1h),7.37(t,j=2.7hz,1h),6.83(d,j=2.9hz,1h),6.48(t,j=2.1hz,1h),4.42(d,j=4.9hz,2h),4.08(d,j=7.0hz,2h),3.61(s,3h),2.80(s,2h),2.37(s,2h),2.11(s,3h),1.80(s,1h),1.63(s,6h),1.59(s,1h),1.50(d,j=11.8hz,2h),1.11-1.08(m,2h),1.06
–
0.92(m,2h).
[0100]
实施例9:1-(仲丁基)-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-3-甲基-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物9)的制备
[0101][0102]
步骤1.中间体甲基-6-溴-1-仲丁基-3-醛基-1h-吲哚-4-甲酸甲酯的制备
[0103][0104]
在冰浴下,在反应瓶中将三氯氧磷(0.83g,5.43mmol)加入到无水dmf(50ml)中,搅拌30分钟,将实施例1步骤1的产物甲基-6-溴-1-仲丁基-1h-吲哚-4-甲酸甲酯(1.40g,4.53mmol)溶于dmf(50ml)中,缓慢加入到反应瓶中,然后继续室温搅拌2.5小时。反应完成后,用冷水稀释,2n氢氧化钠溶液调整ph~8,用乙酸乙酯萃取,联合有机层用冷水和盐水洗
涤,无水硫酸钠干燥,真空浓缩得到产物,产率99%。
[0105]
步骤2.中间体6-溴-仲丁基-3-甲基-1h-吲哚-4-甲酸甲酯的制备
[0106][0107]
将甲基-6-溴-1-仲丁基-3-醛基-1h-吲哚-4-甲酸甲酯(1.51g,4.46mmol)溶于dmf中,常温下加入对甲苯磺酸一水合物(0.11g,0.58mmol)、对甲苯磺酰肼(1.08g,5.8mmol),随后加入环丁砜12ml,随后升温至100℃维持1小时。反应液冷却至室温,分批加入氰基硼氢化钠,升温至100℃维持2小时,然后降至室温,继续搅拌16小时。反应液加水稀释,用乙酸乙酯萃取,合并有机相用冷水、盐水洗涤,无水硫酸钠干燥,真空浓缩,柱层析得到产物,产率34%。
[0108]
步骤3.中间体6-溴-仲丁基-3-甲基-1h-吲哚-4-甲酸的制备
[0109][0110]
参照实施例1步骤2的方法,水解得到目标化合物,产率90%。
[0111]
步骤4.中间体6-溴-1-仲丁基-n-((4,6-二甲基-2-氧-1,2-二氢吡啶-3基)甲基)3-甲基-1h-吲哚4-甲酰胺的制备
[0112][0113]
参照实施例1步骤3的方法,得到目标化合物,产率73%。
[0114]
步骤5.1-(仲丁基)-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-3-甲基-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺的制备
[0115][0116]
参照实施例1步骤4的方法,偶联得到目标化合物,产率24%。
[0117]1h nmr(400mhz,dmso)δ12.10(s,1h),11.45(s,1h),8.18(t,j=4.9hz,1h),7.64(s,1h),7.36(dd,j=6.5,3.9hz,2h),7.28(s,1h),7.17(s,1h),6.51(s,1h),5.86(s,1h),4.53(d,j=7.0hz,1h),4.35(d,j=4.9hz,2h),3.60(s,3h),2.24(s,3h),2.17(s,3h),2.10(s,3h),1.83(dd,j=11.2,7.3hz,2h),1.42(d,j=6.7hz,3h),0.74(t,j=7.3hz,3h).
[0118]
实施例10:1-环己基甲基-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-3-甲基-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物10)的制备
[0119][0120]
以溴甲基环己烷为原料,参照实施例9的方法,得到目标化合物,产率27%。
[0121]1h nmr(400mhz,dmso)δ12.10(s,1h),11.47(s,1h),8.15(s,1h),7.59(s,1h),7.35(s,2h),7.16(d,j=9.1hz,2h),6.51(s,2h),4.38(d,j=4.7hz,2h),3.99(d,j=7.0hz,2h),3.75
–
3.48(m,3h),2.35(d,j=15.6hz,3h),2.17(s,3h),2.09(s,3h),1.75(s,1h),1.63(s,2h),1.51(d,j=13.1hz,2h),1.23(m,4h),1.18
–
1.06(m,3h),0.98(d,j=11.6hz,6h).
[0122]
实施例11:1-(仲丁基)-3-甲基-n-((1-甲基-3-氧代-2,3,5,6,7,5,6,7,8-六羟基喹啉-4-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物11)的制备
[0123][0124]
参照实施例9的方法,其中步骤4以4-(氨甲基)-1-甲基-5,6,7,8-四氢异喹啉-3(2h)-酮为原料,得到目标化合物,产率20%。
[0125]1h nmr(400mhz,dmso)δ12.10(s,1h),11.48(s,1h),8.15(t,j=4.9hz,1h),7.65(s,1h),7.35(dd,j=8.0,5.3hz,2h),7.28(s,1h),7.18(s,1h),6.52(s,1h),4.53(d,j=7.2hz,1h),4.39(d,j=4.8hz,2h),3.60(s,3h),2.78(s,2h),2.37(s,2h),2.19(s,3h),2.09(s,3h),1.92
–
1.74(m,2h),1.63(s,4h),1.42(d,j=6.6hz,3h),0.74(t,j=7.3hz,3h).
[0126]
实施例12:1-(环己基甲基)-3-甲基-n-((1-甲基-3-氧代-2,3,5,6,6,6,7,8-六羟基喹啉-4-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲哚-4-甲酰胺(化合物12)的制备
[0127][0128]
参照实施例9的方法,其中步骤1以溴甲基环己烷为原料,步骤4以4-(氨甲基)-1-甲基-5,6,7,8-四氢异喹啉-3(2h)-酮为原料,得到目标化合物,产率23%。
[0129]1h nmr(400mhz,dmso)δ12.10(s,1h),11.45(s,1h),8.18(t,j=4.9hz,1h),7.59(s,1h),7.43
–
7.24(m,1h),7.15(d,j=8.0hz,2h),6.47(d,j=34.1hz,1h),5.81(d,j=40.1hz,1h),4.35(d,j=4.8hz,2h),3.99(d,j=6.9hz,2h),3.60(s,3h),2.23(s,3h),2.17(d,j=14.8hz,3h),2.10(s,4h),1.21(d,j=17.0hz,4h),1.14(m,8h),0.98(m,3h).
[0130]
实施例13:1-环戊基-n-((4,6-二甲基-2-氧代-1,2-二氢吡啶-3-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)-1h-吲唑-4-甲酰胺(化合物13)的制备
[0131][0132]
以溴代环戊烷和6-溴-1h-吲唑-4-甲酸为原料,参照实施例1的方法,得到目标化合物,产率26%。
[0133]1h nmr(400mhz,dmso)δ12.23(s,1h),11.60(s,1h),8.56(s,1h),8.34(s,1h),7.96(s,1h),7.77(s,1h),7.54(s,1h),7.39(s,1h),6.54(s,1h),5.88(s,1h),5.26(s,1h),4.40(s,2h),3.62(s,3h),2.23(s,3h),2.12(s,3h),2.02-1.96(m,4h),1.92-1.88(m,2h),1.67-1.62(m,2h).
[0134]
实施例14:1-环戊基-n-((1-甲基-3-氧代-2,3,5,6,7,8-六羟基喹啉-4-基)甲基)-6-(6-甲基-7-氧代-6,7-二氢-1h-吡咯[2,3-c]吡啶-4-基)-1h-吲唑-4-甲酰胺(化合物14)的制备
[0135][0136]
参照实施例1的方法,其中步骤1以溴代环戊烷和6-溴-1h-吲唑-4-甲酸为原料,步骤3以4-(氨甲基)-1-甲基-5,6,7,8-四氢异喹啉-3(2h)-酮为原料,得到目标化合物,产率32%。
[0137]1h nmr(400mhz,dmso)δ12.22(s,1h),11.59(s,1h),8.54(s,1h),8.34(s,1h),7.95(s,1h),7.75(s,1h),7.53(s,1h),7.38(s,1h),6.53(s,1h),5.26(t,j=8.0hz,1h),4.42(d,j=4.4hz,2h),3.61(s,3h),2.76(s,2h),2.37(s,2h),2.11-1.98(m,4h),2.07
–
1.94(m,2h),1.88(s,2h),1.70-1.64(m,2h),1.63(s,5h).
[0138]
以下通过实验例证明本发明化合物的有益效果。
[0139]
实验例1:体外酶抑制测定
[0140]
1、实验方法
[0141]
his标记的ezh2或brd4被克隆、表达并且纯化为同质。ezh2或brd4结合和抑制通过
使用alaphascreen技术检测生物素化的h4-四乙酰基肽(anaspec,h4k5/8/12/16(ac),生物素标记的)与靶标的相互作用来评价。在384-孔proxiplate中,在dmso中的化合物稀释系列的存在下,将brd4(2nm最终)在50mm hepes(ph 7.3)、10mm nacl、0.25mm tcep、0.1%(w/v)bsa和0.005%(w/v)brij-35中与肽(15nm最终)合并。在室温25摄氏度温育20分钟后,将α链霉亲和素供体珠和受体珠添加至5μg/ml的最终浓度。在2个小时的平衡之后,在envison仪器上读取板并使用拟合计算ic
50
。
[0142]
以gsk126(一种已知的选择性ezh2抑制剂),jq1(一种已知的bet溴结构域抑制剂)为阳性对照。
[0143]
2、实验结果
[0144]
表1.化合物对酶的抑制活性。
[0145][0146]
可以看出,本发明化合物能够有效抑制ezh2或brd4的活性,特别是化合物1-3、5能够同时有效抑制ezh2和brd4的活性。
[0147]
实验例2:体外肿瘤细胞抑制测定
[0148]
1、实验方法
[0149]
胰腺癌细胞株aspc-1(人转移胰腺癌细胞)和bxpc-3(人原位胰腺癌细胞)均购自于美国标准生物品收藏中心(american type culture collection,atcc),rpmi 1640培养基,胎牛血清(fbs)均购买自美国gibico公司;青霉素和链霉素购自大连宝生物公司;培养细胞用平皿和96孔板等购买于corning公司;各种规格的离心管购自bd公司;mtt试剂购自日本同仁化学研究所(donjindo)。
[0150]
细胞培养条件均用含10%胎牛血清(fbs)、100iu/ml青霉素、100μg/ml链霉素的常
规高糖rpmi1640完全培养基培养于37℃、5%co2的培养箱中培养。
[0151]
为了检测新化合物对细胞的增殖影响。收集处于对数生长期的细胞,调整细胞浓度为1000~2000个/ml的单细胞悬液,按照每孔100ul接种于96孔板中。将化合物储备液(10mm/l溶于dmso)用培养基稀释成不同浓度,采用三倍稀释法。按每孔100ul的体积加入96孔板中,最高浓度为30um,最低浓度为0.1um,每个药物浓度设置3个复孔,并用含0.1%dmso培养基和纯培养基处理细胞作为阴性对照,置细胞培养箱中继续培养6天,采用mtt检测细胞线粒体脱氢酶活性,并计算新化合物对肿瘤细胞的半数有效抑制浓度(ic
50
,μm)值(表1)。
[0152]
2、实验结果
[0153]
表2.化合物对肿瘤细胞株的增殖抑制活性
[0154]
实施例aspc-1ic
50
(μm)bxpc-3(μm)11.63.221.23.331.73.844.47.953.47.363.28.774.012.3815.113.694.39.1108.48.7119.213.812>20>201320.117.21415.218.1gsk12610.213.7jq13.71.4
[0155]
可以看出,本发明化合物能够有效抑制aspc-1(人转移胰腺癌细胞)和bxpc-3(人原位胰腺癌细胞)的活性。
[0156]
综上,提供了一类苯并杂环-吡啶酮衍生物及其制备方法和用途。实验结果表明,本发明化合物能够有效抑制ezh2或brd4的活性,特别是化合物1-3、5能够同时有效抑制ezh2和brd4的活性。因此,本发明化合物可以用于制备ezh2和/或brd4抑制剂,以及预防和/或治疗与ezh2和/或brd4活性有关疾病(包括但不限于滤泡性淋巴瘤、弥漫性大b细胞淋巴瘤、乳腺癌、肺癌、结直肠癌、前列腺癌、胃癌、炎症、胰腺癌、心血管疾病、中枢神经系统疾病、免疫缺陷病毒感染)的药物。对肿瘤细胞株的增殖抑制活性实验进一步证实了,本发明化合物能够有效抑制aspc-1(人转移胰腺癌细胞)和bxpc-3(人原位胰腺癌细胞)的活性。因此,本发明化合物可以用于制备预防和/或治疗胰腺癌(包括转移性胰腺癌或原位胰腺癌)的药物。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1