miR11334及其在植物抗病毒中的应用
mir11334及其在植物抗病毒中的应用
技术领域
1.本发明属于生物技术领域,具体涉及mir11334及其相关生物材料在抗黄瓜绿斑驳花叶病毒中的应用。
背景技术:
2.微小rna(microrna,mirna)是一类内源性的单链、非编码小rna分子,植物mirna可通过指导剪切或抑制翻译等方式调控下游靶基因的表达,参与响应生物和非生物胁迫等多个生命过程。当病原物入侵时,一些植物mirna可发生上调或下调表达,进而通过抑制防御反应中的负调控因子或促进防御反应中的正调控因子来行使功能,这使得mirna介导的抗性具有更高的特异性。因此,利用mirna介导的抗病品种培育研究具有较大发展潜力和应用前景。
3.黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,cgmmv)是一种全球范围的检疫性有害生物,由其引起的绿斑驳花叶病毒病已成为黄瓜、西瓜和甜瓜等葫芦科作物产量和品质的主要制约因素之一。培育抗病性强且抗性稳定的新品种是防治黄瓜绿斑驳花叶病毒病的根本措施,而利用分子生物学技术获得抗性品种已成为稳定、长期且经济有效的策略。因此,鉴定和筛选黄瓜内源mirna及其调控的抗病毒关键基因,系统探究黄瓜mirna介导的抗病毒分子机制,可为培育安全、稳定的抗病品种提供理论基础和技术支持。
技术实现要素:
4.有鉴于此,本发明针对现有技术存在的问题,提供了一种与植物抗病性相关的mir11334及其应用。
5.本发明所提供一种mir11334,其核苷酸序列是seq id no.1,其中,seq id no.1由25个核苷酸组成;其前体序列是seq id no.3,其中,seq id no.3由119个碱基组成。
6.与mir11334相关的生物材料也属于本发明的保护范围。
7.与mir11334相关的生物材料为表达盒,所述表达盒包含编码所述的mirna分子的核酸分子。
8.其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
9.在本发明的一个实施方式中,编码所述的mir11334分子的核酸分子如seq id no.4。
10.与mir11334相关的生物材料为重组载体,所述重组载体包含编码所述的mir11334的核酸分子、或编码抑制所述的mir11334分子的核酸分子、或所述的表达盒。
11.与mir11334相关的生物材料为重组微生物,所述重组微生物包含编码所述的mir11334的核酸分子、或编码抑制所述的mir11334分子的核酸分子、或所述的表达盒、或所述的重组载体。
12.与mir11334相关的生物材料为转基因植物细胞系,所述转基因植物细胞系包含编码所述的mir11334的核酸分子、或编码抑制所述的mir11334分子的核酸分子、或所述的表达盒、或所述的重组载体。
13.所述的mir11334分子、所述的表达盒、或所述的重组载体、或所述的重组微生物、或所述的转基因植物细胞系可用于调控植物抗病性。
14.在本发明的一个具体的实施方式中,上述表达盒,是指能够在宿主细胞中转录加工后形成mir11334的dna,该dna不但可包括启动mir11334基因转录的启动子,还可包括终止mir11334基因转录的终止子;
15.进一步地,所述表达盒还可包括增强子序列。
16.可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异的启动子和诱导型启动子。启动子的例子包括但不限于:花椰菜花叶病毒的组成型启动子35s;合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(nos终止子)、花椰菜花叶病毒camv 35s终止子。
17.在本发明的实施例中,所述的表达盒中启动所述mir11334转录的启动子为camv 35s启动子,终止所述mir11334转录的终止子为农杆菌胭脂碱合成酶终止子(nos终止子)。
18.在本发明的实施例中,所述载体可为质粒、噬菌体或病毒载体。
19.所述重组载体可为表达上述mir11334分子的表达载体,具体为含有seq id no.4的重组表达载体,其出发载体可以为pcambia1304。
20.在本发明的一个具体的实施方式中,所述重组载体为pcambia1304-mir11334。具体的,所述pcambia1304-mir11334为将119bp的dna片段(seq id no.4所示的dna片段)通过同源重组整合到pcambia1304载体中得到的重组载体。
21.在本发明的一个具体的实施方式中,所述重组载体可为表达抑制mir11334表达的核酸分子的表达载体。具体的,可为seq id no.2的重组载体。所述重组载体,是指将长度为134bp的mir11334的短串联靶标模拟(short tandem target mimic,sttm)序列(seq id no.2所示的dna片段)通过同源重组整合到ptrv2载体中获得的载体ptrv2:sttm-mir11334。
22.其中,sttm是一段长度为48个碱基的特定序列:
23.gttgttgttgttatggtctaatttaaatatggtctaaagaagaagaat,将两个tm(target mimic)连接起来,在两个tm上的mirna切割位点处,都有一个由3个碱基(cta)构成的突起结构,由于这个凸起的存在,导致mirna能与其结合但无法真正的对其切割,进而起抑制mirna功能的作用。因此,可利用该载体表达mirna的靶标模拟序列来沉默植物内源mirna。
24.可通过基于烟草脆裂病毒(tobacco rattle virus,trv)的mirna沉默(virus-based microrna silencing,vbms)技术在黄瓜中瞬时沉默mir11334。所述重组载体为ptrv2:sttm-mir11334载体,ptrv2:sttm-mir11334载体是将seq id no.2所示片段导入ptrv2载体获得的重组载体。
25.本发明提供了一种培育抗病性增强的转基因植物的方法,包括沉默受体植物中的所述mir11334分子,获得抗病性高于所述受体植物的转基因植物。
26.具体的,可采用基于烟草脆裂病毒(tobacco rattle virus,trv)的mirna沉默(virus-based microrna silencing,vbms)技术在黄瓜中瞬时沉默mir11334。在本发明的实施例中,是通过用含有ptrv1的重组微生物和含有ptrv2:sttm-mir11334载体的重组微生
物共同转染所述受体植物获得。
27.本发明还提供了一种培育抗性降低的转基因植物的方法,包括向受体植物中导入所述的mir11334分子、或编码所述mir11334分子的核酸分子、或包含编码所述mir11334分子的核酸分子的表达盒、或包含编码所述mir11334分子的核酸分子的重组载体,获得抗病性低于所述受体植物的转基因植物的步骤。
28.所述培育抗性降低的转基因植物的方法中,具体的,所述方法是通过将编码所述mir11334分子的核酸分子导入受体植物,筛选获得过表达所述的mir11334分子的转基因植物,获得抗病性低于所述受体植物的转基因植物。
29.在本发明的具体实施例中,编码所述mir11334分子的核酸分子是通过重组载体pcambia1304-mir11334导入受体植物。
30.所述培育抗性降低的转基因植物的方法或者培育抗病性增强的转基因植物的方法中,通过使用所述的重组微生物向所述向受体植物中导入所述的表达mir11334分子的核酸分子、所述的表达盒、或所述的重组载体。
31.在本发明的实施方式中,所述的重组微生物可为酵母、细菌、藻或真菌。所述细菌可为农杆菌;所述农杆菌具体可为eha105农杆菌或gv3101农杆菌。
32.在本发明的具体实施例中,所述培育抗病性增强的转基因植物的方法中,所述重组微生物为含有ptrv1的gv3101农杆菌和含有载体ptrv2:sttm-mir11334的gv3101农杆菌。
33.培育抗性降低的转基因植物的方法中,所述重组微生物为含有所述重组载体pcambia1304-mir11334的eha105农杆菌。
34.上述方法中,所述转基因植物的抗病性高于所述受体植物体现在如下a1)-a2)中的全部或部分:
35.a1)所述转基因植物中cgmmv rna的积累量低于所述受体植物;
36.a2)所述转基因植物叶片上的褪绿、黄化斑点少于所述受体植物。
37.上述方法中,所述转基因植物的抗病性低于所述受体植物体现在如下a3)-a5)中的全部或部分:
38.a3)所述转基因植物中cgmmv rna的积累量高于所述受体植物;
39.a4)所述转基因植物中cgmmv外壳蛋白的积累量高于所述受体植物;
40.a5)所述转基因植物叶片上的褪绿、黄化斑点多于所述受体植物。
41.在本发明的实施例中,所述的转基因植物细胞系不包括植物的繁殖材料。
42.在本发明的实施例中,所述调控植物抗病性为提高植物抗病性,具体体现在如下b1)-b2)中的全部或部分:
43.b1)当植物中mir11334的表达量降低时,所述植物中cgmmv rna的积累量减少;
44.b2)当植物中mir11334的表达量降低时,述植物叶片上的褪绿、黄化斑点减少。
45.在本发明的另一实施例中,所述调控植所物抗病性为降低植物抗病性,具体体现在如下b3)-b5)中的全部或部分:
46.b3)当植物原生质体中mir11334表达量提高时,所述植物中cgmmv rna的积累量增多;
47.b4)当植物原生质体中mir11334表达量提高时,所述植物中cgmmv外壳蛋白的积累量增多;
48.b5)当植物原生质体中mir11334表达量提高时,所述植物叶片上的褪绿、黄化斑点增多。
49.上述方法中,所述植物为双子叶植物;所述双子叶植物可为黄瓜;所述黄瓜具体可为新泰密刺黄瓜。
50.上述方法中,所述转基因植物理解为不仅包含将所述基因转化目的植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物包括原生质体、种子、完整植株和细胞。
51.本发明采用生物信息学预测、分子克隆技术、农杆菌介导的转化、基于烟草脆裂病毒的mirna沉默(virus-basedmicrorna silencing,vbms)、实时荧光定量pcr、western blot等多种生物学手段,以沉默mir11334或过表达mir11334的黄瓜为研究对象,以转入空载体pcambia1304或ptrv1+ptrv2的黄瓜为对照,首次沉默或过表达了mir11334,通过测定cgmmv接种后病毒rna积累量和外壳蛋白积累量,观察病害发生后叶片上的褪绿、黄化斑点,从分子生物学角度研究了mir11334对染病植物受损伤程度的影响。证明了与对照组植物相比,沉默mir11334的转基因植物的抗病性高于对照组植物,过表达mir11334的转基因植物的抗病性低于对照组植物,说明mir11334是与植物抗病性相关的微小rna,可用于调控目的植物的抗病性。
附图说明
52.图1为黄瓜mir11334的短串联靶标模拟序列示意图;
53.图2为黄瓜mirna vbms沉默实验流程;
54.图3为沉默mir11334黄瓜中mir11334的定量分析;
55.图4为沉默mir11334黄瓜中cgmmv rna积累量的分析;
56.图5为过表达mir11334黄瓜原生质体中mir11334的定量分析;
57.图6为过表达mir11334黄瓜原生质体中cgmmv rna积累量的分析;
58.图7为过表达mir11334黄瓜原生质体中cgmmv外壳蛋白(coat protein,cp)积累量的分析。
59.其中,图3-图4中trv:00代表空白对照组(使用ptrv1+ptrv2混合菌液,按照1:1比例混合后浸润黄瓜幼苗);
60.图3-图4中ts代表瞬时沉默(transient silencing);
61.图5-图7中ev代表空载体(empty vector);
62.图5-图7中oe代表过量表达(over expression)。
具体实施方式
63.以下将配合实施例来详细说明本发明的实施方式,借此对本发明如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
64.本发明实施例中的实验方法,如无特殊说明,均为常规方法。
65.本发明实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
66.本发明实施例中的根癌农杆菌eha105可从上海唯地生物技术有限公司购买。
67.本发明实施例中的农杆菌感受态细胞gv3101可从上海唯地生物技术有限公司购买。
68.本发明实施例中的黄瓜自交系“新泰密刺”购自山东省新泰市新泰密刺黄瓜原种场。
69.本发明实施例中的过量表达载体pcambia1304,可从湖南丰晖生物科技有限公司购买。
70.本发明实施例中的载体ptrv1、ptrv2可从湖南丰晖生物科技有限公司购买。
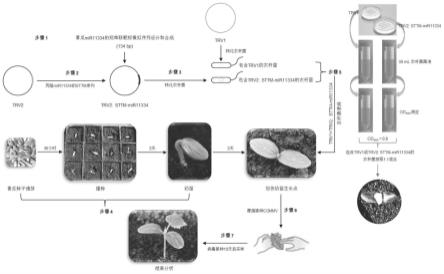
71.本发明中的mir11334成熟序列为序列表中seq id no.1所示的rna分子。
72.本发明中的mir11334前体序列为序列表中seq id no.3所示的rna分子。
73.本发明中的用于沉默mir11334的核酸序列为序列表中seq id no.2所示的dna分子。
74.本发明中的用于构建过表达mir11334的载体所用的核酸序列为序列表中seq id no.4所示的dna分子。
75.本发明以转mir11334的黄瓜为研究对象,以野生型新泰密刺黄瓜为对照,通过检测挑战接种黄瓜绿斑驳花叶病毒的受体植物中病毒rna的积累量和病毒蛋白的含量,从分子生物学的角度研究了mir11334对染病植物受损伤程度的影响,证明了mir11334对植物抗病途径的调控。本发明对揭示mir11334的抗病功能及抗病黄瓜品种的培育具有重大意义,有助于丰富蔬菜育种资源。
76.实施例1、mir11334在调控黄瓜抗病性中的应用
77.一、沉默mir11334对黄瓜抗病性的影响
78.设计并合成mir11334的短串联靶标模拟(short tandem targets mimic,sttm)序列(图1),采用基于烟草脆裂病毒(tobacco rattle virus,trv)的mirna沉默技术(virus-based microrna silencing,vbms),在黄瓜幼苗中沉默mir11334,试验流程见图2。
79.1、沉默mir11334载体构建和黄瓜获得
80.(1)沉默载体ptrv2:sttm-mir11334的构建和转化农杆菌
81.人工合成mir11334的sttm片段(seq id no.2),使用infusion hd cloning kit(购自takara公司)将上述目的片段克隆入ptrv2载体(购自湖南丰晖生物科技有限公司),获得ptrv2:sttm-mir11334载体,取2.5μlin-fusion反应液将ptrv2:sttm-mir11334载体转化入大肠杆菌感受态细胞stellar(购自北京全式金生物技术有限公司);将测序分析鉴定为阳性的ptrv1(购自湖南丰晖生物科技有限公司)、ptrv2:sttm-mir11334的质粒dna分别转入农杆菌gv3101感受态细胞(购自上海唯地生物技术有限公司)中,挑取单菌落进行菌落pcr验证,提取质粒dna进行测序。
82.(2)沉默mir11334黄瓜的获得
83.采用基于病毒的mirna沉默(virus-based microrna silencing,vbms)技术在黄瓜中瞬时沉默mir11334。具体步骤如下:
84.①
新泰密刺黄瓜种子经催芽后,播种于塑料花盆,放置于植物生长培养箱生长;
85.②
当黄瓜幼苗第一片真叶生长点露出时(约5-7天),在黑暗条件下,用刀片轻轻造成微小伤口,用浸润液复苏的含有ptrv1和ptrv2:sttm-mir11334载体的农杆菌(按照1:1的比例混合)浸湿棉花,并放置在微伤口处;使用ptrv1+ptrv2混合菌液(按照1:1的比例混合)
处理作为空白对照;以转入ptrv1和ptrv2:pds的农杆菌(按照1:1的比例混合)作为沉默指示对照组,其中ptrv2:pds(pds为八氢番茄红素去饱和酶,phytoene desaturase,登录号abe99707)具体为将pds的片段插入ptrv2载体的cp和rz之间,替换原有的mcs,进而获得ptrv2:pds。每间隔2h将棉花团用相应菌液再次润湿,重复3次,浸润完成后移去带有菌液的棉花团,将黄瓜幼苗置于植物生长培养箱中,在16h光照,8h黑暗条件下生长,并在生长期间按需进行浇水。
86.2、沉默mir11334对黄瓜抗病性的影响
87.(1)黄瓜幼苗处理后生长约10天,当第一片真叶展开时,摩擦接种cgmmv。黄瓜植株生长第15-20天,对植株上第2片以及第3片叶片进行采样,提取总rna,采用实时荧光定量pcr方法分别检测mir11334的表达水平以及cgmmv病毒rna积累情况。
88.(2)分别采用mir11334、cgmmv的特异性引物进行qrt-pcr检测,并采用2
‑△△
ct
法对mir11334的及cgmmv外壳蛋白基因的相对表达量进行计算,分析表达情况。
89.mir11334的上游引物序列为:
[0090]5’‑
gcgggaattactataataacaccttcac-3’[0091]
下游通用引物由mircute增强型mirna荧光定量检测试剂盒(sybr)(fp411,购自天根生化科技(北京)有限公司)提供;
[0092]
内参基因ef-1a的上游引物序列为:
[0093]5’‑
actggtggttttgaggctggt-3’[0094]
下游引物序列为:5
’‑
cttggagtatttgggtgtggt-3’;
[0095]
内参基因ubiquitin的上游引物序列为:
[0096]5’‑
ctaatggggagtggggaagta-3’[0097]
下游引物序列为:5
’‑
gtctggatggacaatgttgat-3’;
[0098]
cgmmv外壳蛋白基因的qpcr引物序列为:
[0099]
上游5
’‑
acagccgctagggctgagata-3’[0100]
下游5
’‑
ccaatgagcaaaccgttcgat-3’。
[0101]
结果显示:在转染含ptrv1的农杆菌和含ptrv2:sttm-mir11334的农杆菌获得的沉默mir11334的黄瓜中(图中ts-mir11334),相对于转空载体(ptrv1+ptrv2)对照(图中trv:00),mir11334的表达水平降低至0.59(相对于野生型的相对表达量,图3),cgmmv rna的积累量降低至0.30(相对于野生型的相对表达量,图4)。沉默mir11334的黄瓜叶片上的褪绿、黄化斑点少于转空载体对照。
[0102]
综上所述,与对照组植物相比,沉默mir11334的转基因植物的抗病性高于对照组植物,mir11334是与植物抗病性相关的微小rna,可用于调控目的植物的抗病性。
[0103]
二、过表达mir11334对黄瓜抗病性的影响
[0104]
1、过表达mir11334载体构建和黄瓜获得
[0105]
采用gateway技术构建过表达载体pcambia1304-mir11334,并采用根瘤农杆菌介导的原生质体法进行黄瓜的遗传转化,通过定量pcr和western blot检测得到的转mir11334的黄瓜。具体步骤如下:
[0106]
(1)过表达载体pcambia1304-mir11334的构建
[0107]
人工合成的mir11334序列长度为119bp(seq id no.4所示的dna片段),将上述dna
片段通过gateway技术构建到入门载体pentr(购自invitrogen公司)中,然后使用gateway lr clonase tmⅱenzymen mix(购自invitrogen公司)通过lr反应将该dna片段进行同源重组整合到过表达载体pcambia1304中,得到过表达载体pcambia1304-mir11334。
[0108]
(2)重组菌的构建
[0109]
将步骤(1)构建的过表达载体pcambia1304-mir11334导入根瘤农杆菌eha105中,得到含有过表达载体pcambia1304-mir11334的重组菌eha105/pcambia1304-mir11334。
[0110]
(3)过表达mir11334黄瓜的获得
[0111]
根据已建立的方法制备黄瓜原生质体,分别与含有过量表达载体pcambia1304-mir11334的质粒dna共同孵育(原生质体peg介导的遗传转化),具体步骤如下:
[0112]
①
黄瓜种子催芽:选取适量新泰密刺黄瓜种子,使用75%乙醇消毒20s,弃去乙醇,用灭菌水洗涤4-5次,洗去残余的乙醇,洗涤后倒去灭菌水,加入2%-3%次氯酸钠消毒黄瓜种子,放入摇床150rpm、6min消毒,弃去次氯酸钠,用灭菌水洗涤4-5次,洗去残余的次氯酸钠,洗涤后倒去灭菌水,将消毒过的种子摆在湿润的无菌滤纸片上,黑暗条件催芽24h。
[0113]
②
黄瓜种子带毒处理:黄瓜绿斑驳花叶病毒(cucumber green mottle mosaic virus,cgmmv)侵染性克隆作为毒源,使用浸润液复苏重悬,利用负压法使催芽的种子带毒。播种带毒种子于塑料花盆中,培养与实验室植物生长培养箱中,温度25℃,光周期16h/8h白天/夜晚,湿度40-60%,在植株生长期间按需浇水。
[0114]
③
材料选取及酶解:取生长周期为7-12天的平展健康的黄瓜子叶。用锋利的手术刀片将黄瓜子叶切成0.5-1.0mm的长条,放于配置好的纤维素酶解液中(20ml),每份样品约切取40片黄瓜子叶,在40rpm的摇床上酶解4-5h。
[0115]
表1.纤维素酶解液的配制
[0116][0117]
④
获得原生质体:酶解完成后,将等体积预先进行过预冷的w5溶液,加入在用于酶解黄瓜子叶的酶解液当中,混匀,以终止反应,使用预先用w5润湿的尼龙膜将酶解产物过滤。200g,4℃离心2min,弃去上清,加入10ml w5溶液重悬(预冷),200g,4℃离心2min,弃去上清,重复一次保留少许上清重悬,放置于冰上,静置30min。
[0118]
表2.w5溶液的配制
[0119][0120]
⑤
转化:
[0121]
a.按实验需求,将50ml圆底离心管中冰浴后的原生质体分装到2ml离心管中,150g离心2min,弃去上清,使用适量mmg溶液重悬原生质体,使之浓度为每毫升约2
×
106个。
[0122]
表3.mmg溶液的配制
[0123][0124]
b.加入20μg浓度为1μg/μl的含有过量表达载体pcambia1304-mir11334的质粒至新的2ml离心管中,并加入100μl原生质体(约2
×
105个)轻柔混合。
[0125]
c.加入120μl 20%peg 4000溶液,轻柔混匀至无分层,横放,诱导混合物转化约15min。
[0126]
d.室温下在诱导样品中加入600μl的w5溶液,并轻轻混合,终止转化反应。25℃,150g离心2min,弃去上清。加入500μl wi溶液重新悬起黄瓜原生质体,室温避光培养24h左右,收集转化后的黄瓜原生质体。
[0127]
表4.wi溶液的配制
[0128][0129]
2、过表达mir11334对黄瓜抗病性的影响
[0130]
(1)采用qrt-pcr方法检测转化后的黄瓜原生质体中mir11334的表达水平和cgmmv rna的积累量,同时采用western blot方法检测黄瓜原生质体蛋白中cgmmv cp的积累量。
[0131]
(2)分别采用mir11334、cgmmv的特异性引物进行qrt-pcr检测,并采用2
‑△△
ct
法对mir11334及cgmmv外壳蛋白基因的相对表达量进行计算,进而分析表达情况。
[0132]
结果表明:在瞬时过量表达mir11334的黄瓜原生质体(oe-mir11334)中,相比转空载体对照(ev),mir11334的表达水平增加了10.58倍(图5),cgmmv rna积累量增加了3.37倍(图6);同时,western blot检测结果显示cgmmv cp蛋白的积累量增加了1.31倍(图7)。过表
达mir11334的黄瓜叶片上的褪绿、黄化斑点多于转空载体对照。
[0133]
综上所述,与对照组植物相比,过表达mir11334的转基因植物的抗病性低于对照组植物,说明mir11334是与植物抗病性相关的微小rna,可用于调控目的植物的抗病性。
[0134]
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
[0135]
[0136]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1