一种在碱性条件下制备含羧酸酯片段的尿嘧啶类化合物的方法与流程
本发明涉及农药除草剂领域,具体涉及一种制备含羧酸酯片段的尿嘧啶类化合物的方法。该尿嘧啶类化合物可用于制备除草剂2-氯-4-氟-5-(3-甲基-2,6-二氧代-4-(三氟甲基)-3,6-二氢嘧啶-1(2h)-基)苯甲酸酯化合物。
背景技术:
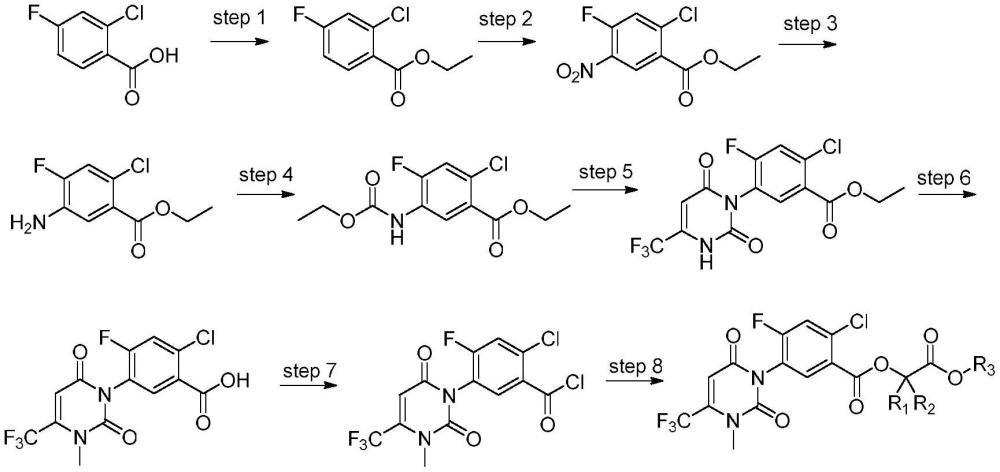
1、专利cn114621150a报道了一种含羧酸酯片段的尿嘧啶类化合物的制备方法:
2、
3、专利cn114621150a还报道了以下合成方法:
4、
5、上式中:
6、r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
7、r3选自c2~5烷基、ch3ch=chch2-、被一个或多个卤素取代的c3~6烯基、ch3c≡cch2-、被一个或多个卤素取代的c3~6炔基、c4~7环烷基、c3~6环烷基-c1~3烷基或c1~6卤素取代烷基;
8、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物。
9、现有的制备尿嘧啶类化合物除草剂的方法大多采用先将羧基进行酯化保护再合成尿嘧啶环,然后进行一步水解,再与相应的片段拼接合成最终化合物。此方法水解步骤条件需强酸条件下高温反应,反应条件剧烈,易产生杂质,同时对反应装置的材质要求比较严格,大多数水解方法采用盐酸醋酸体系,产生大量废酸难以回收,且强酸具有腐蚀性,操作时易发生危险,存在着原子经济效益差、步骤长、成本高、收率低、不环保、后处理困难等问题。目前尿嘧啶类化合物除草剂的制备的关键步骤在于尿嘧啶环的合成,现有报道尿嘧啶类化合物除草剂的成环方法大多比较单一,不利于工业化开发。
技术实现思路
1、本发明要解决的技术问题是:针对现有技术的不足,提供一种在碱性条件下制备含羧酸酯片段的尿嘧啶类化合物的方法。
2、本发明解决上述技术问题的技术方案如下:
3、一种在碱性条件下制备含羧酸酯片段的尿嘧啶类化合物的方法,反应式如下:
4、
5、式(v)的化合物在有机溶剂中,与3-氨基-4,4,4-三氟-2-丁烯酸r5基酯在-20℃至溶剂沸点温度下反应,反应在碱的存在下进行,制得尿嘧啶类化合物(vi);
6、其中r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
7、r3选自c1~3烷氧c1~3烷基、c1~3卤代烷氧c1~3烷基、c2~6烯氧c1~3烷基、c2~6卤代烯氧c1~3烷基、c2~6炔氧-c1~3烷基、c2~6卤代炔氧c1~3烷基或c1~3烷s(o)nc1~3烷基,n代表0、1或2;
8、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物;
9、r4、r5分别选自c1~4烷基。
10、优选地,上述的合成方法:
11、r1、r2分别选自氢或甲基;
12、r3选自c1~3烷氧-c1~3烷基、c1~3卤代烷氧-c1~3烷基、c2~6烯氧-c1~3烷基、c2~6卤代烯氧-c1~3烷基、c2~6炔氧-c1~3烷基或c2~6卤代炔氧-c1~3烷基;
13、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物,混合物中,r与s的比例为1:99至99:1;
14、r4、r5分别选自甲基或乙基;
15、有机溶剂选自甲醇、乙醇、异丙醇、丁醇、叔丁醇、环己醇、乙二醇、戊烷、正己烷、环己烷、庚烷、辛烷、二氯甲烷、1,2-二氯乙烷、氯仿、四氯化碳、石油醚、乙醚、甲基叔丁基醚、乙二醇二甲醚、四氢呋喃、1,4-二氧六环、乙酸乙酯、乙酸丁酯、苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、二甲苯、氯苯、丙酮、丁酮、4-甲基-2-戊酮、环己酮、n-甲基吡咯烷酮、乙腈、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺或二甲亚砜;
16、碱选自甲醇钠、甲醇钾、乙醇钠、乙醇钾、叔丁醇钠、叔丁醇钾、正丁基锂,叔丁基锂、二异丙基胺基锂(lda)、六甲基二硅胺基锂(lihmds)、4-二甲氨基吡啶、三乙胺、二异丙基乙胺、吡啶、2-甲基吡啶、1,8-二氮杂二环十一碳-7-烯(dbu)或2,6-卢剔啶,或者nah、nanh2、nahco3、na2co3、k2co3、khco3、cs2co3、naoh、lioh或koh;
17、碱的量在1.0与2.0当量之间;
18、反应温度为室温至溶剂沸点温度下。
19、更优选地,上述的合成方法:
20、有机溶剂选自n,n-二甲基甲酰胺;
21、碱选自k2co3;
22、碱的量在1.0与1.5当量之间;
23、反应温度为100℃。
24、进一步地,本发明还提供了一种合成具有式(v)苯基氨基甲酸酯化合物的方法,反应式如下:
25、
26、式(iv)的化合物在有机溶剂中,与取代甲酸r4基酯在-20℃至溶剂沸点温度下反应,反应在碱的存在下进行,制得化合物(v)。x选自离去基团,例如氟、氯、溴、碘、甲基磺酸酯基、三氟甲基磺酸酯基、苯磺酸酯基或对甲基苯磺酸酯基;
27、其中r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
28、r3选自c1~3烷氧c1~3烷基、c1~3卤代烷氧c1~3烷基、c2~6烯氧c1~3烷基、c2~6卤代烯氧c1~3烷基、c2~6炔氧-c1~3烷基、c2~6卤代炔氧c1~3烷基或c1~3烷s(o)nc1~3烷基,n代表0、1或2;
29、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物;
30、r4选自c1~4烷基。
31、优选地,上述的合成方法:
32、r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
33、r3选自c1~3烷氧c1~3烷基、c1~3卤代烷氧c1~3烷基、c2~6烯氧c1~3烷基、c2~6卤代烯氧c1~3烷基、c2~6炔氧c1~3烷基或c2~6卤代炔氧c1~3烷基;
34、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物,混合物中,r与s的比例为1:99至99:1;
35、r4选自c1~4烷基;
36、x选自卤素,包括氟、氯、溴、碘;
37、有机溶剂选自戊烷、正己烷、环己烷、庚烷、辛烷、二氯甲烷、1,2-二氯乙烷、氯仿、四氯化碳、石油醚、乙醚、甲基叔丁基醚、乙二醇二甲醚、四氢呋喃、1,4-二氧六环、乙酸乙酯、乙酸丁酯、苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、二甲苯、氯苯、丙酮、丁酮、4-甲基-2-戊酮、环己酮、n-甲基吡咯烷酮、乙腈、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺或二甲亚砜;
38、碱选自4-二甲氨基吡啶、三乙胺、二异丙基乙胺、吡啶、2-甲基吡啶、1,8-二氮杂二环十一碳-7-烯(dbu)或2,6-卢剔啶,或者nah、nanh2、nahco3、na2co3、k2co3、khco3、cs2co3、naoh、lioh或koh;
39、碱的量在1.0与2.0当量之间;
40、反应温度为0℃至室温。
41、更优选地,上述的合成方法:
42、r1、r2分别选自氢或甲基;
43、r3选自c1~3烷氧-c1~3烷基、c1~3卤代烷氧-c1~3烷基、c2~6烯氧-c1~3烷基、c2~6卤代烯氧-c1~3烷基、c2~6炔氧-c1~3烷基或c2~6卤代炔氧-c1~3烷基;
44、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物,混合物中,r与s的比例为1:99至99:1;
45、r4选自甲基或乙基;
46、x选自氯;
47、有机溶剂选自二氯甲烷;
48、碱选自吡啶;
49、碱的量在1.0与1.5当量之间;
50、反应温度为0~5℃,后升至室温。
51、上述式(iv)苯胺化合物可以用如下方法制备:
52、
53、具有式(iv)的化合物典型地通过以下方式制备:式(iii)的化合物在水或有机溶剂中,与还原剂在-20℃至溶剂沸点温度下反应,制得化合物(iv)。优选反应温度40~45℃;反应时间为0.5~48小时,优选8~10小时。溶剂可选自水、醇类,如甲醇、乙醇、异丙醇等,醚类如乙醚、四氢呋喃、二氧六环等,优选甲醇。合适的还原剂选自氢气、金属氢化物、半金属氢化物及其衍生物,如氢化铝锂、二异丁基氢化铝、硼氢化钠、硼烷等,优选氢气,压力为1.5-2mpa,同时氢气可由储氢钢瓶提供,也可以由活泼金属(如还原铁粉、还原锌粉等)在酸性条件(如盐酸、硫酸)下原位发生并参与还原反应;在催化量的过渡金属或在催化量过渡金属化合物,其中,过渡金属可是第8副族化合物,优选ni、pd、pt等(直接使用或经由活性炭、三氧化二铝、二氧化硅等介质负载),更优选pt/c(1%),投料比例为式(iii)化合物质量的1%-5%。
54、其中r1、r2、r3的定义如前所述。
55、本发明还提供了一种合成具有式(iii)硝基苯化合物的方法,反应式如下:
56、
57、式(ii)的化合物在有机溶剂中,在碱的存在下,与取代乙酸酯在-20℃至溶剂沸点温度下反应,制得化合物(iii)。碱的量典型地在1.0与3.0当量之间。式中l为离去基团,选自氯、溴、碘、甲基磺酸酯基、三氟甲基磺酸酯基、苯磺酸酯基或对甲基苯磺酸酯基。
58、其中r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
59、r3选自c1~3烷氧c1~3烷基、c1~3卤代烷氧c1~3烷基、c2~6烯氧c1~3烷基、c2~6卤代烯氧c1~3烷基、c2~6炔氧-c1~3烷基、c2~6卤代炔氧c1~3烷基或c1~3烷s(o)nc1~3烷基,n代表0、1或2;
60、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物。
61、优选地,上述的合成方法:
62、r1、r2分别选自氢或甲基;
63、r3选自c1~3烷氧-c1~3烷基、c1~3卤代烷氧-c1~3烷基、c2~6烯氧-c1~3烷基、c2~6卤代烯氧-c1~3烷基、c2~6炔氧-c1~3烷基或c2~6卤代炔氧-c1~3烷基;
64、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物,混合物中,r与s的比例为1:99至99:1;
65、l为离去基团,例如氯、溴、碘、甲基磺酸酯基、三氟甲基磺酸酯基、苯磺酸酯基或对甲基苯磺酸酯基;
66、有机溶剂选自戊烷、正己烷、环己烷、庚烷、辛烷、二氯甲烷、1,2-二氯乙烷、氯仿、四氯化碳、石油醚、乙醚、甲基叔丁基醚、乙二醇二甲醚、四氢呋喃、1,4-二氧六环、乙酸乙酯、乙酸丁酯、苯、甲苯、邻二甲苯、间二甲苯、对二甲苯、二甲苯、氯苯、丙酮、丁酮、4-甲基-2-戊酮、环己酮、n-甲基吡咯烷酮、乙腈、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺或二甲亚砜;
67、碱选自4-二甲氨基吡啶、三乙胺、二异丙基乙胺、吡啶、2-甲基吡啶、1,8-二氮杂二环十一碳-7-烯(dbu)或2,6-卢剔啶,或者nah、nanh2、nahco3、na2co3、k2co3、khco3、cs2co3、naoh、lioh或koh;
68、碱的量在1.0与2.0当量之间;
69、反应温度为0℃至室温。
70、更优选地,上述的合成方法:
71、l选自氯或溴;
72、有机溶剂选自n,n-二甲基甲酰胺;
73、碱选自k2co3;
74、碱的量在1.0与1.5当量之间;
75、反应温度为室温。
76、本发明还进一步提供了一种式(v)的苯基氨基甲酸酯化合物:
77、
78、其中r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
79、r3选自c1~3烷氧c1~3烷基、c1~3卤代烷氧c1~3烷基、c2~6烯氧c1~3烷基、c2~6卤代烯氧c1~3烷基、c2~6炔氧-c1~3烷基、c2~6卤代炔氧c1~3烷基或c1~3烷s(o)nc1~3烷基,n代表0、1或2;
80、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物;
81、r4选自c1~4烷基。
82、优选地,一种式(v)的苯基氨基甲酸酯化合物:
83、r1、r2分别选自氢或甲基;
84、r3选自c1~3烷氧-c1~3烷基、c1~3卤代烷氧-c1~3烷基、c2~6烯氧-c1~3烷基、c2~6卤代烯氧-c1~3烷基、c2~6炔氧-c1~3烷基或c2~6卤代炔氧-c1~3烷基;
85、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物,混合物中,r与s的比例为1:99至99:1;
86、r4选自甲基或乙基。
87、本发明的部分中间体化合物可以用表1中列出的具体化合物来说明,但本发明并不仅限于这些化合物。
88、表1部分通式(v)化合物的结构
89、
90、
91、
92、
93、
94、
95、
96、
97、
98、
99、
100、
101、
102、
103、
104、
105、
106、
107、
108、
109、
110、
111、
112、
113、
114、
115、
116、
117、
118、本发明还提供一种如式(v)所示的苯基氨基甲酸酯化合物在制备式(vi)含羧酸酯片段的尿嘧啶化合物中的应用。
119、
120、式中r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
121、r3选自c1~3烷氧c1~3烷基、c1~3卤代烷氧c1~3烷基、c2~6烯氧c1~3烷基、c2~6卤代烯氧c1~3烷基、c2~6炔氧-c1~3烷基、c2~6卤代炔氧c1~3烷基或c1~3烷s(o)nc1~3烷基,n代表0、1或2;
122、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物;
123、r4、r5分别选自c1~4烷基。
124、本发明制备的如式(vi)所示含羧酸酯片段的的尿嘧啶化合物,可用于制备式(i)的除草剂2-氯-4-氟-5-(3-甲基-2,6-二氧代-4-(三氟甲基)-3,6-二氢嘧啶-1(2h)-基)苯甲酸酯化合物,反应式如下:
125、
126、具有式(i)的化合物典型地通过以下方式制备:式(vi)化合物在有机溶剂中,在碱的存在下,与甲基化试剂在-20℃至溶剂沸点温度下反应,制得化合物(i)。甲基化试剂选自硫酸二甲酯、氯甲烷、溴甲烷、碘甲烷、对甲苯磺酸甲酯或三氟甲磺酸甲酯。优选硫酸二甲酯。合适的碱包括但不限于4-二甲氨基吡啶、三乙胺、二异丙基乙胺、吡啶、2-甲基吡啶、1,8-二氮杂二环十一碳-7-烯(dbu)或2,6-卢剔啶,或者nah、nanh2、nahco3、na2co3、k2co3、khco3、cs2co3、naoh、lioh或koh,优选k2co3。
127、式中r1、r2分别选自氢或甲基;或者r1和r2与所连接的碳一起形成三元环;
128、r3选自c1~3烷氧c1~3烷基、c1~3卤代烷氧c1~3烷基、c2~6烯氧c1~3烷基、c2~6卤代烯氧c1~3烷基、c2~6炔氧-c1~3烷基、c2~6卤代炔氧c1~3烷基或c1~3烷s(o)nc1~3烷基,n代表0、1或2;
129、当r1选自氢、r2选自甲基时,与其相连的碳原子可选自r型或s型,或者为二者的混合物。
130、上面给出的通式化合物的定义中,汇集所用术语一般定义如下:
131、卤素:指氟、氯、溴或碘。烷基:直链或支链烷基,例如甲基、乙基、丙基、异丙基、正丁基、叔丁基或仲丁基及异构体。烯基:直链或支链烯类,例如乙烯基、1-丙烯基、2-丙烯基和不同的丁烯基、戊烯基和己烯基异构体。烯基还包括多烯类,如1,2-丙二烯基和2,4-己二烯基。炔基:直链或支链炔类,例如乙炔基、丙炔基和不同的丁炔基、戊炔基和己炔基异构体。炔基还包括多炔类,如2,4-己二炔基。环烷基:取代或未取代的环状烷基,例如环丁基、环戊基。取代基如甲基、卤素、氰基等。环烷基烷基:取代或未取代的带有环状烷基的烷基,例如环丙甲基、环丁甲基,取代基如甲基、卤素、氰基等。卤代烷基:直链或支链烷基,在这些烷基上的氢原子可部分或全部被卤原子所取代,例如,氯丙基、溴丙基等。烷氧基烷基:烷基-o-烷基-,如ch3och2-。卤代烷氧烷基:烷基-o-烷基-,在这些烷基上的氢原子可部分或全部被卤原子所取代,例如clch2och2-。烯氧烷基:烯基-o-烷基-,例如ch2=chch2och2ch2-。卤代烯氧烷基:烯基-o-烷基-,其中o与ch2=ch并不直接相连,在这些烯基上的氢原子可部分或全部被卤原子所取代,例如clch=chch2och2ch2-。炔氧烷基:炔基-o-烷基-,例如ch≡cch2och2ch2-,其中o与ch≡c并不直接相连。卤代炔氧烷基:炔基-o-烷基-,在这些炔基上的氢原子可被卤原子所取代,例如clc≡cch2och2ch2-。烷s(o)n烷基:烷基-s(o)n-烷基-,n=0,1或2,如ch3sch2ch2-、ch3soch2ch2-、ch3so2ch2ch2-。
132、本发明的前述方法中还可以包括对前述原料进行必要的预处理和对反应产物进行必要的后处理操作,预处理和后处理的操作手段包括但不限于干燥、洗涤、打浆、过滤、离心、柱层析、重结晶等。本发明的实例部分提供了几种具体的处理手段,本领域技术人员不应理解为对本发明的限制。
133、除另有注明外,反应式中各基团定义同前。
134、本发明制备的具有式(i)的除草剂2-氯-4-氟-5-(3-甲基-2,6-二氧代-4-(三氟甲基)-3,6-二氢嘧啶-1(2h)-基)苯甲酸酯化合物对广谱的经济上重要的单子叶和双子叶一年生有害植物具有杰出的杀除活性,可以有效地控制多种杂草,在低剂量下就可以获得很好的效果,可用作除草剂。
135、本发明中化合物的中文命名与结构式有冲突的,以结构式为准;结构式有明显错误的除外。
136、本发明的有益效果在于:本发明的合成思路在于以2-氯-4-氟-5-硝基苯甲酸为起始原料先将侧链小片段与羧基拼接,最后采用不同方法合成尿嘧啶环。避免了保护基策略,提高了原子经济性,缩短了合成总步骤,减少了杂质的生成,极大的提高了原料试剂的利用率。同时,本发明合成尿嘧啶环成环方式多样,为工业化开发提供了很好的思路,有利于向工业化生产转化。原料试剂易得,反应条件温和,操作及后处理简单,产品收率及纯度高,极大降低了成本。
- 还没有人留言评论。精彩留言会获得点赞!