一种靶向μ阿片受体的小分子荧光探针及其制备和应用
一种靶向
μ
阿片受体的小分子荧光探针及其制备和应用
技术领域
1.本发明属于荧光分子探针技术领域,具体涉及一种靶向μ阿片受体的小分子荧光探针及其制备和应用。
背景技术:
2.在临床镇痛治疗中,阿片类药物主要用来治疗严重急性疼痛和癌痛。由于阿片类药物在应用过程中会出现诸多不良反应,长期使用会产生耐受,以及呼吸抑制、便秘等副作用,所以开发新的副作用小、活性更好、剂量更小的小分子选择性阿片受体激动剂,用于有效治疼痛一直是本领域的研究热点。
3.μ阿片受体(mor)普遍参与了阿片类药物诱导的抗痛性、耐受性和依赖性,mor属于g蛋白偶联受体(gpcrs)家族,由内源性阿片肽和外源性阿片类药物如吗啡、芬太尼等激活,调节痛觉通路和免疫功能,因此在临床中是重要的药物作用靶点。
4.目前已发展出多种策略用于mor特异性配体的分析,包括表面等离子体共振(spr)、生物层干涉(bli)、微量热泳动(mst)和放射性配体结合试验。然而,这些方法不是需要高精度的仪器配合,就是需要对mor蛋白进行繁琐的纯化处理,或者需要对辐射安全进行考虑。这将极大地限制现有方法在mor结合分析中的实际应用,特别是在活细胞原位成像和高通量配体筛选时受到严格限制。
5.近年来,对作用于g蛋白偶联受体的小分子荧光探针的研究已经成为受体化学生物学领域的新兴方向和研究热点。最初开发mor的荧光配体通常是通过直接共轭或连接链将荧光基团连接到具有已知性质的药理物上来实现的。例如,7-硝基-2,1,3-苯并氧杂噁二唑(ndb)和4,4-二氟-4-硼砂-3a,4a-二氮杂-s-茚三酮(bodipy)以及荧光素等荧光基团标记的配体已经被合成并用于mor结合分析。然而,需要注意的一点是,这些荧光配体无论是否与受体结合,都会产生恒定强度的荧光发射,所以需要额外的洗涤步骤来去除未结合的配体,这阻碍了其在实时分析中的应用。并且荧光标记配体缺乏有效的荧光开关机制,会随之产生较强的非特异性结合信号,通常导致较低的信噪比。
6.最近,环境响应型的荧光探针已被用于受体结合的原位可视化,这类探针在与受体结合前的自由状态下表现出微弱的背景荧光,但在结合后将表现出明亮的荧光。例如,γ-氨基丁酸(gaba)受体的探针已被设计为由俄勒冈绿荧光基团和加巴嗪拮抗剂组成,该探针在与受体结合时显示亮光荧光用以筛选受体的变构调节剂。催产素受体的探针是高活性拮抗剂与环境敏感的荧光染料尼罗红共轭连接而合成的,基于此,能够在免洗条件下使用荧光显微镜研究活细胞中受体的微环境。
7.然而,现有技术中还未报道过针对mor的这种类型的探针,可能是因为mor结合部位的高度疏水口袋容易使所设计的探针受到非特异性的结合和脱靶效应导致的。因此开发一种针对μ阿片受体结合配体的筛选方法用于筛选大量的活性化合物,发现活性更高的小分子作为先导化合物以用于进一步的药物研发是目前迫切需要解决的问题。
技术实现要素:
8.本发明的目的在于解决现有技术中存在的问题,提供一种靶向μ阿片受体的小分子荧光探针及其制备和在μ阿片受体原位成像与配体高通量筛选领域中的应用。
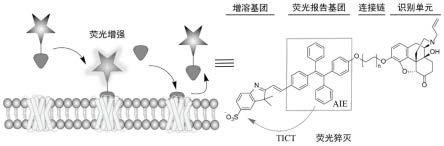
9.本发明的具体技术方案为:一种靶向μ阿片受体的小分子荧光探针,该探针分子tpe[n]n是由mor特异性配体纳洛酮、四苯基乙烯荧光团以及2,3,3-三甲基-3h-吲哚-5-磺酸构建而成的,其结构式如下式(i)所示:
[0010][0011]
其中,2≤n≤6,并且n为整数。
[0012]
进一步地,该荧光探针的合成路线如下:
[0013][0014]
合成步骤为:
[0015]
步骤1、以4-溴二苯甲酮与4-羟基二苯甲酮为原料,在无水thf中通过mcmurry偶联反应生成中间体(ⅱ);
[0016]
步骤2、使用异丙基氯化镁与正丁基锂组合进行溴-金属交换后,加入n,n-二甲基甲酰胺发生格氏反应,将中间体(ⅱ)转化为中间体(iii);
[0017]
步骤3、通过sn2取代反应,中间体(iii)与不同长度的烷基二溴连接,反应得中间体(ⅳ),并与纳洛酮进一步反应得到中间体(
ⅴ
);
[0018]
步骤4、中间体(
ⅴ
)溶于乙醇并与2,3,3-三甲基-3h-吲哚-5-磺酸根离子反应即得
结构式(i)所示的靶向μ阿片受体的小分子荧光探针tpe[n]n。
[0019]
上述靶向μ阿片受体的小分子荧光探针可应用在聚集诱导发光材料领域。
[0020]
上述靶向mor的小分子荧光探针可以与蛋白结合,而相关蛋白如果因为疾病的影响,不能够正常表达或者表达了不能保持正确折叠构象,与探针的结合即会受影响,这种影响由其本身的发光信号放大。所以上述靶向μ阿片受体的小分子荧光探针可应用在制备与μ阿片受体介导的相关疾病的检测/诊断试剂中,所述相关疾病为疼痛病或阿片类药物使用障碍。
[0021]
tpe2n和蛋白结合后,分子本身结构旋转受限、荧光增强,但是当新的配体小分子与tpe2n竞争结合,就会导致荧光恢复,这个过程可以帮助筛选一些有活性的配体小分子。所以上述靶向μ阿片受体的小分子荧光探针可应用在筛选μ阿片受体相关疾病药物中,所述药物主要指μ阿片受体激动剂或拮抗剂。
[0022]
上述靶向μ阿片受体的小分子荧光探针可应用在μ阿片受体原位成像和流式检测中。
[0023]
相比于现有技术,本发明具有如下优点:
[0024]
1.本技术公开的小分子荧光探针tpe[n]n由mor特异性配体纳洛酮、四苯基乙烯(tpe)荧光团以及2,3,3-三甲基-3h-吲哚-5-磺酸构建而成;本技术利用该探针扭曲分子内电荷转移(tict)等光物理特性,将合理的荧光开关机制引入,最终构建出一种针对μ阿片受体的环境响应型荧光配体;
[0025]
2.本技术制备小分子荧光探针tpe[n]n时选择tpe作为母核得益于其不受其他生物基质影响的特性,能够稳定的发生荧光,且能基于分子本身发生荧光转变,纳洛酮作为经典配体被选择不仅是因为其具有合适的修饰位点,而且得益于其对μ阿片受体具有高亲和力,同时,为了在不影响结合过程的同时实现高荧光转变,本技术优化了连接的linker,使得最终获取的tpe[n]n被选择作为特异性响应性的荧光探针具有独特的优势;
[0026]
3.本技术在构建小分子荧光探针tpe[n]n时所选用的荧光发色团是具有环境敏感型的四苯基乙烯发光团,其在水溶液中荧光强度低,而结合到受体的疏水结构域中时可释放出明亮的荧光,由于其荧光背景干扰低,毒性小,可实现对活细胞受体结合状态的的实时监测,从而可应用于μ阿片受体的功能学研究与其配体的高通量筛选;
[0027]
4.本技术公开的小分子荧光探针tpe[n]n的荧光性质会随着周围环境的改变而发生变化,其荧光强度会因为周围环境的极性减少或者黏度增大而增加;
[0028]
5.当本技术公开的小分子荧光探针tpe[n]n与μ阿片受体结合并发生识别过程后,探针分子内的电荷转移与运动会受到影响,会导致荧光发射显著增强,能够实现对受体的原位成像,提高了信噪比,避免了繁琐的洗涤步骤;
[0029]
6.本技术公开的小分子荧光探针tpe[n]n显示出与μ阿片受体较高的亲和力,同时对μ阿片受体特异性较高,可以在配体筛选实验中发挥有利作用。
附图说明
[0030]
图1是实施例一制备的小分子荧光探针用于μ阿片受体成像及其配体筛选的原理示意图;
[0031]
图2为荧光探tpe2n在(a)不同溶剂和(b)不同比例的thf/水混合溶液以及(c)不同
比例的甘油/水混合溶液中的荧光发射光谱;
[0032]
图3为tpe2n的荧光强度与mor浓度的线性关系图(a)以及tpe2n在不同物质作用下的荧光强度图谱(b);
[0033]
图4为tpe2n与不同亚型阿片的剂量响应型的结合与解离曲线,其中a小图表示受体mor,b小图表示κ阿片受体(kor),c小图表示δ阿片受体(dor);
[0034]
图5为不同浓度的tpe2n对hek-293t细胞毒性的检测结果;
[0035]
图6为荧光探针tpe2n对mor原位成像及其配体筛选的共聚焦显微镜图。
具体实施方式
[0036]
下面结合附图对本发明的技术方案作进一步的说明,但并不局限于此,凡是对本发明技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,均应涵盖在本发明的保护范围中。
[0037]
实施例一、靶向μ阿片受体的小分子荧光探针tpe2n的合成
[0038]
合成路线如下:
[0039][0040]
中间体化合物(ⅱ)的合成和结构表征:
[0041]
将4-溴二苯甲酮(5.2g,20mmol)、4-羟基二苯甲酮(1.98g,10mmol)和锌(5.88g,90mmol)溶于无水四氢呋喃(90ml)中。用注射器缓慢加入干燥的ticl4(5ml,45mmol),在0℃下搅拌1小时。随后,将混合物在氮气氛围下回流反应10小时。反应结束后,将混合物冷却到室温并用质量浓度为10%的k2co3水溶液淬灭反应。使用乙酸乙酯(3
×
50ml)萃取,收集有机层并蒸发溶剂,经柱色谱法(乙酸乙酯:石油醚=1:20)纯化,得到白色固体即化合物(ⅱ)(2.5g,产率58%)。
[0042]1hnmr(300mhz,cdcl3):7.25-7.17(m,2h),7.17-6.97(m,10h),6.89(m,4h),6.63-6.52(m,2h)。ms(esi,m/z,c
26h19
bro,[m-h]-):calcd.,425.06;found,425.04755。
[0043]
中间体化合物(ⅲ)的合成和结构表征:
[0044]
将中间体(ⅱ)(2.1g,5mmol,1.0eq))溶解于无水四氢呋喃(25ml)中,并加入2m浓度的异丙基氯化镁溶液(5mmol,1.0eq),在-20℃下搅拌5分钟后,缓慢滴加2.5m浓度的正丁
基锂溶液(10mmol,2.0eq)至反应溶液中。在-20℃以下搅拌30分钟。随后,向反应溶液中加入无水dmf(0.36g,5mmol,1.0eq)并在室温下搅拌10小时。反应结束后,将混合物冷却到-20℃并加入水(6ml)以淬灭反应。使用乙酸乙酯萃取,收集有机层并蒸发溶剂,经硅胶闪蒸色谱法(石油醚:乙酸乙酯=5:1)纯化,得到黄色油状液体即中间体(ⅲ)(1.68g,产率90%)。
[0045]1h nmr(300mhz,cdcl3):9.89(d,j=6.7hz,1h),7.62(dd,j=10.9,8.4hz,2h),7.23-6.93(m,12h),6.94-6.80(m,2h),6.59(t,j=5.5hz,2h)。ms(esi,m/z,c
27h20
o2,[m-h]-):calcd.,375.15;found,375.13216。
[0046]
中间体化合物(ⅳ)的合成和结构表征:
[0047]
将中间体(ⅲ)(752.92mg,2mmol)、k2co3(829.26mg,6mmol)、1,2-二溴乙烷(1.12g,6mmol)溶解在丙酮(20ml)中。将混合物回流反应24小时后冷却至室温,过滤并收集滤液,蒸发去除溶剂后,使用柱色谱法(二氯甲烷:石油醚=1:10)纯化,得到中间体(ⅳ)固体(512mg,产率53%)。
[0048]1h nmr(300mhz,cdcl3):9.94(d,1h),7.67(d,2h),7.25(d,2h),7.19-7.10(m,6h),7.06(dd,j=3.2hz,4h),6.97(d,2h),6.69(d,2h),4.25(t,2h),3.65(t,2h)。
[0049]
中间体化合物(
ⅴ
)的合成和结构表征:
[0050]
将中间体(ⅳ)(483mg,1mmol)、k2co3(276.42mg,3mmol)、纳洛酮(327mg,1mmol)溶解在丙酮(20ml)中,将混合物回流反应24小时,冷却至室温,并过滤收集滤液,经蒸发去除溶剂后,使用柱色谱法(二氯甲烷:石油醚=1:10)纯化,得到中间体(
ⅴ
)固体(370mg,产率53%)。
[0051]
ms(esi,m/z,c
48h43
no6,[m+h]
+
):calcd.,730.31;found,730.31580。
[0052]
探针分子tpe2n的合成和结构表征:
[0053]
将中间体(
ⅴ
)(211mg,0.3mmol)、2,3,3-三甲基-3h-吲哚-5-磺酸根离子(78.6mg,0.3mmol)溶解在无水乙醇(20ml)中,反应混合物回流反应8小时,反应结束后,冷却至室温,蒸发去除溶剂并经柱色谱法(甲醇:乙酸乙酯=1:1)纯化,得到tpe2n固体产物(228mg,收率80%)。
[0054]1h nmr(300mhz,dmsod6):7.60(dd,j=20.4,10.6hz,2h),7.12(d,j=10.1hz,4h),6.98(q,j=9.2,8.8hz,3h),6.86(d,j=7.1hz,1h),6.75(d,j=7.6hz,2h),6.66(d,j=8.6hz,1h),6.60-6.47(m,2h),5.98-5.68(m,1h),5.41-4.99(m,5h),4.81(d,j=28.2hz,2h),4.36(s,1h),4.20(s,1h),3.20-3.09(m,4h),3.05-2.85(m,4h),2.73(q,j=1.9hz,2h),2.43-2.14(m,5h),2.14-1.87(m,5h),1.60-1.35(m,2h),1.24(d,j=2.9hz,6h),0.89-0.74(m,1h)。ms(esi,m/z,c
59h54
n2o8s,[m+h]
+
):calcd.,951.36;found,951.36814。
[0055]
相关性质检测
[0056]
1.周围环境对探针分子tpe2n荧光性质的影响
[0057]
1)使用不同极性的溶剂,测试了tpe2n在四氢呋喃(thf)、乙醇(etoh)、乙腈(mecn)、甲醇(meoh)和水这几种不同极性的溶剂中的荧光光谱。结果如图2中a小图所示,图示结果表明,随着溶剂极性的降低,tpe2n的荧光强度大幅增加。
[0058]
2)测试探针分子tpe2n在不同比例的四氢呋喃/水溶剂中的荧光光谱,结果如图2中b小图所示,从图中可以看出,随着四氢呋喃/水溶液中四氢呋喃比例的增加,探针分子的荧光强度逐渐增加。
[0059]
3)测试探针分子tpe2n在不同比例的甘油/水溶剂中的荧光光谱,结果如图2中c小图所示,从图中可以看出,随着甘油/水溶液中甘油比例的增加,探针分子的荧光强度也逐渐增加,这可能是由于在高黏度环境中探针的分子内运动受到限制,导致荧光强度的增加,这一特性使得该探针分子有望应用在聚集诱导发光材料领域。
[0060]
上述结果均说明tpe2n属于环境敏感型荧光探针,其荧光强度会因为周围环境的极性降低或者黏度增大而增加。
[0061]
2.探针分子tpe2n对mor的响应
[0062]
分别取195μl的tpe2n(250μm in pbs)加入不同的容器中,之后向各个容器中分别加入5μl不同浓度的mor,混合均匀。使得mor终浓度为50μm,100μm,150μm,200μm,250μm,300μm,测定各混合液在激发波长为365nm,发射波长为480nm下的荧光信号值,每个浓度重复测定3次。以mor浓度为横坐标,荧光强度为纵坐标,绘制标准曲线,结果如图3中a小图所示,得到线性方程y=8627x+1744756,r2=0.9623。
[0063]
分别取195μl的tpe2n(250μm in pbs)加入不同的容器中,之后向各个容器中分别加入5μl浓度为1.2mm的mor或生物基质中常见干扰物质,混合均匀,测定激发波长为365nm,发射波长为480nm下的荧光信号值。结果如图3中b小图所示,从图中可以看出,除目标受体mor外,其他干扰物质对荧光探针的荧光强度均无明显影响。试验表明,实施例一制备的探针分子tpe2n可特异性响应mor并具有定量分析mor配体结合事件的潜力。
[0064]
3.检测tpe2n对三种不同亚型阿片受体(mor、dor、kor)的亲和力
[0065]
使用生物层干涉(bli)技术测定了探针分子tpe2n对不同亚型阿片受体的亲和力,结果如图4所示,tpe2n对mor的解离常数(kd)为28.4
±
4.6nm。同时,数据显示探针分子对mor具有较强的选择性,是kor的11倍,dor的34倍。这表明了探针分子tpe2n对mor具有较高的亲和力和特异性。
[0066]
4.探针分子tpe2n的细胞毒性检测
[0067]
用mtt法检测了tpe2n对hek-293t细胞增殖的影响。将hek-293t细胞以8
×
103个/孔的密度接种到96孔板中培养过夜,然后用不同浓度的探针分子tpe2n处理。在避光培养箱中培养24h后,将细胞用pbs缓冲液冲洗3次,然后用新鲜培养基继续培养24h。之后加入10μl浓度为0.5mg/ml的mtt(3-(4,5-二甲基-2-噻唑基)-2,5二苯基溴化四唑)溶液至每个孔中。37℃孵育4h后,加入150μl dmso使溶解结晶物充分溶解。用酶标仪读取490nm处的光吸收值,每个实验进行五次。结果如图5所示,图示结果表明,浓度为0~512nm的tpe2n对细胞增殖均无显著影响。
[0068]
6.探针分子tpe2n在表达mor的hek-293t细胞中对mor的共聚焦成像效果的影响
[0069]
将转染与未转染mor质粒的hek-293t细胞以2
×
105个细胞/孔的接种量接种在细胞板中,并在细胞培养箱中以37℃和5%co2条件培养48h,用pbs冲洗细胞,随后,将荧光探针tpe2n(10μm)与hek-293t细胞共同孵育20min,以转染mor质粒的细胞作为阳性,未转染mor质粒的细胞作为阴性对照。成像前除去培养液,记录荧光共聚焦图像,λex=488nm,λem=525
±
50nm。图6为所得的共聚焦荧光成像图。在加入配体damgo(合成脑啡肽,3μm)后,通过竞争结合取代tpe2n探针,观察到细胞膜上的荧光猝灭。这表明了当tpe2n分散在到溶液中并恢复到其tict状态时,探针将显示出低背景的荧光。
[0070]
由于tpe2n的水溶性得到了一定程度的改善,所以就无需利用助溶试剂来提升探
针本身的溶解性,也就是说可以避免添加细胞毒性的二甲基亚砜(dmso)或其他有机溶剂作为本身溶解性不佳的tpe的助溶试剂,dmso本身生物体内所能接受的最高浓度不超过0.5%,太高的dmso浓度会导致生物毒性,为了提高生物安全性,采用助溶试剂后需将多余的试剂洗去,但是本技术中,采用2,3,3-三甲基-3h-吲哚-5-磺酸作为增溶基团,可帮助探针顺利溶解在水中,因而无需外加具有细胞毒性的助溶试剂,因此,tpe2n允许在活细胞中以免洗涤的方式实时监测mor的动态结合事件。
[0071]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1