利用ε-聚赖氨酸富集细菌细胞外囊泡的方法
利用
ε-聚赖氨酸富集细菌细胞外囊泡的方法
技术领域
1.本发明涉及生物医药领域,尤其涉及利用ε-聚赖氨酸富集细菌细胞外囊泡的方法。
背景技术:
2.细菌细胞外囊泡(bacterial extracellular vesicle, bev)是一类由细菌产生、分泌到细胞外的膜性囊泡,直径一般在20-200 nm之间。分泌胞外囊泡是包括革兰氏阳性菌和革兰氏阴性菌在内的众多细菌存在的保守功能。bev由一层脂质双分子层包裹,对于革兰氏阴性菌,细菌外囊泡膜与细菌细胞外膜同源,表面带有细胞外膜成分脂多糖(lipopolysaccharides, lps),对于革兰氏阳性菌,细菌外囊泡膜与细胞膜同源,表面还含有一部分细菌细胞壁的成分例如脂磷壁酸(lipoteichoic acid, lta)。bev内含有蛋白质、核酸、脂质等多种生物分子,其内容物可被释放到周围环境中或者其他细胞之中来执行不同的功能。bev在细菌的生长、增殖及细胞间信息交流中发挥着多种多样的作用。已有研究发现,bev在人体宿主中也广泛存在,是细菌与宿主沟通交流的重要媒介,在诊断和治疗都具有极大的应用潜力。由于bev粒径微小,难以从生物样本中分离,给领域的发展带来了困难。
3.ε-聚赖氨酸是一种天然的广谱阳离子抗菌肽,由放线菌发酵产生。细菌细胞外囊泡表面带有丰富的负电荷,可以和带正电荷的ε-聚赖氨酸发生相互作用。
4.目前最常用的bev提取方法是基于密度的超速离心法(ultracentrifugation, uc):首先通过高速离心和0.22μm或者0.45μm滤膜除去细菌细胞和大部分的细胞碎片等,然后用超过十万g的超速离心对上清液进行最少2h的离心,收集沉淀,随后需要通过一步清洗重悬再次超速离心对bev进行纯化。
5.另外,还有基于bev大小的分离方法,例如超滤法(ultrafiltration, uf)、剪切流过滤(tangential flow filtration, tff)以及静水过滤(hydrostatic filtration, hf)。对于超滤法,通过一个100-500kda的超滤管对去掉细菌细胞的上清液进行超速离心。剪切流过滤是一个相对较新的方法,同样使用一个滤膜,只不过滤膜方向和液体流向是切向设置,在一定程度上可以减少bev对于滤膜的阻塞。静水过滤通过对一个1000kda的滤膜施加静水压力对含有bev的上清进行过滤,随后对浓缩的上清进行重悬,并通过0.45μm滤膜过滤,再次通过第二步超滤步骤,以及静态透析的方法进行纯化,最后通过过滤管浓缩收集。
6.基于亲和力的分离方法主要有抗体法和核酸适配体方法。这两种方法都基于bev表面一些特征性蛋白,设计对应特异性结合的抗体或者核酸适配体,并将它们连接上组蛋白标签或者磁珠等易于富集的载体,待抗体或者核酸适配体与bev结合后,通过对与抗体或核酸适配体结合的标签或者磁珠等富集来对bev进行收集。
7.之前的技术并不专注于分离细菌细胞外囊泡,细菌属于原核生物,其细胞膜在组成和与哺乳动物膜系统具有巨大的差异,导致产生的囊泡在性质上也与哺乳动物细胞外囊
泡有显著不同。例如:胆固醇是哺乳动物外泌体的重要组成部分,而细菌的膜系统通常不包含胆固醇;细菌细胞外囊泡通常带有脂多糖、脂磷壁酸等细菌特有成分,而哺乳动物细胞外囊泡不可能含有这些物质。因此,细菌细胞外囊泡与哺乳动物外泌体不能视作相同的实体,研究者在针对的对象上与之前的技术有本质的不同。
8.现有的最常用的超速离心法耗时长,设备和耗材昂贵,需要受过训练的技术人员进行操作,且难以处理大体积的样品;超滤等基于大小的分离方法容易造成滤膜的堵塞,增加处理时间,有些还需要自行设计特殊的过滤装置;基于亲和的方法虽然特异性较好,但是目前bev表面普适性marker的选择仍然有待研究,因此基于亲和的富集方法可能损失部分不带有特定marker的bev,而且基于亲和的方法在处理样本体积方面和处理效率方面都具有一定劣势,无法从复杂样品中沉淀细菌来源的囊泡,ε-聚赖氨酸对细菌细胞外囊泡的沉淀能力强于哺乳动物细胞外泌体,具有从混合样品中选择性分离细菌细胞外囊泡的潜力,与之前的方法在目标和效果上都有显著不同。
技术实现要素:
9.有鉴于此,本发明要解决的技术问题在于提供利用ε-聚赖氨酸富集细菌细胞外囊泡的方法,以期提高细菌细胞外囊泡的分离效率。本发明首次提出了利用ε-聚赖氨酸从生物样品中富集细菌细胞外囊泡的方法。
10.ε-聚赖氨酸是一种天然的广谱阳离子抗菌肽,由放线菌发酵产生。细菌细胞外囊泡表面带有丰富的负电荷,可以和带正电荷的ε-聚赖氨酸发生相互作用。
11.本发明提供了分离细菌外囊泡的方法,所述方法包括将ε-聚赖氨酸与细菌细胞外囊泡共孵育,离心收集沉淀,经洗涤、释放、超滤后置换溶液,获得囊泡。与现有经典的超速离心分离方法相比,本发明在仪器方面仅需要使用普通的高速离心机(约10000g),无需使用昂贵的大型超速离心设备,大大提高了方法的实用性;和切向流过滤、静水过滤等方法相比,本发明不需要设计制作特殊过滤装置,操作简便,一般实验人员简单学习即可操作。
12.本发明所述的方法中,所述共孵育前还包括将mes缓冲液与细菌菌液混合,调ph值到7;所述mes缓冲液与细菌菌液的体积比为1:9。
13.本发明所述的方法中,所述共孵育步骤中ε-聚赖氨酸的浓度为30μg/ml~100μg/ml;一些实施例中,所述共孵育时ε-聚赖氨酸的浓度为5μg/ml、15μg/ml、30μg/ml、60μg/ml或100μg/ml;一些具体实施例中,所述共孵育步骤中ε-聚赖氨酸的浓度为100μg/ml。
14.本发明所述的方法中,所述共孵育的时间为15min~60min,室温18~30℃;一些实施例中,所述共孵育的时间为15min、30 min、45 min或60min;一些具体实施例中,所述共孵育的时间为45 min。
15.本发明所述的方法中,所述离心的条件包括4℃转速2,000g~12,000g,时间4min~16min;一些实施例中,所述离心的条件包括4℃转速500g、2,000g、5000g、6000g、8000g、9000g或12,000g,时间4 min、8min、12 min或16min;一些具体实施例中将孵育后的混合物在4℃,12,000g的条件下离心15min。
16.本发明所述的方法中,所述洗涤包括以pbs溶液洗涤2次。一些具体实施例中,所述洗涤包括离心后弃上清,将沉淀用1ml pbs重悬,在4℃,12,000g的条件下离心15min,再重复此过程一次。由于本方法采取沉淀的方式,与超滤以及亲和分离方法相比,具有独有的大
体积样本处理能力。
17.本发明所述的方法中,所述释放包括使用释放缓冲液重悬沉淀,所述释放缓冲液为50 mm tris,0.5m~1m nacl,ph为8~9。一些具体实施例中,所述释放包括将得到的沉淀,用500μl释放缓冲液重悬,室温18℃~30℃,溶解5min。
18.本发明所述的方法中,所述超滤包括超滤后液体体积的浓缩倍数为5倍;所述超滤管规格为100kda。
19.本发明所述的方法中,所述超滤是将ε-聚赖氨酸与细菌细胞外囊泡分离。
20.一些具体实施例中,将溶解后的溶液短暂离心,除掉不溶的沉淀,将上清加入的100kda超滤管中,在4℃,14,000 g的条件下离心至超滤管中的溶液体积减小到1/5,补加释放缓冲液至初始体积,离心至超滤管中的溶液体积再次减小到1/5,重复这个过程3次。
21.本发明所述的方法中,所述释放缓冲液包括50 mm tris,0.5m~1m nacl,ph为8~9。
22.本发明所述的方法中,所述置换溶液包括以pbs溶液置换直至滤出液ph值为7。一些具体实施例中,所述置换包括:向超滤管中加超滤液4倍体积的pbs缓冲液,在4℃,14,000 g的条件下离心至超滤管中的溶液体积减小到1/5,用ph试纸检测滤出液的ph。重复加入pbs缓冲液再离心这一过程,直至滤出液ph恢复到7;获得细菌外囊泡。
23.本发明所述的方法中,所述细菌包括革兰氏阳性菌和/或革兰氏阴性菌。本发明中,以大肠杆菌为例验证该方法对革兰氏阴性菌囊泡的分离效果,以金黄色葡萄球菌为例,验证革兰氏阳性菌囊泡的分离效果。
24.本发明还提供了所述方法制得的囊泡。
25.提供的囊泡是细菌的外囊泡,其由本发明所述的方法富集获得。
26.本发明首次提出了利用ε-聚赖氨酸从生物样品中富集细菌细胞外囊泡的方法。与现有经典的超速离心分离方法相比,本发明在仪器方面仅需要使用普通的高速离心机(约10000g),无需使用昂贵的大型超速离心设备,大大提高了方法的实用性;和切向流过滤、静水过滤等方法相比,本发明不需要设计制作特殊过滤装置,操作简便,一般实验人员简单学习即可操作;由于本方法采取沉淀的方式,与超滤以及亲和分离方法相比,具有独有的大体积样本处理能力;此外,本发明在提取的对象上与之前的技术有本质的不同,本发明有潜力在混合样本中选择性地将细菌来源的细胞外囊泡分离出来,向稀释的胎牛血清或细胞培养基中加入ε-聚赖氨酸,在本方法的条件下无法分离出蛋白,但当血清中混有细菌囊泡时,可以沉淀下细菌相关蛋白,本方法有潜力从体液等复杂样品中沉淀细菌来源的囊泡,能推动细菌囊泡检测和应用研究的发展,与亲和分离方法使用的抗体和核酸适配体相比成本较低,具有较好的经济实用性,以及良好的临床应用前景。
附图说明
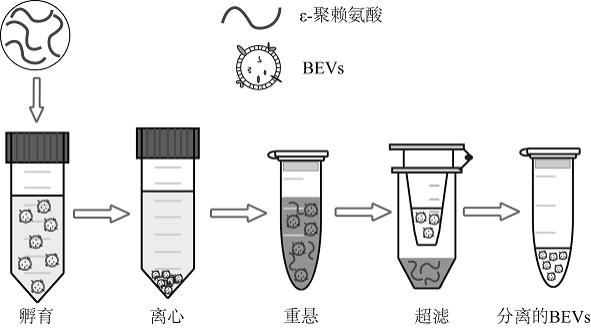
27.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图:图1示ε-聚赖氨酸富集细菌外囊泡流程示意图,富集流程分为ε-聚赖氨酸共孵育沉淀、离心收集沉淀、沉淀重悬、超滤置换溶液四步;
图2示bev的形态学验证;图a~d为bev的透射电镜照片,图2中的a为超速离心法富集得到的大肠杆菌bev;图2中的b为ε-聚赖氨酸沉淀方法得到的大肠杆菌bev;图2中的c为超速离心法富集得到的金黄色葡萄球菌bev;图2中的d为ε-聚赖氨酸沉淀方法得到的金黄色葡萄球菌bev,可见本法与经典的超速离心法能得到类似的具有茶托状的囊泡类型的bev;e~h为纳米力度追踪测得的bev粒径分布;图2中的e为超速离心法富集得到的大肠杆菌bev;图2中的f为ε-聚赖氨酸沉淀方法得到的大肠杆菌bev;图2中的g为超速离心法富集得到的金黄色葡萄球菌bev;图2中的h为ε-聚赖氨酸沉淀方法得到的金黄色葡萄球菌bev,可见本法得到的bev与超速离心法得到的bev粒径分布规律基本一致;图3示分离得到的bev生物学功能验证;图3中的a表示两种方法得到的大肠杆菌和金黄色葡萄球菌bev的细胞毒性测试,在处理时间内,四种bev没有对人单核细胞thp-1细胞表现出明显的细胞毒性;图3中的b~d为thp-1细胞在bev刺激后三种免疫因子il-1β(b)、il-6(c)以及il-8(d)mrna表达水平,可见与阴性对照相比,四种bev刺激均能引起免疫因子表达量明显提高;图3中的e~f为thp-1细胞在bev刺激后两种免疫因子il-8(e)和il-1β(f)的蛋白分泌量水平,可见与对照相比,四种bev刺激均能引起免疫因子分泌量明显提高;图中euc表示超速离心法获得的大肠杆菌bev,epl表示ε-聚赖氨酸沉淀法获得的大肠杆菌bev,suc表示超速离心法获得的金黄色葡萄球菌bev,spl表示ε-聚赖氨酸沉淀法获得的金黄色葡萄球菌bev;图4示不同浓度ε-聚赖氨酸浓度条件沉淀得到的bev的蛋白质凝胶电泳图,可见大于等于30μg/ml的ε-聚赖氨酸可以有效沉淀bev;图5示不同孵育时间沉淀得到的bev的蛋白质凝胶电泳图,可见大于等于45min的孵育可以有效沉淀bev;图6示不同离心转速下得到的bev的蛋白质凝胶电泳图,可见2,000g~12,000g的转速均能有效沉淀bev;图7示不同离心时间下得到的bev的蛋白质凝胶电泳图,可见大于等于8min的离心可以有效得到bev沉淀;图8示蛋白质凝胶电泳图,图中从左到右共有9个泳道,其中1、4、7泳道示蛋白大小的marker;2、3泳道是一种哺乳动物细胞系外泌体的分离结果,2泳道是超速离心法分离的结果,3泳道是本发明方法分离的结果;可以看到3泳道没有明显的条带,说明ε-聚赖氨酸无法将哺乳动物外泌体分离出来;5、6和7、8泳道则分别是大肠杆菌和金黄色葡萄球菌的分离结果,可以看到用本发明的方法可以得到与超速离心法相似的条带;图9示ε-聚赖氨酸和一种抗菌肽多粘菌素b的分离结果;尽管多粘菌素b与ε-聚赖氨酸同为阳离子抗菌肽,但在相同条件下,多粘菌素b对革兰氏阴性菌大肠杆菌的bev和革兰氏阳性菌金黄色葡萄球菌的bev缺乏分离能力;说明ε-聚赖氨酸对bev的沉淀不仅与其正负电荷相互作用有关,还可能依赖于ε-聚赖氨酸的其他特有性质;图10示在离心速度2000g以上大肠杆菌细胞外囊泡可以被有效沉淀下来;图11示离心时间超过8分钟即可以有效分离囊泡;图12示每毫升培养基加入15 μg及以上ε-聚赖氨酸可以有效分离囊泡;图13示向稀释的胎牛血清或细胞培养基中加入ε-聚赖氨酸,在本方法的条件下无法分离出蛋白,但当血清中混有细菌囊泡时,可以沉淀下细菌相关蛋白。
具体实施方式
28.本发明提供了利用ε-聚赖氨酸富集细菌细胞外囊泡的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
29.本发明所述的方法具体包括如下步骤:1、ε-聚赖氨酸、细菌细胞外囊泡团聚和分离在ph 6~7的条件下,30μg/ml~100μg/ml的ε-聚赖氨酸共孵育使细菌细胞外囊泡发生团聚,从而在2000g~12000 g的离心转速下实现对后者的分离。
30.2、ε-聚赖氨酸与细菌细胞外囊泡分离(1):在ph值8~9,nacl浓度0.5m~1m的条件下,ε-聚赖氨酸又可以从细菌细胞外囊泡表面脱落,使聚集体恢复为单个的囊泡。
31.(2):超滤可以将分子质量超过100kda的囊泡与低相对分子质量的ε-聚赖氨酸(相对分子质量在3600da ~4300da)分开,并置换溶液使囊泡分散在pbs缓冲液中,可以直接用于成分和功能的检测。
32.配制实验需要的溶液mes缓冲液:3 m mes,0.15 m nacl,用naoh调ph为5释放缓冲液:50 mm tris,0.5 m nacl,用hcl调ph为8.5pbs缓冲液:ph 7.4细菌培养和培养基的预处理将细菌接种于lb培养基中,于37℃过夜摇瓶培养;将菌液在室温使用6000 g的条件将培养基离心10 min,丢弃沉淀,取上清在4℃,10000g的条件下离心15min,收集上清,用0.45μm滤器过滤除菌。
33.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
34.实施例1ε-聚赖氨酸沉淀bev取200ml离心过滤预处理后的细菌培养基,用广泛ph试纸检测细菌培养基的ph,若向碱性偏离过多,取mes缓冲液,以1:9的比例加入预处理过的细菌培养基中,调整培养基的ph值到7。
35.称取100mg ε-聚赖氨酸,用pbs缓冲液配成10 mg/ml的母液,将母液加入到200 ml ph值调整到7的细菌培养基中,至ε-聚赖氨酸的终浓度为100μg/ml,不同浓度ε-聚赖氨酸的实施例结果如附图4所示;将加入了ε-聚赖氨酸的细菌培养基放置于翘板摇床上,室温混匀孵育45 min,不同孵育时间的实施例结果如图5所示;将孵育后的混合物在4℃,12,000g的条件下离心15min,不同离心速度和离心时间的实施例结果分别如图6和图7所示,小心地丢弃上清,将沉淀用1ml pbs重悬起来,在4℃,
12,000g的条件下离心15min,再重复此过程一次,将得到的沉淀,用500μl释放缓冲液重悬,室温溶解5min;将溶解后的溶液短暂离心,除掉不溶的沉淀,将上清加入0.5ml的100kd超滤管中,在4℃,14,000g的条件下离心至超滤管中的溶液体积减小到100μl左右,补加释放缓冲液至0.5ml,离心至超滤管中的溶液体积减小到100μl左右,重复这个过程3次。
36.向超滤管中加pbs缓冲液至0.5ml,在4℃,14,000g的条件下离心至超滤管中的溶液体积减小到100μl左右,用ph试纸检测滤出液的ph。重复加入pbs缓冲液再离心这一过程,直至滤出液ph恢复到7;取出超滤管中的200μl液体,用于后续分析和检测。
37.实施例2影响结果的实验参数实验利用培养了大肠杆菌的培养基测试了多种细胞外囊泡的分离条件,如离心时间、浓度、离心速度等,利用蛋白凝胶电泳的方法检测所获得的蛋白量。以35kd附近的蛋白条带作为大肠杆菌,该条带包含ompa、ompc、ompf等多种大肠杆菌外膜蛋白,是较为公认的大肠杆菌细胞外囊泡标志物。
38.2.1除离心速度外,其他条件与实施例1相同,研究离心速度对提取效果的影响,结果表明,离心速度500g~12000g在离心速度2000g以上大肠杆菌细胞外囊泡可以被有效沉淀下来,如图10所示。
39.2.2除离心时间外,其他条件与实施例1相同,研究离心时间对提取效果的影响,结果表明,离心时间4~16分钟,离心时间超过8分钟即可以有效分离囊泡,如图11所示。
40.2.3除ε-聚赖氨酸浓度外,其他条件与实施例1相同,研究ε-聚赖氨酸浓度对提取效果的影响,结果表明,ε-聚赖氨酸浓度,每毫升培养基加入15μg及以上ε-聚赖氨酸可以有效分离囊泡,如图12所示。
41.对比例1超速离心法(uc)分离bev取200ml离心过滤预处理后的细菌培养基,4℃条件下,使用160,000g离心2h,小心弃掉上清,随后用1mlpbs溶液重悬沉淀,再次使用160,000g离心2h,弃去上清,使用100μlpbs重悬沉淀,用于后续分析和检测。
42.1、透射电镜(tem)鉴定bev形态将bev稀释适当倍数,取7μl悬液滴加在300目铜网上,室温孵育2min,用滤纸从侧面小心吸去上清,然后滴加7μl醋酸铀,室温孵育1min,用滤纸从侧面小心吸去上清,将铜网完全晾干后在透射电镜下观察细菌细胞外囊泡形态。
43.2、nta鉴定bev粒径分布将所得bev悬液用蒸馏水稀释1000倍,用纳米颗粒追踪分析仪(nta)检测bev粒径分布。
44.3、bev生物学功能鉴定bev与免疫细胞作用验证。使用一定浓度的bev的pbs溶液处理thp-1单核细胞6h,通过荧光定量pcr(qpcr)检测il-8,il-6以及il-1β等免疫因子的mrna表达水平。通过酶联免疫反应(elisa)检测刺激后细胞培养基上清中的免疫因子的分泌情况。
45.对比例2抗菌肽多粘菌素b沉淀bev参照实施例1的方案,以抗菌肽多粘菌素b对细菌bev进行分离,结果如图9。可以看
到,尽管多粘菌素b与ε-聚赖氨酸同为阳离子抗菌肽。但在相同条件下,多粘菌素b对革兰氏阴性菌大肠杆菌的bev和革兰氏阳性菌金黄色葡萄球菌的bev缺乏分离能力。说明ε-聚赖氨酸对bev的沉淀不仅与其正负电荷相互作用有关,还可能依赖于ε-聚赖氨酸的其他特有性质。ε-聚赖氨酸无毒、价格低廉,是用于较大体积样本处理的理想物质,如图9所示。
46.效果验证1、本发明采用的ε-聚赖氨酸针对细菌细胞外囊泡和哺乳动物外泌体具有一定的选择性。如图8所示,蛋白被卡马斯亮蓝染液染成蓝色。图中从左到右共有9个泳道,其中1、4、7泳道是指示蛋白大小的marker。2、3泳道是利用实施例1的方法对哺乳动物细胞系外泌体的分离结果,2泳道是对比例1采用超速离心法分离的结果,3泳道是实施例1方法分离的结果;可以看到,3泳道没有明显的条带,说明ε-聚赖氨酸无法将哺乳动物外泌体分离出来。5、6和7、8泳道则分别是大肠杆菌和金黄色葡萄球菌的分离结果,可以看到实施例1的方法可以得到与超速离心法相似的条带。因此,ε-聚赖氨酸对细菌细胞外囊泡的沉淀能力强于哺乳动物细胞外泌体,具有从混合样品中选择性分离细菌细胞外囊泡的潜力,与对比例1方法在目标和效果上都有显著不同。
47.2、实施例1的方法有潜力在混合样本中选择性地将细菌来源的细胞外囊泡分离出来。如图13,向稀释的胎牛血清或细胞培养基中加入ε-聚赖氨酸,在本方法的条件下无法分离出蛋白。当血清中混有细菌囊泡时,可以沉淀下细菌相关蛋白,如图13所示。由此可见,实施例1的方法可以从体液等复杂样品中沉淀细菌来源的囊泡,能推动细菌囊泡检测和应用研究的发展。
48.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1