一种澄清溶瘤痘苗病毒收获液的方法与流程
1.本发明是关于一种澄清溶瘤痘苗病毒收获液的方法。
背景技术:
2.溶瘤病毒(oncolytic virus)是一类具有复制能力的肿瘤杀伤型病毒,能选择性杀伤肿瘤细胞,而不会对正常组织细胞产生杀伤作用。同时,溶瘤病毒可以杀伤那些抗凋亡的肿瘤细胞,并且不会对现有的抗肿瘤治疗方案产生拮抗作用,适合用于联合用药。
3.痘苗病毒(vaccinia virus,vacv)属于痘病毒家族成员,是迄今为止结构最为复杂的一类dna病毒,曾在全球杀灭天花的行动中得到广泛应用。人类对痘苗病毒的生物学性状和致病机理有着较为深入的了解。同时,痘苗病毒复制快,副作用明确,自身基因组大,可插入大片段外源基因,适合经过改造后用于肿瘤的治疗。
4.目前,用于改造的溶瘤痘苗病毒包括wyeth株、lister株、哥本哈根株、天坛株等。
5.2015年,首款溶瘤病毒产品t-vec获批,用于治疗晚期黑色素瘤,从而掀起了全球研究溶瘤病毒的热潮。近几年,基于病毒的医药产品越来越受重视,如疫苗、基因治疗病毒产品等。这也给病毒类产品的生产工艺带来了机遇和挑战。一般的生产工艺包括哺乳动物细胞培养、病毒的接种、病毒的收获、澄清、超滤和柱层析等一系列步骤。其中,下游的纯化过程尤为重要,旨在提高产品的回收率和纯度。由于病毒本身特性及生产工艺的要求,统一的、标准化的下游纯化工艺并不能适用于每一种病毒产品。
6.很多研究者和厂商对柱层析步骤研究较为深入,针对不同的病毒,开发出了不同材质和性能的填料,取得了一定的成效。然而,针对病毒样品前处理、澄清过滤的研究却并不多。无论是哪种病毒产品,下游生产工艺都是从细胞培养物中收获病毒开始,可以分为3种情况:
①
病毒主要存在于培养上清中,仅需收集上清;
②
病毒主要存在于宿主细胞中,只需要收集和裂解细胞;
③
病毒在宿主细胞和培养上清中的含量都很多,需要同时收集细胞和上清。对于第
①
中情况,上清中杂质较少,澄清过滤较为简单;对于第
②
种和第
③
种情况,需要收集和裂解细胞,细胞裂解后,会释放大量内容物(如宿主蛋白和基因组dna等)和产生大量细胞碎片,给澄清过滤造成了极大的困难,导致病毒回收率非常低。
7.cn104250639a公开了一种收获和生产病毒的方法,其中在收获感染hsv-1或腺病毒的细胞悬浮液中,加入400-1200mm的nacl或kcl,能降低病毒与细胞碎片之间的粘附性,从而提高澄清过滤时病毒的回收率。然而,这些方法运用到痘苗病毒纯化时,效果并不理想。高浓度nacl不损伤病毒,但样品会变得粘稠,澄清过滤时痘苗病毒回收率不高。使用tween 20和benzonase裂解细胞,酶切宿主dna,病毒回收率有一定提高,但对去除宿主dna残留没有太大帮助,同时需要注意tween 20浓度不能太高,否则严重损伤病毒。
技术实现要素:
8.本发明的一个目的在于提供一种改进的澄清溶瘤痘苗病毒收获液的方法。
9.为达上述目的,本发明提供了一种澄清溶瘤痘苗病毒收获液的方法,该方法包括:
10.采用核酸酶和胰酶在tris-hcl缓冲液体系中对溶瘤痘苗病毒细胞进行裂解和酶解处理,释放病毒,得到裂解和酶解处理后的样品;
11.裂解和酶解处理后的样品经过微滤,得到澄清后的溶瘤痘苗病毒收获液(即澄清液)。
12.痘苗病毒主要存在于宿主细胞内,需要裂解细胞释放病毒。但是,细胞裂解后,会释放大量内容物(如宿主蛋白和基因组dna等)和产生大量细胞碎片。病毒会被细胞碎片黏附和包裹,同时,病毒还会与样品中的其它组分结合形成聚集体。若直接过滤去除杂质,病毒损失大,回收率会很低。现有技术中最常用的解决办法是使用全能核酸酶benzonase酶切宿主dna,降低样品黏度,但是酶切效果常常不理想。本发明的澄清溶瘤痘苗病毒收获液的方法中,采用tris-hcl缓冲液重悬、裂解细胞,有澄清作用;采用核酸酶酶切dna,具有澄清作用;并通过引入胰蛋白酶,酶解宿主细胞hcp,与核酸酶协同作用,可促进核酸酶的酶切处理效果和提高病毒澄清过滤的回收率。
13.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,采用核酸酶和胰酶对溶瘤痘苗病毒细胞的裂解处理和酶解处理可顺序进行,也可同时进行。具体地,进行裂解和酶解处理的过程选自以下方式之一:
14.方式一:
15.(1)用含有核酸酶的tris-hcl缓冲液重悬溶瘤痘苗病毒细胞,进行裂解处理,释放病毒,得到裂解样品;
16.(2)向所述裂解样品中加入胰酶,继续酶解处理,得到裂解和酶解处理后的样品;
17.方式二:
18.用含有核酸酶和胰酶的tris-hcl缓冲液重悬溶瘤痘苗病毒细胞,同时进行裂解和酶解处理,得到裂解和酶解处理后的样品。
19.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,所述溶瘤痘苗病毒细胞为感染溶瘤痘苗病毒的宿主细胞。本发明的方法具有普适性,适用于所有利用哺乳动物细胞扩增病毒的方案。在本发明的一些具体实施方案中,所述宿主细胞为hela s3。在本发明的一些具体实施方案中,所述痘苗病毒为痘苗病毒lister。
20.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法还包括:采用离心或深层过滤方法,从培养溶瘤痘苗病毒细胞的培养液中去除培养基,收集得到溶瘤痘苗病毒细胞。
21.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,所述核酸酶为benzonase。
22.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,核酸酶在所述缓冲液中的含量为5-40u/ml,优选10-20u/ml。
23.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,所述tris-hcl在缓冲液中的含量为1-50mm,优选为10mm。
24.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,所述缓冲液的ph为7.0-10.0,优选ph为8.0-10.0,更优选ph为9.0-10.0。ph 9.0-10.0时,细胞破碎效果较好,且不影响benzonase酶切宿主dna。
25.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,进行
裂解处理的条件为:常温处理1-2h。
26.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,所采用的胰酶可以为市售产品,例如可以购自gibco公司。
27.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法,进行酶解处理的条件为:胰酶加入量为0.05%-2.5%trypsin-edta;胰酶加入体积为样品体积的1/10-1/320,优选1/20-1/160,更优选1/40-1/80;常温处理1-3h。
28.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,胰酶加入量为0.25%trypsin-edta。
29.根据本发明的具体实施方案,本发明的澄清溶瘤痘苗病毒收获液的方法中,微滤条件为:0.45微米滤膜过滤。
30.实验证明,本发明的方法不仅能彻底破碎宿主细胞,还能澄清样品,解离和释放出更多病毒,提高痘苗病毒过滤回收率至80%以上,同时还能提高核酸酶benzonase的酶切效果,显著降低宿主dna残留100-1000倍,可有效解决现有病毒收获液澄清过滤回收率仍然很低以及宿主dna残留去除不理想的问题。并且,本发明操作简单,条件温和,仅一步操作,就能解决痘苗病毒澄清过滤回收率低和宿主dna残留难去除的两大关键问题,为大规模制备溶瘤痘苗病毒提供了关键的技术支持。
附图说明
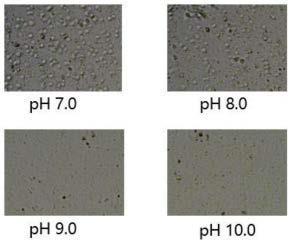
31.图1显示实施例1中不同ph值的10mm tris-hcl裂解细胞情况。
32.图2显示实施例2中不同缓冲液裂解细胞效果及胰酶澄清作用实验结果。
33.图3显示细胞裂解的镜检情况。
34.图4显示胰酶浓度对病毒回收率和样品dna残留的影响。
具体实施方式
35.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对本发明的技术方案进行以下详细说明,但不能理解为对本发明的可实施范围的限定。
36.实施例1:不同ph值的10mm tris-hcl裂解细胞
37.1.细胞培养及病毒扩增
38.使用无血清培养基组合来培养悬浮驯化的hela s3细胞并扩增病毒。具体方法见cn111440770a“人源细胞悬浮培养的培养基组合及溶瘤痘苗病毒的制备方法”。
39.2.病毒收获
40.收毒时,用15ml离心管,收集悬浮hela s3细胞,4ml/管,4管,依次编号为
①‑④
。2000g离心5分钟,去上清,留取细胞沉淀。
41.3.细胞裂解
42.向离心管
①‑④
中各加入4ml不同ph值的10mm tris-hcl溶液重悬细胞,溶液ph分别为7.0、8.0、9.0、10.0。裂解处理1h,对比细胞破碎情况。
43.不同ph值的10mm tris-hcl裂解细胞情况参见图1。可以看出:10mm tris-hcl在ph7.0和8.0时,细胞破碎不彻底,有较多完整细胞;10mm tris-hcl在ph9.0和10.0时,细胞基本破碎。
44.实施例2:不同缓冲液裂解细胞效果及胰酶澄清作用
45.1.细胞培养及病毒扩增
46.使用无血清培养基组合来培养悬浮驯化的hela s3细胞并扩增病毒。具体方法见cn111440770a“人源细胞悬浮培养的培养基组合及溶瘤痘苗病毒的制备方法”。
47.2.缓冲液
48.缓冲液a:10mm tris-hcl(ph 9.0)+10u/ml benzonase
49.缓冲液b:na2co
3-nahco3(0.01m na2co3,0.09m nahco3,ph9.0)+10u/ml benzonase
50.缓冲液c:pbs(145mm nacl,50mm na2hpo4,ph9.0)+10u/ml benzonase
51.3.病毒收获
52.收毒时,收集24ml悬浮hela s3细胞,平均分至3管,8ml/管,2000g离心5分钟,去上清,留取细胞沉淀。
53.4.细胞裂解
54.向3管细胞沉淀中加入3ml缓冲液裂解细胞,缓冲液分别为a、b、c。裂解1h后,观察细胞破碎情况。
55.5.细胞冻融
56.除缓冲液a能较彻底破碎细胞外,其余两种缓冲液都有大量细胞未破。随后将该3管细胞样品置于-80℃反复冻融3次后,观察细胞破碎情况。
57.6.加入胰酶(gibco公司)(0.25%trypsin-edta)
58.向3管样品中加入胰酶1/80
·
v(v为样品体积,8ml),继续处理1h,观察样品澄清情况,并取样检测病毒滴度。
59.7.实验结果参见表1和图2。
60.表1
[0061][0062]
以上结果表明:3种缓冲液a、b、c中,只有缓冲液a(10mm tris-hcl)在不冻融情况下,能较彻底地破碎细胞,释放病毒,显示出了良好的破碎效果。同时,病毒滴度结果也显示,只有缓冲液a(10mm tris-hcl)获得了较高的病毒滴度,显著高于缓冲液b和c。另外,胰酶在不同缓冲液中,都显示出了明显的澄清效果。
[0063]
实施例3:低浓度胰酶(0.25%trypsin-edta)对病毒样品的澄清作用
[0064]
1.细胞培养及病毒扩增
[0065]
使用无血清培养基组合来培养悬浮驯化的hela s3细胞并扩增病毒。具体方法见cn111440770a“人源细胞悬浮培养的培养基组合及溶瘤痘苗病毒的制备方法”。
[0066]
2.溶液配制
[0067]
(1)裂解液10mm tris-hcl(ph9.0),记为a溶液;
[0068]
(2)取30ml a溶液,加入1.2μl benzonase(250u/ml),配成10mm tris-hcl(ph9.0)+10u/ml benzonase溶液,记为b溶液;
[0069]
3.病毒收获
[0070]
收毒时,用15ml离心管,收集悬浮hela s3细胞,7ml/管,4管,依次编号为
①‑④
。2000g离心5分钟,去上清,留取细胞沉淀。
[0071]
4.细胞裂解
[0072]
向离心管
①
中加入7ml a溶液,向剩余离心管
②‑④
中各加入7ml b溶液,重悬细胞,裂解2h。离心管
①
为对照,不含benzonase。
[0073]
5.加入胰酶(0.25%trypsin-edta)
[0074]
向离心管
①
和
②
中各加入3.5ml a溶液,向离心管
③
中加入3.5ml胰酶(胰酶加入量为1/2
·
v,v为样品体积),向离心管
④
中加入0.35ml胰酶(胰酶加入量为1/20
·
v,v为样品体积),再补加a溶液3.15ml,使各管终体积为10.5ml,继续处理1h。
[0075]
6.过滤和取样
[0076]
1h后,各管样品经0.45微米针头滤器(minisart 16533k)过滤,记录滤过体积,并检测滤前和滤后病毒滴度以及滤前宿主dna残留。
[0077]
7.结果参见表2。
[0078]
表2:胰酶澄清病毒收获液
[0079][0080]
注:病毒回收率为相对回收率,计算方法为:各管滤后病毒滴度除以对照滤前的病毒滴度(5.0
×
107pfu/ml)。
[0081]
以上结果表明:未加胰酶的实验组1和2滤过体积分别为1.8ml和3ml,明显低于加胰酶的实验组3和4(均全部滤过,9ml)。其中,加入低浓度胰酶(1/20
·
v)的实验组4的病毒回收率(96%)显著高于其它实验组;加入高浓度胰酶(1/2
·
v)的实验组3,滤后病毒滴度最低,回收率不理想。同时,还可以发现,实验组4的宿主dna残留显著低于对照组,约为对照组dna残留的千分之二。
[0082]
另外,细胞裂解的镜检情况参见图3。其中,左图片为:细胞扩增痘苗病毒后,用10mm tris-hcl(ph9.0)裂解,显微镜观察,有较多聚团的细胞碎片;中间图片为:细胞扩增痘苗病毒后,用10mm tris-hcl(ph9.0)+10u/ml benzonase裂解,显微镜观察,无聚团的细胞碎片,但有大量纤维状杂质;右图片为:细胞扩增痘苗病毒后,用10mm tris-hcl(ph9.0)+10u/ml benzonase裂解2h后,加入1/20
·
v胰酶处理1h,显微镜观察,背景干净,无明显杂质。可表明:加入胰酶后,细胞裂解比较彻底,样品较为澄清。
[0083]
实施例4:胰酶浓度摸索实验
[0084]
1.细胞培养及病毒扩增
[0085]
使用无血清培养基组合来培养悬浮驯化的hela s3细胞并扩增病毒。具体方法见cn111440770a“人源细胞悬浮培养的培养基组合及溶瘤痘苗病毒的制备方法”。
[0086]
2.裂解液配制
[0087]
取60ml 10mm tris-hcl(ph9.0),加入2.4μl benzonase(250u/ml),配成10mm tris-hcl(ph9.0)+10u/ml benzonase裂解液。
[0088]
3.病毒收获
[0089]
收毒时,收集53ml悬浮hela s3细胞,2000g离心5分钟,去上清,留取细胞沉淀。
[0090]
4.细胞裂解
[0091]
用60ml裂解液重悬细胞沉淀,处理2h后,分至8个15ml离心管,8ml/管,依次编号为
①‑⑦
。
[0092]
5.加入胰酶(0.25%trypsin-edta)
[0093]
向离心管
①‑⑥
中加入胰酶,使各管胰酶体积分别为1/5
·
v、1/20
·
v、1/40
·
v、1/80
·
v、1/320
·
v、1/1280
·
v(v为样品体积,8ml),再补加10mm tris-hcl(ph9.0)溶液,使各管终体积为12ml;向离心管
⑦
中加入4ml 10mm tris-hcl(ph9.0)溶液,终体积也为12ml,不加胰酶,作为对照。所有样品继续处理1h。
[0094]
6.过滤和取样
[0095]
1h后,各管样品经0.45微米针头滤器(minisart 16533k)过滤,记录滤过体积,并检测滤前和滤后病毒滴度以及滤前宿主dna残留。
[0096]
7.结果参见表3和图4。
[0097]
表3:胰酶用量摸索实验
[0098]
[0099][0100]
表3和图4结果显示了胰酶浓度对病毒回收率和样品dna残留的影响。
[0101]
以上结果表明:当胰酶加入量在1/320
·
v-1/5
·
v(实验组
①‑⑤
)时,样品全部经过0.45μm针头滤器,滤过体积都为10ml。随着胰酶加入量降低至1/1280
·
v(实验组
⑥
)和不加胰酶(实验组
⑦
)时,样品滤过体积明显降低,分别为3.5ml和2ml,说明适量胰酶的使用能显著澄清样品,增加样品滤过体积。病毒回收率随着胰酶用量的降低,呈现先升后降的趋势,峰值出现在1/80
·
v(实验组
④
),其回收率为97%,说明胰酶用量过高或过低,都不利于病毒过滤回收,原因可能为:胰酶用量过高,样品粘度增加,不利病毒滤过;胰酶用量过低,样品澄清效果不佳,也影响病毒滤过。同时,还可以发现,当胰酶加入量在1/320
·
v-1/20
·
v(实验组
②‑⑤
)时,宿主dna残留显著低于其它实验组,适量的胰酶显著促进benzonase的酶切效果。因此,病毒收获液中加入1/320
·
v-1/40
·
v的胰酶时,澄清过滤病毒的回收率最佳,样品宿主dna残留也非常低。
[0102]
实施例5:裂解液中胰酶加入方式对比
[0103]
1.细胞培养及病毒扩增
[0104]
使用无血清培养基组合来培养悬浮驯化的hela s3细胞并扩增病毒。具体方法见cn111440770a“人源细胞悬浮培养的培养基组合及溶瘤痘苗病毒的制备方法”。
[0105]
2.溶液配制
[0106]
(1)裂解液10mm tris-hcl(ph9.0),记为a溶液;
[0107]
(2)取45ml a溶液,加入1.8μl benzonase(250u/ml),配成10mm tris-hcl(ph9.0)+10u/ml benzonase溶液,记为b溶液;
[0108]
(3)取30ml b溶液,加入0.25ml胰酶,配成10mm tris-hcl(ph9.0)+10u/ml benzonase+1/80
·
v胰酶溶液,记为c溶液。
[0109]
3.病毒收获
[0110]
收毒时,用15ml离心管,收集悬浮hela s3细胞,6ml/管,6管,依次编号为
①‑⑥
。2000g离心5分钟,去上清,留取细胞沉淀。
[0111]
4.细胞裂解
[0112]
向离心管
①
中加入6ml a溶液,向离心管
②
和
③
中各加入6ml b溶液,向离心管
④‑⑥
中加入9ml c溶液,重悬细胞。其中:
[0113]
离心管
①
为对照,不含benzonase,处理2h后,再加入3ml a,共9ml,继续处理1h后,
进行0.45μm过滤;
[0114]
离心管
②
仅benzonase,处理2h后,再加入3ml a,共9ml,继续处理1h后,进行0.45μm过滤;
[0115]
离心管
③
处理2h后,再加入1/80
·
v胰酶,补a溶液至9ml,继续处理1h后,进行0.45μm过滤;
[0116]
离心管
④‑⑥
分别处理1h、2h、3h后,进行0.45μm过滤。
[0117]
5.过滤和取样
[0118]
各管样品经0.45微米针头滤器(minisart 16533k)过滤,记录滤过体积,并检测滤前和滤后病毒滴度以及滤前宿主dna残留。
[0119]
6.结果参见表4。
[0120]
表4:胰酶加入方式对比实验
[0121][0122][0123]
注:病毒回收率为相对回收率,计算方法为:各管滤后病毒滴度除以对照滤前的病毒滴度(1.23
×
108pfu/ml)。
[0124]
以上结果表明:含核酸酶的裂解液中先加入胰酶(实验4-6)与后加胰酶(实验3)相比,后加胰酶的回收率(102%)高于先加胰酶的回收率(83%-88%),但都比不加胰酶(实验1和2)的回收率(49%和54%)要高很多。同时,加胰酶的实验样品全部滤过,滤过体积均为7ml,显著高于不加胰酶的实验,dna残留也显著低于不加胰酶的实验,与前述方案结论一
致。另外,实验4-6结果表明,先加胰酶的实验,分别作用1h、2h、3h,dna残留和病毒回收率差异不大。综上所述,单从病毒澄清过滤回收率考虑,后加胰酶优于先加胰酶,但若从澄清效果和操作简便考虑,先加胰酶也是不错的选择。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1