一种贴壁细胞活性检测试剂盒及其应用的制作方法
1.本发明涉及生物医药技术领域,具体讲是一种贴壁细胞活性检测试剂盒及其应用。
背景技术:
2.cck8法是一种常见的检测方法,其检测原理为活细胞中的琥珀酸脱氢酶与wst
–
8进行反应生成黄色甲臜产物,它是一种高度水溶性黄色甲臜染料,黄色甲臜染料的数量与活细胞成正比,因此可以反映活细胞数量;mtt可以被线粒体内的一些脱氢酶还原生成结晶状的深紫色产物formazan。在dmso存在的情况下,可以被完全溶解。然后通过酶标仪可以测定450nm波长附近的吸光度。细胞增殖越多越快,则吸光度越高,细胞活力越强。
3.目前常用的cck8检测试剂盒和mtt检测试剂盒,都会涉及有毒有害溶剂,如dmso(二甲基亚砜),且反应相对较慢、需要避光、反应后需尽快检测,因此,亟待开发一种安全无污染且迅速检测的代替产品,以实现贴壁细胞活力的安全、快速、稳定、准确地检测。
4.结晶紫,是碱性染料,绿色带有金属光泽结晶或深绿色结晶性粉末,为副品红的六甲基衍生物,含有少量四、五甲基的衍生物;其别名:龙胆紫、氯化甲基玫瑰苯胺、甲紫;常用于细胞染色。
技术实现要素:
5.本发明的目的在于至少解决现有技术中存在的技术问题之一,提供一种贴壁细胞活性检测试剂盒及其应用。
6.本发明的技术解决方案如下:
7.一种贴壁细胞活性检测试剂盒,包括成分一和成分二,所述成分一包括以下终浓度的组分:5-10g/100ml的结晶紫溶液,所述成分二包括以下终浓度的组分:至少95(v/v)%浓度的乙醇溶液;所述成分一和成分二所用的溶剂为无菌水。
8.进一步地,所述成分一的制备方法为:按照组分的终浓度配料,将结晶紫粉末完全溶解,过滤后,于25-30℃的温度下避光保存。
9.进一步地,所述过滤采用滤膜进行。
10.进一步地,所述成分二的制备方法为:按照组分的终浓度配料,将乙醇和无菌水混合均匀,于25-30℃的温度下保存。
11.本发明还公开了一种如上所述的贴壁细胞活性检测试剂盒在贴壁细胞活力检测上的应用。
12.进一步地,包括以下步骤:
13.s1:制备贴壁细胞悬液,稀释适当浓度后,接种于96孔细胞培养板中,在37℃,5(v/v)%co2培养箱中静置培养8-12小时,待细胞贴壁后进行细胞活力影响处理;
14.s2:待细胞活力影响处理结束后,弃培养板中的培养基,并在细胞培养板的每孔板中加入成分一继续培养15-30min;
15.s3:弃所述成分一,用流水轻轻冲洗孔板,晾干;
16.s4:继续在每孔板中加入组分二震荡3-5min,于570nm波长下进行活力检测。
17.进一步地,所述细胞活力影响处理为采用药物或病原菌处理或培养时间的控制。
18.进一步地,所述s1中,每孔板的接种量为100-120μl。
19.本发明的有益效果是:
20.(1)本发明的一种贴壁细胞活性检测试剂盒,采用结晶紫和乙醇分别作为成分一和成分二,在贴壁细胞活力检测上的反应时间短,操作简便、更快速,主要是由于存活的贴壁细胞会贴在孔板壁上,结晶紫可结合在细胞上,然后洗掉未结合多余的结晶紫,再将结合在细胞上的结晶紫用乙醇溶解下来,该结晶紫溶解液在570nm波长下有吸收,吸收值越大说明结晶紫浓度越大,代表活细胞数量越大,即细胞活性越大,反之,如果细胞活性低,结合的结晶紫浓度越小。
21.(2)本发明的一种贴壁细胞活性检测试剂盒,在贴壁细胞活力实验的安全性无污染方面优于传统技术上的cck8和mtt检测方法。
22.(3)本发明的一种贴壁细胞活性检测试剂盒,在贴壁细胞活力实验的成本消耗方面优于传统的cck8和mtt检测方法。
附图说明
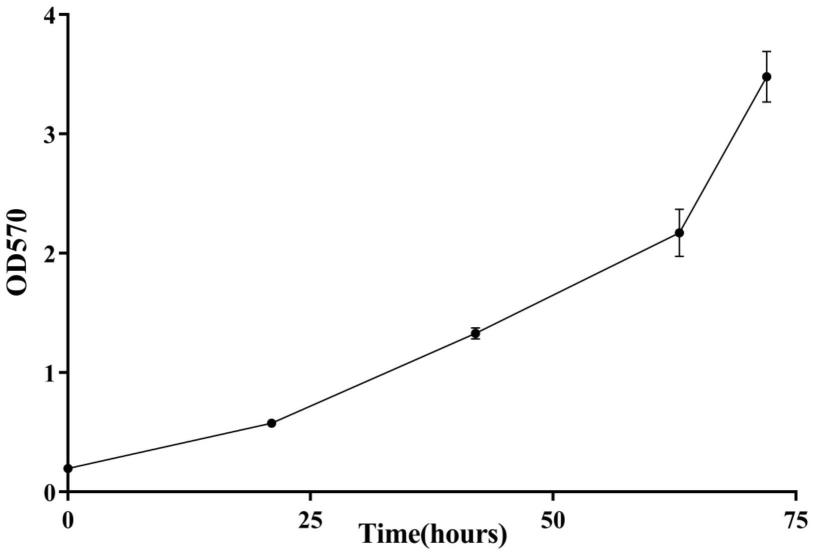
23.图1为本发明实施例2的人肺癌细胞a549活力随静置培养时间变化的曲线图。
24.图2为本发明实施例3的小鼠巨噬细胞raw264.7细胞活力随培养时间变化的曲线图。
25.图3为本发明实施例4的小鼠肺癌细胞llc细胞活力随培养时间变化的曲线图。
26.图4为本发明对比例1的人肺癌细胞a549活力随培养时间变化的曲线图。
27.图5为本发明对比例2的小鼠巨噬细胞raw264.7细胞活力随培养时间变化的曲线图。
28.图6为本发明对比例3的小鼠肺癌细胞llc细胞活力随培养时间变化的曲线图。
29.图7为本发明对比例4的人肺癌细胞a549活力随培养时间变化的曲线图。
30.图8为本发明对比例5的小鼠巨噬细胞raw264.7细胞活力随培养时间变化的曲线图。
31.图9为本发明对比例6的小鼠肺癌细胞llc细胞活力随培养时间变化的曲线图。
具体实施方式
32.本发明实施例采用的传统cck8和mtt检测试剂盒购自碧云天生物技术有限公司,货号分别为c0037和c0009s。其中,文中提到的formazan为水不溶性的蓝紫色结晶甲瓒;cck试剂为wst8(化学名:2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2h-四唑单钠盐);mtt的化学名为3-(4,5-二甲基噻唑-2)(4,二甲基噻唑-2)2,5-二苯基四氮唑溴盐。
33.在本发明的描述中,需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
34.下面结合附图和具体的实施例对本发明做进一步详细说明,所述是对本发明的解释而不是限定。
35.实施例1
36.一种贴壁细胞活力检测试剂盒,包括组分一和组分二;所述组分一包括以下终浓度的组分:结晶紫5g/100ml;所述成分二包括以下终浓度的组分:乙醇95(v/v)%;所述成分一和成分二溶剂均为无菌水。所述组分一的制备及保存方法为:按照组分的终浓度配料,将结晶紫粉末完全溶解,经滤膜过滤后,于室温(25℃)避光处长期保存。
37.所述组分二的制备及保存方法为:按照组分的终浓度配料,乙醇和无菌水混合均匀室温保存。
38.实施例2
39.本实施例提供一种人肺癌细胞a549活力检测方法,是采用实施例1贴壁细胞活力检测试剂盒进行,该检测方法包括以下步骤:
40.s1:将人肺癌细胞a549稀释至50000个/ml后,接种于96孔细胞培养板中,每孔接种量为100μl,在37℃、含有5(v/v)%co2的培养箱中静置培养8小时,待细胞贴壁后继续培养,分别检测21、42、63、72小时的细胞活性;
41.s2:各时间段培养结束后,弃培养基,并在孔板中加入100μl的成分一继续培养15min;
42.s3:弃成分一,用流水冲洗两次,室温晾干;
43.s4:继续在孔板中加入100μl成分二震荡5分钟,于570nm进行活力检测。进行3次平行试验,检测结果如图1所示。
44.图1为人肺癌细胞a549活力随培养时间变化的曲线。
45.实施例3
46.本实施例提供一种小鼠巨噬细胞raw264.7细胞活力随培养时间变化的曲线图,是采用实施例1的贴壁细胞活力检测试剂盒进行,检测方法和步骤同实施例2,结果如图2所示。
47.图2提供了小鼠巨噬细胞raw264.7细胞活力随培养时间变化的曲线。
48.实施例4
49.本实施例提供一种小鼠肺癌细胞llc细胞活力随培养时间变化的曲线图,是采用实施例1的贴壁细胞活力检测试剂盒进行,检测方法和步骤同实施例2,结果如图3所示。
50.图3为小鼠肺癌细胞llc细胞活力随培养时间变化的曲线。
51.对比例1
52.本对比例提供一种人肺癌细胞a549活力检测方法,是采用传统的cck8检测试剂盒进行,该检测方法包括以下步骤:
53.(1)将人肺癌细胞a549稀释至50000个/ml,接种于96孔细胞培养板中,每孔100μl,在37℃,5(v/v)%co2静置培养8小时,待细胞贴壁后继续培养,分别检测培养21、42、63、72小时的细胞活性;
54.(2)各时间段培养结束后,在孔板中加入cck试剂,继续培养4h;
55.(3)于450nm进行活力检测,进行3次平行试验,检测结果如图4所示。
56.图4为本对比例人肺癌细胞a549活力随培养时间变化的曲线,且该试剂盒在该细
胞活力检测实验上检测耗时长、cck试剂中含有所含溶液对人体有毒。
57.对比例2
58.本对比例提供一种小鼠巨噬细胞raw264.7细胞活力检测方法,是采用传统的cck8检测试剂盒进行,该检测方法包括以下步骤:
59.(1)将小鼠肺癌细胞llc稀释至50000个/ml度后,接种于96孔细胞培养板中,每孔100μl,在37℃、含有5(v/v)%co2的培养箱中静置培养8小时,待细胞贴壁后继续培养,分别检测培养21、42、63、72小时的细胞活性;
60.(2)各时间段培养结束后,在孔板中加入cck试剂,继续培养4h;
61.(3)于450nm进行活力检测,进行3次平行试验,检测结果如图5所示。
62.图5为本对比例小鼠巨噬细胞raw264.7细胞活力随培养时间变化的曲线,表明:该试剂盒在该细胞活力检测实验上检测耗时长、所含溶液对人体有毒。
63.对比例3
64.本对比例提供一种小鼠肺癌细胞llc细胞活力检测方法,是采用传统的cck8检测试剂盒进行,该检测方法包括以下步骤:
65.(1)将小鼠肺癌细胞llc稀释至50000个/ml后,接种于96孔细胞培养板中,每孔100μl,在37℃、含有5(v/v)%co2的培养箱中静置培养8小时,待细胞贴壁后继续培养,分别检测21、42、63、72小时的细胞活性;
66.(2)各时间段培养结束后,在孔板中加入cck试剂,继续培养4h;
67.(3)于450nm进行活力检测,进行3次平行试验,检测结果如图5所示。
68.图5提供了本对比例小鼠肺癌细胞llc细胞活力随培养时间变化的曲线,且该试剂盒在该细胞活力检测实验上耗时长、cck试剂所含溶液对人体有毒。
69.对比例4
70.本对比例提供一种人肺癌细胞a549活力检测方法,是采用传统的mtt检测试剂盒进行,该检测方法包括以下步骤:
71.(1)mtt溶液的配制:用5ml mtt溶剂溶解25mg mtt,配制成5mg/ml的mtt溶液。配制后即可使用,或直接-20℃避光保存,也可以根据需要适当分装后-20℃避光保存。
72.(2)将人肺癌细胞a549稀释至50000个/ml后,接种于96孔细胞培养板中,每孔100μl,静置培养8小时,待细胞贴壁后继续培养,分别按照下述方法检测培养21、42、63、72小时的细胞活性;
73.(3)每孔加入10微升mtt溶液,在细胞培养箱内继续孵育4小时。
74.(4)每孔加入100微升formazan溶解液,适当混匀,在细胞培养箱内再继续孵育。直至在普通光学显微镜下观察发现formazan全部溶解。
75.(5)在450nm测定吸光度。
76.图7提供了本对比例人肺癌细胞a549活力随培养时间变化的曲线,且该试剂盒在该细胞活力检测实验上步骤繁琐、所含溶液对人体有毒。
77.对比例5
78.本对比例提供一种小鼠巨噬细胞raw264.7活力检测方法,是采用传统的mtt检测试剂盒进行,该检测方法包括以下步骤:
79.(1)mtt溶液的配制:用5ml mtt溶剂(pbs)溶解25mg mtt,配制成5mg/ml的mtt溶
液。配制后即可使用,或直接-20℃避光保存,也可以根据需要适当分装后-20℃避光保存。
80.(2)将小鼠巨噬细胞raw264.7稀释至50000个/ml后,接种于96孔细胞培养板中,每孔100μl,在37℃、含有5(v/v)%co2的培养箱中静置培养8小时,待细胞贴壁后继续培养,分别检测21、42、63、72小时的细胞活性;
81.(3)每孔加入10微升mtt溶液,在细胞培养箱内继续孵育4小时。
82.(4)每孔加入100微升formazan溶解液,适当混匀,在细胞培养箱内再继续孵育。直至在普通光学显微镜下观察发现formazan全部溶解。
83.(5)在450nm测定吸光度。
84.图8提供了本对比例小鼠巨噬细胞raw264.7活力随培养时间变化的曲线,且该试剂盒在该细胞活力检测实验上步骤繁琐、所含溶液对人体有毒。
85.对比例6
86.本对比例提供一种小鼠肺癌细胞llc活力检测方法,是采用传统的mtt检测试剂盒进行,该检测方法包括以下步骤:
87.(1)mtt溶液的配制:用5ml mtt溶剂溶解25mg mtt,配制成5mg/ml的mtt溶液。配制后即可使用,或直接-20℃避光保存,也可以根据需要适当分装后-20℃避光保存。
88.(2)将小鼠肺癌细胞llc稀释至50000个/ml后,接种于96孔细胞培养板中,每孔100μl,在37℃,5(v/v)%co2静置培养8小时,待细胞贴壁后继续培养,按照下述方法分别检测21、42、63、72小时的细胞活性;
89.(3)每孔加入10微升mtt溶液,在细胞培养箱内继续孵育4小时。
90.(4)每孔加入100微升formazan溶解液,适当混匀,在细胞培养箱内再继续孵育。直至在普通光学显微镜下观察发现formazan全部溶解。
91.(5)在450nm测定吸光度。
92.图9为本对比例小鼠肺癌细胞llc活力随培养时间变化的曲线,且该试剂盒在该细胞活力检测实验上步骤繁琐、所含溶液对人体有毒。
93.从图1-9结果可知,实施例采用结晶紫溶液检测不同种类贴壁细胞活性,随着培养时间的延长,结晶紫溶液的吸光值增加,说明细胞活性增强,与实验期望值一致,且与常规试剂盒cck8和mtt为对照,3种检测方法的结果一致,说明本发明采用的检测试剂盒重复性好,应用的细胞种类多样性,而且结晶紫检测更加快速、安全,而且成本低,而常规的cck8和mtt方法耗时长,且所含溶液有毒,安全性低。
94.在不出现冲突的前提下,本领域技术人员可以将上述附加技术特征自由组合以及叠加使用。
95.以上所述仅为本发明的优选实施方式,只要以基本相同手段实现本发明目的的技术方案都属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1