一种用于人间充质干细胞扩增中的最优因子值的筛选方法及应用与流程
1.本发明涉及干细胞培养的技术领域,具体涉及一种用于人间充质干细胞扩增中的最优因子值的筛选方法及应用。
背景技术:
2.细胞治疗己成为生物治疗领域中最活跃的一个部分,规范化的细胞治疗研究已成为现代医学的重要组成。当前我国细胞治疗中常用的细胞类型是成体来源的细胞,如免疫细胞、骨髓干细胞、脐血和脐带来源的造血或间充质干细胞等。
3.间充质干细胞(mesenchymal stem cell,msc)来源广泛,也较易于分离、培养、扩增和纯化,免疫原性低,无道德伦理问题的限制,所以在免疫治疗和基因治疗方面有着巨大的应用前景。如自体或异基因骨髓或脐血造血干细胞移植用于治疗血液病、恶性肿瘤等;或骨髓和脐带来源的间充质干细胞经移植后转化为肝样细胞、成骨细胞、心肌细胞、汗腺细胞等。
4.在现有的间充质干细胞因子的制备方法的报道,如中国专利申请cn105543313a中公开的人源间充质干细胞因子及其制备方法,收集并合并p1-p5代细胞生长至汇合度75-85%时的上清液,并对上清液进行过滤和超滤得到细胞因子浓缩液即可,该方法未能提供有效的诱导培养基,诱导细胞因子分泌过程不够高效,得到的间充质干细胞因子数量较少,且该方法需要收集多代细胞培养基,效率低,工艺不连续,极易导致样品受到不必要的污染,且多代收集的方法来制备细胞因子,产品均一性较难保证,分离纯化过程不具规模化,较难适应大批量生产。
技术实现要素:
5.针对现有技术的存在的问题,本发明旨在提供一种用于人间充质干细胞扩增中的最优因子值的筛选方法及应用。
6.为了实现上述目的,本发明采用根据下技术方案:
7.一种用于人间充质干细胞扩增中的最优因子值的筛选方法,所述方法包括以下步骤:
8.s1因子筛选,选出可能对人间充质干细胞的扩增起显著效果的因子;
9.s2对所述筛选的因子进行单因子方差分析,根据方差分析结果,判定哪些因子为显著性因子;
10.s3对步骤s2的单因子进行方差分析,根据回归方程判断是否为无法拟合为直线;如否,则返回步骤s1;
11.s4若可以拟合为直线,则进行爬坡实验,找到最优值所在的区间;
12.s5在步骤s4中选取出4个显著因子及区间,进行rsm分析;
13.s6使用bbd方法进行实验设计,并得出所有组别的扩增倍数、细胞活率的数据;
14.s7将步骤s6获得数据进行anova分析得出回归方程及设计空间;
15.s8对扩增倍数、细胞活率分别求出最优因子值。
16.需要说明的是,步骤s2筛选的因子为8个,分别是:温度、ph、溶氧、转速、细胞接种密度、微载体接种密度、培养时间与培养基补液策略。
17.需要说明的是,所述步骤s5中的4个显著因子和区间分别是转速、细胞接种密度、微载体接种密度与培养时间。
18.需要说明的是,所述转速为20-40rpm,所述细胞接种密度为40000-120000cells/ml,所述微载体接种密度0.8-2.4g/l,所述培养时间5-7天。
19.本发明还提供一种利用人间充质干细胞扩增中的最优因子值的筛选方法所获得的最优因子应用于人间充质干细胞扩增方法中。
20.本发明的有益效果在于:
21.1、通过本发明的方法,找到最优的扩增倍数、细胞活率的值;
22.2、通过本发明的方法,得到设计空间及回归方程;
23.3、通过设计空间,得到可以接近最优扩增倍数、细胞活率的控制参数值。
附图说明
24.图1为本发明中扩增倍数、细胞接种密度与搅拌转速的曲面图;
25.图2为本发明中扩增倍数、细胞接种密度与搅拌转速的等值线图;
26.图3为本发明中细胞活率、细胞接种密度与搅拌转速的曲面图;
27.图4为本发明中细胞活率、培养时间与搅拌转速的曲面图;
28.图5为本发明中细胞活率、培养时间与搅拌转速的等值线图。
具体实施方式
29.以下将对本发明作进一步的描述,需要说明的是,以下实施例以本技术方案为前提,给出了详细的实施方式和具体的操作过程,但本发明的保护范围并不限于本实施例。
30.一种用于人间充质干细胞扩增中的最优因子值的筛选方法,所述方法包括以下步骤:
31.s1因子筛选,选出可能对人间充质干细胞的扩增起显著效果的因子;
32.s2对所述筛选的因子进行单因子方差分析,根据方差分析结果,判定哪些因子为显著性因子;
33.s3对步骤s2的单因子进行方差分析,根据回归方程判断是否为无法拟合为直线;如否,则返回步骤s1;
34.s4若可以拟合为直线,则进行爬坡实验,找到最优值所在的区间;
35.s5在步骤s4中选取出4个显著因子及区间,进行rsm分析;
36.s6使用bbd方法进行实验设计,并得出所有组别的扩增倍数、细胞活率的数据;
37.s7将步骤s6获得数据进行anova分析得出回归方程及设计空间;
38.s8对扩增倍数、细胞活率分别求出最优因子值。
39.需要说明的是,步骤s2筛选的因子为8个,分别是:温度、ph、溶氧、转速、细胞接种密度、微载体接种密度、培养时间与培养基补液策略。
40.需要说明的是,所述步骤s5中的4个显著因子和区间分别是转速、细胞接种密度、微载体接种密度与培养时间。
41.需要说明的是,所述转速为20-40rpm,所述细胞接种密度为40000-120000cells/ml,所述微载体接种密度0.8-2.4g/l,所述培养时间5-7天。
42.本发明还提供一种利用人间充质干细胞扩增中的最优因子值的筛选方法所获得的最优因子应用于人间充质干细胞扩增方法中。
43.实施例
44.以下将通过具体的实施例对本发明的技术方案进一步陈述。
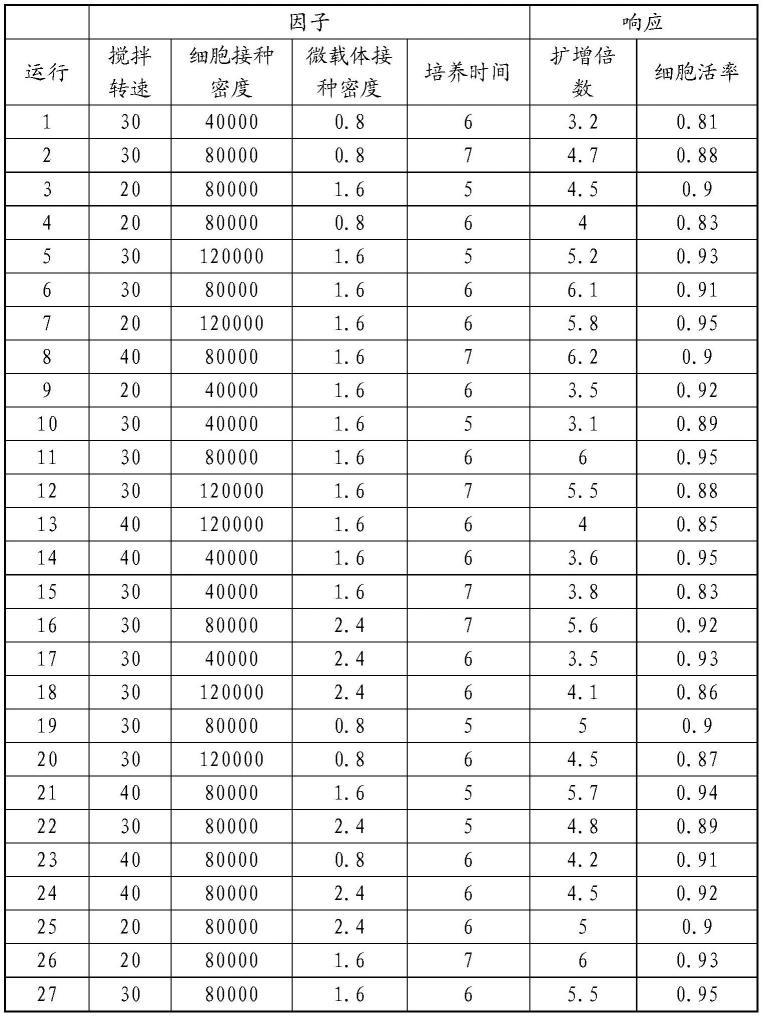
45.1、单因子分析
46.(1)对8个因子进行单因子方差分析,根据方差分析结果,判定哪些因子为显著性因子。
47.(2)对8个因子进行单因子方差分析,根据回归方程判断是否为无法拟合为直线,如果可以拟合为直线,则进行爬坡实验,找到最优值所在的区间。
48.2、rsm分析
49.(1)通过筛选出4个显著因子及区间,进行rsm分析。使用bbd方法进行实验设计,共计27组实验。
50.(2)分别进行27组实验,并得出27组扩增倍数、细胞活率等数据,如下表所示:
[0051][0052]
(3)对27组数据进行anova分析,分析其单因子、复合因子及平方因子的显著性数据,对不显著项进行剔除;如果发现残差数据或拟合数据不合理,则对有问题的实验组进行重新实验。最终得出回归方程及设计空间。
[0053]
(4)对扩增倍数、细胞活率分别求出最优因子值。其中,扩增倍数按照以下算式计算:
[0054]
扩增倍数=-14.71+0.348搅拌转速+0.000124细胞接种密度+3.28微载体接种密度+1.82培养时间-0.00267搅拌转速*搅拌转速-0.000000细胞接种密度*细胞接种密度-1.413微载体接种密度*微载体接种密度-0.104培养时间*培养时间+0.000000搅拌转速*细胞接种密度-0.0219搅拌转速*微载体接种密度-0.0250搅拌转速*培养时间+0.000002细胞接种密度*微载体接种密度-0.000001细胞接种密度*培养时间+0.344微载体接种密度*培养时间。
[0055]
细胞活率=-0.085+0.0159搅拌转速+0.000003细胞接种密度+0.132微载体接种密度+0.212培养时间-0.000275搅拌转速*搅拌转速-0.000000细胞接种密度*细胞接种密度-0.0137微载体接种密度*微载体接种密度-0.0162培养时间*培养时间+0.000000搅拌转速*细胞接种密度+0.00031搅拌转速*微载体接种密度-0.00100搅拌转速*培养时间-0.000001细胞接种密度*微载体接种密度+0.000000细胞接种密度*培养时间-0.0031微载体接种密度*培养时间。
[0056]
仿真试验
[0057]
根据上述技术方案设计的最优因子值,进行3次验证实验,如果与最优的扩增倍数、细胞活率的值接近,则试验成功。
[0058]
如果不接近,分析实验过程,进行问题排查,重新进行实验,直到接近最优值附近结束。
[0059]
对于本领域的技术人员来说,可以根据以上的技术方案和构思,给出各种相应的改变和变形,而所有的这些改变和变形,都应该包括在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1