疟原虫数字PCR快速检测体系及检测方法与流程
疟原虫数字pcr快速检测体系及检测方法
技术领域
1.本发明涉及疟原虫的多重数字pcr快速检测体系及检测方法。
背景技术:
2.疟疾与艾滋病、结核是世界公认的危害人类生命健康的三大公共问题之一,是由疟原虫引起并经按蚊传播的一种寄生虫病。世界卫生组织(who)指出2017年全世界有2.19亿疟疾新病例和43.5万例死亡病例。现在全球疟疾的发病主要流行于非洲、亚洲和拉丁美洲的热带和亚热带地区,以非洲的疟疾疫情最为严重。疟原虫进入人体后在肝脏中繁殖,继而感染并破坏血红细胞,不断繁殖、不断破坏,导致人体发病。症状主要表现为周期性规律发作,全身发冷、发热、多汗,长期多次发作后,可引起贫血和脾肿大。凶险型疟疾可出现因脑、肝、肾、心、肺、胃、肠等受损引起的各种综合征,病情严重者会出现谵妄、昏迷和休克等症状,如诊断不及时或治疗不当,可危及生命。疟疾的早期快速诊断有助于及时治疗感染病例,降低死亡率,同时还可用于对献血者的血液筛查分析。寻找快速、简单、高敏感性和高特异性的疟疾检测方法,成为当前疟疾诊断研究的一个重要方面。
技术实现要素:
3.本发明的目的在于提供高效筛查疟原虫的pcr引物对、探针、微流控卡盒、试剂盒、检测体系和检测方法,所述pcr引物对、探针、微流控卡盒、试剂盒、检测体系和检测方法可用于任意pcr检测体系,包括但不限于常规pcr、rl-pcr、rna-pcr、荧光定量pcr、数字pcr、pcr-酶联免疫吸附测定(pcr-elisa),巢式pcr-高分辨率熔解分析(npcr-hrm)等,优选用于数字pcr。
4.为达到以上目的,本发明采用如下技术方案:
5.项1.一组用于特异性扩增疟原虫基因的pcr引物,其特征在于,所述引物包含如seq id no:1所示的正向引物、和如seq id no:2所示的反向引物。
6.项2.一组用于特异性筛查三日疟原虫的引物和探针组合,其特征在于,所述引物对包含如seq id no:1所示的正向引物、如seq id no:2所示的反向引物,所述探针包含如seq id no:3所示的探针。
7.项3.一组用于特异性筛查卵形疟原虫的引物和探针组合,其特征在于,所述引物对包含如seq id no:1所示的正向引物、如seq id no:2所示的反向引物,所述探针包含如seq id no:4和/或seq id no:5所示的探针。
8.项4.一组用于特异性筛查恶性疟原虫的引物和探针组合,其特征在于,所述引物对包含如seq id no:1所示的正向引物、如seq id no:2所示的反向引物,所述探针包含如seq id no:6所示的探针。
9.项5.一组用于特异性筛查间日疟原虫的引物和探针组合,其特征在于,所述引物对包含如seq id no:1所示的正向引物、如seq id no:2所示的反向引物,所述探针包含如seq id no:7所示的探针。
10.项6.一种基于pcr方法筛查或辅助筛查疟原虫的引物和探针组合,其特征在于,所述引物对包含如seq id no:1所示的正向引物、如seq id no:2所示的反向引物,所述探针包含如seq id no:3至seq id no:7所示的探针中的任意一条、任意两条、任意三条、任意四条、或五条。
11.项7.根据项2-6中任一项所述的引物和探针组合,其特征在于,所述探针序列的5’端标记有荧光报告基团,所述探针序列的3’端标记有荧光淬灭基团;当所述探针位于同一反应体系时,其中筛选不同种类疟原虫的荧光报告基团光谱范围不同。
12.项8.根据项7所述的引物和探针组合,其特征在于,所述荧光报告基团选自fam、vic、rox、cy5和/或hex;所述荧光淬灭基团选自bhq1、bhq2、bhq3、和/或eclipse。
13.项9.根据项8所述的引物和探针组合,其特征在于:其中使用的各探针及其5’端标记的荧光报告基团和3’端标记的荧光淬灭基团如下:
14.筛选三日疟原虫的探针如seq id no:3所示,其5’端荧光标记为fam,3’端荧光标记为bhq1;筛选卵形疟原虫w亚型的探针如seq id no:4所示,其5’端荧光标记为vic,3’端荧光标记为bhq1;筛选卵形疟原虫c亚型的探针如seq id no:5所示,其5’端荧光标记为vic,3’端荧光标记为bhq1;筛选恶性疟原虫的探针如seq id no:6所示,其5’端荧光标记为rox,3’端荧光标记为bhq2;筛选间日疟原虫的探针如seq id no:7所示,其5’端荧光标记为cy5,3’端荧光标记为bhq3。
15.项10.如项6-9任一项所述的引物和探针组合,其为数字pcr(dpcr)反应所用的引物和探针组合。
16.项11.一种筛查疟原虫的数字pcr反应预混液,其特征在于,所述pcr反应预混液包含如项1-9任一项所述的引物和/或探针。
17.项12.根据项11所述的数字pcr反应预混液,其还包括选自以下的一种、两种、三种、四种或五种组分:热启动taq酶、udg酶、dntps,牛血清白蛋白和mg
2+
离子。
18.项13.一种数字pcr微流控卡盒,其含有项11或项12所述的数字pcr反应预混液。
19.项14.一种用于筛查疟原虫的试剂盒,其特征在于,所述试剂盒包括如项11或12所述的数字pcr(dpcr)反应预混液。
20.项15.根据项14所述的试剂盒,其特征在于,所述试剂盒还包括疟原虫阳性对照、和/或阴性对照。
21.项16.根据项14所述的试剂盒,其特征在于,所述试剂盒还包括项13所述的数字pcr微流控卡盒。
22.项17.一种筛查疟原虫的方法,其特征在于,所述方法包括步骤:
23.(1)处理血浆样品;
24.(2)制备数字pcr扩增混合液,其含有步骤(1)提供的待检测样本和根据项11或12所述的数字pcr预混液和蒸馏水;
25.(3)在微流控卡盒内制备微滴,并进行pcr扩增反应;
26.(4)使用微流控卡盒读取仪进行微滴荧光信号读取;
27.(5)结果分析。
28.项18、根据项1所述的引物、根据项6所述的引物和探针、根据项11或12所述数字pcr反应预混液、或项13所述微流控卡盒在制备用于筛查疟原虫的定量检测试剂盒中的用
途。
29.应理解,在本发明范围内,本发明的上述各技术特征和下文中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅不再累述。
30.本发明取得的有益效果在于提供高效扩增并筛选疟原虫的引物对和探针,并可单次同时检测4种不同疟原虫感染。与传统血涂片方法相比,可以对不同疟原虫种类进行绝对定量。新开发的检测方法自动化程度高且易于使用,并且适用于在实际临床中检测到低密度寄生虫感染的无症状患者。该检测方法适用于高灵敏度检测,可用于常规检查和监测。进一步推广疟原虫检测,推动疟原虫耐药性研究、疟疾的个体化和精准化治疗与防控,为人类彻底战胜疟疾增强信心。
附图说明
31.图1为用本技术最优设计的引物和探针对4种疟原虫血液临床标本检测数据的结果图;锐讯数字pcr疟原虫检测试剂盒可以对患者临床样本中的4种疟原虫都有比较好的检出。
32.图2为用本技术非最优设计的引物和探针筛查疟原虫时的结果图。图2a为代表间日疟原虫的cy5荧光;图2b为代表恶性疟原虫的rox荧光;图2c为代表三日疟原虫的fam荧光;图2d为代表卵形疟原虫的hex荧光。
33.图3为用本技术所述的数字pcr微流控卡盒示意图。
具体实施方式
34.下面对本发明的具体实施方式进行详细描述,但应当理解,这些实例仅用于说明本发明而不用于限制本发明的范围。下面实例中未注明具体实验条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件操作。
35.除非另有其他明确表示,否则在整个说明书和权利要求书中,术语“包括”或其变换如“包含”或“包括有”等等将被理解为包括所陈述的成分或组成部分,而并未排除其他成分或其它组成部分。
36.疟原虫,是一类单细胞、寄生性的原生动物。主要有四种疟原虫会使人类感染疟疾,包括恶性疟原虫(plasmodium falciparum)、间日疟原虫(plasmodium vivax)、三日疟原虫(plasmodium malariae)和卵形疟原虫(plasmodium ovale)。这些疟原虫有蚊虫和人两个宿主,包括蚊体内的有性繁殖和人体内的无性增殖,携带疟原虫的按蚊通过叮咬人而传播,引起疟疾寒热往来发作,俗称“打摆子”。而其他种类的疟原虫会感染它种动物,包括其他灵长目动物、啮齿目动物、鸟类及爬虫类。我国主要感染为恶性和间日疟疾,偶尔有传入性三日和卵形疟疾。
37.目前可用于鉴定疟原虫属的诊断工具包括病原学诊断方法、血清学诊断方法和分子生物学诊断法。病原学检查是病原体确诊的“金标准”,包括涂片染色法、动物接种分离法或细胞培养法查找虫体等。血清诊断已成为当今广泛应用的诊断手段,方法种类较多,主要有间接血凝试验(iha)、间接免疫荧光试验(ifa)、酶联免疫吸附试验(elisa)以及免疫色谱侧向流动测定(又称为快速诊断测试,rdt)。但病原学、血清学检测方法存在耗时较长,灵敏度低,甚至敏感的rdt也与显微镜具有相似的局限性,对病原体繁殖不活跃或者潜伏期感染
id no:6所示:5
’‑
tcgaggtgacttttagattgct-3’。
46.另一方面,本技术提供了可筛查间日疟原虫的探针,所述探针的一个实例如seq id no:7所示:5
’‑
tttcttcggagtttattcttagattgc-3’。
47.另一方面,本技术提供了可同时筛查两种疟原虫的引物和探针的组合,所述引物和探针的组合为选自下述组合中的任一种:seq id no:1、seq id no:2、seq id no:3和seq id no:4,seq id no:1、seq id no:2、seq id no:3和seq id no:5,seq id no:1、seq id no:2、seq id no:3和seq id no:6,seq id no:1、seq id no:2、seq id no:3和seq id no:7,seq id no:1、seq id no:2、seq id no:4和seq id no:5,seq id no:1、seq id no:2、seq id no:4和seq id no:6,seq id no:1、seq id no:2、seq id no:4和seq id no:7,seq id no:1、seq id no:2、seq id no:5和seq id no:6,seq id no:1、seq id no:2、seq id no:5和seq id no:7,或seq id no:1、seq id no:2、seq id no:6和seq id no:7。
48.另一方面,本技术提供了可同时筛查三种疟原虫的引物和探针的组合,所述引物和探针的组合为选自下述组合中的任一种:seq id no:1、seq id no:2、seq id no:3、seq id no:4和seq id no:5,seq id no:1、seq id no:2、seq id no:3、seq id no:4和seq id no:6,seq id no:1、seq id no:2、seq id no:3、seq id no:4和seq id no:7,seq id no:1、seq id no:2、seq id no:3、seq id no:5和seq id no:6,seq id no:1、seq id no:2、seq id no:3、seq id no:5和seq id no:7,seq id no:1、seq id no:2、seq id no:3、seq id no:6和seq id no:7,seq id no:1、seq id no:2、seq id no:4、seq id no:5和seq id no:6,seq id no:1、seq id no:2、seq id no:4、seq id no:5和seq id no:7,seq id no:1、seq id no:2、seq id no:4、seq id no:6和seq id no:7,seq id no:1、seq id no:2、seq id no:5、seq id no:6和seq id no:7。
49.另一方面,本技术提供了可同时筛查四种疟原虫的引物和探针的组合,所述引物和探针的组合为:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6,seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:7,seq id no:1、seq id no:2、seq id no:3、seq id no:5、seq id no:6、seq id no:7,seq id no:1、seq id no:2、seq id no:4、seq id no:5、seq id no:6、seq id no:7。
50.另一方面,本技术提供了可同时筛查多种疟原虫的引物和探针的组合,所述引物和探针的组合为:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7。
51.另一方面,本技术所述探针序列的5’端标记有荧光报告基团,本技术所述探针序列的3’端标记有荧光淬灭基团。当所述探针位于同一反应体系时,其中筛选不同种类疟原虫的荧光报告基团光谱范围不同。本技术所述荧光报告基团可以是本领域常用的任何荧光报告基团,包括但不限于fam、vic、rox、cy5和/或hex;所述荧光淬灭基团可以是本领域常用的任何荧光淬灭基团,包括但不限于bhq1、bhq2、bhq3、和/或eclipse。
52.另一方面,本技术使用的各探针及其5’端标记的荧光报告基团和3’端标记的荧光淬灭基团如下:筛选三日疟原虫的探针如seq id no:3所示,其5’端荧光标记为fam,3’端荧光标记为bhq1,即5
’‑
fam-tatatgagtgtttcttttagatagctt-3
’‑
bhq1;筛选卵形疟原虫w亚型的探针如seq id no:4所示,其5’端荧光标记为vic,3’端荧光标记为bhq1,即5
’‑
vic-aagtttttaaataagaaaattccttttg-3
’‑
bhq1;筛选卵形疟原虫c亚型的探针如seq id no:5所
示,其5’端荧光标记为vic,3’端荧光标记为bhq1,即5
’‑
vic-aaaagtttttaaataagagaattccttt-3
’‑
bhq1;筛选恶性疟原虫的探针如seq id no:6所示,其5’端荧光标记为rox,3’端荧光标记为bhq2,即5
’‑
rox-tcgaggtgacttttagattgct-3
’‑
bhq2;筛选间日疟原虫的探针如seq id no:7所示,其5’端荧光标记为cy5,3’端荧光标记为bhq3,即5
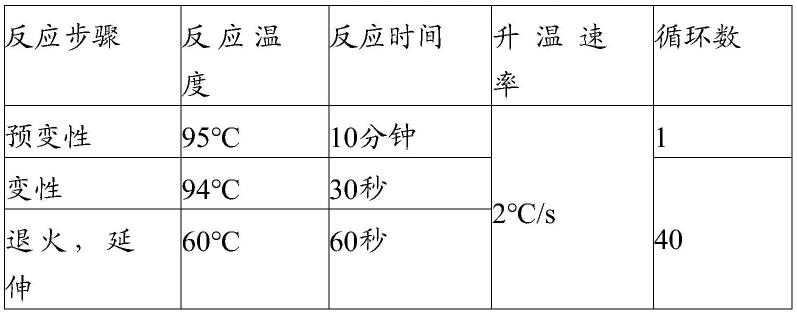
’‑
cy5-tttcttcggagtttattcttagattgc-3
’‑
bhq3。
53.本技术所述的引物和探针可应用于检测疟原虫的任意pcr检测体系,包括但不限于常规pcr、rl-pcr、rna-pcr、荧光定量pcr、数字pcr、pcr-酶联免疫吸附测定(pcr-elisa),巢式pcr-高分辨率熔解分析(npcr-hrm)等。优选将本技术所述引物和探针用于荧光定量pcr或数字pcr。最优选将本技术所述引物和探针用于数字pcr。
54.本技术中的数字pcr反应预混液含有引物、探针、酶(热启动taq酶和/或udg酶)、dntp、mg
2+
、牛血清蛋白等。
55.本技术中的数字pcr扩增混合液与数字pcr反应预混液相比,多了扩增模板(如样本模板、阳性对照或阴性对照)和蒸馏水。
56.一方面,本技术提供了筛查疟原虫的数字pcr反应预混液,所述pcr反应预混液包含上述的引物对、上述任意引物对和探针的组合、或上述引物对和任意探针的组合。
57.另一方面本技术提供的数字pcr反应预混液,除了上述引物对、或者上述任意引物对和探针的组合外,其还可以包括选自以下的任意一种、两种、三种、四种或五种组分:热启动taq酶、udg酶、dntps,牛血清白蛋白和mg
2+
离子。
58.本技术提供了筛查疟原虫的数字pcr(dpcr)反应预混液,其包含前述的任一pcr反应预混液,所述pcr反应预混液包括但不限于:如seq id no:1所示的上游引物和如seq id no:2所示的下游引物,和选自下组的任意一种、两种、三种、四种、或五种荧光标记探针:筛选三日疟原虫的如seq id no:3所示的探针即5
’‑
fam-tatatgagtgtttcttttagatagctt-3
’‑
bhq1、筛选卵形疟原虫w亚型的如seq id no:4所示的探针即5
’‑
vic-aagtttttaaataagaaaattccttttg-3
’‑
bhq1;筛选卵形疟原虫c亚型的如seq id no:5所示的探针即5
’‑
vic-aaaagtttttaaataagagaattccttt-3
’‑
bhq1;筛选恶性疟原虫的如seq id no:6所示的探针即5
’‑
rox-tcgaggtgacttttagattgct-3
’‑
bhq2;筛选间日疟原虫的如seq id no:7所示的探针即5
’‑
cy5-tttcttcggagtttattcttagattgc-3
’‑
bhq3。
59.本技术提供了用于筛查疟原虫的试剂盒,其包括如上所述的引物对,或如上所述的任意引物对和探针的组合、或上述引物对和任意探针的组合。所述试剂盒还可以包括选自以下的任意一种、两种、三种、四种或五种组分:热启动taq酶、udg酶、dntps,牛血清白蛋白和mg
2+
离子。所述试剂盒还可以包括疟原虫阳性对照、和/或阴性对照。
60.本技术提供了用于筛查疟原虫的检测体系,其含有前述引物对;所述检测体系可以含有上述探针中的任意一条、二条、三条、四条或五条。优选所述检测体系同时含有前述上游引物和下游引物以及所有如下表3中的seq id no:3-seq id no:7所示的五条探针。优选所述检测体系同时含有前述上游引物和下游引物以及所有五条被荧光标记的探针。所述荧光标记优选如下述的荧光标记:筛选三日疟原虫的如seq id no:3所示的探针即5
’‑
fam-tatatgagtgtttcttttagatagctt-3
’‑
bhq1、筛选卵形疟原虫w亚型的如seq id no:4所示的探针即5
’‑
vic-aagtttttaaataagaaaattccttttg-3
’‑
bhq1;筛选卵形疟原虫c亚型的如seq id no:5所示的探针即5
’‑
vic-aaaagtttttaaataagagaattccttt-3
’‑
bhq1;筛选恶性疟原虫
的如seq id no:6所示的探针即5
’‑
rox-tcgaggtgacttttagattgct-3
’‑
bhq2;筛选间日疟原虫的如seq id no:7所示的探针即5
’‑
cy5-tttcttcggagtttattcttagattgc-3
’‑
bhq3。
61.本技术提供的序列不限于上述如seq id no:1-7所示具有特定核苷酸序列的引物和探针,在所述核苷酸序列的基础上经过修饰、和/或一个或几个核苷酸的取代、和/或缺失和/或添加一个或几个核苷酸并与seq id no:1-7所示核苷酸序列具有95%以上同一性、且具有相同功能的核苷酸序列也在本技术的保护范围内。
62.另一方面,本技术提供了筛查疟原虫的方法,所述方法包括步骤:
63.(1)处理血浆样品;
64.外周血样品2-10ml,优选使用5-10ml、6-10ml、7-10ml、8-10ml、9-10ml,最优选使用10ml以提高检出率。优选使用edta抗凝剂,不可使用肝素抗凝剂。在血液离体后2小时内分离血浆,一般不宜超过4小时;血浆体积为0.5-4ml,优选1-4ml、2-4ml、3-4ml、最优选4ml。使用800转离心10min取上清。若不能及时分离血浆,可采用真空采血管室温存储,或使用含有游离dna保护剂及防细胞裂解保护剂的专用常温采血管(streck管),保存时间不超过3天。分离后的血浆可于-20℃
±
5℃保存3年。推荐使用商业化试剂盒提取血浆样品中微生物dna。dna提取完毕后,建议立即进行检测,否则最好放置于-20℃以下保存,保存时间不超过3个月。
65.(2)按表1配制数字pcr扩增混合液,其含有步骤(1)提供的待检测样品.和下述的数字pcr反应预混液;数字pcr反应预混液中正向和反向引物的终浓度分别为50-900nm,优选50-500nm,200-500nm,最优选450nm;每种探针的终浓度分别为50-800nm,优选50-500nm,100-400nm,最优选250nm;mg
2+
离子的终浓度为0.5-5mm,优选1-4.5mm,1.5-4mm,2-3.5mm,最优选3mm;牛血清白蛋白的终浓度为0.01-1wt%,优选使用0.02-0.5wt%,0.03-0.1wt%,0.04-0.08wt%,最优选为0.05%;热启动taq酶(可以为抗体修饰热启动taq酶,化学修饰热启动taq酶或适配体修饰热启动taq酶)终浓度为0.5-10u/反应,优选为1-5u/f反应,1.5-4u/反应,2-3.5u/反应,最优为2.5u/反应;dntp终浓度为20-300μm,优选为50-250μm,100-230μm,150-220μm,最优选为200μm。数字pcr反应预混液中还可以含有ung酶,其终浓度为0.1-10u/反应,0.5-5u/反应,1-2.5u/反应,1-2u/反应,最优选1.5u/反应。数字pcr反应预混液的ph值为7-9,优选为ph7.4-8.5,优选为ph 7.8-8.2,最优选为ph 8.0。
66.表1数字pcr扩增混合液
67.试剂体积(μl)数字pcr反应预混液12样本(模板)*或阳性对照或阴性对照**可变ntc(蒸馏水,不含dna酶和/或rna酶)加至20μl总体积20
68.*对于血浆疟原虫dna,将同一个样本抽提的核酸尽可能浓缩在32-40μl体积内,分为4孔全部在一张数字pcr微流控卡盒上上样;
69.**阳性对照(分别含有卵形疟原虫、三日疟原虫、间日疟原虫和恶性疟原虫基因序列的人工合成质粒中的一种、两种、三种或四种的混合物)加入量为4μl;阴性对照(不含有疟原虫基因序列的人工合成质粒)加入量为4μl。ntc:空白无模板对照(no template control)为蒸馏水(未包含在试剂盒内)。其中阳性对照、阴性对照和ntc(空白无模板对照)
中添加的引物和探针与含有样本的体系中是一样的。
70.表1所述数字pcr扩增混合液中所用的引物探针混合液中包含如seq id no:1所示的上游引物和如seq id no:2所示的下游引物,和选自下组的任意一种、两种、三种、四种、或五种荧光标记探针:筛选三日疟原虫的如seq id no:3所示的探针即5
’‑
fam-tatatgagtgtttcttttagatagctt-3
’‑
bhq1、筛选卵形疟原虫w亚型的如seq id no:4所示的探针即5
’‑
vic-aagtttttaaataagaaaattccttttg-3
’‑
bhq1;筛选卵形疟原虫c亚型的如seq id no:5所示的探针即5
’‑
vic-aaaagtttttaaataagagaattccttt-3
’‑
bhq1;筛选恶性疟原虫的如seq id no:6所示的探针即5
’‑
rox-tcgaggtgacttttagattgct-3
’‑
bhq2;筛选间日疟原虫的如seq id no:7所示的探针即5
’‑
cy5-tttcttcggagtttattcttagattgc-3
’‑
bhq3。
71.表1所述数字pcr扩增混合液中所用的引物探针混合液中优选包含如seq id no:1所示的上游引物和如seq id no:2所示的下游引物,以及下述五种荧光标记探针:筛选三日疟原虫的如seq id no:3所示的探针即5
’‑
fam-tatatgagtgtttcttttagatagctt-3
’‑
bhq1、筛选卵形疟原虫w亚型的如seq id no:4所示的探针即5
’‑
vic-aagtttttaaataagaaaattccttttg-3
’‑
bhq1;筛选卵形疟原虫c亚型的如seq id no:5所示的探针即5
’‑
vic-aaaagtttttaaataagagaattccttt-3
’‑
bhq1;筛选恶性疟原虫的如seq id no:6所示的探针即5
’‑
rox-tcgaggtgacttttagattgct-3
’‑
bhq2;筛选间日疟原虫的如seq id no:7所示的探针即5
’‑
cy5-tttcttcggagtttattcttagattgc-3
’‑
bhq3。
72.(3)制备微滴,进行pcr扩增反应;
73.第一步:制备微滴。在微流控卡盒顶部的方形加油孔内先加入50-100μl液滴生成油,优选70-100μl,最优选为75μl。
74.第二步:在微流控卡盒顶部的圆形加样孔内加入13-25μl数字pcr扩增混合液(含有扩增的核酸模板,引物探针等),优选15-25μl,最优选为20μl;
75.第三步:在数字pcr扩增混合液顶部用移液器加入5-10μl密封油,最优选为10μl。
76.第四步:将微流控卡盒的顶部加样孔和加油孔,底部的废液孔分别用2张塑料密封盖盖住;将所述装有pcr扩增混合液的微流控卡盒置于pcr扩增仪上,优选sg-2000pcr扩增仪。可以按照表2推荐的扩增程序进行扩增反应:
77.表2pcr扩增反应程序的一种示例
[0078][0079]
seq id no:18间日疟原虫下游引物5
’‑
aagagctctcaatctgtcaatcc-3’seq id no:19间日疟原虫探针5
’‑
tcaacacgggaaaactcactagttt-3’[0092]
本技术中使用的探针所带荧光标记的一种情况如表5所示:
[0093]
表5本技术中用到的探针荧光标记的一种示例
[0094][0095]
实施例
[0096]
实施例一:4种疟原虫同时筛查的多重数字pcr引物探针序列设计合成
[0097]
1、在ncbi等核酸数据库中获取4种疟原虫基因序列。
[0098]
2、通过软件对4种疟原虫基因序列进行编辑与整理。
[0099]
3、通过blast软件对4种疟原虫检测引物探针定位。
[0100]
4、在primer premier软件上设计4种疟原虫检测引物探针,4种疟原虫共用一对引物。探针的设计区间根据4种疟原虫的特异序列设计,达到用不同探针区分4种疟原虫的检测效果。
[0101]
5、结合设计出的引物和探针序列通过分析软件获取扩增后的目标序列,并进行比对分析;
[0102]
6、分析探针引物的tm值,gc含量,长度,二级结构,结合位点特异性等信息,对引物探针进行综合评价
[0103]
实施例二:4种疟原虫同时筛查的多重数字pcr检测方法(本实施例中采用如表3中所示最优设计的引物和探针,所述探针的荧光标记如表5所示)
[0104]
1、血浆样本处理:
[0105]
取外周血样本10ml。使用edta抗凝剂。在血液离体后2小时内分离血浆,一般不宜超过4小时,血浆体积4ml。使用800转离心10min取上清。使用商业化试剂盒提取血浆样本中微生物dna。dna提取完毕后,立即进行检测。
[0106]
2、按表6配制数字pcr扩增混合液,并涡旋混匀,瞬时离心。将75μl液滴生成油加入数字pcr微流控卡盒的加油孔内,将20μl制备好的数字pcr扩增混合液加入微流控卡盒的加样孔内,将10μl的密封油加在数字pcr扩增混合液的顶部。将微流控卡盒两侧用密封盖盖
住。
[0107]
表6
[0108]
试剂体积(μl)数字pcr预混液12样本(模板)*或阳性对照或阴性对照**可变ntc(蒸馏水,不含dna酶和/或rna酶)加至20μl总体积20
[0109]
*对于血浆疟原虫dna,将同一个样本抽提的核酸浓缩在32-40μl体积内,分为4孔全部在一张数字pcr卡盒上上样;
[0110]
**阳性对照为:4种分别含有卵形疟原虫、三日疟原虫、间日疟原虫和恶性疟原虫基因序列的人工合成质粒混合物,阳性对照加入量为4μl;阴性对照为:不含有疟原虫基因序列的人工合成质粒,阴性对照加入量为4μl。ntc:空白无模板对照(no template control)为蒸馏水(未包含在试剂盒内)。其中阳性对照、阴性对照和ntc(空白无模板对照)中添加的引物和探针与含有样本的体系中是一样的。
[0111]
3、微滴制备及扩增
[0112]
向高通量数字pcr卡盒中的加油孔中加入75μl的液滴生成油,加入10μl密封油,加样孔中加入20μl的扩增混合液,盖上密封盖,置于pcr扩增仪(sg-2000)上。按照表7所示推荐sg-2000扩增程序进行扩增反应:
[0113]
表7
[0114][0115]
4、信号收集
[0116]
生物卡盒阅读仪(dscanner4-1000)上选择mut模式,荧光通道设置fam,hex,rox和cy5,将高通量数字pcr卡盒从pcr扩增仪(sg-2000)上取出,平稳转移置于生物卡盒阅读仪上进行信号收集。
[0117]
1)结果分析
[0118]
点击生物卡盒阅读仪上“analyze”分析实验数据。先查看“accepted droplets”≥10000即可进行后续分析。点击“2d amplitude”查看通道1,通道2,通道3和通道4的2d散点图。根据四组阳性对照,点击2d图来划分出各个区域,每个附图中下方颜色最深的黑色点代表没有扩增模板的液滴,绿色点代表含有fam标记探针的液滴,蓝色点代表含有hex标记探针的液滴,橙色点代表含有rox标记探针的液滴,紫红色点代表含有cy5探针标记的液滴,红
色点代表同时含有两组探针标记的液滴。
[0119]
锐讯数字pcr疟原虫检测方法可以对患者临床样本中的4种疟原虫都有比较好的检出。结果如图1和表8所示:
[0120]
表8
[0121][0122]
实施例三:4种疟原虫同时筛查的多重数字pcr检测方法(对比例,本实施例中采用如表2和表3中所示的非最优设计的引物和探针)
[0123]
采用如实施例2所述相同方法处理血浆样本、配制pcr扩增混合液、制备微滴、扩增、收集信号并分析结果,只是采用如表2和表3所示非最优设计的引物和探针。结果如图2所示。
[0124]
由附图1所示结果可以看出:使用最优设计的引物和探针时,阴性液滴图和阳性液滴图区分清楚,可以划分明显的阈值线。阴性液滴团和阳性液体团之间没有杂点、拖尾或雨状液滴。
[0125]
由附图2所示结果可以看出:使用非最优设计引物和探针的区分效果不佳。所述效果不佳体现在阴阳液滴区分度差,没有明显的分隔,中间有明显的拖尾现象,难以划分阈值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1