一种基于多维纳米敏感材料的细胞胞吐研究芯片及其应用
1.本发明涉及生物学检测技术领域,更具体地涉及一种基于多维纳米敏感材料的细胞胞吐研究芯片及其应用。
背景技术:
2.神经细胞通过囊泡胞吐释放神经递质是神经系统调节机体的主要途径,也是神经生物学、生物化学、临床医疗、病理和药学等多个领域中的基本生物学原理,其机理研究对于神经疾病的预防、诊疗和治疗极为重要。采用经典的安培法对胞吐作用进行测试时,可以在测试图谱上观察到若干个不连续的尖峰,这些尖峰是由胞吐事件引起的信号。对这类尖峰的大小与形态等进行深入分析,可以获得胞吐发生的频率、释放出的神经递质分子数量等丰富的信息,从而为神经细胞或神经元之间的信息交流研究提供了关键的数据。已经证实胞吐作用可以通过各种临床药物来进行有效调控,因此该研究可以为帕金森病等神经退行性疾病的药物治疗提供相关分子作用基础。此外,大量的常用药物例如抗病毒药物和止痛药物等对神经胞吐也可能具有影响作用。但由于神经细胞的胞吐作用测量仍然依赖于精密的测量仪器以及专业的实验操作技能,造成了这类神经细胞胞吐作用的药物调控研究依然不够深入。因此,发展先进的测量方法来直接、便捷测量神经细胞的胞吐作用,对于研究药物(无论是常用药物还是新上市药物)的神经系统影响具有非常重要的作用。
技术实现要素:
3.传统的电化学芯片仅能测试均一溶液中的多巴胺浓度,而无法实时测试神经细胞的胞吐事件。本发明的目的是提供一种基于多维纳米敏感材料的细胞胞吐研究芯片及其应用,从而解决现有技术中神经细胞的胞吐作用测量由于依赖于精密的测量仪器以及专业的实验操作技能而导致相关研究无法深入的问题。
4.为了解决上述技术问题,本发明采用以下技术方案:
5.根据本发明的第一方面,提供一种基于多维纳米敏感材料的细胞胞吐研究芯片,包括对电极、参比电极以及工作电极,所述工作电极上涂覆有多维纳米敏感材料,所述多维纳米敏感材料由一维zno纳米线、二维还原氧化石墨烯纳米片和多孔的沸石咪唑啉骨架-8纳米壳组成,所述细胞胞吐研究芯片可用于检测多巴胺能神经元细胞的胞吐事件。
6.根据本发明的一个优选方案,所述多维纳米敏感材料的制备方法包括:取1~4mg mng-1材料与150μl乙醇以及50μl nafion溶液混合,并超声处理10~15分钟,获得均匀的浆料,即得。
7.所述细胞胞吐研究芯片的制备方法包括:用移液器取1~3μl所述多维纳米敏感材料,涂覆于工作电极所在的区域,在室温下放置20~30分钟至溶剂充分挥发,即得。
8.根据本发明的第二方面,提供一种基于多维纳米敏感材料的细胞胞吐研究芯片在检测多巴胺能细胞的胞吐事件中的应用。
9.根据本发明的一个优选方案,所述应用包括以下步骤:a1:提供一种如上面所述的
基于多维纳米敏感材料的细胞胞吐研究芯片;a2:通过pbs溶液稀释多巴胺能细胞,获得指定浓度的细胞分散液;a3:使用移液器充分吹打步骤a2获得的细胞分散液,分别取5~20μl指定浓度的细胞分散液置于电化学传感芯片的检测区域,使分散液充分覆盖工作电极、参比电极和对电极;a4:设置检测电位为0.30~0.40v,取样间隔为0.005~0.012秒,利用安培法检测电流;a5:待基线稳定后,使用移液器向所述细胞分散液中加入高浓度的k
+
溶液刺激所述多巴胺能细胞进行胞吐;a6:继续测试150秒后,终止实验,统计加入k
+
溶液后测试曲线上出现尖峰的数量及面积,对多巴胺能细胞胞吐事件发生的数量和释放的多巴胺分子数进行分析。
10.优选地,步骤a5包括:待基线稳定后,使用移液器向所述细胞分散液中加入为细胞分散液总体积五分之一体积的含有480mm的氯化钾和12mm的氯化钙溶液,分散液中最终的钾离子浓度为80mm,钙离子浓度为2mm。
11.优选地,步骤a6包括:将电流值大于噪音值2~3倍的信号认定为尖峰,统计加入钾、钙后测试曲线上出现尖峰的数量与面积,多巴胺能细胞胞吐事件发生的数量随着多巴胺能细胞的数量增加而增加。
12.步骤a6还包括:尖峰曲线积分得到的面积q为一个胞吐事件中被da分子氧化过程中总的转移电量,根据法拉第方程q=nnf,q为尖峰面积,n为一个多巴胺分子被氧化转移的电子个数,n为一个胞吐事件所释放的多巴胺分子数量,f为法拉第常数(96500c/mol),即可计算出平均每个胞吐事件释放的多巴胺分子数量n。
13.根据本发明的另一优选方案,所述应用还包括通过对多巴胺能细胞的胞吐事件的检测,实现药物对神经系统的影响的研究,所述药物是对神经细胞分泌多巴胺有已知或潜在影响的药物。
14.所述应用包括以下步骤:b1:提供一种如上面所述的基于多维纳米敏感材料的细胞胞吐研究芯片;b2:通过pbs溶液稀释多巴胺能细胞,获得一定浓度的细胞分散液,分别采用不同药物对所述细胞分散液中的细胞进行处理,充分吹打均匀后,置入37℃培养箱中静置10~15分钟;b3:使用移液器充分吹打步骤b2获得的未加药处理的细胞分散液、不同药物处理的细胞分散液,分别取5~20μl细胞分散液置于电化学传感芯片的检测区域,使分散液充分覆盖工作电极、参比电极和对电极;b4:设置检测电位为0.30~0.40v,取样间隔为0.005~0.012秒,利用安培法检测电流;b5:待基线稳定后,使用移液器向所述细胞分散液中加入高浓度的k
+
溶液刺激所述多巴胺能细胞进行胞吐;b6:继续测试150秒后,终止实验,统计加入k
+
溶液后测试曲线上出现尖峰的数量及面积,观察不同药物处理对多巴胺能细胞胞吐事件发生的影响。
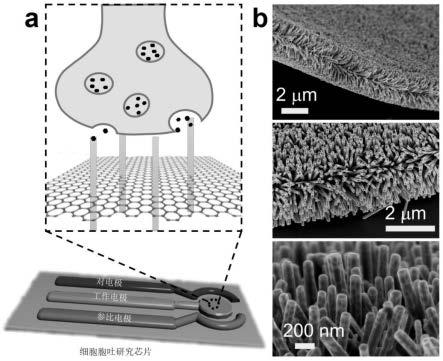
15.根据本发明提供的一种基于多维纳米敏感材料的细胞胞吐研究芯片,该细胞胞吐研究芯片的整体结构如图1中的a所示,多维纳米敏感材料mng-1的结构如图1中的b所示,mng-1材料由一维zno纳米线、二维还原氧化石墨烯(rgo)纳米片和多孔的沸石咪唑啉骨架-8(zif-8)纳米壳组成(即zif-8@zno@go),具体通过在二维氧化石墨烯(rgo)上生长阵列式的一维纳米线,并进一步在纳米线表面生长多孔的沸石咪唑啉骨架-8(zif-8)纳米壳构建而成(有关该材料zif-8@zno@go的制备方法,具体可参见multi-dimensional multi-level sensing nanostructure for high-performance detection to trace-level dopamine molecules,pengcheng xu,manyi liu,xinxin li,etc.,transducers 2017,kaohsiung,
taiwan,june 18-22,2017)。该多维纳米敏感材料具有密集排列的天线状结构,有助于从各个方向检测活细胞的胞吐情况,并且具有协同效应,可以检测活细胞原位释放神经递质多巴胺(da)的胞吐事件。
16.具体的协同效应如下:1)zif-8壳层作为固体碱纳米催化剂,在溶液中深度氧化da分子,氧化过程中的电子转移产生的电信号可用于对胞吐事件进行分析;2)阵列纳米线有助于从各个方向捕获胞吐事件,而zno纳米线提供锌以支持zif-8的生长;3)rgo纳米片具有高导电性,有助于将反应产生的电子传输到传感器电极,此外,rgo纳米片容纳致密的zno纳米线作为电子传输通道。当将mng-1纳米结构材料加载到丝网印刷芯片上时,形成电化学微生物传感器,之后只需将多巴胺能细胞分散液滴加到芯片的微小传感区域即可完成样品制备。
17.众所周知的是,传统的电化学芯片仅能测试均一溶液中的多巴胺浓度,而无法实时测试神经细胞的胞吐事件。本发明的创造性主要在于,将多维纳米敏感材料mng-1制作成细胞胞吐研究芯片,并将其应用到细胞胞吐事件的检测中,首次制备这样一种基于多维纳米敏感材料的细胞胞吐研究芯片,基于该多维纳米敏感材料独特的纳米结构与尺度,其纳米线与细胞可充分接触,从而实现对多巴胺能神经元细胞的胞吐事件的直接检测。
18.目前对胞吐的检测方法是利用碳纤维电极,需要倒置显微操作系统进行极其精密的操作使微米直径的碳纤维电极逼近细胞,效率很低,而且需要高端昂贵的信号放大和电磁屏蔽系统。然而,本发明基于纸基电化学芯片,第一,利用多维材料克服了普通电化学芯片无法实时测试胞吐事件的技术难点,能够实现对胞吐尖峰的捕捉与记录;第二,在操作方式上,无需高难度的细胞操作,只需将细胞滴加在芯片上即可测试,大大提高了测试效率;第三,无需高端的电磁屏蔽操作间和信号放大系统,仅用普通的电化学工作站和小型屏蔽箱即可操作,降低了研究的门槛与成本;第四,碳纤维电极每次仅能测试一个细胞,要获得能具有统计学重要性的大量数据所需的时间与工作量巨大,而本发明可以一次性测试1~100个细胞,在短时间内获得具有统计学重要性的数据,大大提高检测与研究效率。
19.本发明不依赖于精密的测量仪器以及专业的实验操作技能,成功实现了多巴胺能细胞胞吐事件的研究,以及神经细胞胞吐作用的药物调控研究。总之,本发明通过直接、便捷地测量神经细胞的胞吐作用,对于研究无论是常用药物还是新上市药物的神经系统影响具有非常重要的作用。
20.与现有技术相比,本发明具有如下有益效果:
21.1)测定方法简便快捷,无需高端的电流放大与屏蔽系统、复杂精密的仪器操作和前处理过程,只要将所需数目的多巴胺能细胞滴加到电化学传感芯片上即可测试;
22.2)此方法基于电化学技术与丝网印刷电极,检测成本低,电极可一次性使用;
23.3)检出时间快,制样测试时间少于300秒;
24.4)可用于药物对囊泡释放影响评估,细胞生理过程研究等领域。
25.综上所述,根据本发明提供的一种基于多维纳米敏感材料的细胞胞吐研究芯片及其应用,解决了现有技术中神经细胞的胞吐作用测量由于依赖于精密的测量仪器以及专业的实验操作技能而导致相关研究无法深入的问题,通过直接、便捷地测量神经细胞的胞吐作用,可为帕金森病等精神疾病的药物治疗提供关键的分子作用基础,在细胞生理过程研究、常用药物研究以及新药开发研究等领域均具有广阔的应用前景。
附图说明
26.图1示出了根据本发明制备的一种基于多维纳米敏感材料的细胞胞吐研究芯片的结构示意图(a),以及多维纳米敏感材料的扫描电镜图片(b);
27.图2是实施例1中安培法检测不同数量pc12细胞在高钾离子浓度刺激下的胞吐事件的测量曲线;
28.图3是实施例2中安培法检测不同药物对pc12细胞的胞吐事件的影响的测量曲线。
具体实施方式
29.以下结合具体实施例,对本发明做进一步说明。应理解,以下实施例仅用于说明本发明而非用于限制本发明的范围。
30.实施例1
31.本实施例实时检测不同数量pc12细胞在高钾离子浓度刺激下的胞吐行为,将5微升含有所需数量的pc12细胞分散液滴到生物传感器的微电极上。由于zno纳米线的阵列结构,细胞可以粘附在mng-1材料的表面,zif-8催化剂可以接近细胞膜。然后,用高浓度k
+
溶液刺激活细胞进行胞吐。具体操作如下:
32.1)取1~4毫克mng-1材料与150微升乙醇和50微升nafion溶液混合,并超声处理10分钟得到均匀的浆料;
33.2)用移液器取1微升浆料,涂覆于电化学传感芯片的工作电极区域,在室温下放置30分钟至溶剂充分挥发;
34.3)pc12细胞由中国科学院细胞库提供,培养基为含有10%马血清,5%牛血清和1%青霉素-链霉素双抗的rpmi-1640培养液,放置在37摄氏度、5%co2的培养箱中,每两天以1:1的比例传代一次。
35.4)使用细胞计数板确定细胞浓度为7.5
×
105个/毫升,充分吹打均匀后取此细胞分散液20微升加入980微升pbs缓冲液中,得到浓度为15000个/毫升的细胞分散液(细胞分散液-1);取133.3微升细胞分散液-1加入866.7微升pbs缓冲液中,得到浓度为2000个/毫升的细胞分散液(细胞分散液-2);取100微升细胞分散液-2加入900微升pbs缓冲液中,得到浓度为200个/毫升的细胞分散液(细胞分散液-3)。
36.5)使用移液器充分吹打三种细胞分散液,分别取5微升细胞分散液-3、2、1于电化学传感芯片的检测区域,使分散液充分覆盖工作电极、参比电极和对电极,分别检测1个、10个和75个pc12细胞的胞吐情况;
37.6)利用安培法检测电流:设置检测电位为0.34v,取样间隔为0.012秒。
38.7)待基线稳定后(约100s秒),使用移液器向分散液中小心加入1微升含有480mm的氯化钾和12mm的氯化钙溶液,分散液中最终的钾离子浓度为80mm,钙离子浓度为2mm。
39.8)继续测试150秒后,终止实验。
40.9)统计加入钾、钙后测试曲线上出现尖峰的数量与面积,可观察到随着pc12细胞的数量增加,尖峰的数量增加;尖峰曲线积分得到的面积q为一个胞吐事件中被da分子氧化过程中总的转移电量,根据法拉第方程q=nnf(q为尖峰面积,n为一个da分子被氧化转移的电子个数,n为一个胞吐事件所释放的da分子数量),f为法拉第常数(96500c/mol),即可计算出平均每个胞吐事件释放的多巴胺分子数量n。
41.测量曲线如图2所示,用高浓度k
+
溶液刺激活细胞进行胞吐,在测量曲线中可依次观测到许多尖峰信号,并且随着pc12细胞的数量增加,尖峰的数量增加。通过以上法拉第方程计算得出平均每个胞吐事件释放的da数量为166
±
22zmol,与其他文献报导相符。
42.实施例2
43.da浓度与神经系统疾病的发生密切相关。例如,低浓度的da可能是由神经退行性疾病如帕金森氏症引起的。在实际医疗中,常用一些能显著促进神经细胞da分泌的药物(如金刚烷胺)来改善帕金森病的症状。相反,一些临床使用的麻醉剂(如利多卡因)能抑制神经细胞分泌da。本实施例分别采用金刚烷胺和利多卡因对多巴胺能细胞进行处理,然后观测该药物对多巴胺能细胞胞吐事件的影响。具体操作如下:
44.1)取1~4毫克mng-1材料与150微升乙醇和50微升nafion溶液混合,并超声处理10分钟得到均匀的浆料;
45.2)用移液器取1微升浆料,涂覆于电化学传感芯片的工作电极区域,在室温下放置30分钟至溶剂充分挥发;
46.3)pc12细胞由中国科学院细胞库提供,培养基为含有10%马血清,5%牛血清和1%青霉素-链霉素双抗的rpmi-1640培养液,放置在37摄氏度、5%co2的培养箱中,每两天以1:1的比例传代一次。
47.4)使用细胞计数板确定细胞浓度为7.5
×
105个/毫升,充分吹打均匀后取此细胞分散液20微升加入980微升pbs缓冲液中,得到浓度为15000个/毫升的细胞分散液(细胞分散液-1);分别取133.3微升细胞分散液-1加入866.7微升pbs缓冲液,得到浓度为2000个/毫升的细胞分散液(细胞分散液-2)。
48.s5.取两份100微升细胞分散液-2在1000转/分钟条件下离心5分钟,去除上清pbs缓冲液,分别加入含有0.3微克/毫升金刚烷胺溶液和1.2毫克/毫升利多卡因的pbs缓冲液,充分吹打均匀后,置入37摄氏度培养箱中静置10分钟。
49.6)使用移液器充分吹打未加入药物处理的细胞分散液-1、金刚烷胺和利多卡因处理过的细胞分散液,分别取5微升置于电化学传感芯片的检测区域,使分散液充分覆盖工作电极、参比电极和对电极,分别检测10个pc12细胞在无药物处理、金刚烷胺处理和利多卡因处理后的胞吐情况;
50.7)利用安培法检测电流:设置检测电位为0.34v,取样间隔为0.012秒。
51.8)待基线稳定后(约100s秒),使用移液器向分散液中小心加入1微升含有480mm的氯化钾和12mm的氯化钙溶液,分散液中最终的钾离子浓度为80mm,钙离子浓度为2mm。
52.9)继续测试150秒后,终止实验。
53.10)统计加入钾、钙后测试曲线上出现尖峰的数量,观察金刚烷胺对细胞胞吐的促进作用以及利多卡因对胞吐事件的抑制作用。
54.测量曲线如图3所示,与未经处理的pc12细胞的值相比,经金刚烷胺预处理的pc12细胞的曲线中的尖峰数量显著增加,而使用麻醉剂利多卡因预处理过的pc12细胞的曲线中的尖峰数量明显减少,该结果进一步验证了金刚烷胺可显著促进神经细胞分泌da,而利多卡因可以减少或停止神经细胞分泌da。
55.以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。凡是依据本发明申请的权利要求书及说明书内容所作的简
单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种治疗感冒的中药组合物的制作方法
- 阿掏比克酸三唑基与1h?四氮唑基衍生物的组合物用于制备抗病毒药物的制作方法
- Schiglautone A衍生物的组合物用于制备抗病毒药物的制作方法
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 一种白头翁与蛴螬有效部位配伍后抗rsv病毒的制备方法
- 表达信号肽替换的呼吸道合胞病毒f蛋白的重组新城疫耐热疫苗株及制备方法
- 一种蛴螬中可抗呼吸道合胞病毒的有效部位及制备方法
- Salviskinone A的苯并咪唑基和二(2-甲硫基乙基)胺基衍生物的组合物在抗病毒药物中 ...的制作方法
- 一种呼吸道合胞体病毒疫苗及其制备方法与应用
- Virosaine A的四氢吡咯基和吗啉基衍生物的组合物在抗病毒药物中的应用