两种小米源寡肽及其在治疗代谢综合征中的应用
1.本技术属于生物活性肽领域和代谢类疾病治疗领域,具体地,本技术提供了两种小米源寡肽及其在治疗代谢综合征中的应用。
背景技术:
2.代谢综合征是指人体的碳水化合物、脂肪、蛋白质等物质发生代谢紊乱的病理状态,症状包括高血压、高血糖、中心性肥胖和血脂异常等,其在全球成年人中的患病率为20%~45%。目前认为代谢综合征不仅与遗传、免疫关系密切,还受高脂、高碳水化合物的膳食结构,缺乏体育锻炼等影响。判断代谢综合征的指标主要包括血压、血糖、肥胖、甘油三酯和高密度脂蛋白胆固醇,上述三项以上指标超过正常水平则表明患有代谢综合征。
3.代谢综合征是心血管疾病和糖尿病的高危因素,增加人群死亡风险,其发生和发展严重威胁人类健康,给国家和家庭带来沉重的经济负担和医疗压力。目前,饮食和运动干预是预防和早期干预治疗代谢综合征的有效手段,但是该手段多数人难以坚持且存在周期长和反弹迅速的问题。代谢综合征的治疗多根据临床症状来选择对症药物,如利尿剂、β受体拮抗剂、钙通道阻滞剂、血管紧张素转换酶抑制剂用于降压,双胍类、磺脲类和α-葡萄糖苷酶抑制剂药物用于降糖,他汀类、贝特类、烟酸类、胰脂肪酶抑制剂和胆固醇酯酶抑制剂药物用于减肥和缓解血脂异常。这些药物针对代谢综合征的各项单一风险因素具有良好的疗效,然而代谢综合征往往同时具有多种临床表现。此外,药物调节虽然能够达到一定的代谢综合征治疗目的,但是长期服用药物存在一定的副作用,停药也会导致代谢综合征的复发。因此,亟待发现一种既能够预防和调节代谢综合征的多个风险因素,又能够避免对人体产生副作用的物质。
4.小米是一种药食两用优质杂粮,起源于我国黄河流域,已有8000多年种植历史。小米营养成分丰富,富含膳食纤维、不饱和脂肪酸、矿物质、维生素和生物活性物质。《神农百草经》记载小米养肾气,去胃脾中热,消渴,利小便。现代医学研究也揭示小米具有各种生理作用,如抗高血压、降糖、抗肥胖、缓解血脂异常等。小米富含蛋白质(9.0%~13.99%),并且低敏性的小米蛋白也是优质植物蛋白质的重要来源。目前,已有众多文献指出小米蛋白是小米发挥多种健康功效的关键成分。小米蛋白在一级结构中加密了具有广泛生物活性的各种生物活性肽,这些生物活性肽在蛋白被酶水解后得以释放。因此我们通过酶解、分离纯化、肽测序、生物信息学等技术筛选出小米蛋白中能够预防和调节代谢综合征中多个风险因素的生物活性肽并进行功能验证,为开发和代谢综合征有关的食品、保健品以及药品提供技术支持。
技术实现要素:
5.为解决现有代谢综合征治疗药物毒副作用明显,以及无法同时预防和调节代谢综合征中多个风险因素的问题,提供两种小米源可预防、缓解和治疗代谢综合征的寡肽。本发明首先经胃蛋白酶-胰酶消化体系水解得到小米蛋白水解物,再通过分离纯化、肽测序、生
物信息学等技术筛选出生物活性肽,然后基于分子对接技术实现生物活性肽的代谢综合征作用靶点(血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶)筛选,最后利用fmoc固相合成方法制备的生物活性肽验证其对血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶的抑制活性,并阐明抑制机理。
6.本发明的两种小米源亲水性/碱性寡肽,酪氨酸-色氨酸-苏氨酸-精氨酸-脯氨酸-组氨酸(tyr-trp-thr-arg-pro-his,ywtrph),酪氨酸-色氨酸-苏氨酸-丙氨酸-精氨酸-脯氨酸(tyr-trp-thr-ala-arg-pro,ywtarp),是发明人通过大量工作筛选得到的,具有天然、无毒、无过敏性、分子量小、不被胃肠道消化的特点,血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶抑制活性高,并且进一步发现它们通过盐桥、疏水相互作用、π-π堆积、π-阳离子相互作用、氢键与作用靶点酶的氨基酸残基结合实现抑制活性的发挥。同时本发明提供的两种寡肽的制备方法简单,易于工业化生产,可大规模制备。相较于ywtarp,ywtrph具有更加显著的α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶抑制活性,并且“ywt-rp”结构有助于血管紧张素转化酶抑制活性的发挥。两种小米源寡肽的发现为开发和代谢综合征有关的食品、保健品以及药品提供了新的资源,对于预防、缓解和治疗代谢综合征具有重要的应用意义。
7.本技术提供了小米来源的寡肽,所述寡肽具有血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶抑制活性;所述寡肽序列为ywtx1x2x3rpx4x5x6x7;其中x1、x2、x3、x4、x5、x6、x7为任意氨基酸残基或者不存在。
8.进一步地,所述寡肽序列为ywtrph或者ywtarp。
9.进一步地,所述寡肽为6肽。
10.进一步地,所述寡肽具备血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶抑制活性。
11.另一方面,本技术提供了上述寡肽在制备治疗代谢综合征中的药物组合物、保健品或者食品用途。
12.进一步地,所述治疗代谢综合征包括降低血压、降低血糖、降低血脂和控制肥胖。
13.使用本领域已知的算法,例如blast、genpast等计算与上述寡肽具备80%以上序列同一性的寡肽也考虑具有类似的功能和用途。
14.本技术还提供了用于治疗代谢综合征的药物组合物、保健品或者食品,其包含上述寡肽。
15.本技术还提供了上述寡肽在制备血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶抑制剂中的应用。
16.本技术中所述的治疗代谢综合征包括但不限于降低血压、降低血糖、降低血脂、降低血黏度、降低尿酸、降低心梗可能性、降低脑梗可能性和控制肥胖等本领域已知的代谢综合征症状。所述“控制”是指消除、减轻症状或者抑制症状的发展速度。
17.所述药物组合物或者保健品中还包括选自填充剂、包衣机、ph调节剂、抗氧化剂、溶剂、助溶剂、润滑剂、矫味剂中的一种或多种的辅料。
18.所述药物组合物或者保健品的剂型选自片剂、胶囊剂、粉末剂、口服液、水针剂、粉针剂。
19.上述药物组合物的剂型和赋形剂本领域技术人员可以根据寡肽的稳定性、溶解性
等特性,结合药剂学一般认识和工具书进行设计和选择。
20.本技术还提供了上述寡肽的fmoc固制备方法,包括:
21.(1)使用分子筛浸泡n,n-二甲基甲酰胺,甲醇除杂;
22.(2)n,n-二甲基甲酰胺溶胀活化wang树脂;
23.(3)接第一个氨基酸;
24.(4)fmoc保护基脱除;
25.(5)接第二个氨基酸并脱除fmoc保护基;
26.(6)重复步骤(5)多次,直到合成到最后一个氨基酸并脱除fmoc保护基;
27.(7)树脂的脱落及纯品分离检测;所述检测通过液相和/或质谱方法进行。
28.进一步地,所述步骤(3)为:室温下,通过抽滤去掉n,n-二甲基甲酰胺,加入1mmol 5倍摩尔过量的c端第一个氨基酸,5倍摩尔过量的dmap,5倍摩尔过量的n,n-二异丙基碳二亚胺,n,n-二甲基甲酰胺做溶剂室温反应3h;反应完毕用n,n-二甲基甲酰胺洗4~6次,每次5-6ml。再加入体积比为1:1的吡啶和乙酸酐,反应30min。反应完毕用n,n-二甲基甲酰胺洗4~6次,每次5-6ml;
29.进一步地,所述步骤(4)为:抽滤去掉n,n-二甲基甲酰胺,将10ml 20%的哌啶n,n-二甲基甲酰胺溶液加入到树脂中,n2搅拌10min后滤出溶液,再加入10ml 20%的哌啶n,n-二甲基甲酰胺溶液,n2吹动搅拌5min再滤去溶液,反复重复此操作两次后,用n,n-二甲基甲酰胺洗4次,甲醇洗2次,每次5-6ml;
30.进一步地,所述步骤(5)为:称取3倍摩尔过量的c端第二个氨基酸,3倍摩尔过量的hbtu和3倍摩尔过量的1-羟基苯并三氮唑于反应管中,加入适量n,n-二甲基甲酰溶液使其完全溶解后,再加入10倍摩尔过量的n,n-二异丙基乙胺,室温反应40min,用n,n-二甲基甲酰洗4~6次,每次5-6ml;取少量树脂用茚三酮检测试剂检测,显无色,然后加入10ml 20%的哌啶n,n-二甲基甲酰溶液脱fmoc,进行两次,分别为10min、5min,之后用n,n-二甲基甲酰洗4次,甲醇洗2次,每次5-6ml。
31.进一步地,所述步骤(7)包括:以含95%三氟乙酸、2%三异丙基硅烷、2%乙二硫醇、1%h2o的三氟乙酸切割液切割2h,抽滤反应液,得寡肽的三氟乙酸溶液,将裂解液用氮气吹干,再用乙醚沉淀、离心,然后用乙醚洗3~5次,得白色固体,用纯水溶解后,经hplc脱盐提纯,冻干后析出晶体;
32.取样品在超声溶解后,置于分析型高效液相色谱仪中检测;hplc分析参数为:流动相a:100%乙腈加0.1%三氟乙酸;流动相b:100%水加0.1%三氟乙酸;流速:1ml/min,检测波长:220nm;和/或使用质谱检测,质谱参数为离子源为电喷雾离子化源,雾化气流速:1.5l/min,cdl:-20.0v,cdl温度:250℃,加热块温度:200℃,离子源电压:+4.5kv,检测器电压:1.5kv,流动相流速:0.2ml/min,流动相比例:50%h2o/50%acn。
33.所述方法中使用茚三酮检测fmoc保护基脱除效果。
34.本技术中的液相和质谱检测方法可以使用本领域市售的仪器和耗材,适合的参数和试剂本领域技术人员可以根据该领域的一般认识和适当的初步实验确定。
附图说明
35.图1为寡肽ywtrph(a)和ywtarp(b)的高效液相色谱结果图;
36.图2为寡肽ywtrph(a)和ywtarp(b)的质谱结果图;
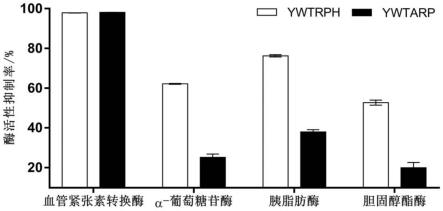
37.图3为两种寡肽的酶活性抑制率;
38.图4为寡肽ywtrph(a)和ywtarp(b)的血管紧张素转化酶活性抑制机理;
39.图5为寡肽ywtrph(a)和ywtarp(b)的α-葡萄糖苷酶活性抑制机理;
40.图6为寡肽ywtrph(a)和ywtarp(b)的胰脂肪酶活性抑制机理;
41.图7为寡肽ywtrph(a)和ywtarp(b)的胆固醇酯酶活性抑制机理。
具体实施方式
42.实施例1小米蛋白的提取
43.将小米粉以1:5(w/v)的比例分散在正己烷中,37℃水浴震荡4h并静置1h。明显分层后,倒出上层正己烷,收集下层沉淀物,并在通风橱中干燥12h以完全除去正己烷残留。风干后的小米脱脂粉过60目筛备用。
44.将脱脂小米粉按1:7(w/v)的比例分散在70%乙醇中,37℃水浴震荡4h,随后在8000rpm下离心15min并收集上清液。用透析袋对上清液透析36h,期间更换蒸馏水4-5次。透析结束后,将透析液在7000rpm下离心5min,收集沉淀进行冻干,即得小米蛋白。根据凯氏定氮法测得小米蛋白的蛋白质含量为90.68%。
45.实施例2胃蛋白酶-胰酶消化体系制备蛋白水解物
46.将小米蛋白按照5%(w/v)的比例在蒸馏水中混合均匀,使用1mol/l hcl调节蛋白溶液ph值到2.0。然后加入4%胃蛋白酶(w/w,250u/mg),混匀后置于摇床中振荡酶解,摇床转速为300rpm,酶解时间2h,酶解温度37℃。胃蛋白酶酶解结束后,先使用0.9mol/lnahco3将溶液ph值调节到5.3,再用1mol/l naoh将ph值维持在7.5,最后加入4%胰酶(w/w,8
×
usp),并在37℃下酶解2h。胰酶酶解结束后,酶解液沸水浴10min,灭活残留的酶。酶解液经室温冷却后,在4℃,7000
×
g下离心20min,收集上清液即得小米蛋白水解物。
47.实施例3蛋白水解物的分离纯化及肽序列鉴定
48.超滤制备《3kda级分
49.12ml小米蛋白水解物溶液转移至3kda离心超滤管,4℃,5000
×
g离心30min后即得分子量<3kda级分,冷冻干燥并在-20℃保存。
50.肽序列鉴定
51.《3kda级分样品用c18除盐柱除盐后,经由配备分析柱acclaim pepmap c18,75μm
×
25cm和在线纳喷离子源的lc-ms/ms分析。进样量:3μl,柱流量:300nl/min,柱温:40℃,电喷雾电压:2kv。流动相a相:0.1%甲酸水溶液,b相:含0.1%甲酸的80%的acn溶液。梯度从4%的b相起始,平衡1min,在53min 40sec以非线性梯度升高到50%,40s内升高到95%,维持5min 40sec。
52.质谱仪在数据依赖采集模式下运行,自动在ms和ms/ms采集间切换。质谱参数:(1)ms:扫描范围(m/z):350-1550,agc target:8e5,分辨率:120000,最大注入时间:100ms;(2)hcd-ms/ms:分辨率:30000,agc target:1e5,动态排除时间:30s,最大注入时间:54ms。串联质谱图经过peaks studio version 10.6分析。peaks db对uniprot-setaria_italica(version202204,35905entries)数据库搜库,肽段卡值为:-10lgp≥20;在数据库中未检索到的肽段,通过设置alc(%)≥80得出,部分典型结果见表1。
53.实施例4基于生物信息学的生物活性肽筛选
54.作为功能成分用于和代谢综合征有关的食品、保健品以及药品的生物活性肽,其无毒、无过敏性和高潜在生物活性是筛选的基本前提。研究发现2-6个氨基酸组成,分子量在1000da以下的活性肽可以不被胃肠道消化,而保证活性肽抵抗胃肠消化是肽发挥体内生物学活性的重要前提。故基于生物信息学技术对《3kda级分中的肽段,依据分子量小(《1000da)、无毒、无过敏性、高潜在生物活性和胃肠道不消化为标准,筛选出符合开发要求的生物活性肽。
55.采用toxinprep(https://webs.iiitd.edu.in/raghava/toxinpred/index.html)平台,基于svm(swiss-port)算法,对肽进行毒性预测。利用allertop v.2.0(http://www.ddg-pharmfac.net/allertop/)对肽进行过敏性预测。通过peptideranker在线平台(http://distilldeep.ucd.ie/peptideranker/)分析肽的潜在生物学活性,其中阈值大于0.5则被认为具有生物活性;进一步利用ahtpin(http://crdd.osdd.net/raghava/ahtpin/index.php)平台对肽进行抗高血压活性预测。采用peptidecutter(https://web.expasy.org/peptide_cutter/)对肽基于胃蛋白酶和胰蛋白酶进行胃肠道消化性预测。依据分子量小(《1000da)、无毒、无过敏性、高生物活性(》0.5)和抗高血压活性、胃肠道不消化为标准,首次从小米蛋白中筛选得到未经报道的生物活性肽ywtrph和ywtarp(见表1)。
56.进一步运用计算机软件对ywtrph和ywtarp的物理特性进行预测,其中总平均亲水性通过expasy(https://web.expasy.org/protparam/),等电点通过pepdraw(http://www.tulane.edu/~biochem/ww/pepdraw/)评估。如表1所示,总平均亲水性可以用来表征蛋白质的亲疏水性,其中负值越大表明亲水性越强,结果表明ywtrph和ywtarp具有较好的亲水性。ywtrph和ywtarp的等电点大于7,表明它们均呈碱性。
57.表1基于生物信息学的小米肽性质预测
58.[0059][0060]
实施例5代谢综合征作用靶点的筛选
[0061]
以筛选出的生物活性肽为配体,常见的代谢综合征作用靶点(血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶)为受体,通过分子对接实现生物活性肽的代谢综合征作用靶点筛选。
[0062]
将上述筛选的寡肽ywtrph和ywtarp进行血管紧张素转化酶分子对接试验,以明确作用靶点。从rcsb蛋白数据库(http://www.rcsb.org/)获取血管紧张素转化酶(pdb编号:1o8a)的晶体结构,采用dock 6.9将ywtrph和ywtarp与血管紧张素转化酶进行半柔性对接,基于grid打分函数进行能量评价。在分子对接前保留zn
2+
和cl-,去除水分子和其他配体。分子对接以血管紧张素转化酶的s1活性口袋(ala354、glu384和tyr523)为中心,即坐标为x:44.831,y:34.109,z:46.363。对接打分是配体与大分子结合的近似势能,较低的得分值表明目的大分子与配体之间具有强亲和力。范德华力贡献指的是π-π堆积、疏水作用等非极性作用。静电力贡献则表现为盐桥、氢键等极性作用。对接打分是范德华力贡献和静电力贡献的总和。表2显示了寡肽ywtrph与血管紧张素转化酶的对接打分是-130.1984kcal/mol,范德华力贡献是-123.4071kcal/mol,静电力贡献是-6.7913kcal/mol;ywtarp与血管紧张素转化酶的对接打分是-121.5255kcal/mol,范德华力贡献是-112.7777kcal/mol,静电力贡献是-8.7478kcal/mol。通常小于-50kcal/mol的对接打分值表示较好的结合力。两个寡肽与血管紧张素转化酶的对接打分均远远低于-50kcal/mol,故血管紧张素转化酶是其潜在的代谢综合征作用靶点。
[0063]
将上述筛选的寡肽ywtrph和ywtarp进行α-葡萄糖苷酶分子对接试验,以明确作用靶点。从rcsb蛋白数据库(http://www.rcsb.org/)获取α-葡萄糖苷酶(pdb编号:3a4a)的晶
体结构,采用dock 6.9将ywtrph和ywtarp与α-葡萄糖苷酶进行半柔性对接,基于grid打分函数进行能量评价。在分子对接前去除多余的水分子,同时分子对接以α-葡萄糖苷酶活性位点(asp215、glu277和asp352)为中心,即坐标为x:21.016,y:-5.15,z:21.61。表2显示了寡肽ywtrph与α-葡萄糖苷酶的对接打分是-121.198380kcal/mol,范德华力贡献是-106.085022kcal/mol,静电力贡献是-15.113354kcal/mol;ywtarp与α-葡萄糖苷酶的对接打分是-114.761948kcal/mol,范德华力贡献是-104.379944kcal/mol,静电力贡献是-10.382000kcal/mol。通常小于-50kcal/mol的对接打分值表示较好的结合力。两个寡肽与α-葡萄糖苷酶的对接打分均远远低于-50kcal/mol,故α-葡萄糖苷酶是其潜在的代谢综合征作用靶点。
[0064]
将上述筛选的寡肽ywtrph和ywtarp进行胰脂肪酶分子对接试验,以明确作用靶点。从rcsb蛋白数据库(http://www.rcsb.org/)获取胰脂肪酶(pdb编号:1eth)的晶体结构,采用dock 6.9将ywtrph和ywtarp与胰脂肪酶进行半柔性对接,基于grid打分函数进行能量评价。在分子对接前保留胰脂肪酶分子的链a(包含448个氨基酸残基)用于对接分析,同时去除共结晶分子和其他多肽链。分子对接以胰脂肪酶活性位点(ser153、asp177和his264)为中心,即坐标为x:64.153,y:39.278,z:127.241。表2显示了寡肽ywtrph与胰脂肪酶的对接打分是-102.9663kcal/mol,范德华力贡献是-104.3507kcal/mol,静电力贡献是1.3844kcal/mol;ywtarp与胰脂肪酶的对接打分是-108.1043kcal/mol,范德华力贡献是-102.4495kcal/mol,静电力贡献是-5.6548kcal/mol。通常小于-50kcal/mol的对接打分值表示较好的结合力。两个寡肽与胰脂肪酶的对接打分均远远低于-50kcal/mol,故胰脂肪酶是其潜在的代谢综合征作用靶点。
[0065]
将上述筛选的寡肽ywtrph和ywtarp进行胆固醇酯酶分子对接试验,以明确作用靶点。从rcsb蛋白数据库(http://www.rcsb.org/)获取胆固醇酯酶(pdb编号:1f6w)的晶体结构,采用dock 6.9将ywtrph和ywtarp与胆固醇酯酶进行半柔性对接,基于grid打分函数进行能量评价。在分子对接前去除多余的水分子,同时分子对接以胆固醇酯酶活性位点(ser194、his435和asp320)为中心,即坐标为x:8.039,y:-1.404,z:21.544。表2显示了寡肽ywtrph与胆固醇酯酶的对接打分是-114.5726kcal/mol,范德华力贡献是-103.0823kcal/mol,静电力贡献是-11.4903kcal/mol;ywtarp与胆固醇酯酶的对接打分是-111.2468kcal/mol,范德华力贡献是-100.7896kcal/mol,静电力贡献是-10.4572kcal/mol。通常小于-50kcal/mol的对接打分值表示较好的结合力。两个寡肽与胆固醇酯酶的对接打分均远远低于-50kcal/mol,故胆固醇酯酶是其潜在的代谢综合征作用靶点。
[0066]
表2两种六肽的分子对接结果
[0067][0068]
实施例6生物活性肽的人工合成
[0069]
采用fmoc固相合成法制备寡肽ywtrph和ywtarp,具体如下:
[0070]
①
溶剂处理
[0071]
n,n-二甲基甲酰胺(dmf)、甲醇在使用前用g3孔的分子筛浸泡过夜除杂质和水。
[0072]
②
树脂充分溶胀
[0073]
称取2.0g空白wang树脂于洁净干燥的反应管中,加入15ml dmf,室温活化30min。
[0074]
③
接第一个氨基酸
[0075]
室温下,通过沙芯抽滤掉上步溶剂,加入1mmol 5倍摩尔过量的c端第一个氨基酸,5倍摩尔过量的dmap,5倍摩尔过量的n,n-二异丙基碳二亚胺,dmf做溶剂室温反应3h。反应完毕用dmf洗4~6次,每次5-6ml。再加入体积比为1:1的吡啶和乙酸酐,反应30min。反应完毕用dmf洗4~6次,每次5-6ml。
[0076]
④
fmoc保护基的离去
[0077]
抽滤去掉
③
的溶剂,将10ml 20%的哌啶dmf溶液加入到树脂中,n2搅拌10min后滤出溶液,再加入10ml 20%的哌啶dmf溶液,n2吹动搅拌5min再滤去溶液,反复重复此操作两次后,用dmf洗4次,甲醇洗2次,每次5-6ml。
[0078]
⑤
茚三酮检测脱除效果
[0079]
取出少量树脂,用甲醇洗三次,加入茚三酮、kcn、苯酚溶液各一滴,105℃-110℃加热5min,变深蓝色为阳性反应,说明脱除完全,即可进行下步反应;若呈无色,说明保护基没有脱除完全,则需要重复以上脱保护操作。
[0080]
⑥
接第二个氨基酸及fmoc保护基脱除
[0081]
称取3倍摩尔过量的c端第二个氨基酸,3倍摩尔过量的hbtu和3倍摩尔过量的1-羟
基苯并三氮唑于反应管中,加入适量dmf溶液使其完全溶解后,再加入10倍摩尔过量的n,n-二异丙基乙胺,室温反应40min,用dmf洗4~6次,每次5-6ml。取少量树脂用茚三酮检测试剂检测,显无色,然后加入10ml 20%的哌啶dmf溶液脱fmoc,进行两次,分别为10min、5min,之后用dmf洗4次,甲醇洗2次,每次5-6ml。取出少量树脂用茚三酮检测试剂检测,检测为蓝色,即可进行下一步反应。
[0082]
⑦
以此类推,重复
⑥
的步骤,直到合成到n端最后一个氨基酸,去掉fmoc保护基,然后抽干。
[0083]
⑧
树脂的脱落及纯品分离检测
[0084]
最后用三氟乙酸切割液(95%三氟乙酸:2%三异丙基硅烷:2%乙二硫醇:1%h2o)切割2h,抽滤反应液,得寡肽的三氟乙酸溶液,将裂解液用氮气吹干,再用乙醚沉淀、离心,然后用乙醚洗3~5次,得白色固体,用纯水溶解后,经hplc脱盐提纯,冻干后析出晶体。
[0085]
⑨
肽的质量检测
[0086]
取少量样品在超声溶解后,置于分析型高效液相色谱仪中检测。hplc参数为:色谱柱:4.6
×
250mm,sinochrom ods-bp 5μm;流动相a:100%乙腈加0.1%三氟乙酸;流动相b:100%水加0.1%三氟乙酸;流速:1ml/min;进样量:5μl,检测波长:220nm。
[0087]
对于ywtrph而言,梯度程序如下表:
[0088][0089][0090]
对于ywtarp而言,梯度程序如下表:
[0091][0092]
agilent-6125b质谱参数:离子源为电喷雾离子化源(esi源),雾化气流速:1.5l/min,cdl:-20.0v,cdl温度:250℃,加热块温度:200℃,离子源电压:+4.5kv,检测器电压:1.5kv,流动相流速:0.2ml/min,流动相比例:50%h2o/50%acn。
[0093]
最后通过高效液相色谱和质谱分析,确定寡肽ywtrph和ywtarp的纯度均大于95%,具体的色谱和质谱结果分别见图1和图2。
[0094]
实施例7作用靶点的抑制效果评价
[0095]
血管紧张素转化酶活性抑制实验
[0096]
使用100mm硼酸钠缓冲液(ph 8.3,300mm氯化钠)配制5mm马尿酰组氨酰亮氨酸(hhl)溶液和0.1u/ml血管紧张素转化酶溶液。
[0097]
将200μl 1mg/l ywtrph/ywtarp溶液(等量蒸馏水作为对照组)与500μl hhl溶液在37℃下孵育5min。然后加入200μl血管紧张素转化酶溶液涡旋混匀,37℃下孵育60min。反应结束后,加入100μl 0.2mm hcl溶液终止反应。反应液经孔径为0.22μm聚四氟乙烯过滤膜过滤后,使用hplc测定产物马尿酸的峰面积。每个样品做3个平行。
[0098]
hplc参数:色谱柱:inertsil ods-sp 5um 4.6
×
150mm,柱温:30℃,进样量:10μl。流动相a:100%水;流动相b:75%水/25%乙腈,流速:1ml/min,检测波长:228nm。血管紧张素转化酶活性抑制率的计算公式如下:
[0099][0100]
式(1)中a
blank
为不添加六肽产生的马尿酸的峰面积,a
sample
为添加六肽产生的马尿酸的峰面积。
[0101]
α-葡萄糖苷酶活性抑制实验
[0102]
使用磷酸钠缓冲液(0.1mol/l,ph 6.9)分别配制1u/mlα-葡萄糖苷酶溶液和5mm对硝基苯基-α-d-吡喃葡萄糖苷(pnpg)溶液。
[0103]
25μl 10mg/ml ywtrph/ywtarp溶液(等量蒸馏水作为对照组)和50μlα-葡萄糖苷酶溶液在37℃孵育10min后,添加25μl pnpg溶液,并在37℃孵育5min,最后酶标仪在405nm处读取吸光度。α-葡萄糖苷酶活性抑制率的计算公式如下:
[0104][0105]
式(2)中:a:对照吸光度;b:对照空白吸光度;c:样品吸光度;d:样品空白吸光度。
[0106]
胰脂肪酶活性抑制实验
[0107]
使用ph 7.3的磷酸缓冲液配制2.5mg/ml胰脂肪酶溶液,然后以5500rpm离心5min取上清液。使用ph 7.3的磷酸缓冲液稀释对硝基苯基丁酸酯至10mm。
[0108]
将50μl 5mg/ml ywtrph/ywtarp溶液(等量蒸馏水作为对照组)、40μl胰脂肪酶溶液和20μl对硝基苯丁酸酯溶液在37℃孵育30min后,酶标仪在405nm处记录吸光度。胰脂肪酶活性抑制率的计算公式如下:
[0109][0110]
式(3)中:a:对照吸光度;b:对照空白吸光度;c:样品吸光度;d:样品空白吸光度。
[0111]
胆固醇酯酶活性抑制实验
[0112]
使用ph 7.0的磷酸缓冲液(含100mm nacl,5.16mm牛磺胆酸钠)分别配制25μg/ml胆固醇酯酶溶液和10mm对硝基苯基丁酸酯溶液。
[0113]
将50μl 8mg/ml ywtrph/ywtarp溶液(等量蒸馏水作为对照组)、50μl胆固醇酯酶溶液和50μl对硝基苯丁酸酯溶液在25℃孵育5min后,酶标仪在405nm处记录吸光度。胆固醇酯酶活性抑制率的计算公式如下:
[0114]
[0115]
式(4)中:a:对照吸光度;b:对照空白吸光度;c:样品吸光度;d:样品空白吸光度。
[0116]
体外试验结果显示,寡肽ywtrph和ywtarp的血管紧张素转化酶活性抑制率分别是97.84%和98.11%,α-葡萄糖苷酶活性抑制率分别是62.19%和25.18%,胰脂肪酶活性抑制率分别是76.20%和37.96%,胆固醇酯酶活性抑制率分别是52.64%和19.94%(见图3)。这表明两个寡肽对血管紧张素转化酶、α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶有一定的抑制活性,其中两者均对血管紧张素转化酶具有极好的抑制效果,这可能与“ywt-rp”结构密切有关。另外,相较于ywtarp,ywtrph具有更加显著的α-葡萄糖苷酶、胰脂肪酶和胆固醇酯酶抑制活性。总之,这两个寡肽可有效预防、缓解和治疗代谢综合征,并有望作为功能成分广泛应用于和代谢综合征有关的食品、保健品以及药品中,具有良好的市场前景。
[0117]
实施例8作用靶点的抑制机理分析
[0118]
通过分子对接技术明确生物活性肽与靶点酶之间的作用位点和相互作用力,进一步阐明抑制作用机理。具体实验参数设置参照实施例5。
[0119]
分子对接模拟图4a展示了寡肽ywtrph与血管紧张素转化酶氨基酸残基的结合主要依赖于盐桥、疏水相互作用和氢键。具体地说,ywtrph与氨基酸残基(lys368、glu123)形成盐桥,与氨基酸残基(phe391、val518)形成疏水相互作用,与氨基酸残基(ser355、tyr360、ser219)形成氢键。分子对接模拟图4b展示了寡肽ywtarp与血管紧张素转化酶氨基酸残基的结合主要依赖于盐桥、疏水相互作用、π-阳离子相互作用和氢键。具体地说,ywtarp与氨基酸残基(glu123、glu403)形成盐桥,与氨基酸残基(glu403、trp357)形成疏水相互作用,与氨基酸残基(his387)形成π-阳离子相互作用,与氨基酸残基(his353、nxa702、tyr523、trp220)形成氢键。
[0120]
分子对接模拟图5a展示了寡肽ywtrph与α-葡萄糖苷酶氨基酸残基的结合主要依赖于盐桥、疏水相互作用、π-π堆积、π-阳离子相互作用和氢键。具体地说,ywtrph与氨基酸残基(glu411、asp242)形成盐桥,与氨基酸残基(pro312、arg315、asp352、tyr72、phe178、val216)形成疏水相互作用,与氨基酸残基(phe303)形成π-π堆积,与氨基酸残基(tyr158)形成π-阳离子相互作用,与氨基酸残基(pro312、thr306、ser240、gln279、glu411、his112)形成氢键。分子对接模拟图5b展示了寡肽ywtarp与α-葡萄糖苷酶氨基酸残基的结合主要依赖于盐桥、疏水相互作用、π-π堆积、π-阳离子相互作用和氢键。具体地说,ywtarp与氨基酸残基(asp242、asp352、glu411)形成盐桥,与氨基酸残基(arg315、asp352、tyr72、phe178、tyr158、val216)形成疏水相互作用,与氨基酸残基(phe303)形成π-π堆积,与氨基酸残基(his280)形成π-阳离子相互作用,与氨基酸残基(asp307、thr306、gln279、his112)形成氢键。
[0121]
分子对接模拟图6a展示了寡肽ywtrph与胰脂肪酶氨基酸残基的结合主要依赖于疏水相互作用、π-阳离子相互作用和氢键。具体地说,ywtrph与氨基酸残基(leu265、val260、phe78、tyr115、ile210)形成疏水相互作用,与氨基酸残基(his264)形成π-阳离子相互作用,与氨基酸残基(trp86、his152)形成氢键。分子对接模拟图6b展示了六肽ywtarp与胰脂肪酶氨基酸残基的结合主要依赖于疏水相互作用、π-π堆积和氢键。具体地说,ywtarp与氨基酸残基(pro181、phe78、ile79、leu265、val260)形成疏水相互作用,与氨基酸残基(phe216、his264)形成π-π堆积,与氨基酸残基(ser153)形成氢键。
[0122]
分子对接模拟图7a展示了寡肽ywtrph与胆固醇酯酶氨基酸残基的结合主要依赖
于盐桥、疏水相互作用和氢键。具体地说,ywtrph与氨基酸残基(lys445、asp437、asp434)形成盐桥,与氨基酸残基(ile439、ala117、phe324、ala108、val285)形成疏水相互作用,与氨基酸残基(his435、glu193、asn121)形成氢键。分子对接模拟图7b展示了寡肽ywtarp与胆固醇酯酶氨基酸残基的结合主要依赖于盐桥、疏水相互作用和氢键。具体地说,ywtarp与氨基酸残基(asp434、asp437)形成盐桥,与氨基酸残基(phe324、val285、ala108、trp227)形成疏水相互作用,与氨基酸残基(glu193、his435)形成氢键。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1