一种生物反应器泡沫控制方法与流程
1.本发明生物反应器泡沫技术领域,具体为一种生物反应器泡沫控制方法。
背景技术:
2.在重组蛋白工艺开发和放大过程中,往往在20l生物反应器中对开发的工艺进行确认和锁定,并用于中试200-500l的生产中。在20l生物反应器中培养时,部分项目会出现氧通气量较高(1l/min以上),且出现大量泡沫,进而引起培养后期发酵液逃液至尾气瓶,造成发酵液的损失、细胞数的减少并堵塞尾气瓶,容易引起污染。传统泡沫控制方法为在培养前期使用大泡通气(鼓泡器孔径1mm),培养后期切换为15μm微泡通气。然而培养后期的细胞密度往往较高,通常会超过3
×
107cells/ml,经常会引起微泡通气孔的堵塞,从而无法使用微泡通气,只能继续使用大泡通气。
3.培养后期使用大泡通气往往会造成泡沫无法有效控制,逃液严重。虽然可以间歇性添加消泡剂进行气泡消除,但在夜间无人值守的情况下,极易引起泡沫无法控制,逃液也无法有效控制。
技术实现要素:
4.本发明的目的在于提供一种生物反应器泡沫控制方法,以解决上述背景技术中提出的从而无法使用微泡通气,只能继续使用大泡通气,培养后期使用大泡通气往往会造成泡沫无法有效控制,逃液严重。虽然可以间歇性添加消泡剂进行气泡消除,但在夜间无人值守的情况下,极易引起泡沫无法控制,逃液也无法有效控制,
5.为了解决传统泡沫控制带来的问题,本专利通过使用100μm微泡头和消泡剂连续补加策略,使得泡沫和逃液得到有效控制,使得发酵顺利进行。
6.一种生物反应器泡沫控制方法,通过培养复苏重组cho细胞作为实验用的种子细胞进行培养,然后在使用100μm微泡头和消泡剂连续补加方式使得泡沫和逃液得到有效控制;
7.泡沫控制方法步骤如下:
8.第一步:以复苏重组cho细胞作为实验用的种子细胞进行培养创造培养环境;
9.第二步:在培养过程中,目视泡沫高度超过20cm时,逐滴添加消泡剂(3%有效浓度)进行消泡至液面无气泡明显覆盖;
10.第三步:培养至中后期,泡沫较多且传统泡沫控制方法无法有效控制时。增加连续泵装置,定时向反应器中泵入消泡剂。
11.其中复苏重组cho细胞作为实验用的种子细胞进行培养过程如下:
12.(1)从细胞库中复苏重组cho细胞,以(0.2-0.3)
×
106cells/ml活细胞密度接种于摇瓶中,培养基为cd cho,置于37℃、7% co2的培养箱中培养,转速为110rpm,作为实验用的种子细胞;
13.(2)取对数生长期的cho细胞,以约0.8
×
106cells/ml的活细胞密度接种至20l反
应器(applikon),培养体积为12l,每24h取样,计数,培养液用于营养物、代谢副产物检测;
14.(3)基础培养基和补料培养基分别为dynamis和cell boost7a/7b,第3天开始每天补料2.50% cell boost 7a+0.25% cell boost7b,初始培养温度为37.0℃,第5天降温至34.0℃培养;
15.(4)培养时反应器操作条件:do为40%,温度为37℃,搅拌转速为180rpm,底部空气初始设定值为0.20lpm,ph为7.0(dead band设为
±
0.2);
16.(5)ph的控制采用深层通入co2或者补入1mol/l碳酸钠溶液的方式;
17.(6)添加葡萄糖控制隔天残余葡萄糖浓度在2-12g/l。
18.与现有技术相比,本发明的有益效果是:
19.本专利通过使用100μm微泡头和消泡剂连续补加策略,使得泡沫和逃液得到有效控制,使得发酵顺利进行。
附图说明
20.图1传统方法控制泡沫时的活细胞密度(vcd)和活率
21.图2传统方法时泡沫及逃液
22.图3专利方法控制泡沫时的活细胞密度(vcd)和活率
23.图4专利方法时泡沫及逃液情况
具体实施方式
24.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
25.请参阅图1-4,本发明提供一种技术方案:一种生物反应器泡沫控制方法
26.蛋白表达量检测;蛋白表达量使用protein a-hplc方法检测。色谱仪为agilent 1260,色谱柱为poros a20色谱柱(20μm,2.1mm
×
30mm),色谱柱柱温30.0℃,流速为2.0ml/min,检测器波长设置为280nm。
27.蛋白质量检测;收获液经protein a亲和层析纯化后,采用凝胶分子排阻色谱法hplc进行sec检测,采用毛细管凝胶电泳法利用sciex pa-800仪器进行ce-sds检测,采用hilic-uhplc进行n-糖谱(n-glycan)检测分析。
28.实例1,使用传统方法进行泡沫控制:
29.使用传统方法进行泡沫控制的活细胞密度和细胞活率如图1所示。如图可知,培养前期活细胞密度随着培养天数的增加,呈稳定上升趋势并在第10天达到峰值。之后由于泡沫增长速度较快,传统泡沫控制方法无法有效维持夜间对泡沫的控制,导致反应器泡沫溢出,料液开始逃逸,如图2所示。随后活细胞密度及活率呈快速下降趋势,第10-12天逃液量在2l左右。因无法有效控制泡沫解决料液逃逸问题,最终在第12天结束培养,最终蛋白表达量为3.6g/l。
30.使用传统方法进行泡沫控制如图2所示,传统方法进行泡沫控制的质量如表1所示。由表可知,在传统方法下料液逃逸对产物质量没有明显的影响,各质量评估项均在可接
受水平。
31.表1传统方法控制泡沫时的质量总结
[0032][0033]
实例2,使用本专利方法进行泡沫控制:
[0034]
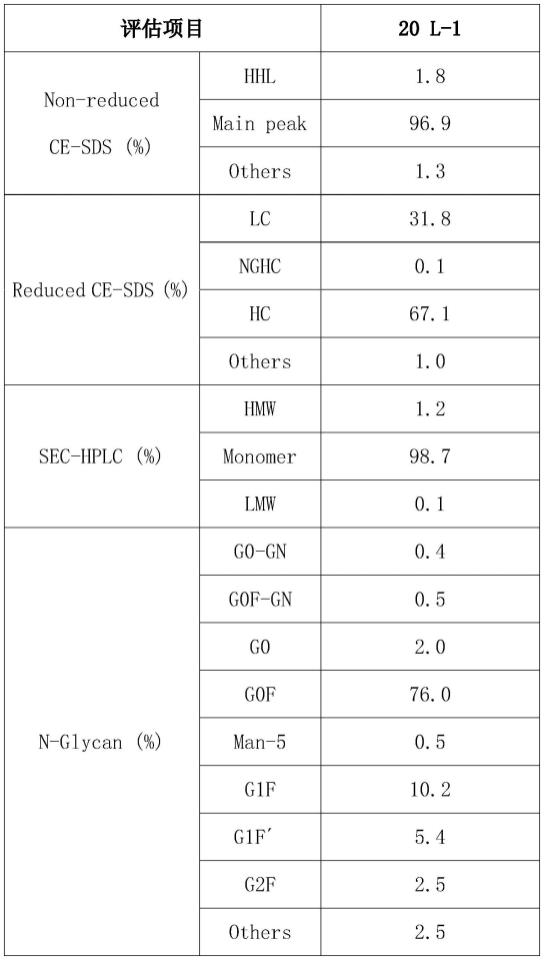
使用本专利方法进行泡沫控制的活细胞密度和细胞活率如图3所示。如图可知,培养前期活细胞密度随着培养天数的增加,呈稳定上升趋势并在第10天达到峰值后续缓慢下降。培养至第7天时在传统控制泡沫的方法上增加连续泵装置,间隙添加消泡剂(流量:18.75ml/min、液量:0.625ml、计时:30min),第9天料液高度增加,再次调整连续泵参数(流量:4.14ml/min、液量:0.69ml、计时:20min),第12天培养后期调整参数(流量:3.00ml/min、液量:0.5ml、计时:10min),第13天调整参数(流量:3.00ml/min、液量:0.5ml、计时:10min),第14天调整参数(流量:4.14ml/min、液量:0.69ml、计时:20min)。本专利方法进行泡沫控制效果明显如图4所示。最终在第14天收获料液其表达在6.0g/l。
[0035]
使用传统方法进行泡沫控制如图4所示,本专利方法进行泡沫控制的质量如表2所示。由表可知,使用本专利方法进行泡沫控制的产物质量对比传统方法的产物质量没有显
著变化,说明该专利方法在不影响产物质量的前提下实现了对泡沫和料液逃逸现象的有效控制。
[0036]
表2专利方法控制泡沫时的质量总结
[0037]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1