胶束催化
胶束催化
1.本发明涉及一种进行合成有机反应的方法,其中反应物中的一种包含核苷酸序列(例如dna序列)。该反应在表面活性剂存在的情况下进行。该方法在dna编码库(del)的制备方面是特别有用的。
2.背景
3.dna编码库(del)是通过亲和力选择发现化学配体的新兴技术。它们对于寻找药物发现和化学生物学中的探针分子的起点特别有用。通常,筛选库由dna缀合的单体构建,该dna缀合的单体通常称为“头件(headpiece)”,这使用多轮拆分池并行合成,结合在每个步骤编码dna序列的退火而精心制作,该编码dna序列对每个结构单元是独特的,使得库中的每一种最终化合物与独特的dna序列缀合,该独特的dna序列用作化学结构的条形码。通过进行多个合成循环,在一些情况下每个循环有数百个并行步骤,可以制备潜在的数百万至数十亿种化合物的库,这超出了传统化学合成的能力。这些库可以通过以下针对蛋白靶标进行筛选:亲和力选择,随后是pcr扩增和dna测序以鉴定结合物,该结合物然后被“脱dna(off-dna)”单独地合成以提供化学命中。
4.目前该方法的显著限制是在dna序列存在的情况下可以进行的化学反应的范围和效率。这意味着试剂必须与溶解dna所需的水性条件相容,并且必须不采用与dna的任何官能团反应的试剂。因此,酸、强碱、氧化剂和反应性烃基化-酰化剂被排除在外。大多数报道的用于dna上(on-dna)合成的方法虽然已被证明是有效的,但通常仅在一定范围的底物上以中等效率进行。在大多数情况下,各个转化的反应效率,虽然被称为收率,但实际上被报道为从起始材料到产物的转化百分比,忽略了副产物的形成。即使在这里,转化水平通常也是中等的。
5.ep3360962描述了合成del的方法。del在包含定制的改性表面活性剂的胶束反应器中被合成。dna标签经由聚乙二醇接头与反应物中的一种缀合。
6.公开内容的简述
7.在本发明的第一方面中,提供了一种进行合成有机反应的方法,所述方法包括:
8.使第一反应物与第二反应物在包含活化剂、非离子型表面活性剂、水和有机溶剂的反应介质中反应,以产生反应产物x-y-za;
9.其中所述第一反应物是式(i)的有机分子:
10.x-y-z(i)
11.其中x是核苷酸序列;
12.y是接头基团,该接头基团被选择使得x与z之间的连续链中的原子数在15-30的范围内,并且连续链中不多于5个原子不是碳;
13.z是有机部分,该有机部分包含能够在活化剂存在的情况下与所述第二反应物反应的官能团;
14.其中所述第二反应物是能够在活化剂存在的情况下与所述第一反应物的有机部分的官能团反应的分子;并且
15.其中za是z与所述第二反应物之间反应的产物。
16.这些条件可以导致在核苷酸标签不被改变的情况下的完全反应转化(≥95%)。这种方法不需要特殊的定制试剂。表面活性剂、活化剂和反应物全都可以是容易从商业供应商可得的那些。不希望受理论束缚,认为表面活性剂在水中形成胶束,该胶束具有疏水核心。有机组分优先分配到胶束中。第一反应物可以使其本身与胶束外部的核苷酸序列和胶束中心的有机部分z一起定向,使得有机部分z与第二反应物之间的反应发生。
17.在某些优选的实施方案中,活化剂是酰胺偶联剂,并且反应产物包含酰胺。本发明人已经发现,可以使用第一方面的反应形成酰胺。与第一方面的反应条件类似的反应条件(其中使用聚乙二醇接头替代接头基团y)不允许在反应物之间有效地形成酰胺键。然而,本发明人已经发现,当使用非极性接头基团,即在接头中具有最少数目的非碳原子的基团时,可以在反应物之间以高转化率形成酰胺键。
18.在本发明的第二方面中,提供了一种制备dna编码化合物库的方法,包括第一方面的方法。
19.在某些优选的实施方案中,制备dna编码化合物库的方法包括(i)使x
(n-1)-y-z化合物的x
(n-1)
部分与核苷酸结构单元连接以产生x-y-z;(ii)在第一方面的方法中使x-y-z与第二反应物反应以形成x-y-za。
20.表面活性剂
21.表面活性剂是非离子型表面活性剂。非离子型表面活性剂包括疏水部分和亲水部分。疏水部分通常主要包括碳原子和氢原子,例如,可能的是,疏水部分中大于80%(例如,大于90%或大于95%)的原子选自碳和氢。疏水部分还可以包括氧原子。可能的是,疏水部分中存在的任何氧原子不呈羟基基团的形式。疏水部分可以包含从10个至40个碳原子。疏水部分可以包含烃基基团,其可以是直链或支链和/或环状的基团,例如环烃基或苯环。所述环烃基或苯环可以连接以形成多环基团。亲水部分通常包含聚乙二醇基团,例如甲氧基聚乙二醇基团。聚乙二醇基团可以包含8个和30个之间的二醇单元。
22.可能的是,表面活性剂是能够形成胶束的表面活性剂,例如当表面活性剂处于水/有机溶剂混合物中时。合适的表面活性剂的说明性实例包括:聚氧乙基-α-生育酚癸二酸酯(tps)、生育酚甲氧基聚乙二醇琥珀酸酯(tpgs-750-m)、β-谷甾醇甲氧基乙二醇琥珀酸酯(nok)和甲氧基聚乙二醇10-(丙基磺酰基)癸酸酯(mc-1)。
23.表面活性剂可以以高于临界胶束浓度的浓度存在。表面活性剂可以以相对于水的量按重量计从0.5%至10%的量存在。表面活性剂可以以相对于水的量按重量计从1%至5%的量存在。表面活性剂可以以相对于水的量按重量计从2%至4%的量存在。
24.活化剂
25.将根据第一反应物与第二反应物之间的预期反应的性质来选择活化剂。
26.可能的是存在一种活化剂。可能的是存在多种活化剂,例如两种、三种或四种活化剂。
27.可能的是活化剂(或者,在存在多于一种活化剂的情况下,至少一种活化剂)是偶联剂。
28.可能的是活化剂(或者,在存在多于一种活化剂的情况下,至少一种活化剂)是酰胺偶联剂。这样的活化剂可以用于合适的酰胺偶联剂的实例中,合适的酰胺偶联剂包括:n,n
’‑
二环己基碳二亚胺(dcc),1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶
鎓3-氧化物六氟磷酸盐(hatu)、n,n
’‑
二异丙基碳二亚胺(dic),n-(3-二甲基氨基丙基)-n
’‑
乙基碳二亚胺盐酸盐(edc)、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉鎓氯化物(dmtmm)、1-羟基-7-氮杂苯并三唑(hoat)、羟基苯并三唑(hobt))。可能的是酰胺偶联剂选自dic、hatu、hoat和hobt。可能的是酰胺偶联剂选自dic和hoat。
[0029]
可能的是活化剂(或者,在存在多于一种活化剂的情况下,至少一种活化剂)是催化剂。催化剂可以是过渡金属催化剂,例如包括钯、铂、铜、钌或钼的络合物的催化剂体系。过渡金属催化剂可以由预催化剂和配体预形成或原位形成。
[0030]
可能的是活化剂(或者,在存在多于一种活化剂的情况下,至少一种活化剂)是有机碱。
[0031]
在存在偶联剂(例如酰胺偶联剂)的情况下,偶联剂可以以偶联剂∶第一反应物大于10∶1的摩尔比存在。偶联剂可以以偶联剂∶第一反应物大于100∶1的摩尔比存在。偶联剂可以以偶联剂:第一反应物大于500∶1的摩尔比存在。偶联剂可以以偶联剂∶第一反应物小于5000∶1的摩尔比存在。
[0032]
在存在偶联剂的情况下,偶联剂可以以从0.01m至10m的浓度存在。偶联剂可以以从0.1m至1m的浓度存在。偶联剂可以以从0.25m至0.8m的浓度存在。
[0033]
在存在催化剂的情况下,催化剂可以以催化剂∶第一反应物大于1∶100的摩尔比存在。催化剂可以以催化剂∶第一反应物大于1∶10的摩尔比存在。催化剂可以以催化剂∶第一反应物大于1∶1的摩尔比存在。催化剂可以以催化剂∶第一反应物小于1∶1的摩尔比存在。
[0034]
有机溶剂
[0035]
有机溶剂可以是水可混溶的。合适的溶剂的实例包括醚溶剂(例如四氢呋喃、二氧六环、二乙二醇二甲醚(diglyme))、酰胺溶剂(例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基-吡咯烷酮)和其他水溶性溶剂(例如二甲基亚砜、乙腈)。
[0036]
有机溶剂可以是有机碱。因此,有机溶剂可以是叔胺(例如三乙胺、二异丙基乙胺、n-甲基吗啉、1,4-二氮杂双环[2.2.2]辛烷)或者可以包括吡啶(例如吡啶、喹啉、2,6-二甲基吡啶、2,6-二叔丁基-4-甲基哌啶)或咪唑(例如n-甲基咪唑)。有机溶剂可以包括吡啶。有机溶剂可以是被从1个至3个选自c
1-c
4-烃基、卤素、o-c
1-c
3-烃基和氰基的基团取代的吡啶。有机溶剂可以是被从1个至3个c
1-c
4-烃基基团取代的吡啶。有机溶剂可以是2,6-二甲基吡啶。
[0037]
有机溶剂(例如有机碱)在20℃和1个大气压可以是液体。
[0038]
有机溶剂(例如有机碱)可以以从0.05m至10m的浓度存在。有机溶剂(例如有机碱)可以以从0.1m至5m的浓度存在。有机溶剂(例如有机碱)可以以从0.5m至3m的浓度存在。
[0039]
可能的是存在一种溶剂物质。可能的是多种溶剂物质存在于溶剂混合物中,例如两种溶剂。可能的是溶剂混合物包括不是有机碱的溶剂和是有机碱的溶剂(例如叔胺、吡啶或咪唑)。可能的是溶剂混合物包括醚溶剂(例如四氢呋喃、二氧六环、二乙二醇二甲醚)和有机碱(例如叔胺、吡啶或咪唑)。可能的是溶剂混合物包括酰胺溶剂(例如n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n-甲基-吡咯烷酮)和有机碱(例如叔胺、吡啶或咪唑)。可能的是溶剂混合物包括水溶性有机溶剂(例如二甲基亚砜、乙腈)和有机碱(例如叔胺、吡啶或咪唑)。
[0040]
第一反应物
[0041]
可能的是y是被选择使得x与z之间的连续链中的原子数在20-25的范围内的接头
基团。
[0042]
可能的是接头基团y的连续链中不多于4个原子不是碳。可能的是接头基团y的连续链中不多于3个原子不是碳。可能的是接头基团y的连续链中不多于1个原子不是碳。
[0043]
可能的是接头基团y是c
15-c
30
烃基链或由一个或更多个酰胺基团或酯基团连接的多于一个c
2-c
22
烃基链。可能的是接头基团y是由一个或更多个酰胺基团连接的多于一个c
2-c
22
烃基链。可能的是接头基团y是由酰胺基团连接的两个c
2-c
22
烃基链。
[0044]
为了不存在疑义,形成接头基团y的连续链的原子可以被其他基团取代。例如,碳原子可以被h基团、c
1-c
4-烃基基团或c=o基团取代。氮原子可以被c
1-c
4-烃基基团取代。形成接头基团y的连续链的任何一个或更多个原子可以是一个或更多个环体系或多环体系的一部分,例如环烃基基团或芳基基团。然而,可能的是接头基团y的连续链中没有一个原子形成环状基团的一部分。
[0045]
可能的是式(i)的化合物是式(ii)的化合物:
[0046]
x-y
1-y
2-y
3-y
4-z(ii)
[0047]
其中z和x如本说明书中其他地方所定义;
[0048]
其中y1是c
2-c
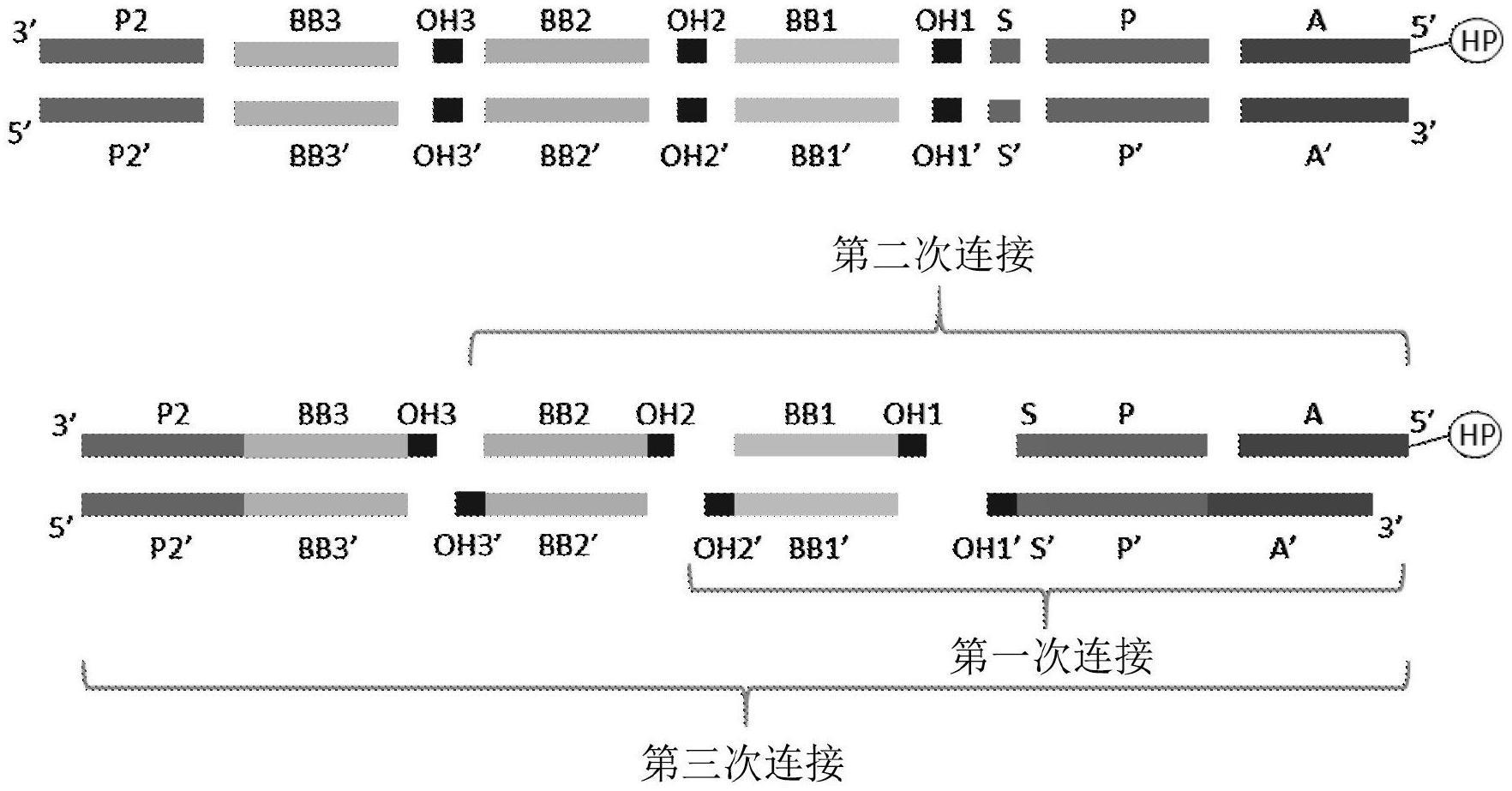
8-烃基链,任选地被从1个至10个c
1-c
4-基团取代;
[0049]
y2选自共价键、-c(o)nr
1-、-nr1c(o)-、-s(o)2nr1、-nr1s(o)
2-、-c(o)o-、-oc(o)-、-o-、-s-和-nr
2-;
[0050]
y3是c
8-c
22-烃基链,任选地被从1个至20个c
1-c
4-基团取代;
[0051]
y4选自共价键、-c(o)nr
1-、-nr1c(o)-、-s(o)2nr1、-nr1s(o)
2-、-c(o)o-、-oc(o)-、-o-、-s-和-nr
2-;
[0052]
r1选自h和c
1-c
4-烃基;并且
[0053]
r2选自h、c
1-c
4-烃基、c(o)c
1-c
4-烃基和s(o)2c
1-c
4-烃基。
[0054]
在该实施方案中,接头基团y是y
1-y
2-y
3-y4。为了不存在疑义,在y2和y4基团是不对称的(例如-nr1c(o)-)情况下,如所书写的此基团的左手原子被附接至连接至x的烃基链,并且如所书写的此基团的右手原子被附接至连接至z的烃基链。
[0055]
可能的是y1是c
4-c
8-烃基链,例如c
6-链。可能的是y1是未被取代的。
[0056]
可能的是y2选自-c(o)nr
1-、-nr1c(o)-、-s(o)2nr1、-nr1s(o)
2-、-c(o)o-和-oc(o)-。可能的是y2选自-c(o)nr
1-、-nr1c(o)-、-s(o)2nr1和-nr1s(o)
2-。可能的是y2选自-c(o)nr
1-、-nr1c(o)-、-c(o)o-和-oc(o)-。可能的是y2选自-c(o)nr
1-和-nr1c(o)-。可能的是y2是-nr1c(o)-。
[0057]
可能的是y4选自-c(o)nr
1-、-nr1c(o)-、-s(o)2nr1、-nr1s(o)
2-、-c(o)o-和-oc(o)-。可能的是y4选自-c(o)nr
1-、-nr1c(o)-、-s(o)2nr1和-nr1s(o)
2-。可能的是y4选自-c(o)nr
1-、-nr1c(o)-、-c(o)o-和-oc(o)-。可能的是y4选自-c(o)nr
1-和-nr1c(o)-。可能的是y4是-nr1c(o)-。
[0058]
可能的是y3是c
10-c
20-烃基链。可能的是y3是c
12-c
16-烃基链,例如c
14-链。可能的是y3是未被取代的。
[0059]
可能的是y1是c
4-c
8-烃基链,y2选自-c(o)nr
1-和-nr1c(o)-,并且y3是c
12-c
16-烃基。
[0060]
z可以是任何有机部分,只要它包含能够在活化剂存在的情况下与第二反应物反应的官能团。例如,z可以是多达15个烃基基团、烃基链、环烃基环、杂环烃基环、苯环或杂芳
基环的任何组合,它们可以经由键或经由选自醚、胺(仲胺或叔胺)、硫醚、酯、酰胺、砜、磺酰胺、碳酸酯、氨基甲酸酯、脲和硫脲的接头基团连接在一起。环可以被连接以便形成多环基团。烃基基团、烃基链、环烃基基团和杂环烃基基团可以是部分不饱和的,例如可以具有至少一个碳-碳双键、至少一个碳-碳三键或至少一个碳-杂原子双键。烃基基团、烃基链、环烃基环、杂环烃基环、苯环或杂芳基环可以在化学上可能的情况下被选自卤素、硝基、氰基、co2h、oh、sh、nh2、conh2、=o、=s和s(o)2nh2的基团取代。
[0061]
为了方便起见,能够在活化剂存在的情况下与第二反应物反应的官能团在本说明书中可以被称为
‘
第一官能团’。因此,z包括第一官能团。
[0062]
z可以是第一官能团。
[0063]
第一官能团可以选自co2h、oh、nhrz(其中rz选自h和c
1-c
4-烃基)、酮或醛羰基基团、碳-碳双键、碳-碳三键、芳基-卤化物、乙烯基-卤化物、芳基-硼酸或芳基-硼酸酯以及环氧化物。
[0064]
第一官能团可以是co2h。第一官能团可以是nhrz,例如nh2。
[0065]
z可以是co2h。z可以是nhrz,例如nh2。
[0066]
核苷酸序列x可以是dna序列。可选择地,核苷酸序列x可以是rna序列。
[0067]
核苷酸序列(例如dna或rna)可以是单链的或双链的。核苷酸序列可以包括天然核苷酸或非天然核苷酸或者由天然核苷酸或非天然核苷酸组成。在dna的背景下,天然核苷酸是选自由da、dg、dt和dc组成的组的四种脱氧核糖核苷酸中的任何一种。在rna的背景下,天然核苷酸是选自由a、g、u和c组成的组的四种核糖核苷酸中的任何一种。非天然核苷酸是不落入上文天然核苷酸的定义内的任何核苷酸。
[0068]
另外地或可选择地,核苷酸序列(例如dna或rna)中的所有或部分可以在发夹环(hairpinloop)中连接。发夹环还可以包含寡核苷酸或合成连接链。
[0069]
可能的是核苷酸序列不是回文结构的(palindromic)。可能的是核苷酸具有少于90%(例如少于80%、少于70%、少于60%、少于50%、少于40%或更少)的gc含量。
[0070]
可能的是核苷酸序列是可扩增的。核苷酸序列将通常包含在待扩增区域的任一端处的引物退火序列。
[0071]
可能的是核苷酸序列包含两个或更多个核苷酸结构单元,每个核苷酸结构单元的长度是从3个至25个碱基。核苷酸结构单元中的一些或所有可以相同或可以不同。
[0072]
可能的是核苷酸序列的长度是从3个至200个碱基。可能的是核苷酸序列的长度大于90个碱基。
[0073]
可能的是接头基团y经由核苷酸序列的末端5’羟基基团附接至核苷酸序列x。为了不存在疑义,所述羟基基团将不是式(i)或式(ii)的化合物中的羟基基团,而是接头基团y将经由替代所述羟基基团的官能团附接至核苷酸序列x。接头基团y可以使用酯、醚或酰胺基团附接至核苷酸序列x。在接头基团y经由核苷酸序列的末端5’羟基基团附接至核苷酸序列x的情况下,接头基团y可以使用酯基团或醚基团附接至核苷酸序列x。优选地,接头基团y可以使用醚基团附接至核苷酸序列x。
[0074]
第一反应物可以以从1μm至10mm的浓度存在。第一反应物可以以从10μm至1mm的浓度存在。第一反应物可以以从25μm至250μm的浓度存在。第一反应物可以以从100μm至150μm的浓度存在。
[0075]
第二反应物
[0076]
第二反应物是能够在活化剂存在的情况下与第一反应物的有机部分的官能团反应的分子。第二反应物可以选自有机分子、h2以及h2的来源。
[0077]
第二反应物可以是能够在活化剂存在的情况下与第一反应物的有机部分的官能团反应的有机分子。通常,第二反应物包含能够在活化剂存在的情况下与第一反应物的有机部分的官能团反应的官能团。为了方便起见,能够在活化剂存在的情况下与第一反应物的有机部分的官能团反应的官能团在本说明书中可以被称为
‘
第二官能团’。
[0078]
第二反应物可以是任何有机分子。例如,第二反应物可以是多达15个烃基基团、烃基链、环烃基环、杂环烃基环、苯环或杂芳基环的任何组合,它们可以经由键或经由选自醚、胺(仲胺或叔胺)、硫醚、酯、酰胺、砜、磺酰胺、碳酸酯、氨基甲酸酯、脲和硫脲的接头基团连接在一起。环可以被连接以便形成多环基团。烃基基团、烃基链、环烃基基团和杂环烃基基团可以是部分不饱和的,例如可以具有至少一个碳-碳双键、至少一个碳-碳三键或至少一个碳-杂原子双键。烃基基团、烃基链、环烃基环、杂环烃基环、苯环或杂芳基环可以在化学上可能的情况下被选自卤素、硝基、氰基、co2h、oh、sh、nh2、conh2、=o、=s和s(o)2nh2的基团取代。
[0079]
第二官能团可以选自co2h、oh、nhrz(其中rz选自h和c
1-c
4-烃基)、酮或醛羰基基团、碳-碳双键、碳-碳三键、芳基-卤化物、乙烯基-卤化物、芳基-硼酸或芳基-硼酸酯以及环氧化物。
[0080]
第二官能团可以是co2h。第二官能团可以是nhrz,例如nh2。
[0081]
第二反应物可以以第二反应物∶第一反应物大于10∶1的摩尔比存在。第二反应物可以以第二反应物∶第一反应物大于100∶1的摩尔比存在。第二反应物可以以第二反应物∶第一反应物大于500∶1的摩尔比存在。第二反应物可以以第二反应物∶第一反应物小于5000∶1的摩尔比存在。
[0082]
在反应是氢化的情况下,第二反应物可以是h2。可选择地,第二反应物可以是h2的来源,例如甲酸铵。
[0083]
第二反应物可以以从0.01m至10m的浓度存在。第二反应物可以以从0.1m至1m的浓度存在。第二反应物可以以从0.25m至0.8m的浓度存在。
[0084]
反应
[0085]
反应介质可以包含另外的添加剂,例如以维持适当的ph(例如磷酸盐缓冲液)或离子性(例如nacl)。
[0086]
所进行的反应可以是将两种反应物偶联在一起的任何反应。所进行的反应可以是例如钯催化的偶联反应(例如suzuki、heck、sonogoshira、buchwald-hartwig)。所进行的反应可以是交叉复分解反应。所进行的反应可以是亚胺形成。所进行的反应可以是环氧化物开环反应。所进行的反应可以是氢化(在这种情况下,第二反应物可以是h2或h2的来源,诸如甲酸铵)。
[0087]
然而,优选地,该反应是酰胺偶联反应。
[0088]
酰胺形成
[0089]
活化剂可以是酰胺偶联剂。因此,反应产物可以包含酰胺。所述酰胺由伯胺或仲胺与羧酸之间的反应形成,所述伯胺或仲胺和羧酸包含在第一反应物和第二反应物中。
[0090]
可能的是第一反应物的有机部分的官能团是伯胺或仲胺,并且第二反应物包含羧酸。可能的是第一反应物的有机部分的官能团是伯胺,并且第二反应物包含羧酸。在这些实施方案中,可能的是偶联剂是hatu。
[0091]
可能的是第一反应物的有机部分的官能团是羧酸,并且第二反应物包含伯胺或仲胺。可能的是第一反应物的有机部分的官能团是羧酸,并且第二反应物包含伯胺。在这些实施方案中,可能的是偶联剂是dic。
[0092]
对于酰胺偶联反应,优选的是有机溶剂是有机碱,例如如上文在小标题
‘
有机溶剂’下描述的有机碱。
[0093]
在某些实施方案中,第一方面的方法还可以包括使前体化合物x
(n-1)-y-z与核苷酸结构单元连接以在第一反应物与第二反应物反应之前产生第一反应物x-y-z。x
(n-1)
是当添加核苷酸结构单元时形成x的核苷酸序列。
[0094]
在某些实施方案中,第一方面的方法还可以包括纯化反应产物。可能的是纯化反应产物包括在乙醇中沉淀。
[0095]
制备dna编码化合物库的方法
[0096]
制备dna编码化合物库的方法可以包括:
[0097]
(i)使x
(n-1)-y-z化合物的x
(n-1)
部分与核苷酸结构单元连接以产生x-y-z;
[0098]
(ii)以第一方面的方法使x-y-z与第二反应物反应以形成x-y-za。
[0099]
可能的是,该方法还包括(iii)纯化反应产物x-y-za以形成纯化的产物x-y-za。可能的是步骤(iii)中的纯化包括在乙醇中沉淀。
[0100]
步骤(i)还可以包括在连接x
(n-1)-y-z的x
(n-1)
部分之前使核苷酸结构单元磷酸化。
[0101]
步骤(ii)的反应可以是x-y-z与第二反应物之间的酰胺偶联,其中第二反应物可以是氨基酯。可能的是步骤(ii)还包括在酰胺偶联步骤之后使酯官能团水解以形成x-y-za。
[0102]
可以迭代地重复该方法。例如,该方法还可以包括(iv)重复步骤(i)和步骤(ii),或步骤(i)至步骤(iii),其中产物x-y-za是用于步骤(i)的第二次迭代的起始材料。该方法形成产物x
b-y-zb,其中xb是核苷酸序列,它是由将核苷酸结构单元添加至xa产生的,并且yb是ya与第二反应物之间反应的产物。该方法的所述迭代重复可以根据需要进行多次。例如,该方法还可以包括步骤(i)和步骤(ii)或步骤(i)至步骤(iii)的至少一次、至少两次、至少三次、至少四次或至少五次迭代。
[0103]
为了避免疑义,在步骤(i)的每次迭代中使用的核苷酸结构单元可以相同或其可以不同。同样,在步骤(ii)的每次迭代中使用的第二反应物可以相同或其可以不同。
[0104]
为了避免疑义,通过该方法的每次迭代制备的产物(例如x-y-xa、x
b-y-zb等)中的每一种可以是dna编码库的组成部分或者可以用作用于该方法的进一步迭代的起始材料。
[0105]
附图简述
[0106]
参考附图在下文中进一步描述了本发明的实施方案,在附图中:
[0107]
图1示出了用于产生本发明的dna编码库的总体编码策略。
[0108]
图2示出了del合成的第一阶段。a)在第一库阶段中使用的连接计划;b)第一库连接(library ligation)的4%琼脂糖凝胶电泳结果。
[0109]
图3示出了del合成的第二阶段。a)在第二库阶段中使用的连接计划;b)第二库连
接的4%琼脂糖凝胶电泳结果,其显示出在~65bp处的带。
[0110]
图4示出了del合成的第三阶段。a)在第三库阶段中使用的连接计划;b)第三库连接的4%琼脂糖凝胶电泳结果,其显示出在~100bp处的带。
[0111]
图5示出了a)本发明中使用的pcr方法,包括没有引物的阴性对照;和b)pcr扩增的4%琼脂糖凝胶电泳结果,其显示出在~140bp处的带。
[0112]
图6示出了酰胺偶联反应中使用的双链起始材料74的色谱图。
[0113]
图7示出了双链酰胺偶联产物75a的色谱图。
[0114]
图8示出了酰胺偶联反应中使用的双链起始材料71的色谱图。
[0115]
图9示出了双链反向酰胺偶联产物72a的色谱图。
[0116]
详细描述
[0117]
术语
‘
有机溶剂’通常是指没有净电荷的有机分子。通常,它们具有在30gmol-1
至150gmol-1
,例如40gmol-1
至110gmol-1
的范围内的分子量。可能的是有机溶剂在25℃和1个大气压是液体。然而,可能的是有机溶剂在25℃和1个大气压是固体,但在反应条件下完全溶解在水中。
[0118]
术语
‘
有机分子’和
‘
有机部分’通常是指包括至少一个碳-碳共价键并且通常仅包括选自h、c、n、o、p、b、s、f、cl、br和i的原子的分子和分子部分,所述原子通过共价键键合在一起。
[0119]
术语
‘
有机碱’是指包含携带孤对电子的氮原子的有机分子,该孤对电子未共轭到邻近的π轨道中。有机碱通常是指具有在从4至16的范围内、更优选地在从5至10的范围内的水性pka的化合物。在本发明的某些实施方案中,有机碱将是不会参与酰胺形成反应的化合物,例如三烃基胺和包含吡啶的化合物。
[0120]
术语c
m-cn是指具有m个至n个碳原子的基团。
[0121]
术语“烃基基团”是指单价直链或支链的饱和烃链。例如,c
1-c
6-烃基可以是指甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、正戊基和正己基。烃基基团可以是未被取代的或被一个或更多个取代基例如卤素基团取代的。
[0122]
术语“烃基链”是指二价直链的饱和烃链。例如,c
1-c
3-亚烃基可以是指亚甲基、亚乙基或亚丙基。烃基链可以是未被取代的或被一个或更多个取代基例如c
1-c
4-烃基基团或=o基团取代的。
[0123]
术语“环烃基”是指饱和或部分饱和的烃环。部分饱和的,意指环可以包含一个或两个双键。例如,“c
3-c
6-环烃基”可以指环丙基、环丁基、环戊基、环己基。
[0124]
术语“杂环烃基”是指在环体系中具有从y个至z个原子并且在环体系中包含1个或2个独立地选自o、s和n的杂原子(换言之,形成环体系的原子中的1个或2个原子选自o、s和n)的单环或双环饱和或部分饱和的基团。部分饱和的,意指环可以包含一个或两个双键。这特别地适用于具有从5个至6个成员的单环。双键将通常在两个碳原子之间,但可以在碳原子与氮原子之间。杂环烃基基团的实例包括:哌啶、哌嗪、吗啉、硫代吗啉、吡咯烷、四氢呋喃、四氢噻吩、二氢呋喃、四氢吡喃、二氢吡喃、二氧六环、吖庚因。
[0125]
杂芳基环可以是包含从1个至4个独立地选自o、s和n的杂原子(换言之,形成环体系的原子中的从1个至4个原子选自o、s和n)的任何芳族5元或6元环体系(即包含2(2n+1)个π电子的环体系)。因此,任何杂芳基基团可以独立地选自:5元杂芳基基团,其中杂芳族环被
1个-4个独立地选自o、s和n的杂原子取代;和6元杂芳基基团,其中杂芳族环被1个-3个(例如1个-2个)氮原子取代。具体地,杂芳基环可以独立地选自:吡咯、呋喃、噻吩、吡唑、咪唑、噁唑、异噁唑、三唑、噁二唑、噻二唑、四唑、吡啶、哒嗪、嘧啶、吡嗪、三嗪。
[0126]
芳基-卤化物和芳基硼酸或芳基硼酸酯是指直接附接至苯环的碳原子或杂芳基环的碳原子的卤素原子或硼酸或硼酸酯基团。乙烯基-卤化物是指直接附接至碳-碳双键的碳原子的卤素原子。
[0127]
术语“dna编码库(del)”是指化合物的库,所述化合物中的每一种与独特的dna序列缀合。这种缀合允许经由pcr扩增和dna测序容易地鉴定结合分子。
[0128]
术语“催化剂”可以是指在其使反应活化后可以在反应条件下再生的活化剂。因此,这些物质可以使反应多次活化。这样的物质传统上被认为是有机合成中的催化剂,但在del的合成中可以以超化学计量的量使用。
[0129]
术语“核苷酸结构单元”是指短核苷酸序列(例如短dna序列)。
[0130]
在整个本说明书的描述和权利要求书中,词语“包含/包括(comprise)”和“包含(contain)”及其变型意指“包括但不限于”,并且它们不意图(并且不)排除其他部分、添加剂、组分、整数或步骤。在整个本说明书的描述和权利要求书中,除非上下文另外要求,否则单数涵盖复数。特别地,除非上下文另外要求,否则在使用不定冠词的情况下,本说明书应被理解为设想多于一个以及单个。
[0131]
结合本发明的特定方面、实施方案或实施例所描述的特征、整数、特性、化合物、化学部分或化学基团应被理解为可应用于本文描述的任何其他方面、实施方案或实施例,除非与该方面、实施方案或实例不相容。在本说明书(包括任何随附的权利要求、摘要和附图)中公开的所有特征和/或如此公开的任何方法或工艺的所有步骤可以以任何组合进行组合,除了其中这样的特征和/或步骤中的至少一些相互排斥的组合之外。本发明不限于任一前述实施方案的细节。本发明扩展至在本说明书(包括任何随附的权利要求、摘要和附图)中公开的特征中的任何新颖特征或特征的任何新颖组合,或者扩展至如此公开的任何方法或工艺的步骤中的任何新颖步骤或步骤的任何新颖组合。
[0132]
读者的注意被引导到与本说明书同时提交或在此之前提交的与本技术有关的、并且与本说明书一起向公众开放供查阅的所有论文和文献,并且所有这样的论文和文献的内容通过引用并入本文。
实施例
[0133]
一般实验
[0134]
已经使用了每个dna片段的以下代码缩写:
[0135][0136][0137]
示例性的bb1、bb1
′
、bb2、bb2
′
、bb3和bb3
′
序列在下文的实施例中论述。
[0138]
实施例1:头件合成
[0139]
步骤1:mmt脱保护
[0140][0141]
附接至固体支持物的单链dna的平均载量是通过使用下文方法从固体支持物上裂解并且重复3次而得到的。裂解的dna的nanodrop浓度显示,103mg给出2μmol的dna。
[0142]
所使用的单链dna是14聚体(gtcttgccgaattc;seq id no:1),其具有在3’端处与固体支持物结合的5’mmt氨基c6接头。将固体支持的dna(103mg,约2μmol)用在dcm(6
×
500μl)中的5%三氯乙酸洗涤。黄色指示脱保护正在进行中。在这种颜色消退后,将固体支持的dna用dcm(3
×
500μl)洗涤,并且静置空气干燥持续20分钟,然后与头件偶联。
[0143]
步骤2a:酸头件
[0144][0145]
在1.5ml微型离心管中添加hatu(17mg,44μmol)、dipea(17μl,100μmol)和dmf(1ml)。向其中添加十六烷二酸(17mg,40μmol)或3,6,9,12,15-五氧杂十七烷二酸(18mg,40μmol),并且将混合物在室温摇动持续20分钟。添加脱保护的固体支持的dna(约2μmol),并且将混合物在室温摇动过夜。然后将混合物过滤,并且用dmf(3
×
500μl)、mecn(3
×
500μl)、meoh(3
×
500μl)和dcm(3
×
500μl)洗涤,并且允许空气干燥持续20分钟。添加水(1.5ml)并且将混合物在室温摇动持续1小时,然后过滤并且用水(3
×
500μl)洗涤。将在水(500μl)中的40%甲胺和在水(500μl)中的33%氨在1.5ml离心管中混合。然后添加固体支持的dna,并且将混合物在室温摇动持续1小时。然后将混合物过滤,并且用水(3
×
500μl)洗涤,并且使用genevac在40℃浓缩至~0.5ml。然后粗制产物通过hplc纯化,将级分使用genevac在40℃浓缩,并且溶解在水(1ml)中。然后将样品的浓度使用thermofisher的nanodrop1通过uv进行定量。在hplc纯化之后,通常的量是约0.5μmol-1μmol的dna。然后在水中添加确切量的互补14聚体(gaattcggcaagac;seq id no:2),并且将混合物加热至80℃持续1小时,允许其缓慢冷却。然后将双链dna使用genevac在40℃浓缩,直到干燥,并且溶解在水中或在水中的2%tpgs-750-m中,以形成1mm的酸溶液。然后将溶液铺板到20μl的孔中,每孔具有20nmol的dna,并且在-20℃冷冻。在用于反应之前,将样品在室温解冻持续30分钟。
[0146]
步骤2b:胺头件
[0147][0148]
在1.5ml微型离心管中添加hatu(17mg,44μmol)、dipea(17μl,100μmol)和dmf(1ml)。向其中添加12-((((9h-芴-9-基)甲氧基)羰基)氨基)十二烷酸(26mg,40μmol),并且将混合物在室温摇动持续20分钟。添加脱保护的固体支持的dna(约2μmol),并且将混合物在室温摇动过夜。然后将混合物过滤,并且用dmf(3
×
500μl)、mecn(3
×
500μl)、meoh(3
×
500μl)和dcm(3
×
500μl)洗涤,并且允许空气干燥持续20分钟。将在水(500μl)中的40%甲胺和在水(500μl)中的33%氨在1.5ml离心管中混合。然后添加固体支持的dna,并且将混合物在室温摇动持续1小时。然后将混合物过滤,并且用水(3
×
500μl)洗涤,并且使用genevac
在40℃浓缩至~0.5ml。然后粗制产物通过hplc纯化,将级分使用genevac在40℃浓缩,并且溶解在水(1ml)中。然后将样品的浓度使用thermofisher的nanodrop1通过uv进行定量。在hplc纯化之后,通常的量是约0.5μmol-1μmol的dna。然后在水中添加确切量的互补14聚体(gaattcggcaagac;seq id no:2),并且将混合物加热至80℃持续1小时,允许其缓慢冷却。然后将双链dna使用genevac在40℃浓缩,直到干燥,并且溶解在水中或在水中的2%tpgs-750-m中,以形成1mm的产物溶液。然后将溶液铺板到20μl的孔中,每孔具有20nmol的dna,并且在-20℃冷冻。在用于反应之前,将样品在室温解冻持续30分钟。
[0149]
步骤3a:将胺偶联至酸头件
[0150][0151]
将等分试样的胺溶液(60μl,在nmp中的0.25m)和hoat(20μl,在nmp中的10mg/100μl)添加至用于para-dox
tm 96孔微型光氧化还原/优化板的50μl玻璃插件中。然后在genevac中在55℃去除nmp持续60分钟。向该溶液中添加酸头件(30μl,在于水中的4.5%tpgs-750-m中的5nmol)、2,6-二甲基吡啶(5.2μl,0.045mmol)和dic(2.2μl,0.015mmol)。将小瓶各自涡旋持续30秒以增强混合。然后将样品在para-dox
tm 96孔微型光氧化还原/优化板中在45℃加热持续5小时。使用质谱法来分析反应。样品通过将反应混合物(1μl)添加至水(20μl)中来制备,并且通过亲水ptfe过滤器过滤。为了纯化每个样品,将它们用水(50μl)稀释,向每个样品中添加dcm(2
×
100μl),并且将小瓶涡旋。如果乳液剩余,则将样品离心以帮助分离。去除有机物,并且用乙酸乙酯(2
×
100μl)水性洗涤。添加氯化钠水溶液(8μl,4m)和乙醇(264μl),并且将混合物在-78℃孵育持续1小时。然后将混合物离心并且去除乙醇层。然后将dna沉淀物(pellet)溶解在水中,以给出1mm溶液。
[0152]
步骤3b:将酸偶联至胺头件
[0153][0154]
将等分试样的酸溶液(60μl,在nmp中的0.25m)添加至用于para-dox
tm 96孔微型光
氧化还原/优化板的50μl玻璃插件中。然后在genevac中在55℃去除nmp持续60分钟。向该溶液中添加胺头件(30μl,在于水中的3.5%tpgs-750-m中的5nmol)、2,6-二甲基吡啶(6.92μl,0.06mmol)和hatu(5.7mg,0.015mmol)。将小瓶各自涡旋持续30秒以增强混合。然后将样品在para-dox
tm 96孔微型光氧化还原/优化板中在45℃加热过夜。使用质谱法来分析反应。样品通过将反应混合物(1μl)添加至水(20μl)中来制备,并且通过亲水ptfe过滤器过滤。为了纯化每个样品,将它们用水(50μl)稀释,向每个样品中添加dcm(2
×
100μl),并且将小瓶涡旋。如果乳液剩余,则将样品离心以帮助分离。去除有机物,并且用乙酸乙酯(2
×
100μl)水性洗涤。添加氯化钠水溶液(8μl,4m)和乙醇(264μl),并且将混合物在-78℃孵育持续1小时。然后将混合物离心并且去除乙醇层。然后将dna沉淀物溶解在水中,以给出1mm溶液。
[0155]
实施例2:筛选化合物使用连续酰胺偶联的代表性合成
[0156]
循环1
[0157][0158]
将等分试样的甘氨酸乙酯盐酸盐(60μl,在nmp中的0.25m)和hoat(20μl,在nmp中的10mg/100μl)添加至用于para-dox
tm 96孔微型光氧化还原/优化板的50μl玻璃插件中。然后在genevac中在55℃去除nmp持续60分钟。向该溶液中添加酸头件(30μl,在于水中的4.5%tpgs-750-m中的24nmol)、2,6-二甲基吡啶(5.2μl,0.045mmol)和dic(2.2μl,0.015mmol)。将小瓶各自涡旋持续30秒以增强混合。然后将样品在para-dox
tm 96孔微型光氧化还原/优化板中在45℃加热持续5小时。使用质谱法来分析反应。样品通过将反应混合物(1μl)添加至水(20μl)中来制备,并且通过亲水ptfe过滤器过滤。hrms(esi):确切质量计算值:4760.0604;实测值:4760.0629。
[0159]
将反应用水(50μl)稀释,向每个反应中添加dcm(2
×
100μl),并且将小瓶涡旋。如果乳液剩余,则将样品离心以帮助分离。去除有机物,并且用乙酸乙酯(2
×
100μl)水性洗涤。添加氯化钠水溶液(8μl,4m)和乙醇(264μl),并且将混合物在-78℃孵育持续1小时。然后将混合物离心并且去除乙醇层。然后将dna沉淀物溶解在0.25m lioh(50μl)中,并且摇动持续1小时。添加氯化钠水溶液(5μl,4m)和乙醇(165μl),并且将混合物在-78℃孵育持续1小时。然后将混合物离心并且去除乙醇层。然后将dna沉淀物溶解在水(100μl)中,并且通过3000道尔顿分子量的自旋过滤器纯化,用水(3
×
100μl)洗涤。将产物洗脱并且使用质谱法来分析反应。hrms(esi):确切质量计算值:4732.0291;实测值:4732.0543。
[0160]
循环2
[0161][0162]
将等分试样的l-苏氨酸甲酯盐酸盐(60μl,在nmp中的0.25m)和hoat(20μl,在nmp中的10mg/100μl)添加至用于para-dox
tm 96孔微型光氧化还原/优化板的50μl玻璃插件中。然后在genevac中在55℃去除nmp持续60分钟。向该溶液中添加酸头件-甘氨酸(30μl,在于水中的4.5%tpgs-750-m中的15nmol)、2,6-二甲基吡啶(5.2μl,0.045mmol)和dic(2.2μl,0.015mmol)。将小瓶各自涡旋持续30秒以增强混合。然后将样品在para-dox
tm 96孔微型光氧化还原/优化板中在45℃加热持续5小时。使用质谱法来分析反应。样品通过将反应混合物(1μl)添加至水(20μl)中来制备,并且通过亲水ptfe过滤器过滤。hrms(esi):确切质量计算值:4847.0924;实测值:4847.0302。
[0163]
将反应用水(50μl)稀释,向每个反应中添加dcm(2
×
100μl),并且将小瓶涡旋。如果乳液剩余,则将样品离心以帮助分离。去除有机物,并且用乙酸乙酯(2
×
100μl)水性洗涤。添加氯化钠水溶液(8μl,4m)和乙醇(264μl),并且将混合物在-78℃孵育持续1小时。然后将混合物离心并且去除乙醇层。然后将dna沉淀物溶解在0.25m lioh(50μl)中,并且摇动持续1小时。添加氯化钠水溶液(5μl,4m)和乙醇(165μl),并且将混合物在-78℃孵育持续1小时。然后将混合物离心并且去除乙醇层。然后将dna沉淀物溶解在水(100μl)中,并且通过3000道尔顿分子量的自旋过滤器纯化,用水(3
×
100μl)洗涤。将产物洗脱并且使用质谱法来分析反应。hrms(esi):确切质量计算值:4833.0768;实测值:4833.0264。
[0164]
循环3
[0165][0166]
将等分试样的3-溴丙-2-炔-1-胺盐酸盐(60μl,在nmp中的0.25m)和hoat(20μl,在nmp中的10mg/100μl)添加至用于para-dox
tm 96孔微型光氧化还原/优化板的50μl玻璃插件中。然后在genevac中在55℃去除nmp持续60分钟。向该溶液中添加酸头件-甘氨酸-苏氨酸
(30μl,在于水中的4.5%tpgs-750-m中的4nmol)、2,6-二甲基吡啶(5.2μl,0.045mmol)和dic(2.2μl,0.015mmol)。将小瓶各自涡旋持续30秒以增强混合。然后将样品在para-dox
tm 96孔微型光氧化还原/优化板中在45℃加热持续5小时。将反应用水(50μl)稀释,向每个反应中添加dcm(2
×
100μl),并且将小瓶涡旋。如果乳液剩余,则将样品离心以帮助分离。去除有机物,并且用乙酸乙酯(2
×
100μl)水性洗涤。添加氯化钠水溶液(8μl,4m)和乙醇(264μl),并且将混合物在-78℃孵育持续1小时。然后将混合物离心并且去除乙醇层。然后将dna沉淀物溶解在水(100μl)中,并且通过3000道尔顿分子量的自旋过滤器纯化,用水(3
×
100μl)洗涤。将产物洗脱并且使用质谱法来分析反应。hrms(esi):确切质量计算值:4948.0189;实测值:4947.9343。
[0167]
实施例3:dna编码库使用连续酰胺偶联的合成
[0168]
乙醇沉淀
[0169]
向反应混合物中添加10%体积的nacl(在水中的5m)和3
×
体积的冷乙醇。允许混合物在-78℃静置持续1小时,或在-20℃过夜。然后将混合物以13500rpm离心持续30分钟。将上清液倾析,并且添加70%冷etoh。允许混合物在-78℃静置持续1小时,然后以13500rpm离心持续30分钟,并且将上清液倾析。然后允许沉淀物空气干燥,然后再溶解在适当的溶剂中。
[0170]
酰胺偶联程序
[0171]
将等分试样的胺或氨基酯溶液(60μl,在nmp中的0.25m)和hoat(20μl,在nmp中的10mg/100μl)添加至用于para-dox
tm 96孔微型光氧化还原/优化板的50μl玻璃插件中。然后在genevac中在55℃去除nmp持续60分钟。向该溶液中添加对应的连接库等分试样(在于水中的4.5%tpgs-750-m中的30μl)、2,6-二甲基吡啶(5.2μl,0.045mmol)和dic(2.2μl,0.015mmol)。将小瓶各自涡旋持续30秒以增强混合。然后将样品在para-dox
tm 96孔微型光氧化还原/优化板中在45℃加热持续5小时。将反应用水(50μl)稀释,并且将所有反应等分试样合并。添加dcm(2
×
4000μl)并且将小瓶涡旋。如果乳液剩余,则将样品离心以帮助分离。去除有机物,并且用乙酸乙酯(2
×
4000μl)水性洗涤。使用一般乙醇沉淀法使dna沉淀。然后将dna沉淀物溶解在水(400μl)中,并且通过3000道尔顿分子量的自旋过滤器纯化,用水(3
×
100μl)洗涤。将产物洗脱并且分析总库浓度。
[0172]
酯水解
[0173]
将酰胺偶联步骤之后的库溶解至浓度为0.25m lioh(1ml)并且摇动持续1小时。使用一般乙醇沉淀法使dna沉淀。然后将dna沉淀物溶解在水(400μl)中,并且通过3000da分子量的自旋过滤器纯化,用水(3
×
100μl)洗涤。将产物洗脱并且分析总库浓度。
[0174]
磷酸化
[0175]
在连接之前,使每条链的5’末端磷酸化。向dna链(450μm,在20μl的总反应介质中9000pmol)中添加pnk反应缓冲液(2μl,500mm tris-hcl[在25℃时ph 7.6]、100mm mgcl2、50mm dtt、1mm亚精胺)、atp(2μl,10mm,thermo scientific)、t4多核苷酸激酶(1μl,10u/μl,thermo scientific)和无核酸酶水(多达20μl)。将反应在37℃进行持续1小时,随后加热至75℃持续10分钟。在没有纯化或沉淀的情况下将dna用于连接步骤。
[0176]
连接
[0177]
连接(ligation)包含dna(100μm,在90μl的总反应介质中9000pmol)、磷酸化dna链
(20μl,9000pmol)、10
×
t4 dna连接酶缓冲液(9μl,400mm tris-hcl、100mm mgcl2、100mmdtt、5mm atp9)、水(多达90μl)和t4 dna连接酶(3μl,30weiss u/μl)。将连接在25℃进行持续16小时,随后加热至75℃持续10分钟。在随后的有机反应发生之前,通过乙醇沉淀纯化每个连接。用于99,405个成员库的编码策略描绘于图1中。
[0178]
库量
[0179]
下文表1示出了每个反应阶段之后的核酸浓度和所得到的库量。使用nanodrop
tm
one/onec微量uv-vis分光光度计计算分析,将1μl的样品移液在样品装载板上。
[0180]
表1
[0181][0182]
pcr和ngs
[0183]
设计正向引物和反向引物以扩增del库,侧翼是5’illumina衔接子序列,以使得能够实现下游序列分析。在包含amplitaq360主混合物(thermo fisher)和100ng 1
×1×
1原型库(在4.2μm)的50μl反应混合物中进行每个pcr。所使用的每种引物的最终浓度是10μm。使用bio-rad mj mini personal热循环仪进行pcr。热循环条件如下:在95℃10min,随后在95℃30s、在55℃30s和在72℃1min的40次循环,以及在72℃420s的最终延长时间。在每次运行中包括阴性对照(蒸馏水替代引物)。pcr反应后,将样品在4%琼脂糖e-凝胶上运行,提取凝胶并且使用下一代测序(genewiz,south plainfield,nj,usa)进行测序。
[0184]
表2示出了用于pcr和ngs的正向引物和反向引物。引物序列和ngs延伸序列。
[0185]
表2
[0186][0187]
库合成
[0188]
库合成拆分为3个阶段,在每个阶段中具有连接和化学修饰。第一阶段是将第一结构单元和其他序列连接至接头部分,随后是简单的乙醇沉淀作为纯化。然后第一酰胺偶联
步骤发生,并且所有样品将被汇集并一起纯化。这包括分子量过滤,以从连接中去除任何小dna序列起始材料以及以去除任何额外的小分子相关物质。然后使用氢氧化锂使整个库水解,随后是2次乙醇沉淀以纯化库。将库拆分,并且对第二结构单元重复该过程。在完成后,将第三结构单元添加有对应的序列并且将引物序列加帽。在该阶段不需要水解,因为所有胺都是末端的。库通过制备型hplc纯化,准备用于筛选。除了该库之外,将测试1
×1×
1库与较大库并行合成。可以使用该化合物以显示在库合成步骤已经发生之后,所得到的库可以被pcr扩增并且测序。
[0189][0190]
第一库合成步骤
[0191]
第一连接包括包含衔接子、引物、支架代码、突出端和结构单元1代码的序列(图2a)。在连接之前,任何需要连接的dna链的5’末端都被磷酸化。在这种情况下,它包括具有标识符ps、oh1bb1x和a’p’s’oh1’的序列,其中衔接子序列和bb1’序列不需要磷酸化。由于代码ps和ap’s’oh1’将用于所有连接反应,它们在eppendorf管中被大量磷酸化。在所有实施例中,将反应缩放为以450μm的相同浓度,并且然后静置反应持续1小时。
[0192]
然后在pcr管中使用20μl的每种磷酸化反应混合物加上非磷酸化a和oh2’bb1x’的9μl的1mm溶液进行连接。这些反应以100μm的dna制成多达总计90μl,并且静置持续16小时,然后在75℃变性持续10分钟。跨越pcr板的对角线取等分试样,以通过凝胶电泳进行分析
(图2b)。所预期的dna序列长度是50个和54个碱基对,在梯状物的50个碱基对标志物附近观察到明显的带。通过乙醇沉淀纯化每个dna序列,并且将单独的沉淀物溶解在于水中的4.5%tpgs-750-m中。
[0193]
每个dna序列被分配至对应的氨基酯结构单元,如表3和表4中描绘的。对于每个结构单元提供海明距离(hamming distance)为4的8碱基对序列,用于库筛选中的鉴定。在反应之前将每种结构单元溶解在0.25mnmp溶液中,并且将每一种60μl连同以1mg/10μl的20μl hoat添加至对应的反应孔中,并且使用genevac离心蒸发器将样品减少至干燥。
[0194]
表3示出了代表性的氨基酯、随后的反应孔和bb1代码,以及对应的8个碱基结构单元代码序列和4个碱基突出端。在表3的每个序列表中,
‘‑’
用于突出显示序列中存在的单独dna片段。
[0195]
表3
[0196][0197]
氨基酯、随后的反应孔和bb1代码、对应的8个碱基结构单元代码序列和4个碱基突出端的另外的实例提供于表4中。在表4的每个序列表中,
‘‑’
用于突出显示序列中存在的单独dna片段。
[0198]
表4
[0199]
[0200]
[0201]
[0202][0203]
在将结构单元干燥后,将对应的dna连接产物连同2,6-二甲基吡啶和dic一起添加在30μl的4.5%tpgs-750-m中,并且将反应在密封的paradox板中加热至40℃持续3小时。此后,将反应冷却至室温并且合并,用30μl的水洗涤每个反应管。然后将合并的反应稀释至4ml总体积,并且用dcm和乙酸乙酯洗涤;需要离心来去除在该步骤中形成的乳液。然后将所得到的水相使用乙醇沉淀。将沉淀物溶解在水中,并且使用3000da自旋过滤用水洗涤几次来进一步纯化,以去除任何另外的有机物和小的连接产物。将1
×1×
1反应产物以与大部分库相同的方式单独地纯化。
[0204][0205]
在库已经被纯化后,nanodrop浓度指示,库是325nmol(72%),并且1
×1×
1测试化合物是8.5nmol(94%)。
[0206]
为了使酯水解,在乙醇沉淀之前,将整个库用0.25m氢氧化锂处理持续1小时,给出311nmol的库和8.5nmol的1
×1×
1测试化合物。
[0207]
第二库合成步骤
[0208]
将第一次结构单元添加之后的库(总量为311nmol)溶解以产生1mm溶液。结构单元的第二次添加是使用不同的代码作为标识符的在第一次添加中使用的47个氨基酯的重复。
使用存在的突出端使库与47个互补的编码序列连接(图3a)。首先,使用eppendorf管,在将dna的浓度保持在325μm的大规模反应中使整个库磷酸化。bb2oh2序列的5’末端也需要磷酸化,这在pcr管中以条带形式以325μm和20μl反应进行。将反应进行持续1小时,并且在连接反应之前变性。
[0209]
在pcr管中使用20μl的每种磷酸化反应混合物(包括库加上非磷酸化oh3’bb2x’序列的9μl的1mm溶液)进行连接。总dna浓度为100μm,使用65μl总反应介质,并且进行持续16小时,并且然后如先前在75℃变性。对于1
×1×
1测试化合物也重复这一过程。产物的凝胶电泳分析显示,在长度为约65个碱基对处存在显著的带(图3b),在任何产物中没有可见的起始材料。然后使用乙醇使dna链单独沉淀,并且溶解在4.5%tpgs-750-m中,准备用于第二次酰胺偶联结构单元的添加。
[0210]
与第一次结构单元添加一样,所使用的每个氨基酯被分配鉴定的8碱基对序列(如表5和表6中描绘的)和对应的代码。再一次,这些鉴定的8碱基对序列和对应的代码对于每个单独的结构单元都是独特的,并且不同于第一次添加中使用的那些。将nmp中的结构单元溶液连同hoat一起添加至相应的反应孔中,并且如先前在genevac中干燥。然后将包含dna的溶液连同dic和2,6-二甲基吡啶一起添加至氨基酯中,密封在paradox微孔板中,并且在40℃加热持续3小时。
[0211]
表5示出了代表性的氨基酯、随后的反应孔和bb2代码,以及对应的8个碱基结构单元代码序列和4个碱基突出端。在表5的每个序列表中,
‘‑’
用于突出显示序列中存在的单独dna片段。
[0212]
表5
[0213][0214][0215]
氨基酯、随后的反应孔和bb2代码、对应的8个碱基结构单元代码序列和4个碱基突
出端的另外的实例提供于表6中。在表6的每个序列表中,
‘‑’
用于突出显示序列中存在的单独dna片段。
[0216]
表6
[0217]
[0218]
[0219]
[0220]
[0221][0222]
将反应合并,并且通过用有机溶剂洗涤、乙醇沉淀和分子量自旋过滤,使用与先前实施例相同的程序纯化。以相同方式纯化1
×1×
1库。将两个样品溶解在水中并且通过nanodrop进行分析,指示库的收率为186nmol,并且1
×1×
1化合物的收率为5.6nmol。为了使产物水解,将它们与0.25m氢氧化锂一起摇动持续1小时,随后是乙醇沉淀。将沉淀物溶解在水中,并且通过nanodrop进行分析。库的最终收率为151nmol(51%),并且1
×1×
1化合物的最终收率为4.3nmol。
[0223][0224]
第三库合成步骤
[0225]
在第二库合成步骤已经发生之后,总库为151.3nmol。将库溶解在水中以产生1mm
的dna溶液。在第三库步骤中,将使用胺帽(amine cap)来完成库合成(图4a)。选择45种胺用于该库步骤,并且库被拆分在45个孔内,具有45个单独的鉴定序列。连接较长的dna序列,并入单独序列标识符以及使引物序列加帽(长度为31个和35个碱基对)。使p2bb3xoh3序列在单独的孔中以165μm总dna浓度磷酸化。库也再次被大量磷酸化,准备拆分为单独的连接反应。1
×1×
1化合物也使用结构单元代码50作为其标识符进行磷酸化。
[0226]
在磷酸化已经发生后,将dna序列以55μm的浓度转移至对应的pcr管中,并且使用t4连接酶连接持续16小时。使用凝胶电泳来分析产物(图4b),其中在~100bp(预期为97bp)处观察到亮带。使用乙醇使dna链单独沉淀,并且溶解在4.5%tpgs-750-m中,准备用于最终酰胺偶联结构单元的添加。
[0227]
表7示出了代表性的胺、随后的反应孔和bb3代码,以及对应的8个碱基结构单元代码序列、引物和4个碱基突出端。在表7的每个序列表中,
‘‑’
用于突出显示序列中存在的单独dna片段。
[0228]
表7
[0229][0230]
氨基酯、随后的反应孔和bb3代码、对应的8个碱基结构单元代码序列和4个碱基突出端的另外的实例提供于表8中。在表8的每个序列表中,
‘‑’
用于突出显示序列中存在的单独dna片段。
[0231]
表8
[0232]
[0233]
[0234]
[0235]
[0236][0237]
如表7和表8中所描绘的,每种胺都被分配了对应的8碱基对序列和单独的标识符代码。1
×1×
1样品再次利用库中表示的结构单元,但使用结构单元代码50作为标识符。这允许1
×1×
1针对库中那些结构单元中的任何结构单元具有独特的序列。在反应可以发生之前,将每种胺溶解在0.25m nmp溶液中,取出60μl,并且与hoat一起在genevac中干燥。然后将包含dna的tpgs-750-m溶液连同dic和2,6-二甲基吡啶一起添加至对应的胺中,密封在paradox微孔板中,并且在40℃反应持续3小时。
[0238]
[0239]
在完成后,将包含孔的库合并,用dcm和乙酸乙酯洗涤,乙醇沉淀并且再溶解在水中。进一步纯化使用10000da分子量的自旋过滤器实现。对1
×1×
1库进行相同的纯化过程。
[0240]
使用制备型hplc对整个库进行最终纯化,该制备型hplc在c
18
柱上使用包含16.3mmtea和400mm hfip的缓冲液。在纯化之后,将库级分在genevac中干燥并且再溶解在水中,产生79nmol的总库(19%总收率)。
[0241]1×1×
1化合物的pcr和测序
[0242][0243]
在所有实施例中使用1μg(0.5μl)的dna模板和0.2μm或2μm的引物浓度连同省略了引物的阴性对照进行pcr扩增(图5a)。在通过在4%琼脂糖凝胶上的凝胶电泳进行分析之前,总计进行了40次pcr循环(图5b)。
[0244]
通过琼脂糖凝胶电泳的分析显示,在长度140个-150个碱基对附近存在清晰的带。使用33个碱基对ngs延伸扩增后dna链的预期长度是148个碱基对。通过ngs分析pcr产物,77000个读段中的》80%与预期的序列完全一致。
[0245]
实施例4:酰胺偶联反应的结果
[0246][0247]
表9示出了使用fed后优化的偶联条件在筛选中起始材料至产物75a-n的转化率。条件:胺头件(5nmol)、酸(0.5m)、2,6-二甲基吡啶(2m)、hatu(0.5m)、3.5%tpgs、30μl总体积、45℃、16小时。起始材料74和产物75a的色谱图分别描绘在图6和图7中。
[0248]
表9
[0249]
[0250][0251]
表10示出了使用fed后优化的偶联条件在筛选中起始材料酸头件至产物72a-s的转化率。条件:酸头件(5nmol)、胺(0.5m)、2,6-二甲基吡啶(2m)、hatu(0.5m)、3.5%tpgs、30μl总体积、45℃、16小时。起始材料71和产物72a的色谱图分别描绘在图8和图9中。
[0252]
表10
[0253]
[0254][0255]
表11示出了使用优化的dic条件在筛选中起始材料酸头件至产物72a-t的转化率。条件71(5nmol)、胺(0.5m)、2,6-二甲基吡啶(2m)、dic(0.5m)、hoat(0.5m)、4.5%tpgs、30μl总体积、45℃、4小时。
[0256]
表11
[0257]
[0258]
[0259][0260]
实施例5:在不同条件的情况下的结果
[0261]
碱
[0262]
表12示出了使用甘氨酸乙酯和2-氨基咪唑的碱筛选;条件:酸头件(4nmol)、胺(0.5m)、碱(1.5m)、hatu(0.5m)、30μl总体积、16小时、40℃。
[0263]
表12
[0264]
[0265][0266]
偶联剂筛选
[0267]
表13示出了使用不同偶联剂在以下初始酰胺偶联条件的情况下对几种代表性化合物所观察到的反应概况:酸头件(4nmol)、dipea(1.2m)或2,6-二甲基吡啶(1.5m)、偶联剂(0.5m)、30μl总体积、16小时、40℃。*其他未鉴定的副产物。
[0268]
表13
[0269][0270]
表14示出了偶联剂筛选的结果;条件:酸头件(5nmol)、胺(0.5m)、2,6-二甲基吡啶(2m)、hatu(0.5m)、3.5%tpgs、30μl总体积、45℃、16小时
[0271]
表14
[0272][0273][0274]
使用hatu的因子实验设计:
[0275]
表15示出了使用hatu偶联剂评估甘氨酸乙酯和2-氨基咪唑的转化的因子实验设
计。
[0276]
表15
[0277][0278]
使用dic的因子实验设计:
[0279]
表16示出了使用dic偶联剂评估甘氨酸乙酯和2-氨基咪唑的转化的因子实验设计。
[0280]
表16
[0281][0282]1×1×
1化合物合成和编码
[0283][0284]
使用3个连续酰胺偶联循环来合成代表性的编码化合物。条件:i)连接(引物和bb1密码子),然后甘氨酸乙酯(0.5m)、2,6-二甲基吡啶(1.5m)、dic(0.5m)、4.5%tpgs、(30μl)、45℃、3h,2步的收率为94%;ii)0.25m lioh(0.25m)、1h、100%收率;iii)连接(bb2密码子),然后苏氨酸甲酯(0.5m)、2,6-二甲基吡啶(1.5m)、dic(0.5m)、4.5%tpgs、(30μl)、45℃、3h,然后lioh(0.25m)、1h、3步的收率为51%;iv)连接(bb3密码子和封闭(closing)引物序列),然后4-氟苯胺(0.5m)、2,6-二甲基吡啶(1.5m)、dic(0.5m)、4.5%tpgs、(30μl)、45℃、3h,2步的收率为63%。通过nanodrop
tm
分光光度法确定收率。
[0285]
库中1
×1×
1化合物的ngs测序
[0286]
通过genewiz对来自1
×1×
1的最终产物的pcr扩增样品进行ngs测序。
[0287]
对于正向引物,61879/76902读段对应于预期的序列
[0288]
(tgtagaccatgtagttgaggtcaggtgccgtcgtatgtgcgcgtaggagtcgatcatacagccaaatccgttcacaccgacct)(seq id no:292)
[0289]
对于反向引物,62909/76902读段对应于预期的序列
[0290]
(aggtcggtgtgaacggatttggctgtatgatcgactcctacgcgcacatacgacggcacctgacctc
aactacatggtctaca)(seq id no:293)
[0291]
省略了表面活性剂的比较性偶联
[0292]
将等分试样的适当的胺(60μl,在nmp中的0.25m)和hoat(20μl,在nmp中的10mg/100μl)的溶液添加至用于para-dox
tm 96孔微型光氧化还原/优化板的50μl玻璃插件中。然后在genevac中在55℃去除nmp持续60分钟。向该溶液中添加酸头件(30μl,在水中的5nmol)、2,6-二甲基吡啶(5.2μl,0.045mmol)和dic(2.2μl,0.015mmol)。将小瓶各自涡旋持续30秒以增强混合。然后将样品在para-dox
tm 96孔微型光氧化还原/优化板中在45℃加热持续5小时。使用质谱法来分析反应。样品通过将反应混合物(1μl)添加至水(20μl)中来制备,并且通过亲水ptfe过滤器过滤。
[0293]
观察到的转化率如下:
[0294]
胺转化率评论苄胺46%另外的杂质峰甘氨酸乙酯45%显著另外的杂质峰
[0295]
用peg接头的比较性偶联
[0296]
nh
2-peg
4-己基酰氨基-dna(5nmol)与一组多种多样的酸的偶联。条件:酸(0.5m)、2,6-二甲基吡啶(2m)、hatu(0.5m)、3.5%tpgs、30μl总体积、45℃、16小时。观察到的转化率如下:
[0297][0298]
观察到的转化率如下:
[0299]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1